蛋白酶可切割的前药的制作方法
本技术涉及前药,这些前药包含通过蛋白酶可切割的肽接头连接至结合物的药物分子,该结合物可逆地抑制该药物分子的生物活性,并且涉及抑制性结合物本身。还描述了编码本文所述的重组蛋白的核酸,和制备所述重组蛋白的方法,以及这些重组蛋白的治疗方法和医学用途。
背景技术:
1、药物候选物必须满足某些功效标准,但它们也必须表现出可接受的安全特性。许多药物分子具有一些不良的脱靶(off-target)和/或靶上(on-target)副作用,并且一些药物分子也可能由于对药物分子的预期靶标的夸大的和不良的药理学作用而导致不利的靶上作用。对于某些药物种类,不良作用不能避免,因此它们必须被减轻。对此有几种选择。例如,非类固醇类抗炎药(nsaid)可损害胃的内层,因此它们通常与保护胃的药剂(诸如质子泵抑制剂奥美拉唑(omeprazole))共施用。对于其他药物分子,不良作用或其风险可使用特定剂量方案来减轻,使得药物以多剂量或在较长时间内连续地施用于患者。这种情况的示例可以包括每天多次服用药物,或静脉内(iv)输注药物。
2、尽管分次剂量和iv药物输注是公认的和可接受的给药方式,但它们并非没有缺点。对患者而言繁重的剂量方案,诸如在相对短的时间段内需要多次用药的那些剂量方案,与差的患者依从性以及因此更差的治疗结果相关。尽管iv输注方法不太可能遭受差的患者依从性,但患者必须在医疗护理下。这对于患者是破坏性的,并且导致对医疗保健系统增加的负担。因此,本领域需要减轻不良药物作用的改进方式。
3、一类通常与不良作用相关的药物是抗癌剂。t细胞接合剂药物(tce)通过同时与靶细胞上的肿瘤相关抗原(taa)和t细胞上的cd3受体结合,从而形成人工免疫突触,来引导细胞毒性t细胞对肿瘤细胞的应答。它们已被证明是非常有效的抗肿瘤药物,如通过博纳吐单抗(blinatumomab)(一种α-cd19×α-cd3双特异性抗体)所例示的。然而,针对血液肿瘤和实体瘤的tce的开发受到几个因素的阻碍。除了抗肿瘤活性外,tce也与全身性内皮活化和大量淋巴细胞再分布以及神经毒性相关,特别是在首次剂量施用后(velasquez,blood,2018,131(1),30-38)。tce还与由t细胞的靶上/肿瘤外募集和细胞因子释放综合征(crs)和高细胞因子血症(也称为“细胞因子风暴”)引起的严重毒性相关。
4、crs或高细胞因子血症通常在第一剂药物后迅速发生,并且其特征在于体内细胞因子的不受控制的过量释放。虽然细胞因子释放是正常免疫功能的关键部分,但是过多的细胞因子过快地释放到血液中会导致诸如高热、发炎、严重疲劳、恶心以及有时甚至是多器官衰竭和死亡的症状。在参与者发展出严重的高细胞因子血症后,不得不放弃意欲用于治疗b细胞慢性淋巴细胞白血病和类风湿关节炎的药物西拉利珠单抗(theralizumab)的临床试验。症状的发作在给药一小时内发生,并且试验中的所有参与者都需要紧急的医院护理。crs还由受免疫疗法影响的免疫细胞向血液中大量、快速释放细胞因子引起。crs的症状包括发烧、恶心、头痛、皮疹、快速心跳、低血压和呼吸困难。有时,crs可能是严重的或威及生命的。
5、在肿瘤和健康组织两者上表达靶抗原的患者中出现了由于靶上/肿瘤外毒性导致的免疫疗法的严重不良作用。这种表达模式对于用于靶向癌症疗法的许多靶抗原是典型的,诸如例如表皮生长因子受体(egfr)家族的某些成员。这种抗原的一个示例是her2,其是用于癌症疗法的有吸引力的靶标,因为它可以在肿瘤中过表达40倍至100倍。长期以来,使用单克隆抗体诸如曲妥珠单抗对her2进行靶向治疗。her2也已被免疫疗法靶向。一种基于曲妥珠单抗序列的her2 car-t细胞疗法被用于治疗患有结肠直肠癌的患者,并且不幸的是,对患者的心肺系统的肿瘤外靶向引起致死毒性(morgan等人,molther.,2010;18(4):843–851)。细胞输注后的血清样品显示出各种细胞因子的显著增加,这与细胞因子风暴一致,并且这种细胞因子风暴可能是由所施用的细胞对肺上皮细胞上低水平的her2的识别所触发的。基于曲妥珠单抗的临床研究或基于临床前动物研究,没有预见到这种不良作用。
6、这些毒性经常影响临床试验设计和剂量递增策略,并且已经证明尤其是在具有高疾病负荷的患者中,由于严重程度而具有剂量限制。也可能需要预先用药和/或主动干预,最终导致复杂的临床试验设计。已经设计了几种策略用于与施用t细胞接合剂药物相关的crs的临床管理。这些策略包括逐步给药(逐步剂量递增)、用类固醇(尤其是地塞米松(dexamethasone))预治疗或用托珠单抗(tocilizumab)(抗il6受体抗体)治疗(参见例如aldoss等人current oncology reports,2019,21:4)。用类固醇的预治疗延迟了治疗的开始,这对于侵袭性疾病状态是不推荐的,并且在具有高体重指数(bmi)和/或血压的患者中使用类固醇可能是禁忌的。fda在2017年批准用托珠单抗治疗以避免crs。然而,这种药物的免疫抑制作用可使患者易受其他感染性疾病的伤害。
7、总之,仍然需要新的或改进的方法来避免、减少或减轻用于治疗疾病(包括癌症)的药物的不良作用或其风险。
技术实现思路
1、本技术寻求提供一种避免或减轻施用药物分子后的不良作用或其风险的新方法。本发明提供了一种通过结合部分抑制药物分子的生物活性的方法,该结合部分可逆地结合至该药物分子并且通过蛋白酶可切割的肽接头连接至该药物分子。被该结合部分抑制的该药物分子的生物活性可以是例如该药物分子与生物靶标的结合。在通过蛋白酶(诸如在肿瘤组织中表达的蛋白酶)切割肽接头时,该结合部分从该药物分子解离,从而在蛋白水解切割的位点处将活性药物分子释放到体内。这种方法避免了施用后不久体内活性药物分子浓度达到峰值,并将活性药物分子的释放定位于适当蛋白酶的表达位点。这种方法的有益应用的一个示例是在施用包含tce和通过蛋白酶可切割的肽接头与其连接的抑制性结合部分的前药tce蛋白之后,降低靶上/肿瘤外毒性和crs的风险。
2、本技术描述了新的前药蛋白,这些前药蛋白包含(i)结合部分和(ii)药物分子;其中所述结合部分可逆地结合至所述药物分子;其中所述结合部分当结合时抑制所述药物分子的生物活性;其中所述结合部分和所述药物分子通过肽接头连接;并且其中所述肽接头包含一个或多个蛋白酶切割位点。优选地,可切割肽接头的蛋白酶在药物分子的靶组织(诸如肿瘤组织)中以升高的水平表达。在本技术中还描述了特异性结合部分,其可以与各种药物分子组合用于此类前药方法中。本发明的结合部分可以是药物分子的抗独特型结合物。在一些实施方案中,本发明的前药蛋白还包含血清半衰期延长部分。优选地,此类半衰期延长部分与该抑制性结合部分共价连接,使得在肽接头被蛋白水解切割时,该半衰期延长部分与该结合部分一起从药物分子上被切割下来。以这种方式,前药蛋白具有延长的血清半衰期,但在肽接头被蛋白水解切割时释放的活性药物分子没有延长的血清半衰期。因此,药物分子的生物活性的持续时间相对较短,从而进一步有助于避免在活性药物分子从肿瘤组织分布到体内其他部位时可能发生的靶上/肿瘤外毒性。
3、在这种前药方法的具体应用中,本发明提供了一种tce前药(cd3-pdd),该前药包含taa结合物和cd3结合物,经由蛋白酶可切割的接头连接至抗独特型抗cd3结合物结合部分(下文称为结合物),参见图1。这种α-taa×α-cd3×结合物前药在其非切割状态下无法结合并募集t细胞,但被设计成在肿瘤微环境(tme)中在通过肿瘤相关蛋白酶切割接头时被活化。
4、此类蛋白酶可活化的前药的基本理念是利用肿瘤微环境中的蛋白酶的错误调节,即通过构建前药分子,该前药分子在循环和健康组织中是非活性的,但一旦进入tme,就会因肿瘤相关蛋白酶切割蛋白酶敏感性接头而被活化,参见图1。
5、前药的阻断概念依赖于“强制接近”现象,即接近cd3结合物的非常高浓度的结合物。这是由于接头所施加的距离约束,使得结合物只能接触cd3结合物周围的一定体积。当通过肿瘤相关蛋白酶切割接头时,强制接近被消除,并且结合物可以自由扩散开,仅受结合物与cd3结合物之间的解离速率限制。
6、在一个实施方案中,半衰期延长部分(诸如hsa结合物)附接至tce前药分子的阻断部分(即,结合物)。这提供了另一层安全保障:在切割时,t细胞接合剂被赋予活性,但同时失去其半衰期延长部分。因此,从tme回漏到循环中的活性tce由于其小尺寸和短半衰期而被快速从系统中清除。
7、总之,本文描述了一种可条件活化的tce前药,其显示出与对应的组成型活性(即非阻断型)tce类似的功效,但没有毒性。所描述的前药方法为未来前药tce治疗剂的开发带来了希望,使得能够利用肿瘤相关抗原(taa)作为高效tce的靶标,即使这些肿瘤相关抗原也在一些非靶向组织(即健康组织)中表达。
8、综上所述,本发明提供了可条件活化的前药,这些前药包含通过蛋白酶可切割的肽接头连接至结合部分的药物分子,当结合时,该结合部分抑制该药物分子的生物活性。此外,本发明提供了可用于各种前药的抑制性结合部分本身。还提供了编码本文所述的重组蛋白的核酸,和使用宿主细胞制备所述重组蛋白的方法,以及使用该重组蛋白的医学用途和治疗方法。
9、基于本文提供的公开内容,本领域技术人员将认识到或仅能够使用常规实验来确定本文所述的本发明的具体实施方案的许多等同物。此类等同物旨在由以下实施方案(e)涵盖。
10、在第一实施方案中,本发明涉及一种重组蛋白,所述重组蛋白包含(i)结合部分和(ii)药物分子;
11、其中所述结合部分可逆地结合至所述药物分子;
12、其中所述结合部分当结合时抑制所述药物分子的生物活性;其中
13、所述结合部分和所述药物分子通过肽接头连接;并且其中所述肽接头包含蛋白酶切割位点。
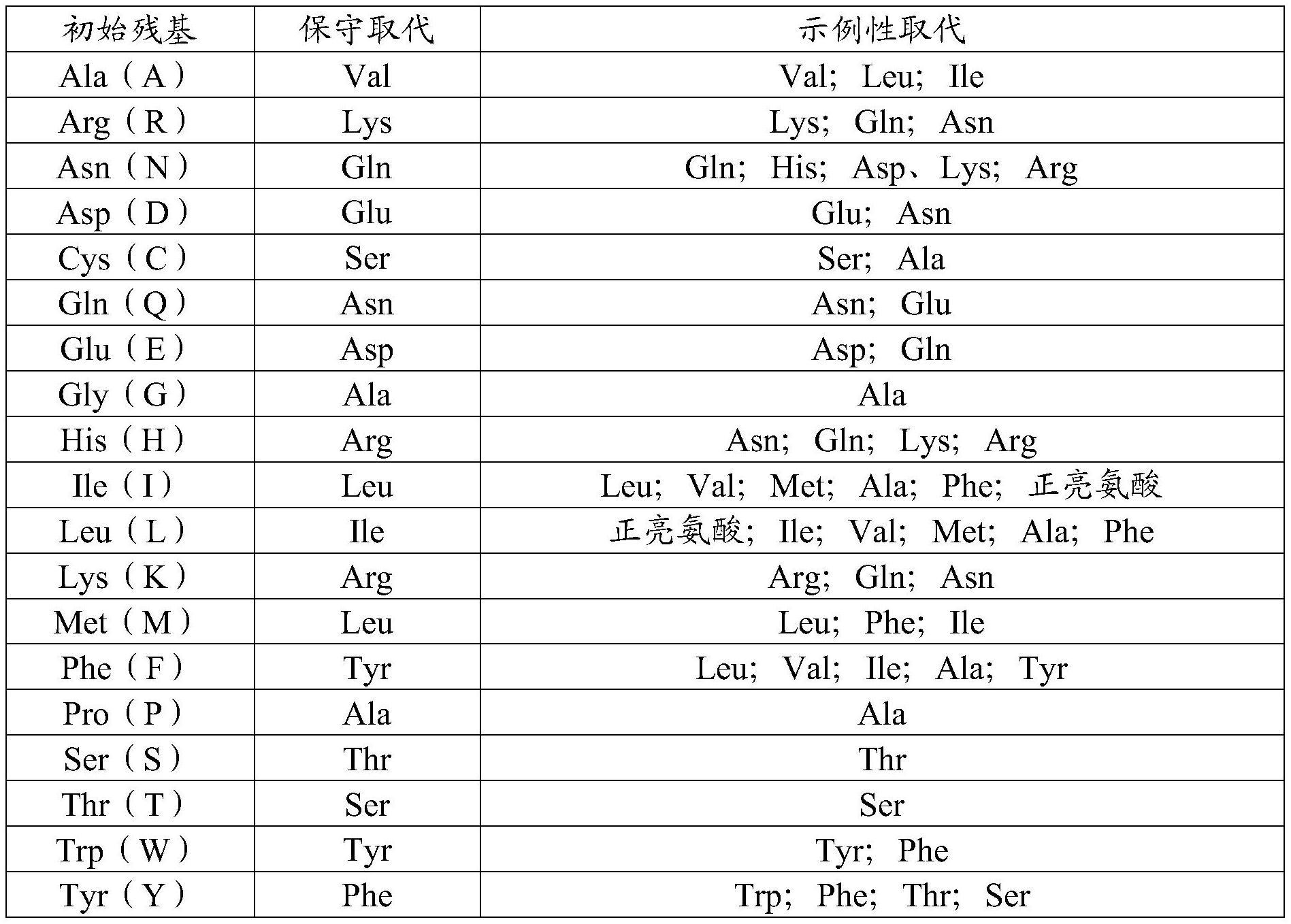
14、在第二实施方案中,本发明涉及根据实施方案1所述的重组蛋白,其中所述结合部分包含抗体、替代性支架或多肽。
15、在第三实施方案中,本发明涉及根据实施方案1或2所述的重组蛋白,其中所述结合部分包含免疫球蛋白分子或其片段。
16、在第四实施方案中,本发明涉及根据实施方案1或2所述的重组蛋白,其中所述结合部分包含非免疫球蛋白分子。
17、在第五实施方案中,本发明涉及根据实施方案1至4中任一项所述的重组蛋白,其中所述结合部分包含衍生自单克隆抗体、多克隆抗体、重组抗体、嵌合抗体、人抗体、人源化抗体、单结构域抗体、重链可变结构域(vh)、轻链可变结构域(vl)或可变结构域(vhh)的抗原结合结构域。
18、在第六实施方案中,本发明涉及根据实施方案1至4中任一项所述的重组蛋白,其中所述结合部分包含抗原结合结构域,所述抗原结合结构域衍生自以下项或与以下项相关:阿德耐汀(adnectin)、单抗体、亲和体(affibody)、阿菲林(affilin)、阿菲默(affimer)、适体、阿非汀(affitin)、α抗体(alphabody)、抗运载蛋白(anticalin)、重复蛋白结构域、犰狳重复结构域、阿去默(atrimer)、阿维默(avimer)、锚蛋白重复结构域、非诺莫(fynomer)、打结素(knottin)、库尼兹结构域(kunitz domain)或t细胞受体(tcr)。
19、在第七实施方案中,本发明涉及根据任一前述实施方案所述的重组蛋白,其中所述药物分子的所述生物活性是所述药物分子与生物靶标的结合。
20、在第八实施方案中,本发明涉及根据任一前述实施方案所述的重组蛋白,其中所述药物分子的所述生物活性是酶活性。
21、在第九实施方案中,本发明涉及根据任一前述实施方案所述的重组蛋白,其中当将所述重组蛋白施用于哺乳动物时,所述肽接头在所述蛋白酶切割位点处的切割允许所述药物分子从所述结合部分释放。
22、在第十实施方案中,本发明涉及根据实施方案9所述的重组蛋白,其中所述哺乳动物是人。
23、在第十一实施方案中,本发明涉及根据实施方案9和10中任一项所述的重组蛋白,其中所述肽接头的所述切割发生在肿瘤组织中。
24、在第十二实施方案中,本发明涉及根据任一前述实施方案所述的重组蛋白,其中所述蛋白酶切割位点是被肿瘤组织中存在的蛋白酶识别的位点。
25、在第十三实施方案中,本发明涉及根据任一前述实施方案所述的重组蛋白,其中所述结合部分以小于约1μm,诸如小于约1μm、小于约500nm、小于约250nm、小于约100nm或小于约50nm的解离常数(kd)结合所述药物分子。
26、在第十四实施方案中,本发明涉及根据任一前述实施方案所述的重组蛋白,其中所述结合部分以约1μm与约10pm之间,诸如约1μm与约10pm之间、约1μm与约20pm之间、约1μm与约50pm之间或约1μm与约100pm之间的离解常数(kd)结合所述药物分子。
27、在第十五实施方案中,本发明涉及根据实施方案13或14所述的重组蛋白,其中所述解离常数(kd)是在磷酸盐缓冲盐水(pbs)中测量的。
28、在第十六实施方案中,本发明涉及根据任一前述实施方案所述的重组蛋白,其中所述结合部分包含经设计的锚蛋白重复结构域。
29、在第十七实施方案中,本发明涉及根据实施方案16所述的重组蛋白,其中所述经设计的锚蛋白重复结构域包含锚蛋白重复模块,所述锚蛋白重复模块包含选自由以下组成的组的氨基酸序列:(1)seq id no:45至64,以及(2)其中seq id no:45至64中的任一者中的至多9个氨基酸被其他氨基酸取代的序列。
30、在第十八实施方案中,本发明涉及根据实施方案16或17所述的重组蛋白,其中所述经设计的锚蛋白重复结构域包含选自由以下组成的组的氨基酸序列:(1)seq id no:1至12,以及(2)与seq id no:1至12中的任一者具有至少85%氨基酸序列同一性的序列。
31、在第十九实施方案中,本发明涉及根据任一前述实施方案所述的重组蛋白,其中所述药物分子包含抗体、替代性支架或多肽。
32、在第二十实施方案中,本发明涉及根据任一前述实施方案所述的重组蛋白,其中所述药物分子包含免疫球蛋白分子或其片段。
33、在第二十一实施方案中,本发明涉及根据任一前述实施方案所述的重组蛋白,其中所述药物分子包含非免疫球蛋白分子。
34、在第二十二实施方案中,本发明涉及根据任一前述实施方案所述的重组蛋白,其中所述药物分子包含衍生自单克隆抗体、多克隆抗体、重组抗体、嵌合抗体、人抗体、人源化抗体、单结构域抗体、重链可变结构域(vh)、轻链可变结构域(vl)或可变结构域(vhh)的抗原结合结构域。
35、在第二十三实施方案中,本发明涉及根据任一前述实施方案所述的重组蛋白,其中所述药物分子包含抗原结合结构域,所述抗原结合结构域衍生自以下项或与以下项相关:阿德耐汀、单抗体、亲和体、阿菲林、阿菲默、适体、阿非汀、α抗体、抗运载蛋白、重复蛋白结构域、犰狳重复结构域、阿去默、阿维默、锚蛋白重复结构域、非诺莫、打结素、库尼兹结构域或t细胞受体(tcr)。
36、在第二十四实施方案中,本发明涉及根据任一前述实施方案所述的重组蛋白,其中所述药物分子对cd3具有结合特异性。
37、在第二十五实施方案中,本发明涉及根据任一前述实施方案所述的重组蛋白,其中所述药物分子包含至少一个对肿瘤相关抗原(taa)具有结合特异性的结合结构域。
38、在第二十六实施方案中,本发明涉及根据任一前述实施方案所述的重组蛋白,其中所述药物分子包含经设计的锚蛋白重复结构域。
39、在第二十七实施方案中,本发明涉及根据实施方案26所述的重组蛋白,其中所述经设计的锚蛋白重复结构域对cd3具有结合特异性。
40、在第二十八实施方案中,本发明涉及根据实施方案26和27中任一项所述的重组蛋白,其中所述经设计的锚蛋白重复结构域包含选自由以下组成的组的氨基酸序列:(1)seqid no:13至17,以及(2)与seq id no:13至17中的任一者具有至少85%氨基酸序列同一性的序列。
41、在第二十九实施方案中,本发明涉及根据实施方案27和28中任一项所述的重组蛋白,其中所述经设计的锚蛋白重复结构域以小于约100nm的解离常数(kd)结合至cd3。
42、在第三十实施方案中,本发明涉及根据实施方案1至25中任一项所述的重组蛋白,其中所述药物分子包含抗体。
43、在第三十一实施方案中,本发明涉及根据实施方案30所述的重组蛋白,其中所述抗体对cd3具有结合特异性。
44、在第三十二实施方案中,本发明涉及根据任一前述实施方案所述的重组蛋白,其中所述药物分子是t细胞接合剂药物分子(tce)。
45、在第三十三实施方案中,本发明涉及根据实施方案32所述的重组蛋白,其中所述tce包含结合至cd3的结合结构域并且还包含结合肿瘤相关抗原(taa)的结合结构域。
46、在第三十四实施方案中,本发明涉及根据实施方案32和33中任一项所述的重组蛋白,其中所述结合部分与所述tce药物分子的结合抑制所述tce药物分子与t细胞的结合和/或t细胞的活化。
47、在第三十五实施方案中,本发明涉及根据实施方案32至34中任一项所述的重组蛋白,其中所述tce是双特异性或多特异性抗体。
48、在第三十六实施方案中,本发明涉及根据实施方案32至34中任一项所述的重组蛋白,其中所述tce是双特异性或多特异性锚蛋白重复蛋白。
49、在第三十七实施方案中,本发明涉及根据实施方案33至36中任一项所述的重组蛋白,其中所述结合至cd3的结合结构域位于所述结合肿瘤相关抗原(taa)的结合结构域的c-末端侧。
50、在第三十八实施方案中,本发明涉及根据任一前述实施方案所述的重组蛋白,其中所述结合部分是所述药物分子的抗独特型结合物。
51、在第三十九实施方案中,本发明涉及根据实施方案38所述的重组蛋白,其中所述结合部分是对cd3具有结合特异性的所述经设计的锚蛋白重复结构域的抗独特型结合物。
52、在第四十实施方案中,本发明涉及根据实施方案38所述的重组蛋白,其中所述结合部分是对cd3具有结合特异性的所述抗体的抗独特型结合物。
53、在第四十一实施方案中,本发明涉及根据任一前述实施方案所述的重组蛋白,其中所述结合部分、所述药物分子和所述肽接头从n-末端至c-末端按以下格式排列:药物分子–肽接头–结合部分。
54、在第四十二实施方案中,本发明涉及根据实施方案1至41中任一项所述的重组蛋白,其中所述结合部分、所述结合至cd3的结合结构域、所述结合肿瘤相关抗原(taa)的结合结构域和所述肽接头从n-末端至c-末端按以下格式排列:结合肿瘤相关抗原(taa)的结合结构域–结合至cd3的结合结构域–肽接头–结合部分。
55、在第四十三实施方案中,本发明涉及根据任一前述实施方案所述的重组蛋白,所述重组蛋白还包含延长重组蛋白在哺乳动物中的血清半衰期的药剂。
56、在第四十四实施方案中,本发明涉及根据实施方案43所述的重组蛋白,其中所述延长重组蛋白在哺乳动物中的血清半衰期的药剂具有对血清白蛋白的结合特异性。
57、在第四十五实施方案中,本发明涉及根据实施方案44所述的重组蛋白,其中所述延长重组蛋白在哺乳动物中的血清半衰期的药剂包含对血清白蛋白具有结合特异性的经设计的锚蛋白重复结构域。
58、在第四十六实施方案中,本发明涉及根据实施方案45所述的重组蛋白,其中所述对血清白蛋白具有结合特异性的经设计的锚蛋白重复结构域包含选自由以下组成的组的氨基酸序列:(1)seq id no:65至67,以及(2)与seq id no:65至67中的任一者具有至少85%氨基酸序列同一性的序列。在另外的实施方案中,本发明涉及根据实施方案46所述的重组蛋白,其中所述经设计的锚蛋白重复结构域以小于约100nm的解离常数(kd)结合至人血清白蛋白。
59、在第四十七实施方案中,本发明涉及根据实施方案43至46中任一项所述的重组蛋白,其中所述延长重组蛋白在哺乳动物中的血清半衰期的药剂与所述结合部分位于所述肽接头的同一侧。
60、在第四十八实施方案中,本发明涉及根据实施方案47所述的重组蛋白,其中所述结合部分和所述延长重组蛋白在哺乳动物中的血清半衰期的药剂均位于所述肽接头的c-末端侧。
61、在第四十九实施方案中,本发明涉及根据实施方案43至47中任一项所述的重组蛋白,其中所述延长重组蛋白在哺乳动物中的血清半衰期的药剂位于所述结合部分的c-末端侧。
62、在第五十实施方案中,本发明涉及根据实施方案43至49中任一项所述的重组蛋白,其中所述结合部分、所述结合至cd3的结合结构域、所述结合肿瘤相关抗原(taa)的结合结构域、所述肽接头和所述延长重组蛋白在哺乳动物中的血清半衰期的药剂从n-末端至c-末端按以下格式排列:结合肿瘤相关抗原(taa)的结合结构域–结合至cd3的结合结构域–肽接头–结合部分–延长重组蛋白在哺乳动物中的血清半衰期的药剂。
63、在第五十一实施方案中,本发明涉及一种核酸,所述核酸编码根据前述实施方案中任一项所述的重组蛋白。
64、在第五十二实施方案中,本发明涉及一种宿主细胞,所述宿主细胞包含根据实施方案51所述的核酸分子。
65、在第五十三实施方案中,本发明涉及一种制备根据实施方案1至50中任一项所述的重组蛋白的方法,所述方法包括在其中表达所述重组蛋白的条件下培养根据实施方案52所述的宿主细胞。
66、在第五十四实施方案中,本发明涉及根据实施方案53所述的方法,其中所述宿主细胞是原核宿主细胞。
67、在第五十五实施方案中,本发明涉及根据实施方案53所述的方法,其中所述宿主细胞是真核宿主细胞。
68、在第五十六实施方案中,本发明涉及一种药物组合物,所述药物组合物包含根据实施方案1至50中任一项所述的重组蛋白或根据实施方案51所述的核酸,以及药学上可接受的载剂或稀释剂。
69、在第五十七实施方案中,本发明涉及根据实施方案1至50中任一项所述的重组蛋白、根据实施方案51所述的核酸或根据实施方案56所述的药物组合物,所述重组蛋白、所述核酸或所述药物组合物在疗法中使用。
70、在第五十八实施方案中,本发明涉及根据实施方案57所述使用的重组蛋白、核酸或药物组合物,所述使用的重组蛋白、核酸或药物组合物在治疗增殖性疾病中使用,任选地其中所述增殖性疾病是癌症。
71、在第五十九实施方案中,本发明涉及一种治疗方法,所述方法包括向有需要的受试者施用根据实施方案1至50中任一项所述的重组蛋白、根据实施方案51所述的核酸或根据实施方案56所述的药物组合物的步骤。
72、在第六十实施方案中,本发明涉及根据实施方案59所述的方法,其中所述方法是治疗增殖性疾病的方法,任选地其中所述增殖性疾病是癌症。
73、在第六十一实施方案中,本发明涉及一种在有需要的受试者中活化t细胞的方法,所述方法包括向所述受试者施用根据实施方案1至50中任一项所述的重组蛋白、根据实施方案51所述的核酸或根据实施方案56所述的药物组合物的步骤。
74、在第六十二实施方案中,本发明涉及一种控制体内活性药物分子释放的方法,所述方法包括将根据实施方案1至50中任一项所述的重组蛋白、根据实施方案51所述的核酸或根据实施方案56所述的药物组合物施用于有需要的受试者。
75、在第六十三实施方案中,本发明涉及根据实施方案59至62中任一项所述的方法,其中所述受试者是人。
76、在第六十四实施方案中,本发明涉及一种控制药物分子的生物活性的方法,所述方法包括将根据实施方案1至6、13至18和38至40中任一项所定义的结合部分与根据实施方案19至37中任一项所定义的药物分子用包含蛋白酶切割位点的肽接头连接起来,以形成重组蛋白,并将所述重组蛋白施用于有需要的患者,其中所述蛋白酶切割位点被肿瘤组织中存在的蛋白酶识别。
77、在第六十五实施方案中,本发明涉及根据实施方案64所述的方法,其中所述药物分子的所述生物活性是所述药物分子与生物靶标的结合。
78、在第六十六实施方案中,本发明涉及根据实施方案64所述的方法,其中所述药物分子的所述生物活性是酶活性。
79、在第六十七实施方案中,本发明涉及一种对药物分子具有结合特异性的结合部分,其中当通过肽接头与所述药物分子连接时,所述结合部分抑制所述药物分子的生物活性。
80、在第六十八实施方案中,本发明涉及根据实施方案67所述的结合部分,其中所述结合部分与所述药物分子的结合形成可逆地抑制所述药物分子的生物活性的复合物。
81、在第六十九实施方案中,本发明涉及根据实施方案67或68中任一项所述的结合部分,其中所述结合部分是所述药物分子的抗独特型结合物。
82、在第七十实施方案中,本发明涉及根据实施方案67至69中任一项所述的结合部分,其中所述药物分子的所述生物活性是所述药物分子与生物靶标的结合。
83、在第七十一实施方案中,本发明涉及根据实施方案67至69中任一项所述的结合部分,其中所述药物分子的所述生物活性是酶活性。
84、在第七十二实施方案中,本发明涉及根据实施方案67至71中任一项所述的结合部分,所述结合部分对所述药物分子具有小于约1μm,诸如小于约1μm、小于约500nm、小于约250nm、小于约100nm或小于约50nm的结合亲和力(kd)。
85、在第七十三实施方案中,本发明涉及根据实施方案67至72中任一项所述的结合部分,其中所述结合部分以约1μm与约10pm之间,诸如约1μm与约10pm之间、约1μm与约20pm之间、约1μm与约50pm之间或约1μm与约100pm之间的离解常数(kd)结合所述药物分子。
86、在第七十四实施方案中,本发明涉及根据实施方案72或73所述的结合部分,其中所述解离常数(kd)是在磷酸盐缓冲盐水(pbs)中测量的。
87、在第七十五实施方案中,本发明涉及根据实施方案67至74中任一项所述的结合部分,其中所述结合部分包含抗体、替代性支架或多肽。
88、在第七十六实施方案中,本发明涉及根据实施方案67至75中任一项所述的结合部分,其中所述结合部分包含免疫球蛋白分子或其片段。
89、在第七十七实施方案中,本发明涉及根据实施方案67至76中任一项所述的结合部分,其中所述结合部分包含非免疫球蛋白分子。
90、在第七十八实施方案中,本发明涉及根据实施方案67至77中任一项所述的结合部分,其中所述结合部分包含衍生自单克隆抗体、多克隆抗体、重组抗体、嵌合抗体、人抗体、人源化抗体、单结构域抗体、重链可变结构域(vh)、轻链可变结构域(vl)或可变结构域(vhh)的抗原结合结构域。
91、在第七十九实施方案中,本发明涉及根据实施方案67至78中任一项所述的结合部分,其中所述结合部分包含抗原结合结构域,所述抗原结合结构域衍生自以下项或与以下项相关:阿德耐汀、单抗体、亲和体、阿菲林、阿菲默、适体、阿非汀、α抗体、抗运载蛋白、重复蛋白结构域、犰狳重复结构域、阿去默、阿维默、锚蛋白重复结构域、非诺莫、打结素、库尼兹结构域或t细胞受体(tcr)。
92、在第八十实施方案中,本发明涉及根据实施方案67至79中任一项所述的结合部分,其中所述结合部分包含经设计的锚蛋白重复结构域。
93、在第八十一实施方案中,本发明涉及根据实施方案80所述的结合部分,其中所述经设计的锚蛋白重复结构域包含锚蛋白重复模块,所述锚蛋白重复模块包含选自由以下组成的组的氨基酸序列:(1)seq id no:45至64,以及(2)其中seq id no:45至64中的任一者中的至多9个氨基酸被其他氨基酸取代的序列。
94、在第八十二实施方案中,本发明涉及根据实施方案80或81中任一项所述的结合部分,其中所述经设计的锚蛋白重复结构域包含选自由以下组成的组的氨基酸序列:(1)seqid no:1至12,以及(2)与seq id no:1至12中的任一者具有至少85%氨基酸序列同一性的序列。
95、在第八十三实施方案中,本发明涉及一种核酸,所述核酸编码根据实施方案67至82中任一项所述的结合部分。
96、在第八十四实施方案中,本发明涉及一种核酸,所述核酸编码根据实施方案80至82中任一项所述的经设计的锚蛋白重复结构域。
97、在第八十五实施方案中,本发明涉及一种宿主细胞,所述宿主细胞包含根据实施方案83或84所述的核酸分子。
98、在第八十六实施方案中,本发明涉及一种制备根据实施方案67至82中任一项所述的结合部分的方法,所述方法包括在其中表达所述结合部分的条件下培养根据实施方案85所述的宿主细胞。
99、在第八十七实施方案中,本发明涉及根据实施方案86所述的方法,其中所述宿主细胞是原核宿主细胞。
100、在第八十八实施方案中,本发明涉及根据实施方案86所述的方法,其中所述宿主细胞是真核宿主细胞。
101、在第八十九实施方案中,本发明涉及一种药物组合物,所述药物组合物包含根据实施方案67至82中任一项所述的结合部分或根据实施方案83和84中任一项所述的核酸,以及药学上可接受的载剂和/或稀释剂。
102、在第九十实施方案中,本发明涉及根据实施方案67至82中任一项所述的结合部分、根据实施方案83和84中任一项所述的核酸或根据实施方案89所述的药物组合物,所述结合部分、所述核酸或所述药物组合物在疗法中使用。
103、在第九十一实施方案中,本发明涉及一种治疗方法,所述方法包括向有需要的受试者施用根据实施方案67至82中任一项所述的结合部分、根据实施方案83和84中任一项所述的核酸或根据实施方案89所述的药物组合物。
- 还没有人留言评论。精彩留言会获得点赞!