具有1-(二硫烷基)烷氧基-羰基单元的前药的制作方法
本发明涉及化合物、用于制备所述化合物的试剂、用于制备所述化合物的方法和所述化合物作为(共同)前药、先药(antedrug)、药物、疗法、显像剂或诊断剂的用途,以及所述化合物作为与药物分子附接的接头的用途,以改善所述药物分子的以下一项或多项:溶解度、渗透性、稳定性、味道、口服生物利用度、溶出和/或处置。本发明属于医学科学领域。其提供了新的制药方法和制剂。本发明涉及通过将药物转化为含有前体部分的1-取代二硫烷基烷基碳酸酯、硫代氨基甲酸酯或氨基甲酸酯前药来改善药物的药代动力学、物理化学或制药性质的方法。具体地,本发明涉及通过将药物转化为含有前体部分的1-(二硫烷基烷基)碳酸酯、硫代碳酸酯或氨基甲酸酯前药来改善药物的溶解度、渗透性、稳定性和/或口服生物利用度的方法。本发明还提供了新的组合物,其包含共价附接至含有前体部分的1-(二硫烷基烷基)碳酸酯或氨基甲酸酯的药物。更具体地,本发明涉及通过将含有前体部分的1-二硫烷基烷氧基羰基单元共价附接至含有羟基或胺的药物来增加药物的口服生物利用度的方法,其中前体部分含有1-o-、1-s-、6-o-或6-s-连接的单糖。本发明涉及新化合物,特别是作为前药的分子。本发明提供了使用取代的1-(二硫烷基)烷氧基羰基部分从含羟基、巯基和胺的药物生产二硫烷基烷基碳酸酯、-硫代碳酸酯和-氨基甲酸酯以及1-(二硫烷基)烷基碳酸酯、-硫代碳酸酯和-氨基甲酸酯作为三联前药的组合物和方法,用以增加所述药物的溶解度和渗透性并通过改变药物的物理化学、药代动力学或制药性质使得到达患者体内的血流和/或其作用位点的活性药物的量最大化。本发明还涉及使用取代的1-(二硫烷基)烷氧基羰基部分作为前药来限制活性药物在可能不是预期作用位点的暴露组织(如胃肠道)中发生不期望的作用的组合物和方法。本发明还涉及通过将药物连接至取代的1-(二硫烷基)烷氧基羰基单元以获得本发明的化合物来增加药物的口服利用度的方法。
背景技术:
1、药物的先决条件是其能够以足够的效力与其预期的生物靶点接合。同时,药物应表现出尽可能小的由于与其他生物实体(如酶、受体、离子通道等)相互作用造成的副作用。然而,具备先决条件并不能使分子成为可接受的药物。药物还需要与其预期的施用途径相容,包括皮下、静脉内、肌内、腹膜内、鞘内、口服、口腔、舌下、直肠、经皮、鼻内、肺内或眼部途径。对于许多药物来说,口服适用性是期望的或甚至是必需的。因此,理想的口服药物应表现出足够的溶解度、对一定ph范围的稳定性、跨膜能力、对肠道和肝脏代谢的稳定性、对排泄到胆汁或通过外排转运蛋白排泄的抵抗性、以治疗水平分配到靶器官中并且不分配到不期望的组织或受限。然而,许多药物未能在可接受的程度上满足所有这些要求,这将导致所述药物的疗效降低。药物的物理化学、制药和药代动力学特性的优化是药物开发的关键要素。
2、口服施用是向患者输送药物的最优选途径之一。然而,口服生物利用度不足是制药界的一个重大问题。低口服生物利用度与较低的功效和可变的患者反应相关[参见出版物:hellriegel,e.t.,clin.pharmacol.ther.,1996,60,601-7]。口服生物利用度低的药物转化为可接受的制剂更加困难且成本更高。
3、为了补偿低口服生物利用度,通常需要更高的剂量来实现预期的治疗效果,但更高的剂量也可能导致与剂量相关的副作用的负担更大,特别是在胃肠道中。此外,将口服生物利用度较低的药物重新定位用于新适应症的潜力较低。此外,一些药品目前只能以注射制剂的形式提供,因此非常需要能够促进将这些药物重新配制为有效口服应用的技术。
4、根据生物制药药物处置分类系统(bddcs)[benet,l.z.,aaps j.,2011,13,519-47]对大量上市药物进行分析发现,40%的上市药物表现出溶解度差(2类,4种药物),而30%的上市药物表现出较差的渗透性,如由其代谢较差所指明的(3类,4种药物)。进一步估计,在业界正研究的候选药物中,高达70%为难溶性2类化合物,另外20%不仅难溶性而且渗透性差,属于4类化合物。因此可以得出结论,设计具有足够口服生物利用度的新化学实体正变得越来越困难。
5、已经提出了许多补救措施来解决药物口服生物利用度不理想的问题[参见出版物:fasinu,p.,biopharm drug disp.,2011,32,185-209]。所提出的增加口服生物利用度的策略包括例如增溶技术,如使用不同的药学上可接受的盐、减小药物的粒径(例如通过微粉化或纳米化技术)、使用喷雾干燥分散体和热熔挤出以及使用亲脂性液体和半固体基体。这些策略似乎都不能普遍适用于解决每种药物的口服生物利用度问题,并且每次都需要根据具体情况研究其潜力。
6、提高药物口服生物利用度的另一种策略是使用前药[参见出版物:prodrugs andtargeted delivery,rautio,j,(ed.),2011,wiley-vch,weinheim,germany]。前药是应对这一挑战的主要策略,它是药物分子的无活性的或活性较低的衍生物,在患者体内经历酶促或化学转化以再生成所述药物的活性形式。在到达患者体内的作用位点之前,通过暂时性地改变药物的物理化学特性(例如通过屏蔽电荷或保护所述药物的电离基团),前药在克服胃肠道等生理障碍方面有着悠久的历史。在靶向癌症疗法中,缺乏内在靶点特异性的传统化疗药剂经过合理修饰以将其细胞毒性集中并重新定向到肿瘤细胞。许多常规的非特异性化疗剂,如多柔比星、紫杉醇、喜树碱、顺铂及其衍生物的可用性已通过修饰成前药,特别是那些含有细胞靶向部分的前药而得到明显扩展。
7、前药的常见子集包括增溶前体部分,如胺、氨基酸、羧酸盐、磷酸盐、膦酸盐、硫酸盐、磺酸盐等,以及暂时掩蔽极性官能团的前体部分,如羧酸酯、磷酸酯和膦酸酯的酯类。此外,增加或减少药物亲脂性的前体部分的附接可以克服某些药物的缺点。另一个应用领域是附接亲脂链作为促进淋巴摄取的前体部分。
8、前药在概念上可以分为两类:生物前体前药和载体前药[参见出版物:thepractice of medicinal chemistry,ch.31-32,ed.wermuth,academic press,san diego,calif.,2008]。一般来说,生物前体前药是这样的化合物,其与相应的活性药物化合物相比无活性或活性较低,但可通过患者体内代谢或水解转化为其活性形式。
9、载体前药是含有前体部分的药物化合物,即可以具有多种用途的共价结合分子:a)前体部分可以瞬时纠正候选药物的特定次优的物理化学性质,如溶解度和/或膜渗透性,从而导致更高的口服生物利用度;b)前体部分可以(例如在缓释制剂中)延迟活性药物的产生;c)前体部分的存在可以防止由于活性药物对胃肠道的作用而引起的这些组织的副作用;d)前体可以阻断或减慢特定位置的新陈代谢。此类载体前药不仅对于口服施用的药物有利,而且对于静脉内、皮下、腹膜内、直肠、透皮或鞘内给药的药物也有利。载体前药也有利于将药物靶向特定组织或细胞,因为这些类别的前药可以充当归位装置将药物引导至靶组织。实例包括horizant(1型单羧酸转运蛋白的底物)和缬更昔洛韦(pept1转运蛋白的底物)。其他实例包括使用抗体-药物缀合物(adc)或使用葡萄糖苷酸-药物缀合物来靶向在特定肿瘤细胞中过度表达的酶。前体部分可以通过共价键直接附接至药物的官能团(二联前药),或者可以通过接头分子间接附接至药物(三联前药)。
10、载体前药的一个特殊子集是所谓的药物糖苷,其中糖部分充当前体部分。在这些前药中,糖部分的异头羟基与药物分子共价连接,该连接是以直接方式(例如,连接至药物的羟基),或者是以间接方式通过使用可以连接到药物中的任何官能团的接头部分进行。wo2019121734中公开了糖-氨基甲酰亚烷基药物缀合物,以提高药物的口服生物利用度。尽管口服生物利用度有所提高,但药物缀合物在患者体内的水解效率似乎取决于药物的结构特征。替代地,糖部分可以通过非异头羟基,例如糖的6-oh,同样通过接头分子连接至药物分子。例如,已知葡萄糖的6-o-酮洛芬和吲哚美辛酯,以及半乳糖的6-羟基和多巴胺之间的琥珀酸酯接头。尽管这些缀合物均不具有口服生物利用度,因此不可用于口服施用,但它们能够穿过血脑屏障并促进药物在大脑中的积累。
11、载体前药的另一个特殊子集是adc。这些前药是生物缀合物和免疫缀合物的实例,是一类重要的高效药物,被设计为治疗癌症患者的靶向疗法。与化疗不同,adc旨在仅靶向并杀死癌细胞,而不伤害健康细胞。adc是由与生物活性细胞毒性有效负载或药物连接的单克隆抗体组成的复杂分子。adc的抗体部分专门靶向某种肿瘤标志物,并追踪患者体内的这些蛋白质并将其附接在癌细胞表面。抗体和靶蛋白之间的生化反应触发肿瘤细胞中的信号,然后肿瘤细胞将抗体与细胞毒素一起吸收或内化。adc被内化后,细胞毒性药物被释放并杀死癌细胞。由于这种靶向,理想情况下该药物具有较低的副作用,并且可能比其他化疗药物提供更广泛的治疗窗口。药物可以通过多种方式与抗体偶联。通常,接头用作药物和抗体之间的界面。
12、其他特殊类别的载体前药是共同前药(或共药)和先药。在共同前药中,两种药理学活性剂连接在一起形成单个分子。然后,这些药物中的每一种都充当另一种药物的载体。前药是活性药物,当部分药物水解时会失活。该可水解部分可与前药中的前体部分进行比较。
技术实现思路
1、本发明的一个目的是提供充当前药并包含改善的接头的新化合物,该化合物表现出改善的性质。
2、本发明的另一个目的是提供可用作(共同)前药、先药、药物、疗法、显像剂或诊断剂的新化合物,以及所述化合物作为附接至药物分子的接头以改善所述药物分子的以下一项或多项的用途:溶解度、渗透性、稳定性、味道、口服生物利用度、溶出和/或处置。本发明中“所述化合物作为附接至药物分子的接头的用途”是指根据第一方面的化合物是前药,包含其一个或多个所记载的特性待改善的药物。
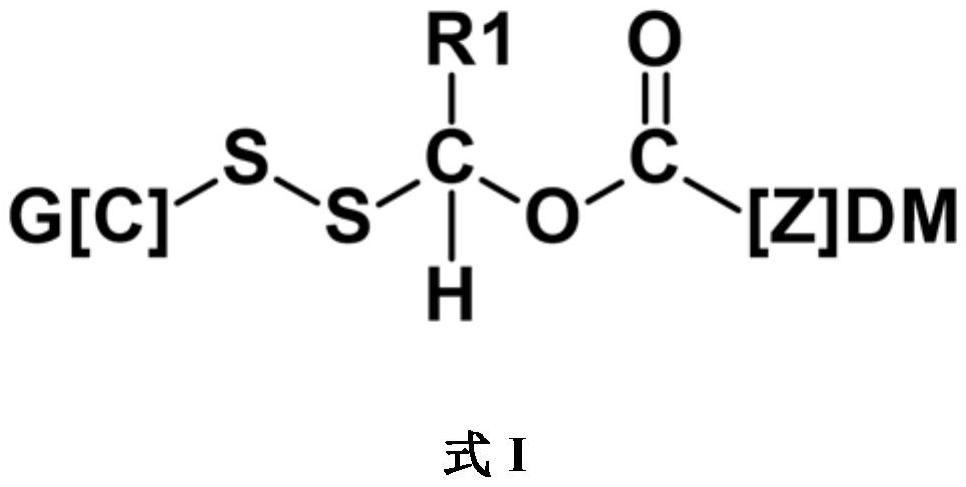
3、在第一方面,本发明涉及根据权利要求1的根据式i的化合物或其药学上可接受的盐。在另一方面,本发明涉及一种试剂化合物—适合于制备根据本发明(根据权利要求9的根据式viii)的化合物。在另一方面,本发明涉及一种用于制备根据权利要求10的所述试剂化合物的方法。在另一方面,本发明涉及用于制备根据权利要求11所述的根据式ia的化合物或其药学上可接受的盐的方法。在另一方面,本发明涉及用于制备根据权利要求12所述的根据式i的化合物或其药学上可接受的盐的方法。在另一方面,本发明涉及用作前药、共同前药或先药的根据本发明的化合物。在另一方面,本发明涉及用作药物、疗法、显像剂或诊断剂的根据本发明的化合物。在另一方面,本发明涉及根据本发明的化合物,其用作附接至药物分子的接头以改善所述药物分子的以下一项或多项:溶解度、渗透性、稳定性、味道、口服生物利用度、溶出和/或处置。
4、这些方面的实施方案在下文和所附权利要求中公开。
5、定义列表
6、在本说明书和权利要求中使用以下定义来定义所述的主题内容。下面未引用的其他术语意味着具有本领域普遍接受的含义。
7、本说明书中使用的“烷基”是指可以是支链或非支链的烷基基团。烷基的实例包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基和正戊基。
8、本说明书中使用的“烷氧基”是指与氧原子键合的烷基基团。烷氧基的实例包括甲氧基、乙氧基和丙氧基。
9、本说明书中使用的“烯基”是指具有至少一个碳碳双键的支链或非支链烃残基。烯基的实例包括次乙基(乙烯基)、烯丙基、丙-1-烯基、丁-1-烯基、丁-2-烯基、丁-3-烯基、2-甲基-丙-2-烯基、戊烯基和己烯基。
10、本说明书中使用的“炔基”是指具有至少一个碳碳三键的烃残基。炔基的实例包括乙炔基、丙炔基、丁炔基和戊炔基。
11、本说明书中使用的“氰基”是指:-cn。
12、本说明书中使用的“氨基”是指:-nh2。
13、本说明书中使用的“酰胺”是指:-c(=o)nh2。
14、本说明书中使用的“氨基甲酸酯”是指:-nh-c(=o)-o-。
15、本说明书中使用的“脲”是指:-nh-c(=o)-nh-。
16、本说明书中使用的“碳酸酯”是指:-o-c(=o)-o-。
17、本说明书中使用的“环烷基”是指饱和烃环结构。环烷基的实例包括环丙基、环丁基、环戊基、环己基、环庚基和环辛基。
18、本说明书中使用的“环杂烷基”是指环内具有一个或多个杂原子如o、n或s的饱和烃环结构。环杂烷基的实例包括氮杂环丁烷、氧杂环丁烷、吡咯烷、四氢呋喃、哌啶、四氢吡喃、哌嗪和吗啉。
19、本说明书中使用的“环烯基”是指部分饱和的烃环结构。环烯基的实例包括环丁烯基、环戊烯基和环己烯基。
20、“杂环”是指具有3至6个碳原子和1至4个杂原子(如n、s和o)的芳香族、饱和或部分饱和的环结构。杂环的实例包括噻吩基、呋喃基、吡喃基、吡咯基、咪唑基、吡唑基、异噻唑基、异噁唑基、吡啶基、吡嗪基、嘧啶基、哒嗪基、氧杂环丁基、四氢呋喃基、四氢吡喃基、三唑基、四唑基、噁唑基、噁二唑基、吡咯啉基、哌啶基和吗啉基。
21、本说明书中使用的“芳基”是指芳香族烃环。芳基的实例包括苯基和萘基。
22、本说明书中使用的“药物分子”的“药物”是指药物活性剂。这可以是已批准的医药药物或正在进行实验室测试、或临床前或临床试验的候选药物。
23、本说明书中使用的“药物部分”是指作为根据本发明的化合物的一部分/连接至根据本发明的化合物的药物分子。
24、本说明书中使用的“氨基酸”是指天然l-氨基酸及其d-对应物,并且还指同型氨基酸和衍生自甘氨酸或β-丙氨酸核心结构的非天然氨基酸。
25、本说明书中使用的“糖”是指α-和β-连接的单糖、二糖、三糖和四糖。单糖的分子通式为(ch2o)n,其中n可以是4、5或6。可以根据分子中碳原子的数量对它们进行分类。n为4的单糖称为丁糖,n为5的单糖称为戊糖,例如核糖和脱氧核糖,n为6的单糖称为己糖,例如甘露糖、葡萄糖和半乳糖。二糖由两个单糖单元组成。相关二糖的实例是麦芽糖、异麦芽糖、纤维二糖、龙胆二糖和乳糖。三糖和四糖是分别由三个和四个单糖单元组成的寡糖。三糖的实例是麦芽三糖、异麦芽三糖、negerotriose和松三糖。四糖的实例是麦芽四糖和黑四糖。
26、本说明书中使用的“维生素”是指维生素a、b1-9、c、d2-3和e。
27、本说明书中使用的“抗体”是指属于免疫球蛋白超家族且平均分子量为150kda的糖蛋白。它们通常由基本结构单元组成—每个单元都有两条大重链和两条小轻链。有几种不同类型的抗体重链,它们定义了可附接到抗原结合片段的五种不同类型的可结晶片段(fc)。五种不同类型的fc区使抗体可以分为五种同种型。尽管所有抗体的总体结构非常相似,但蛋白质尖端的小区域被称为高变区,允许存在数百万个尖端结构或抗原结合位点略有不同的抗体。这些变体中的每一个都可以结合至不同的抗原。
28、本说明书中使用的“蛋白质”是指由一个或多个长链氨基酸残基组成的大生物分子或大分子。这些生物分子还可能含有寡糖链。
29、本说明书中使用的“口服生物利用度”是指口服施用后药物进入体循环、从而可到达所需作用位点的程度和速率。本发明上下文中的口服生物利用度在本文中定义为口服施用的药物到达体循环的分数。
30、本说明书中使用的“保护基”或“保护基团”是指作为分子中现有官能团如-oh基团的可逆形成的衍生物的基团。临时附接保护基团以降低官能团的反应性,使得受保护的官能团在分子在一个或多个后续步骤中所经历的合成条件下不发生反应。在本发明中,具有一个或多个这些保护基团的化合物是前体化合物,并且在根据本发明的化合物是例如用于进一步合成,例如作为前药的前体部分,需要除去这些一个或多个保护基团以使最终获得的化合物(例如前药)具有活性。
31、本说明书中使用的“lc-ms/ms方法”是指用于检测残留化合物、确认性鉴定小有机分子以及确认和定量药物和食品样品中的污染物和掺假物的工具。该缩写代表具有串联质谱的液相色谱。
- 还没有人留言评论。精彩留言会获得点赞!