UGT84A1基因在调控花青素合成上的应用
ugt84a1基因在调控花青素合成上的应用
技术领域
1.本发明属于生物技术领域,涉及一种ugt84a1基因在调控花青素合成上的应用。
背景技术:
2.糖基转移酶是将活性糖转移到不同的受体分子上, 如蛋白质、核酸、脂质和小分子物质等, 以改变其稳定性、溶解性、生物活性和定位等的酶 (hou et al., 2004; 2001)。糖基化是生物体内一种普遍的化学修饰,由糖基转移酶催化,糖基化修饰是调节植物生长发育和细胞内物质平衡的重要机制。糖基转移酶家族中的尿苷二磷酸 (udp)-糖基转移酶 (ugt) 在糖基化修饰机制中发挥最为重要的作用 (rahimi et al., 2019)。ugt成员在c端具有保守的氨基酸序列, 该序列由44个氨基酸组成, 被称为pspg区域 (plant secondary product glycosyltransferase), 该序列与udp的识别结合相关, 当该区域突变后, 糖基转移酶活性丧失 (huang et al., 2021; li et al., 2001)。而n端氨基酸序列通常具有多样性, 被认为与底物的识别有关, 底物通常是带有-oh、-cooh、-nh2、-sh的分子物质 (lim and bowles, 2004)。ugt成员通常以udp-糖作为糖供体, 包括udp-葡萄糖、udp-半乳糖、udp-鼠李糖等, 其中udp-葡萄糖是最常见的糖供体(lim and bowles, 2004)。
3.花青素是一类水溶性黄酮类物质,对人和动物的健康具有重要价值。研究表明, 花青素具有多种生物学活性, 如抗氧化、抗炎、抗癌等功能, 并能够预防心血管疾病 (fairlie-jones et al., 2017; gan et al., 2020; reis et al., 2016)。因此花青素具有重要的营养价值和药理价值,在作物改良中具有重要的研究价值。
4.然后目前,关于如何从基因水平控制花青素的合成的研究还相对较少。
技术实现要素:
5.为实现快速培育能够控制花青素合成的植株,本发明经过研究发现通过使ugt84a1基因过表达可以提高植物中花青素含量,使ugt84a1基因功能丧失可以降低植物中花青素含量利用本发明的方法为提高牧草花青素含量从而改良牧草品质提供了有力的技术支持。
6.为实现本发明的技术目的,本发明第一方面提供ugt84a1基因在调控花青素合成方面的应用。
7.特别是,所述应用至少包括b1)至b3)中的任一种:b1) 通过增加植物中ugt84a1基因的表达提高花青素的积累;b2) 通过抑制植物中ugt84a1基因的表达降低花青素的积累;b3) 将ugt84a1基因或促进ugt84a1基因表达的生物试剂或抑制ugt84a1基因表达的生物试剂用于制备调控植物花青素含量的制剂。
8.其中,所述植物为十字花科植物或豆科植物。
9.优选的,所述植物为拟南芥或蒺藜苜蓿。
10.其中,所述通过增加植物中ugt84a1基因的表达提高花青素的积累是通过基因工程手段增加活性基因的数量,包括:将ugt84a1基因连接至过表达载体并对宿主细胞进行浸染,所述宿主细胞能够浸染植物并将目的基因整合至植物的染色体中。
11.特别是,所述通过抑制植物中ugt84a1基因的表达降低花青素的积累是通过基因工程手段使ugt84a1基因功能丧失。
12.特别是,所述通过基因工程手段使ugt84a1基因功能丧失包括向ugt84a1基因中插入tnt1转座子。
13.特别是,所述通过基因工程手段使ugt84a1基因功能丧失包括通过rnai抑制ugt84a1基因表达。
14.其中,所述通过rnai抑制ugt84a1基因表达是通过构建rnai表达载体转入苜蓿植株中,进而抑制ugt84a1基因的表达。
15.特别是,所述通过基因工程手段使ugt84a1基因功能丧失包括利用基因编辑敲除ugt84a1基因。
16.其中,所述基因编辑包括但不限于crispr,talen。
17.为实现本发明的技术目的,本发明第二方面提供ugt84a1突变体在降低植物中花青素的积累方面的应用,其中,所述ugt84a1突变体含有插入tnt1转座子的ugt84a1基因。
18.为实现本发明的技术目的,本发明三方面提供ugt84a1过表达载体在提高植物中花青素的积累方面的应用。
19.为实现本发明的技术目的,本发明第四方面提供一种促进植物中花青素含量方法,包括:通过基因工程手段获取高表达ugt84a1基因的植株。
20.为实现本发明的技术目的,本发明第五方面提供一种降低植物中花青素含量方法,包括:通过向ugt84a1中插入tnt1转座子或通过rnai抑制ugt84a1基因表达或利用基因编辑敲除植物中的ugt84a1基因获取ugt84a1表达抑制的植株。
21.为实现本发明的技术目的,本发明第六方面提供一种培育植物的方法,通过提高受体植物中ugt84a1蛋白的表达量,得到转基因植物;与受体植物相比,转基因植物的花青素含量升高。
22.为实现本发明的技术目的,本发明第七方面提供一种培育植物的方法,通过减少受体植物中ugt84a1蛋白的表达量,得到植物;与受体植物相比,植物中花青素含量降低。
23.有益效果,本发明利用ugt84a1基因,使其在植物中过表达或功能丧失即可实现快速培育花青素含量升高或降低的植株,从而改良牧草品质提供了有力的技术支持。
附图说明
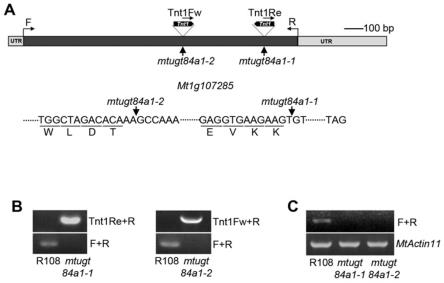
24.图1是实施例1中dna和rna水平鉴定mtugt84a1突变体的结果图,其中,1a表示tnt1在mtugt84a1-2突变体的插入位置;1b表示突变体为纯合体,1c表示mtugt84a1基因在突变体中的表达结果;图2是实施例1中mtugt84a1突变体表型分析结果图,其中,图2a是野生型和突变体萌发后幼苗材料下胚轴和叶柄照片,图2b是野生型和突变体幼苗期(出苗30天)叶片和叶柄的照片,图2c是野生型和突变体材料生长3个月整株表型照片,图2d是图c植株分枝放大照
片,图2e是野生型和突变体材料叶柄长度测定结果,图2f是野生型和突变体材料花青素含量测定结果,图2g是野生型和突变体材料株高测定结果;图2h是野生型和突变体材料节间长测定结果,图2i是野生型和突变体材料节间数量测定结果;图3是实施例2中花青素合成基因的表达分析结果;图4是实施例3中野生型和突变体材料花青素糖苷含量测定结果,其中图4a表示野生型和突变体材料中花青素糖苷芍药素3-氧-葡萄糖苷(peonidin3-o-glucoside)含量测定结果,图4b表示野生型和突变体材料花青素糖苷飞燕草素3-氧葡萄糖苷(delohinidin3-o-glucoside)含量测定结果;图5是实施例4中检测mtugt84a1糖基化活性结果,5a表示芍药素糖基化活性,5b表示飞燕草素糖基化活性图6是实施例5中检测mtugt84a1对不同光强的响应结果,其中图6a是mtugt84a1启动子上6个光响应元件和2个茉莉酸响应元件预测的位置图,图6b是不同光照强度(nil表示正常光照,hil强光照)处理后野生型和突变体材料中mtugt84a1的表达水平,图6c是野生型和突变体材料在不同光照强下的表型茎和叶柄的颜色,图6d是在不同光强下野生型和突变体材料中花青素含量。
25.图7是实施例6中不同meja浓度下表型分析结果,其中,图7a为野生型和突变体的表型照片,图7b是野生型和突变体的叶柄长度统计结果,图7c是冠部花青素含量检测结果,图7d是mtugt84a1基因的表达结果;图8是实施例7中过表达mtugt84a1蒺藜苜蓿表型,其中图8a是2株过表达材料和野生型材料的芽茎照片,图8b是2株过表达材料和野生型材料的植株照片,图8c是2株过表达材料和野生型材料的mtugt84a1基因表达结果,图8d是过表达材料和野生型材料的花青素含量结果;图9是实施例7中,过表达mtugt84a1拟南芥表型,其中,图9a是3株过表达材料和野生型材料的植株照片,图9b是3株过表达材料和野生型材料的植株叶片照片;图9c是3株过表达材料和野生型材料的mtugt84a1基因表达量检测结果。图9d是3株过表达材料和野生型材料的花青素含量测定结果。
具体实施方式
26.下面参考具体实施例,对本发明进行说明,需要说明的是,这些实施例仅仅是说明性的,而不能理解为对本发明的限制。若未特别指明,实施例中所采用的技术手段为本领域技术人员所熟知的常规手段,所采用的试剂和产品也均为可商业获得的。未详细描述的各种过程和方法是本领域中公知的常规方法,所用试剂的来源、商品名以及有必要列出其组成成分者,均在首次出现时标明,其后所用相同试剂如无特殊说明,均以首次标明的内容相同。
27.实施例1mtugt84a1基因的来源 本发明对50多份蒺藜苜蓿tnt1突变体材料,对其进行表型筛选,并与野生型蒺藜苜蓿r108进行比对,获得了花青素积累受抑制且植株矮小的蒺藜苜蓿突变体mtugt84a1-1(nf17856)和mtugt84a1-2(nf7002)。上述突变体材料及野生型材料均购自于美国诺贝尔研究所(nobleresearchinstitute,ardmore,ok,usa)。
28.0028.为了鉴定造成该突变体表型的基因,我们对该突变体进行了测序,测序方法参照发表文章(lietal.,2019)。用tnt1转座子特异片段作为探针,富集带有tnt1的dna片段,对tnt1的侧翼序列进行测序,进而鉴定出tnt1的插入位置。测序所用引物为: tnt1fw:acagtgctacctcctctggatg; tnt1re:cagtgaacgagcagaacctgtg; f:atgacatacgaagatcccattaa; r:ctagatgttaacattattaattaat。
29.测序结果如表1所示,共有11个基因在可信范围之内,其中1号染色体上的mtr1g107285和2号染色体上的mtr2g033880被富集到的概率最高。剪取50株突变体叶片混合提取dna,选取表1中11个基因在tnt1两端的侧翼序列设计引物,采用本领域常规方法并根据在tnt1两端的侧翼序列设计的引物均可以实现本发明的技术目的。然后利用pcr检测混合dna中的11个基因的扩增条带。结果显示,只有mtr1g107285的检测结果没有扩增条带,可见,该突变体的表型是由tnt1插入mtr1g107285基因造成的。mtr1g107285编码尿苷二磷酸-葡萄糖基转移酶(uridinediphosphate(udp)-glucosyltransferase,ugt),同源比对结果显示,该糖基转移酶与拟南芥atugt84a1同源性为50.9%,因此将其命名为mtugt84a1,将nf17856命名为mtugt84a1-1。
30.表1tnt1插入位点。
31.经发明人研究发现,上述蒺藜苜蓿突变体mtugt84a1-1(nf17856)和mtugt84a1-2(nf7002)的tnt1转座子插入在mtugt84a1基因的位点不同。tnt1插入在mtugt84a1-1突变体atg下游1,252bp处,tnt1插入在mtugt84a1-2突变体atg下游830bp处,两个突变体均为纯和,如图1a和1b所示。rna水平鉴定结果显示,tnt1的插入导致两个突变体中mtugt84a1基因没有表达(图1c)。
32.可见,tnt1的插入导致两个突变体中mtugt84a1基因没有表达,导致花青素积累受抑制。
33.其中,所述mtugt84a1基因的核苷酸序列如genbank:geneid:25485386基因编号mtr_1g107285所示。
34.当然,本领域技术人员还可以应用本领域其他常规技术使mtugt84a1基因在植物体中表达降低或不表达,例如通过构建rnai表达载体转入植株中,进而干扰ugt84a1基因的表达或抑制ugt84a1基因的表达,本领域技术人员还可以采用基因编辑技术对植物中的
ugt84a1基因进行编辑,例如crispr敲除ugt84a1基因或talen编辑ugt84a1基因。
35.实施例2突变体材料的表型鉴定 1、突变体材料的培养 将购自于美国诺贝尔研究所(nobleresearchinstitute,ardmore,ok,usa)的蒺藜苜蓿突变体mtugt84a1-1(nf17856)、mtugt84a1-2(nf7002)与蒺藜苜蓿(medicagotruncatula)野生型r108采用培养箱进行种植培养,具体为: 将蒺藜苜蓿种子在细砂纸上轻轻摩擦去掉硬皮,将种子平铺于湿润滤纸上,放于4℃冰箱水合两天,在温度为24℃、光照周期为16h(光照)/8h(黑暗)的培养箱中萌发生长4天至两片子叶伸展,获得蒺藜苜蓿突变体mtugt84a1-1(nf17856)幼苗和蒺藜苜野生型r108幼苗。
36.将进口土、蛭石、东北黑土按比例1:1:1混匀,分装到小花盆中,提前将土润湿,将上述4天的幼苗移栽到土壤中继续培养,培养光周期为16h(光照)/8h(黑暗),湿度:70%,温度:24℃,得到植株。
37.2、表型鉴定 观察突变体以及野生型蒺藜苜蓿幼苗期和成株期的生长状态及花青素含量,具体表型观察结果如图2所示。
38.从图2a中可以看出,与野生型r108相比,突变体幼苗期下胚轴颜色变浅,这是由于野生型108幼苗期下胚轴颜色为紫色,而突变体的幼苗期下胚轴颜色为翠绿色,导致图2a中突变体幼苗期下胚轴颜色以及整个生育期叶片和茎秆的颜色变浅。同时野生型叶片特有的斑点消失,整个叶片呈浅色(图2b),突变体株高和节间长度明显低于野生型(图2c、图2d)。突变体叶柄长度显著短于野生型(图2e),花青素含量测定结果显示,两个突变体花青素含量显著降低(图2f),对野生型和突变体的株高统计结果显示,突变体的株高和节间长度显著低于野生型(图2g、图2h),节数显著多于野生型(图2i)。可见,突变体具有花青素含量积累和生长发育受抑制的表型。
39.实施例3mtugt84a1突变体中花青素的分析1、花青素合成相关基因的检测mtugt84a1突变体中花青素含量显著低于野生型,为了确定花青素合成途径发生改变的环节,发明人对该突变体和野生型的rna进行测序分析,结果发现花青素合成基因mtchs、mtchi、mtf3h和mtdfr显著上调,qrt-pcr方法检测结果如图3所示。其中,qrt-pcr所用引物为:mtactin11f:caaaagatggcagatgctgaggat;mtactin11r:catgacaccggtatgacgaggtcg。
40.atactin2/8f:acggtaacattgtgctcagtggtg;atactin2/8r:cttggagatccacatctgctgga。
41.mtugt84a1f:gcaaagggtgccactgttat;mtugt84a1r:agagctctgaaggctgaacg。
42.mtf3hf:catcaagcaccacagaatgg;mtf3hr:gggaaagaggtgttgatgga。
43.mtchsf:gcagtcattgttggctctga;
mtchsr:ggaatgcctcaaacaatgct。
44.mtchif:tcaatcaccgcaatcactgt;mtchir:tccatttggcagctagtgaa。
45.mtdfrf:tcaagtggttctgctgtttca;mtdfrr:gcttagggcaaacaaaacga。
46.mtmyc2f:cctgaacttggaatggagga;mtmyc2r:cttggttggccttgtttgat。
47.当然,本领域技术人员还可以采用常规方法设计引物。
48.从图3可以看出,mtugt84a1基因发生突变后,花青素合成基因上调,说明mtugt84a1突变体中花青素含量的降低不是由于合成阶段缺陷造成的,可见,mtugt84a1在花青素合成途径中发挥反馈调节作用,从而精细调节花青素的平衡。
49.2、花青素的定性定量分析由于mtugt84a1突变体总花青素含量显著低于野生型,而花青素合成基因上调,可见,花青素含量降低不是由于花青素合成缺陷造成的。于是本发明对野生型和mtugt84a1突变体中花青素进行了液相色谱-串联质谱分析。结果显示,mtugt84a1突变体中多种花青素糖苷含量显著降低,包括芍药素3-氧-葡萄糖苷及其衍生物芍药素3,5-氧-双葡萄糖苷和芍药素3-氧(6-氧-丙二酰-d-葡萄糖苷)分别降低为野生型的20%、24%和20%,飞燕草素3-氧-葡萄糖苷及其衍生物牵牛花素3-氧-葡萄糖苷分别降低为野生型的38%和30%(图4,表1)。其中一些黄酮醇糖苷,如槲皮素3-氧-葡萄糖苷和芦丁的含量也显著低于野生型,原花青素b2也显著降低。上述结果说明,mtugt84a1基因突变后花青素3-氧-葡萄糖苷等主要花青素含量显著降低。
50.表2野生型和突变体材料类黄酮代谢物含量。
51.实施例4体外检测mtugt84a1对芍药素和飞燕草素的糖基化本发明还在体外检测了mtugt84a1的糖基化活性,进一步揭示mtugt84a1对花青素糖基化的影响。具体是将mtugt84a1和mtugt84a1δpspg (缺失udp结合域pspg) 分别与带
有gst标签的载体连接,转化大肠杆菌bl21,在体外纯化带有gst标签的蛋白。以葡萄糖为糖供体,将各蛋白分别与芍药素和飞燕草素进行孵育反应。结果显示,mtugt84a1能够在体外糖基化芍药素和飞燕草素。以芍药素3-氧-葡萄糖苷和飞燕草素3-氧-葡萄糖苷为对照,分别在7min和6min处检测到吸收峰,而gst标签蛋白和mtugt84a1δpspg蛋白均不能糖基化这两种花青素(如图5所示)。可见,mtugt84a1能够在体外糖基化芍药素和飞燕草素,从而影响花青素的积累。
52.实施例5光诱导mtugt84a1调控花青素的积累花青素合成和积累受光调控(jaakolaetal.,2002steynetal.,2002)。于是本发明还对mtugt84a1基因atg前2kb的启动子进行分析,在该启动子上找到6个光响应原件见图6a中六条浅色竖线,同时找到两个茉莉酸响应原件见图6a中两个深色线段,暗示mtugt84a1表达受光的调控,本发明首先对mtugt84a1基因是否响应不同光强进行了检测。将野生型和突变体材料进行强光照处理(450molm-2s-1)。结果显示,与正常光照(150molm-2s-1)相比,强光处理后野生型材料中mtugt84a1的表达水平显著升高(图6b),野生型材料的茎和叶柄的颜色显著加深(图6c),花青素含量也显著升高,而突变体材料表型和花青素含量都无显著差别(图6d)。
53.可见,强光诱导了mtugt84a1的表达,从而促进了花青素的积累。
54.实施例6mtugt84a1通过茉莉酸信号途径调控蒺藜苜蓿生长对mtugt84a1基因启动子分析结果显示,该启动子上有meja响应元件(图6a)。因此,本发明检测不同浓度meja条件下野生型和mtugt84a1突变体表型的变化。对野生型和突变体材料外施20mmeja,然后检测各材料的表型。结果显示,当在水培液中外施meja后,野生型生长受到抑制,株高和叶柄长度类似于突变体生长受到抑制的表型,且茎的颜色显著加深,而突变体的表型并无明显变化(图7a,b)。花青素含量测定结果显示,20mmeja处理后,野生型材料花青素含量显著升高,突变体中花青素含量并无显著差别(图7c)。表达量检测结果显示,mtugt84a1基因的表达受meja诱导升高(图7d)。研究结果表明,mtugt84a1突变体生长受抑制的表型可能是体内茉莉酸含量过高所致,表明在茉莉酸诱导下mtugt84a1表达量的上调在花青素积累调控中发挥重要作用。
55.根据实施例4-6的试验结果可以看出,mtugt84a1基因在花青素积累调控中发挥重要作用。
56.实施例7mtugt84a1基因的过表达试验为了进一步证明mtugt84a1的功能,将mtugt84a1的cds序列连接过表达载体pcambia1302,获得35s:mtugt84a1高表达载体,然后转入农杆菌eha105和gv3101,最后分别转化到野生型蒺藜苜蓿和野生型拟南芥中,获得蒺藜苜蓿过表达材料和拟南芥过表达材料。
57.其中,cds序列是通过https://plants.ensembl.org/medicago_truncatula/info/index获得,序列号loc25485386,转化蒺藜苜蓿的方法参照文献(cossonetal.,2006),转化拟南芥的方法参照文献(cloughandbent,1998)。
58.1、蒺藜苜蓿过表达材料的表型验证选择两个表达量显著高于野生型的过表达材料进行表型检测,结果如图8所示。过表达材料下胚轴和茎的颜色明显深于野生型(图8a-c),花青素含量测定结果显示过表达
材料的花青素含量显著高于野生型 (图8d)。可见,具有mtugt84a1基因的过量表达促进蒺藜苜蓿花青素积累。
59.2、拟南芥过表达材料的表型验证选择三个表达量显著高于野生型的拟南芥过表达材料进行表型检测,如图9所示,结果显示,过表达mtugt84a1拟南芥莲座叶的颜色明显深于野生型 (图9a-c),花青素含量测定结果显示过表达材料的花青素含量显著高于野生型 (图9d)。进一步说明,mtugt84a1基因能够促进植物花青素积累。
60.综上可知,与突变体和野生型材料相比,mtugt84a1基因功能的丧失使得突变体材料的花青素含量积累受抑制,而mtugt84a1基因过表达材料促进了花青素的积累。
61.因此,本领域技术人员通过常规的基因工程手段使植物体内的ugt84a1基因高表达,即可促进植物中花青素含量或者培育转基因植物;通过分子生物技术手段使ugt84a1基因丧失,即可降低植物中花青素积累或者培育转基因植物。
62.本发明的内容不限于具体实施例所举例,本领域技术人员通过阅读本说明书而对本发明技术方案采取的任何等效的变换,均为本发明的权利要求所涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1