一种治疗性细胞或其前体细胞的制备方法
本发明涉及一种治疗性细胞或其前体细胞的制备方法,属于生物医药。
背景技术:
1、关于将目的基因整合到细胞中的技术,例如将car基因(嵌合抗原受体基因)整合至t/nk细胞中的技术,传统方法是用包含car基因的慢病毒或逆转录病毒感染t/nk细胞,该方法的弊端是car基因随机整合到t/nk细胞基因组中,容易导致随机插入的安全隐患,例如插入点突变或诱导细胞发生转化甚至癌变的风险。
2、现有技术中公开了一些定点整合技术,例如,利用双链微载体,或者通过基因编辑系统(诸如zfn、talen或crispr-cas9等)将目标基因定点整合到细胞中的特定位点,尤其是将识别肿瘤抗原的car基因整合到t/nk细胞中的特定位点,获得治疗用car-t/nk细胞。
3、关于整合的特定位点的选择,目前经过本领域科学家验证的常规整合位点,主要包括:t细胞受体tcr恒定区基因位点(例如trac位点)、pd-1、hpk1和aavs1。在这些经过验证的特定位点敲入,能确保敲入的外源目的基因片段(car基因片段)能被正常转录、实现预期功能。
4、例如,eyquem j等人利用crispr-cas9技术将car基因定点整合到人原代t细胞中的trac位点,在敲除tcr的同时表达car,制备治疗型car-t细胞。这种方法制备出来的car-t细胞相对于逆转录病毒制备的car-t细胞而言,car表达更均一,car-t细胞的耗竭更少,car-t细胞的记忆表型增多,car-t细胞的治疗效果更好。(eyquem j, et al. targeting acar to the trac locus with crispr/cas9 enhances tumour rejection. nature.2017;543(7643):113-117.)
5、由于大片段的外源目的基因(例如car基因表达盒)的敲入效率较低,为提高定点整合的效率,现有技术将基因编辑系统与同源介导修复机制相结合。具体来说,通过基因编辑系统(诸如zfn、talen或crispr-cas9等)对上述常规的特定位点进行剪切,修复模板在同源介导修复机制下对断裂位点进行修复,同时将外源目的基因(例如car基因表达盒)敲入到该特定位点,制备获得特定位点基因敲除且稳定表达外源目的基因的细胞。目前使用的修复模板主要有质粒dna、双链dna、单链dna和腺相关病毒载体。对于大片段基因敲入,目前腺相关病毒载体效率相对较高。
6、除了上述的提高目的基因在特定位点的定点整合效率以外,如何进一步提高治疗性细胞(例如car-t/nk细胞)的治疗效果,也是本领域技术人员亟待解决的技术问题。
技术实现思路
1、本技术的发明人突破了本领域技术人员的常规思维定势,选用非常规的靶点基因位点作为整合的特定位点,尝试着将结合靶点抗原的受体基因定点整合至治疗性细胞及前体细胞靶点基因位点,发现能够从技术手段上实现靶点敲除与定点整合两个步骤二合一,即在敲除/破坏治疗性细胞及前体细胞中的靶点基因的同时,将结合靶点抗原的受体基因定点整合至靶点基因位点,获得具备抗自相残杀的能力的治疗性细胞(诸如car-t/nk细胞),并意外发现这些细胞的体内外抗肿瘤疗效更好。
2、具体来说,现有技术中,本领域研究者们发现,在开发免疫细胞疗法治疗t/nk细胞相关恶性肿瘤时候,需要针对恶性t/nk细胞上的一些分子,如cd5、cd7、cd38等,开发相应的car-t/nk细胞,比如靶向cd5的car-t/nk细胞、靶向cd7的car-t/nk细胞、靶向cd38的car-t/nk细胞。但是用来制备car-t/nk的正常t细胞或nk细胞自身也会表达这些靶点分子,从而引发自相残杀并影响相应的car-t细胞和car-nk细胞的功能。
3、为了提高car-t/nk细胞的抗自相残杀的能力,并进而提高car-t/nk细胞的抗肿瘤活性,本领域科学家们尝试通过crispr-cas9技术来改造t/nk细胞,例如,采用crispr-cas9技术将t/nk细胞中引发自相残杀的基因(例如cd5、cd7、cd38等基因)敲除或破坏。
4、然而,关于car基因敲入的特定位点的选择,正如背景技术中所述,目前经过本领域科学家验证的常规敲入位点,主要包括:t细胞受体tcr恒定区基因位点(例如trac位点)、pd-1、hpk1和aavs1。在这些经过验证的特定位点敲入,能确保敲入的外源目的基因片段(car基因片段)能被正常转录、实现预期功能。
5、因此,基于目前现有技术中理论与操作手段上的局限,本领域技术人员的常规思维定势是,在现有的通过定点整合技术将car基因敲入上述的常规特定位点或用逆转录/慢病毒转导技术将car基因随机整合的步骤之前,增加一个敲除/破坏步骤;即先采用crispr-cas9技术将t/nk细胞中可能引发自相残杀的基因(例如cd5、cd7、cd38等基因)敲除或破坏,再通过定点整合技术将car基因敲入上述的常规特定位点或用逆转录/慢病毒将car基因随机整合到基因组。
6、具体来说,目前已公开的解决自相残杀的技术方案如下:
7、maksim mamonkin课题组报道了在用逆转录病毒转染cd7 car之前用crispr-cas9技术将t细胞的cd7基因敲除能减少car-t自相残杀、促进car-t扩增,同时不影响car-t的细胞毒性作用(gomes-silva d, et al. cd7-edited t cells expressing a cd7-specificcar for the therapy of t-cell malignancies. blood. 2017;130(3):285-296.)。基于此的cd7 car-t疗法治疗t细胞肿瘤现已进入临床阶段(nct03690011)。另一项通用型ucart7研究也是利用crispr-cas9技术,在用慢病毒病毒转染cd7 car之前,将cd7和tcrα进行敲除,用来解决自相残杀和排异问题。
8、michael o’dwyer课题组报道,在表达cd38 car的nk细胞中,利用crispr-cas9技术破环cd38基因,能够减少car-nk细胞之间的自相残杀,促进car-nk细胞对肿瘤细胞的有效杀伤(gurney m, et al. cd38 knockout natural killer cells expressing anaffinity optimized cd38 chimeric antigen receptor successfully target acutemyeloid leukemia with reduced effector cell fratricide. haematologica. 2022;107(2):437-445.)。
9、然而,本技术的发明人突破了上述本领域技术人员的常规思维定势,尝试着将结合靶点抗原的受体基因定点整合至治疗性细胞及前体细胞靶点基因位点,发现能够从技术手段上实现敲除与定点整合两个步骤二合一。本发明方法的技术方案,将两个步骤二合一,在提高生产效率的同时,发明人还意外发现本技术方案获得的治疗性细胞与现有技术的相比,还能够提高治疗性细胞在体外扩增时的活率,提高治疗性细胞在体外扩增的产量,减少治疗性细胞在体外的耗竭,更为重要的是能够增强治疗性细胞在体内的抗肿瘤疗效,具有良好的临床应用前景。
10、本发明第一方面提供了一种治疗性细胞或其前体细胞的制备方法,其中,
11、该制备方法包括如下步骤:
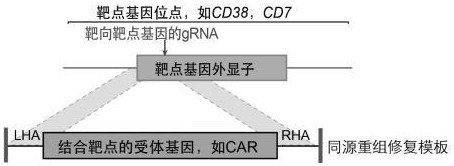
12、步骤1),获取免疫细胞或其前体细胞;所述免疫细胞或其前体细胞具有靶点基因,所述靶点基因表达靶点抗原;
13、步骤2),将基因编辑系统递送至所述免疫细胞或其前体细胞,以断裂所述靶点基因的位点,和
14、将包含了结合所述靶点抗原的受体基因的同源重组修复模板载体递送至所述免疫细胞或其前体细胞,从而将所述受体基因定点整合至所述靶点基因的断裂位点,并破坏或敲除所述靶点基因;
15、通过上述步骤1)和2)制备获得的治疗性细胞或其前体细胞,其表达结合所述靶点抗原的受体,并且其缺失所述靶点抗原,从而具备抗自相残杀的能力。
16、关于“破坏或敲除所述靶点基因”的表述中,所述“敲除”是指靶点抗原的表达被敲除(不表达靶点抗原),所述“破坏”是导致非功能性抗原的表达(表达的抗原不具有靶点功能)。
17、在本发明的一个具体实施方案中,所述免疫细胞为t细胞、nk细胞、b细胞、巨噬细胞、树突状细胞、单核细胞。在本发明的一个优选实施方案中,所述免疫细胞为t细胞、nk细胞。
18、在本发明的一个具体实施方案中,所述前体细胞为ipsc、hsc干细胞。
19、未经基因工程化处理的前体细胞(没有经过本发明方法处理的前体细胞),其虽然包含靶点基因,但通常来说,其分化前不表达靶点抗原,分化后才表达靶点抗原。
20、在本发明的另一个具体实施方案中,所述免疫细胞或所述前体细胞是自体来源或同种异体来源的。
21、在本发明的一个具体实施方案中,所述靶点抗原为cd38、cd7、cd5、cd3、cd4 或者cd1a。
22、在本发明的一个优选实施方案中,所述受体基因为car基因、tcr基因、star基因或hit受体基因。
23、在本发明的一个优选实施方案中,所述同源重组修复模板载体为腺相关病毒载体、质粒、单链dna、双链线性dna或微环dna;优选的,所述同源重组修复模板载体为腺相关病毒载体。
24、在本发明的一个具体实施方案中,所述同源重组修复模板从5’到3’依次包含:右端同源臂、外源启动子、受体基因、polya序列、左端同源臂。
25、在本发明的一个优选实施方案中,所述同源重组修复模板中采用外源启动子,所述免疫细胞为t细胞或nk;所述靶点抗原为cd7,所述受体基因为结合cd7的car基因。在本发明的另一个优选实施方案中,所述同源重组修复模板中采用外源启动子,所述免疫细胞为t细胞,所述靶点抗原为cd38,所述受体基因为结合cd38的car基因。
26、更优选的,所述外源启动子可以为ef1α外源启动子。
27、在本发明的一个具体实施方案中,所述同源重组修复模板从5’到3’依次包含:左端同源臂、2a序列、受体基因、右端同源臂。内源启动子在敲入位点的上游。
28、在本发明的一个优选实施方案中,所述同源重组修复模板中包含有2a序列以及受体基因,所述免疫细胞为nk细胞,所述靶点抗原为cd38,所述受体基因为结合cd38的car基因。
29、在本发明的一个优选实施方案中,所述左端同源臂和所述右端同源臂的长度分别具有10-1000bp的长度,可以选择例如200bp、300bp、400bp、500bp、600bp、700bp、800bp、900bp、1000bp的片段长度;优选200bp、300bp、800bp的长度。
30、在本发明的一个优选实施方案中,所述受体基因为car基因。优选的,所述car基因包含信号肽、抗原结合区、铰链区、跨膜区、一个或两个共刺激结构和激活区。
31、优选的,所述信号肽选自cd8、il2、gm-csf信号肽结构域,更优选cd8信号肽结构域,更优选cd8a信号肽结构域。
32、所述抗原结合区为结合靶点抗原的部分,优选为抗体scfv或者相应配体。
33、优选的,铰链区选自igg1、igg4、igd和cd8铰链结构域,优选cd28铰链结构域。
34、优选的,所述跨膜区选自cd3、cd4、cd5、cd8、cd9、cd16、cd22、cd27、cd28、cd33、cd37、cd45、cd64、cd80、cd86、cd134、cd137、cd152、cd154和pd1跨膜结构域,优选地cd28跨膜结构域。
35、优选的,所述共刺激结构选自cd2、cd7、cd27、cd28、cd30、cd40、cd54、cd83、cd134、cd137、cd150、cd152、cd223、cd270、cd273、cd274、cd278、card11、nkd2c、dap10、lat、slp76、zap70和4-1bb共刺激结构域;优选cd28共刺激结构域。
36、优选的,所述激活区为cd3ζ激活结构域。
37、在本发明的一个具体实施方案中,所述基因编辑系统选自zfn、talen、crispr;优选crispr。
38、在本发明的一个具体实施方案中,所述crispr系统的核酸酶选自spcas9、sacas9、espcas9、cas12a、cas13或cpf1;优选的,所述crispr系统的核酸酶为spcas9。
39、在本发明的一个具体实施方案中,所述crispr系统的grna还包括碱基的化学修饰;优选的,所述化学修饰为甲基化修饰或硫代修饰或二者的组合;更优选的,所述grna的5’端和/或3’端的1-5个碱基进行2’-0-甲基化修饰和/或3’硫代硫酸化修饰。
40、在本发明的一个具体实施方案中,所述crispr系统的grna为靶向所述靶点基因的grna。优选的,grna的序列设计为靶向cd7基因或cd38基因的grna。
41、在本发明的一个具体实施方案中,所述步骤2)中,将基因编辑系统递送至所述免疫细胞或其前体细胞的方式选自:电穿孔、载体转化、转染、热休克、转导、显微注射;优选,电穿孔。
42、本发明第二方面提供了上述的制备方法获得的治疗性细胞或其前体细胞。
43、本发明第三方面提供了上述的治疗性细胞或其前体细胞在制备基因治疗药物中的应用。
44、在本发明的一个优选实施方案中,所述基因治疗药物用于治疗的疾病选自:恶性肿瘤、自身免疫疾病、免疫排斥反应;
45、所述恶性肿瘤选自:淋巴瘤、慢性淋巴细胞性白血病、急性淋巴细胞性白血病、急性髓细胞性白血病、非霍奇金淋巴瘤、弥漫性大细胞淋巴瘤、多发性骨髓瘤、t系恶性肿瘤、nk相关恶性肿瘤。
46、优选地,所述自身免疫疾病是艾滋病。
47、本发明涉及一种治疗性细胞或其前体细胞的制备方法,该制备方法将结合靶点抗原的受体基因定点整合至治疗性细胞及前体细胞靶点基因位点,从技术手段上实现了敲除与定点整合两个步骤二合一(敲除/破坏治疗性细胞及前体细胞中的靶点基因的同时,将结合靶点抗原的受体基因定点整合至靶点基因位点),通过此方法可以敲除/破坏受体基因的靶点,避免治疗性细胞(诸如car-t/nk细胞)间的自相残杀,不仅提高了生产效率,还能够提高治疗性细胞在体外扩增时的活率,提高治疗性细胞在体外扩增的产量,减少治疗性细胞在体外的耗竭,更为重要的是能够增强治疗性细胞在体内的抗肿瘤疗效,具有良好的临床应用前景。
48、具体来说,1)与传统的慢病毒和逆转录病毒随机整合car基因方法产生的car-t/nk细胞相比,本发明的制备方法获得的治疗性细胞(例如car-t/nk细胞),在小鼠体内的抗肿瘤效果更佳。2)与现有技术中的敲除靶点基因后,再将受体基因整合到常规位点(例如trac位点)的方法相比,本发明的整个制备过程只需要一条grna(只靶向一个靶点基因),仅断裂一处靶点基因位点,显著提高受体基因的整合效率,降低脱靶效应,并且显著提高治疗性细胞(例如car-t/nk细胞)的存活率;此外,在达到同样的受体基因整合效率的情况下,需要的grna的总量更低,能够减低成本。
- 还没有人留言评论。精彩留言会获得点赞!