一种遗传型转甲状腺素蛋白淀粉样变疾病模型的构建方法及应用
本发明涉及疾病模型,具体而言,涉及一种遗传型转甲状腺素蛋白淀粉样变疾病模型的构建方法及应用。
背景技术:
1、遗传型转甲状腺素蛋白淀粉样变(mutant transthyretin amyloidosis,attrm)是由于ttr基因突变引起ttr蛋白错误折叠形成淀粉样物质异常沉积于心脏所致的严重的进展性疾病。attrm患者生活质量差、生存率低,目前超过120个ttr基因致病性突变已被鉴定与attrm发病密切相关。其中v122i突变为第122位缬氨酸被异亮氨酸取代,被认为是attrm患者的重要突变位点:(1)发病率高。既往研究报道,v122i突变在非裔美国人中普遍存在,携带率约为3-4%。近期2个大型三级学术医疗中心对9000多名非裔美国人进行全外显子/全基因组测序结果显示v122i携带率为3.2%,进一步证实v122i的高发病率(j amcoll cardiol.2020jul 7;76(1):93-95.)。(2)心脏受累为主。纳入了来自30个中心957名attr患者的thaos研究结果显示,v122i是attrm心脏淀粉样变最常见的致病突变位点,在所有携带v122i突变的患者中,96.9%的患者表现出心脏受累症状。(3)发病倾向老年。中位随访时间为14年的临床影像研究显示,在50岁以上的v122i携带者中,44%患有心力衰竭或心肌病,在70岁和80岁以上的携带者中,这一比例分别上升至70%和100%。(jamacardiol.2021;6(6):718-722.)(4)生存期短,预后较差。早期一份对4000多名非裔美国人的研究显示结果,与年龄和性别相配对的65岁以上的非裔美国人对照组相比,v122i携带者的心力衰竭(hf)患病率(38%vs 15%)和死亡率(76%vs 53%)更高。英国国家淀粉样变中心数据和美国梅奥诊所数据同样显示,在所有attrm患者亚组中,v122i突变携带者的诊断中位生存期最短,为诊断后不到五年(amyloid,2015;22(2):123-31.hum mutat,2019jan;40(1):90-96.)。
2、基于以上研究,v122i型淀粉样变患者是一种特殊的attrm患者亚型,是老年心力衰竭患者的重要致病因素。
3、随着基因治疗的迅猛发展,基于基因组编辑的多项技术手段逐步尝试用于各种疾病的治疗。基于crispr-cas9系统和细胞同源重组修复机制的基因编辑技术,在基因点突变治疗方面显示出极大的潜力。另一方面,随着胞嘧啶碱基编辑器、腺嘌呤碱基编辑器及prime editing等单碱基编辑系统的开发(nature,2016may 19;533(7603):420-4.),可实现致病点突变的特异性修复,有望在基因组水平修正v122i点突变,达到针对疾病病因的精准治疗。然而,目前各种基因治疗技术正在发展阶段,其有效性及安全性需进一步经临床前研究验证。因此,建立高度接近人类致病基因组特点的人源化动物模型,不仅可以研究揭示基因组点突变致病的生物学原理,更有利于全新疾病治疗手段的研发。缺乏v122i点突变人源化小鼠模型严重阻碍深入研究v122i型attrm的发病机制,以及上述治疗方案如碱基编辑器在v122i型attrm患者治疗研究。
4、为进一步探索v122i突变型ttr蛋白心脏特异性表型的机制及相应治疗方案,构建v122i特异性点突变小鼠模型至关重要。
5、鉴于此,特提出本发明。
技术实现思路
1、本发明的目的在于提供一种遗传型转甲状腺素蛋白淀粉样变疾病模型的构建方法及应用以解决上述技术问题。
2、本发明是这样实现的:
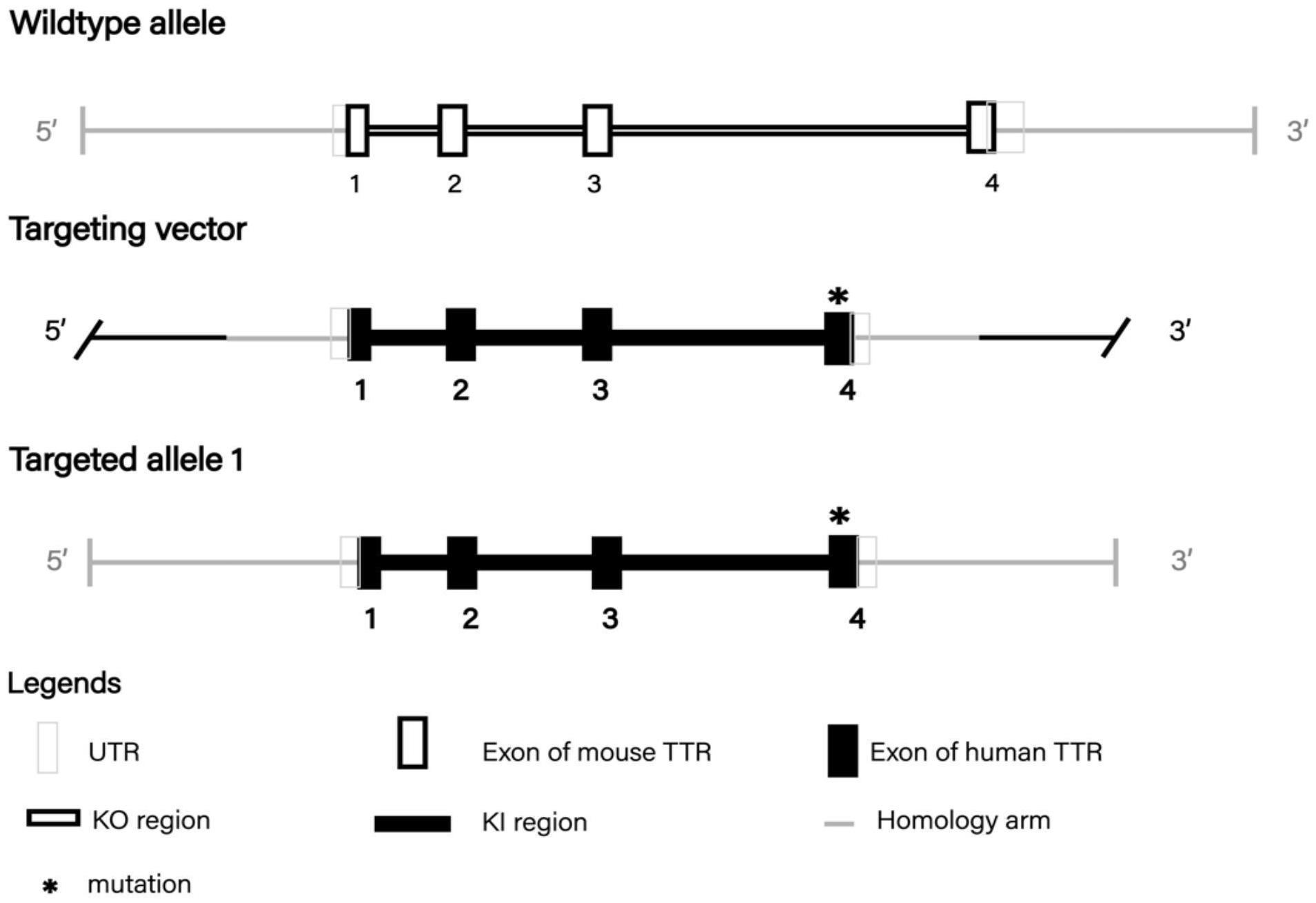
3、第一方面,本发明提供了一种载体,靶向载体含携带点突变的人ttr序列,且人ttr序列包括ttr编码序列和非编码序列;点突变是指人ttr基因c.424g>a点突变(p.val142ile)。
4、发明人首次发现,具有上述点突变的载体可以用于构建遗传型转甲状腺素蛋白淀粉样变疾病模型(attrm模型),获得的疾病模型的肝脏组织和心脏组织免疫组化结果显示阳性,表现httr蛋白沉积,心脏受累特点与临床一致。此外,在疾病模型的眼、大脑、小脑、脊髓、坐骨神经、胃、小肠、胰腺、肾脏、脾脏、脂肪等多个组织均显示阳性,表现人源ttr蛋白沉积。表明本发明成功构建v122i特异性点突变小鼠模型。
5、上述疾病模型的基因状态与人类c.424g>a(p.val142ile)单碱基突变基因组状态一致,此动物模型可完全还原人类v122i突变患者基因序列,并同步观察到明显的心脏httr蛋白沉积。可基于此动物模型评估prime editing等基因治疗技术的真实效果,将来有望基于此动物模型实现v122i基因突变的精准治疗。
6、在本发明应用较佳的实施方式中,携带点突变的人ttr序列与seq id no:1所示的序列具有至少90%,95%,96%,97%,98%,99%,或100%的一致性。
7、在本发明应用较佳的实施方式中,载体在人ttr序列两端还分别设置有5’非翻译区域和3’非翻译区域。
8、第二方面,本发明还提供了一种宿主细胞,其包括上述的载体。
9、宿主细胞例如选自哺乳动物细胞,哺乳动物细胞选自es细胞。
10、在一种可选的实施方式中,宿主细胞还包括sgrna表达载体,sgrna的核苷酸序列如seq id no:2和seq id no:3所示。
11、seq id no:2:gcaaaggaggaagagtcgaaggg。
12、seq id no:3:gggctgagtctctcaattctggg。
13、第三方面,本发明还提供了一种遗传型转甲状腺素蛋白淀粉样变疾病模型的构建方法,其包括如下步骤:
14、通过基因敲除技术使得非人目标哺乳动物的第18号染色体上的ttr编码基因的第1至第4号外显子替换为包含p.val142ile突变位点的人源化ttr编码基因的第1至第4号外显子。
15、突变位点位于第4号外显子。
16、在一种可选的实施方式中,通过基因敲除技术使得非人目标哺乳动物的第18号染色体上的ttr基因座的从ttr起始密码子至ttr终止密码子的区域替换为含ttr基因c.424g>a点突变位点相应的人ttr序列。
17、在一种可选的实施方式中,基因敲除技术为crispr/cas9技术、锌指核酸酶技术或转录激活因子样效应物核酸酶技术。
18、在一种可选的实施方式中,构建方法包括:通过权利要求1-2任一项的载体、sgrna表达载体、cas9 mrna共注射或共电转至非人哺乳动物的受精卵细胞质或细胞核中,并将受精卵移植至假孕非人哺乳动物,筛选成功插入包含p.val142ile突变位点的人源化ttr编码基因片段的阳性f0非人哺乳动物;sgrna的核苷酸序列如seq id no:2和seq id no:3所示。
19、在一种可选的实施方式中,遗传型转甲状腺素蛋白淀粉样变疾病模型的心脏、肝脏、眼、大脑、小脑、脊髓、坐骨神经、胃、小肠、胰腺、肾脏、脾脏、脂肪至少一个部位的httr蛋白阳性。
20、多组织器官httr蛋白阳性表明多组织器官httr蛋白沉积。因此,本发明提供的具有多组织器官病理特征的疾病模型可在器官层面评估真实治疗效果及不同器官的疗效反应。而人源点突变ttr基因的序列特征使此模型在基因组层面充分反映基因编辑真实治疗效果。
21、非人哺乳动物选自小鼠、大鼠或猴。
22、第四方面,本发明还提供了一种遗传型转甲状腺素蛋白淀粉样变疾病模型的构建方法构建获得的遗传型转甲状腺素蛋白淀粉样变疾病模型在筛选遗传型转甲状腺素蛋白淀粉样变疾病预防或治疗药物中的应用。
23、本发明具有以下有益效果:
24、发明人发现,具有c.424g>a点突变(p.val142ile)的载体可以用于构建遗传型转甲状腺素蛋白淀粉样变疾病模型(attrm模型),获得的疾病模型的肝脏组织和心脏组织免疫组化结果显示阳性,表现httr蛋白沉积,心脏受累特点与临床一致。此外,该疾病模型的眼、大脑、小脑、脊髓、坐骨神经、胃、小肠、胰腺、肾脏、脾脏、脂肪等多个组织均显示阳性,表现人源ttr蛋白沉积。因此,本发明成功构建了v122i特异性点突变小鼠模型。
25、构建的疾病模型的基因状态与人类c.424g>a(p.val142ile)单碱基突变基因组状态一致,可完全还原人类v122i突变患者基因序列,并同步观察到明显的心脏httr蛋白沉积。可基于此动物模型评估prime editing等基因治疗技术的真实效果,将来有望基于此动物模型实现v122i基因突变的精准治疗。可以用于筛选遗传型转甲状腺素蛋白淀粉样变疾病预防或治疗药物。
- 还没有人留言评论。精彩留言会获得点赞!