嘧啶环类化合物、其中间体、其药物组合物及其应用的制作方法
本发明涉及嘧啶环类化合物、其中间体、其药物组合物及其应用。
背景技术:
1、ras表示一群具有189个氨基酸的密切相关的单体球状蛋白(21kda分子量),其与质膜相关并结合gdp或gtp。ras充当分子开关。当ras含有结合的gdp时,其处于静止或关闭位置且“无活性”。对细胞暴露于某些生长促进刺激物进行响应时,ras被诱导以将其结合的gdp交换为gtp。在结合gtp的情况下,ras被“打开”并能够与其他蛋白(其“下游靶标”)相互作用并活化所述蛋白。ras蛋白本身具有极低的使gtp水解回gdp、由此使其本身变成关闭状态的固有能力。关闭ras需要称为gtp酶活化蛋白(gap)的外源性蛋白,其与ras相互作用且极大地加速gtp转化成gdp。ras中影响其与gap相互作用或使gtp转化回gdp的能力的任何突变将导致蛋白活化延长,且因此传导至细胞告诉其继续生长和分裂的信号延长。由于这些信号导致细胞生长和分裂,因此过度活化的ras信号传导可最终导致癌症。
2、在结构上,ras蛋白包含负责ras的酶促活性——鸟嘌呤核苷酸结合和水解(gtp酶反应)的g结构域。其还包含称为caax盒的c端延伸区,其可被转译后修饰并负责使该蛋白靶向膜。g结构域在尺寸上大约为21-25kda并含有磷酸结合环(p-环)。p-环表示蛋白中结合核苷酸的囊袋,并且这是具有保守氨基酸残基的结构域的刚性部分,所述保守氨基酸残基为核苷酸结合和水解所必需的(甘氨酸12、苏氨酸26和赖氨酸16)。g结构域还含有所谓的开关i区(残基30-40)和开关ii区(残基60-76),其均为蛋白的动态部分,由于该动态部分在静止和负载状态之间进行转换的能力而常常被表示为“弹簧加载”机制。主要相互作用为由苏氨酸-35和甘氨酸-60与gtp的γ-磷酸所形成的氢键,其使开关1区和开关2区分别维持它们的活性构象。在水解gtp和释放磷酸盐之后,此两者松弛成无活性的gdp构象。
3、ras亚家族中最值得注意的成员为hras、kras和nras,其主要牵涉许多类型的癌症。然而,存在许多其他成员,包括diras1;diras2;diras3;eras;gem;mras;nkiras1;nkiras2;nras;rala;ralb;rap1a;rap1b;rap2a;rap2b;rap2c;rasd1;rasd2;rasl10a;rasl10b;rasl11a;rasl11b;rasl12;rem1;rem2;rerg;rergl;rrad;rras和rras2。
4、ras基因的三种主要的同种型(hras、nras或kras)中的任一个的突变为人类肿瘤形成中最常见的事件之一。发现所有的人类肿瘤中约30%的肿瘤在ras基因中携有一些突变。值得注意的是,在25%-30%的肿瘤中检测到kras突变。相比之下,nras和hras家族成员中发生致癌突变的比率低得多(分别为8%和3%)。最常见的kras突变发现在p-环中的残基g12和g13处以及残基q61处。在肿瘤相关kras g12突变中,kras g12d的突变发生概率占比最高,约40%。
5、基于kras异常激活在癌症进展中的重要性和kras基因突变在人类癌症中的普遍性,kras一直是药物开发人员关注的靶点。尽管已在这个领域中取得进展,但在本领域中仍需要改进的kras g12d突变蛋白抑制剂。
6、近年来,人们利用泛素蛋白酶体通路具有特异性降解蛋白底物的功能特点,构建出靶向泛素化蛋白降解嵌合型分子(proteolysis-targeting chimeras,protac),protac是具有两个异功能的配体通过linker连接的化合物:一个配体靶向于目的蛋白(poi),而另一个配体特异性地募集e3连接酶。当protac结合e3连接酶和目的蛋白时形成了三元复合物,通过劫持e3连接酶,protac使poi呈现出有利的空间位置以促进其泛素化,从而选择性地降低靶蛋白的水平。这种方法的优点是protac可以催化样的多轮降解靶蛋白,这是protac分子与小分子抑制剂最大的不同。
7、cn110684015a公开了一种靶向alk的protac分子,成功制备得到了靶向alk的protac分子,能有效靶向于目标蛋白,并降低细胞中alk的含量,同时具有较好的体内体外抗肿瘤活性,对正常细胞毒性较低,符合高效低毒的特征。但本领域尚未报道靶向krasg12d的protac分子。
技术实现思路
1、本发明的所要解决的技术为克服现有技术中能靶向降解或抑制kras突变体的化合物的种类较少的缺陷,为此,提供了一种嘧啶环类化合物、其中间体、其药物组合物及其应用。本发明的化合物对kras突变体具有良好的抑制作用或蛋白降解作用。
2、本发明是通过以下方法来解决上述技术问题的。
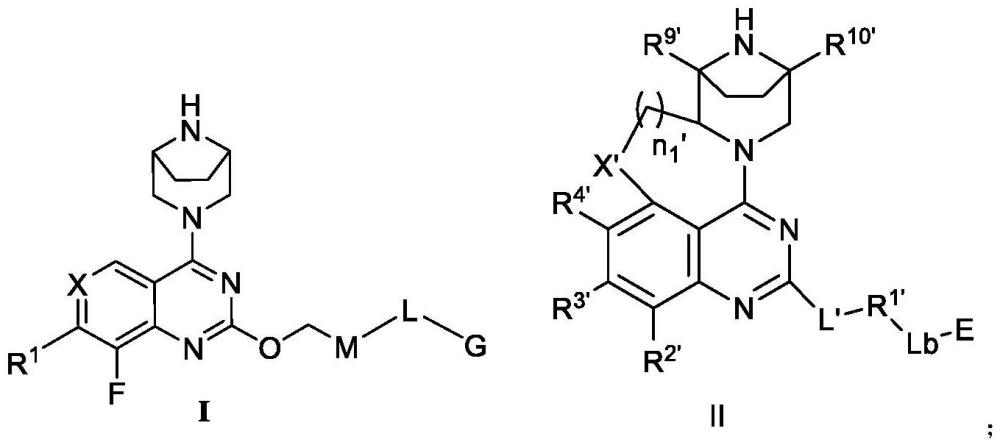
3、本发明提供一种如式i或式ii所示的化合物,或它们药学上可接受的盐;
4、
5、其中,如式i所示的化合物中:
6、r1为c6~c14的芳基、被一个或多个r1-1取代的c6~c14的芳基、6~14元的杂芳基或被一个或多个r1-2取代的6~14元的杂芳基;
7、r1-1和r1-2各自独立地为oh、c1~c6的烷基、c3~c8环烷基、卤素、nh2、cn、-o(c=o)nr1-ar1-b、-op(=o)(or1-c)2、-o(s=o)2-r1-d、c2~c6的炔基、c1~c6的烷氧基、被一个或多个卤素取代的c1~c6的烷基、被一个或多个卤素取代的c1~c6的烷氧基或被一个或多个r1-e取代的c3~c8环烷基;
8、r1-a、r1-b和r1-c各自独立地为h或c1~c6的烷基;
9、r1-d独立地为被一个或多个r1-d-1取代的c6~c14的芳基;r1-d-1独立地为no2;
10、r1-e独立地为c1~c6的烷基;
11、x为n或cr2;
12、r2为卤素;
13、m为3~10元的亚杂环烷基或被一个或多个卤素取代的3~10元的亚杂环烷基;
14、l为以下情况中的任一种(l左端与m连接,右端与g连接):
15、i:l为-l1-(c=o)nh-,l1为具有2~9个链原子的亚杂烷基;
16、ii:l为-l2-l3-l4--(c=o)nh-,其中l2为连接键或c1~c6的亚烷基,l3为5~6元的亚杂环烷基,l4为连接键或c1~c6的亚烷基;
17、iii:l为-l5-l6-l7-l8-,l5为c1~c6的亚烷基或具有2~9个链原子的亚杂烷基,l6为5~6元的亚杂环烷基或氧代的5~6元的亚杂环烷基,l7为连接键或c1~c6的亚烷基,l8为连接键或5~6元的亚杂环烷基;
18、上述连接键表示该键连接的两个基团直接相连(例如l为-l5-l6-l7-l8-,若l7为连接键时,l为-l5-l6-l8-);
19、g为情形1、情形2或情形3:
20、情形1:g为
21、情形2:g为(例如)、(例如)、
22、情形3:g为
23、当g为情形2时,l为-l5-l6-l7-l8-,r1为c6~c14的芳基、被一个或多个r1-1取代的c6~c14的芳基;
24、所述的亚杂环烷基、所述的亚杂烷基或所述的杂芳基中的杂原子各自独立地为氮、氧或硫中的一种或多种,杂原子的个数各自独立地为1、2、3或4个;
25、其中,所述如式i所示的化合物不为如下任一化合物:
26、
27、
28、如式ii所示的化合物中:
29、x’为n、o或s;
30、n1’为1、2、3或4;
31、l’为-o-(crl-1rl-2)n2’-*、-(crl-3rl-4)n3’-*或*表示与r1’相连的一端;n2’和n3’各自独立地为1、2、3或4;
32、rl-1、rl-2、rl-3和rl-4分别独立地为h、c1-c6烷基、c1-c6烷氧基、被一个或多个rl-1-1取代的c1-c6烷基或卤素;
33、各rl-1-1分别独立地为卤素或c1-c6烷氧基;
34、各r1’为被一个或多个r1-1’取代的4-10元杂环烷基;所述被一个或多个r1-1’取代的4-10元杂环烷基中4-10元杂环烷基里的杂原子独立地为n、o或s中的1、2或3种,杂原子个数为1、2或3个;
35、各r1-1’分别独立地为卤素、羟基、-o-c1-c6烷基、c1-c6烷基或被一个或多个r1-1-1’取代的c1-c6烷基;
36、各r1-1-1’分别独立地为羟基、4-10元杂环烷基或被一个或多个r1-1-1-1’取代的4-10元杂环烷基;所述的4-10元杂环烷基和所述的被一个或多个r1-1-1-1’取代的4-10元杂环烷基里的杂原子独立地为n、o或s中的1、2或3种,杂原子个数为1、2或3个;
37、各r1-1-1-1’分别独立地为c1-c6烷基;
38、r2’为h或卤素;
39、r3’为c6-c10芳基、5-10元杂芳基、被一个或多个r3-1’取代的c6-c10芳基或被一个或多个r3-2’取代的5-10元杂芳基,所述5-10元杂芳基和所述的“被一个或多个r3-2’取代的5-10元杂芳基”中的杂原子独立地为n、o或s中的1、2或3种,杂原子个数为1、2或3个;
40、各r3-1’和r3-2’分别独立地为oh、卤素、c1-c6烷基、被一个或多个r3-1-1’取代的c1-c6烷基、c2-c6炔基、3-8元环烷基、-s-c(r3-1-2’)3、-s(r3-1-3’)5、氨基、c1-c6烷基、5-10元杂芳基或-o-c1-c6烷基;
41、或者任一相邻的两个r3-1’与其连接的碳原子一起形成5-10元杂芳基或“被一个或多个r3-1-4’取代的5-10元杂芳基”,所述5-10元杂芳基和所述的“被一个或多个r3-1-4’取代的5-10元杂芳基”中的杂原子独立地为n、o或s中的1、2或3种,杂原子个数为1、2或3个;
42、各r3-1-1’分别独立地为氧代基(=o)、oh、c1-c6烷氧基或卤素;
43、各r3-1-2’和r3-1-3’分别独立地为卤素;
44、各r3-1-4’分别独立地为c1-c6烷基;
45、r4’为h、oh、c1-c6烷基、c1-c6烷氧基、“被一个或多个r4-1’取代的c1-c6烷基”、氰基或卤素;
46、各r4-1’分别独立地为卤素;
47、r9’和r10’各自独立地为h、c1-c6烷基或卤素,
48、lb为连接r1’和e的连接子;
49、e为e3泛素连接酶的配体。
50、某一实施方案中,如式i所示的化合物中:
51、其中,r1为c6~c14的芳基或被一个或多个r1-1取代的c6~c14的芳基;
52、各r1-1独立地为oh、c1~c6的烷基、c3~c8环烷基、卤素或c2~c6的炔基;
53、x为n或cr2;
54、r2为卤素;
55、m为3~10元的亚杂环烷基或被一个或多个卤素取代的3~10元的亚杂环烷基;
56、l为以下情况中的任一种(l左端与m连接,右端与g连接):
57、i:l为-l1-(c=o)nh-,l1为具有2~9个链原子的亚杂烷基;
58、ii:l为-l2-l3-l4--(c=o)nh-,其中l2为连接键或c1~c6的亚烷基,l3为5~6元的亚杂环烷基,l4为连接键或c1~c6的亚烷基;
59、iii:l为-l5-l6-l7-l8-,l5为c1~c6的亚烷基或具有2~9个链原子的亚杂烷基,l6为5~6元的亚杂环烷基或氧代的5~6元的亚杂环烷基,l7为连接键或c1~c6的亚烷基,l8为连接键或5~6元的亚杂环烷基;
60、上述连接键表示该键连接的两个基团直接相连(例如l为-l5-l6-l7-l8-,若l7为连接键时,l为-l5-l6-l8-);
61、g为
62、
63、所述的亚杂环烷基和所述的亚杂烷基中的杂原子各自独立地为氮、氧或硫中的一种或多种,杂原子的个数独立地为1、2、3或4个;
64、其中,所述如式i所示的化合物不为如下任一化合物:
65、
66、
67、某一实施方案中,如式i所示的化合物中:
68、其中,r1为c6~c14的芳基或被一个或多个r1-1取代的c6~c14的芳基;
69、各r1-1独立地为oh、c1~c6的烷基、c3~c8环烷基或卤素;
70、x为n或cr2;
71、r2为卤素;
72、m为3~10元的亚杂环烷基或被一个或多个卤素取代的3~10元的亚杂环烷基;
73、l为以下情况中的任一种(l左端与m连接,右端与g连接):
74、i:l为-l1-(c=o)nh-,l1为具有2~9个链原子的亚杂烷基;
75、ii:l为-l2-l3-l4--(c=o)nh-,其中l2为连接键或c1~c6的亚烷基,l3为5~6元的亚杂环烷基,l4为连接键或c1~c6的亚烷基;
76、iii:l为-l5-l6-l7-l8-,l5为c1~c6的亚烷基或具有2~9个链原子的亚杂烷基,l6为5~6元的亚杂环烷基或氧代的5~6元的亚杂环烷基,l7为连接键或c1~c6的亚烷基,l8为连接键或5~6元的亚杂环烷基;
77、上述连接键表示该键连接的两个基团直接相连(例如l为-l5-l6-l7-l8-,若l7为连接键时,l为-l5-l6-l8-);
78、g为
79、所述的亚杂环烷基和所述的亚杂烷基中的杂原子各自独立地为氮、氧或硫中的一种或多种,杂原子的个数独立地为1、2、3或4个;
80、其中,所述如式i所示的化合物不为如下任一化合物:
81、
82、
83、某一实施方案中,所述如式ii所示的化合物中,lb的定义与式i所示的化合物中l的定义相同。
84、某一实施方案中,所述如式ii所示的化合物中,e的定义与式i所示的化合物中g的定义相同。
85、某一实施方案中,r1中,所述的c6~c14的芳基或被一个或多个r1-1取代的c6~c14的芳基中的c6~c14的芳基可独立地为c6~c10的芳基,例如苯基或萘基,优选为萘基,例如
86、某一实施方案中,r1中,所述的6~14元的杂芳基或被一个或多个r1-2取代的6~14元的杂芳基中的c6~c14的杂芳基可独立地为c6~c10杂芳基,例如吡啶基、嘧啶基、吲哚基、苯并噁唑基、苯并咪唑基、苯并吡唑基、喹啉基、异喹啉基、苯并噻唑基、吡啶并吡唑基、苯并噻吩基,例如
87、某一实施方案中,r1-1、r3-1’和r3-2’中,所述的c1~c6的烷基可独立地为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,例如乙基。
88、某一实施方案中,r1-1中,所述的c3~c8环烷基可为环丙基、环丁基、环戊基或环己基,例如环丙基。
89、某一实施方案中,r1-1、r1-1’和r3-1-1’中,所述的卤素可独立地为氟、氯、溴或碘,例如氟。
90、某一实施方案中,r1-1中,所述的c2~c6的炔基为乙炔基。
91、某一实施方案中,r2和r2’中,所述的卤素可独立地为氟、氯、溴或碘,例如氟。
92、某一实施方案中,r1’中,所述的被一个或多个r1-1’取代的4-10元杂环烷基中的4-10元杂环烷基可独立地为5~8元的单环杂环烷基或其中中,环a和环b各自独立地为3~5元的饱和杂环,所述的饱和杂环中的杂原子的种类为氮、氧或硫,杂原子的个数为1或2个;y为c或杂原子;较佳地,环a和环b各自独立地为5元的饱和杂环,所述的5元的饱和杂环中杂原子例如为氮,杂原子的个数例如为1个,更佳地,环a和环b各自独立地为四氢吡咯环。
93、某一实施方案中,r3’中,所述的c6-c10芳基或被一个或多个r3-1’取代的c6-c10芳基中的c6-c10芳基可独立地为苯基或萘基,优选为萘基,例如
94、某一实施方案中,r3’中,所述的5-10元杂芳基或被一个或多个r3-2’取代的5-10元杂芳基中的5-10元杂芳基可独立地为吡啶基、嘧啶基、吲哚基、苯并噁唑基、苯并咪唑基、苯并吡唑基、喹啉基、异喹啉基、苯并噻唑基、吡啶并吡唑基、苯并噻吩基,例如
95、某一实施方案中,m中,所述的3~10元的亚杂环烷基或被一个或多个卤素取代的3~10元的亚杂环烷基中的3~10元的亚杂环烷基可独立地为5~8元的单环亚杂环烷基或其中中,环a和环b各自独立地为3~5元的饱和杂环,所述的饱和杂环中的杂原子的种类可为氮、氧或硫,杂原子的个数可为1或2个;y为c或杂原子;表示环a或环b中任意的可连接位点与分子中的其他部分相连。
96、某一实施方案中,m中,当所述的3~10元的亚杂环烷基或被一个或多个卤素取代的3~10元的亚杂环烷基中的3~10元的亚杂环烷基独立地为时,环a为5元的饱和杂环,所述的5元的饱和杂环中杂原子可为n,杂原子的个数可为1个,较佳地,环a为四氢吡咯环。
97、某一实施方案中,m中,当所述的3~10元的亚杂环烷基或被一个或多个卤素取代的3~10元的亚杂环烷基中的3~10元的亚杂环烷基独立地为时,环b为5元的饱和杂环,所述的5元的饱和杂环中杂原子可为n,杂原子的个数可为1个,较佳地,环b为四氢吡咯环。
98、某一实施方案中,m中,所述的3~10元的亚杂环烷基或被一个或多个卤素取代的3~10元的亚杂环烷基中的亚杂环烷基的杂原子可独立地为n,杂原子的个数可独立地为1个。
99、某一实施方案中,m中,所述的3~10元的亚杂环烷基或被一个或多个卤素取代的3~10元的亚杂环烷基中的3~10元的亚杂环烷基可独立地为亚四氢吡咯基或亚六氢-1h-吡咯里嗪基,例如其中结构式中的a端与l相连。某一实施方案中,m中,所述的被一个或多个卤素取代的3~10元的亚杂环烷基中的卤素可为氟、氯、溴或碘,例如氟。
100、某一实施方案中,m中,所述的一个或多个卤素取代的3~10元的亚杂环烷基可为其中a端与l相连。
101、某一实施方案中,l1中,所述的具有2~9个链原子的亚杂烷基中的亚杂烷基可为直链亚杂烷基。
102、某一实施方案中,l1中,所述的具有2~9个链原子的亚杂烷基可为具有2~6个链原子的亚杂烷基,例如2个链原子的亚杂烷基、3个链原子的亚杂烷基、4个链原子的亚杂烷基、5个链原子的亚杂烷基或6个链原子的亚杂烷基。
103、某一实施方案中,l1中,所述的具有2~9个链原子的亚杂烷基中杂原子的种类可为氧,杂原子的个数可为1个。
104、某一实施方案中,l1中,所述的具有2~9个链原子的亚杂烷基可为-(ch2)n1o(ch2)n2-,n1和n2各自独立地为0、1、2或3,该基团左端与m相连,例如-(ch2)3o(ch2)2-、-(ch2)2o(ch2)2-、-(ch2)o(ch2)-、-o(ch2)-或-(ch2)1o(ch2)2-。
105、某一实施方案中,-l1-(c=o)nh-为其中结构式中的c端与g相连。
106、某一实施方案中,l2和l4中,所述的c1~c6的亚烷基可独立地为-ch2-、-ch2ch2-、-ch2ch2ch2-、-ch(ch3)ch2-或-ch2ch(ch3)-,例如-ch2-或-ch2ch2-,当上述基团为l2中的基团时,其左端与m相连,当上述基团为l4中的基团时,其左端与l3相连。
107、某一实施方案中,l2和l4中,所述的c1~c6的亚烷基可独立地-ch2ch2ch2-,当此基团为l2中的基团时,其左端与m相连,当此基团为l4中的基团时,其左端与l3相连。
108、某一实施方案中,l3中,所述的5~6元的亚杂环烷基可为6元的亚杂环烷基。
109、某一实施方案中,l3中,所述的5~6元的亚杂环烷基中杂原子的种类可为氮,杂原子的个数可为1个。
110、某一实施方案中,l3中,所述的5~6元的亚杂环烷基可通过杂原子与l2或l4相连。
111、某一实施方案中,l3中,所述的5~6元的亚杂环烷基可为亚哌啶基,例如其中结构式中的d端与l2相连。
112、某一实施方案中,-l2-l3-l4--(c=o)nh-可为以下情况中的任一种:
113、①:l2为连接键,l3为5~6元的亚杂环烷基,l4为c1~c6的亚烷基;
114、②:l2为c1~c6的亚烷基,l3为5~6元的亚杂环烷基,l4为连接键。
115、较佳地,-l2-l3-l4--(c=o)nh-为或者-l2-l3-l4--(c=o)nh-为其中,结构式张的e端与g相连。
116、某一实施方案中,l5和l7中,所述的c1~c6的亚烷基可独立地为-ch2-、-ch2ch2-、-ch2ch2ch2-、-ch(ch3)ch2-或-ch2ch(ch3)-,例如-ch2-,其中,当上述基团为l5中的基团时,其左端与m相连,当上述基团为l7中的基团时,其左端与l6相连。
117、某一实施方案中,l5和l7中,所述的c1~c6的亚烷基可独立地为-ch2ch2-。
118、某一实施方案中,l5中,所述的具有2~9个链原子的亚杂烷基中的亚杂烷基可为直链亚杂烷基。
119、某一实施方案中,l5中,所述的具有2~9个链原子的亚杂烷基可为具有2~4个链原子的亚杂烷基,例如具有2个链原子的亚杂烷基或3个链原子的亚杂烷基。
120、某一实施方案中,l5中,所述的具有2~9个链原子的亚杂烷基中的杂原子的种类可为氧,杂原子的个数可为1个。
121、某一实施方案中,l5中,所述的具有2~9个链原子的亚杂烷基可为-(ch2)n3o(ch2)n4-,该基团左端与m相连,n3和n4各自独立为0、1或2,进一步可为-(ch2)2o或-ch2o-。
122、某一实施方案中,l6中,所述的5~6元的亚杂环烷基或氧代的5~6元的亚杂环烷基中的5~6元的亚杂环烷基可独立地为6元的亚杂环烷基。
123、某一实施方案中,l6中,所述的5~6元的亚杂环烷基或氧代的5~6元的亚杂环烷基中的5~6元的亚杂环烷基的杂原子的种类可独立地为氮,杂原子的个数可独立地为1个或2个。
124、某一实施方案中,l6中,所述的5~6元的亚杂环烷基或氧代的5~6元的亚杂环烷基中的5~6元的亚杂环烷基杂原子可与l5或l7相连。
125、某一实施方案中,l6中,所述的5~6元的亚杂环烷基或氧代的5~6元的亚杂环烷基中的5~6元的亚杂环烷基可独立地为亚哌啶基或亚哌嗪基,例如f端与l5相连。
126、某一实施方案中,l6中,所述的氧代的5~6元的亚杂环烷基可为f端与l5相连。
127、某一实施方案中,l8中,所述的5~6元的亚杂环烷基可为6元的亚杂环烷基。
128、某一实施方案中,l8中,所述的5~6元的亚杂环烷基的杂原子的种类可为氮,杂原子的个数可为2个。
129、某一实施方案中,l8中,所述的5~6元的亚杂环烷基的杂原子可与l7或所述的g相连。
130、某一实施方案中,l8中,所述的5~6元的亚杂环烷基可为亚哌嗪基,例如
131、某一实施方案中,-l5-l6-l7-l8-可为以下情况中的任一种:
132、(i):l5为c1~c6的亚烷基,l6为5~6元的亚杂环烷基,l7和l8为连接键;
133、(ii):l5为c1~c6的亚烷基,l6为5~6元的亚杂环烷基,l7为c1~c6的亚烷基,l8为5~6元的亚杂环烷基;
134、(iii):l5为具有2~9个链原子的亚杂烷基,l6为氧代的5~6元的亚杂环烷基,l7和l8为连接键。
135、较佳地,所述的-l5-l6-l7-l8-为或者所述的-l5-l6-l7-l8-为g端与g相连。
136、某一实施方案中,所述的r1为
137、某一实施方案中,所述的r1为
138、
139、
140、某一实施方案中,所述的x为n或cf。
141、某一实施方案中,m为其中结构式中的a端与l相连。
142、某一实施方案中,l为其中上述结构式中的c端与g相连、e端与g相连,g端与g相连。
143、某一实施方案中,l为
144、其中上述结构式中的c端与g相连、e端与g相连,g端与g相连。
145、某一实施方案中,n1’为1或2。
146、某一实施方案中,x’为o。
147、某一实施方案中,r2’为f。
148、某一实施方案中,r4’为f。
149、某一实施方案中,r9’和r10’各自独立地为h。
150、某一实施方案中,l’为-och2-。
151、某一实施方案中,r1’为其中结构式中的a端与lb相连。
152、某一实施方案中,lb为
153、其中上述结构式中的c端与e相连、e端与e相连,g端与e相连。
154、某一实施方案中,e为优选
155、某一实施方案中,r3’为
156、
157、
158、某一实施方案中,所述的如式i所示的化合物为以下化合物中的任一种:
159、
160、
161、
162、
163、
164、
165、
166、
167、
168、
169、
170、
171、
172、
173、
174、优选:
175、
176、
177、
178、
179、进一步优选:
180、
181、
182、
183、
184、
185、某一实施方案中,所述如式ii所示的化合物为以下化合物中的任一种;
186、
187、
188、
189、
190、
191、
192、
193、
194、
195、
196、
197、
198、优选:
199、
200、进一步优选:
201、
202、某一实施方案中,所述的如式i所示的化合物为以下化合物中的任一种:
203、的一个阻转异构体,所述阻转异构体中,的阻转构型与化合物a1的阻转构型相同,所述的化合物a1为在以下条件下先出峰的化合物:手性柱chiral art cellulose-sc,3x25厘米,5微米;流动相:a相为超临界二氧化碳,b相为异丙醇/二氯甲烷(v/v=1/1,0.1%氨甲醇溶液);流速:100毫升/分钟;45%流动相b洗脱;较佳地,在所述的条件下,所述的先出峰的化合物的保留时间为2.55min;
204、的一个阻转异构体,所述阻转异构体中,的阻转构型与化合物a2的阻转构型相同,所述的化合物a2为在以下条件下后出峰的化合物:手性柱chiral art cellulose-sc,3x25厘米,5微米;流动相:a相为超临界二氧化碳,b相为异丙醇/二氯甲烷(v/v=1/1,0.1%氨甲醇溶液);流速:100毫升/分钟;45%流动相b洗脱;较佳地,在所述的条件下,所述的后出峰的化合物的保留时间为4.17min;
205、的一个阻转异构体,所述的阻转异构体中,的阻转构型与化合物b1的阻转构型相同,所述的化合物b1为在以下条件下先出峰的化合物:手性柱chiralart cellulose-sc,2×25厘米,5微米;流动相:a相为正己烷(0.5%,2摩尔/升氨甲醇),b相为乙醇;流速:20毫升/分钟;20%的b相进行洗脱;较佳地,在所述的条件下,所述的先出峰的化合物的保留时间为6min;
206、的一个阻转异构体,所述的阻转异构体中,的阻转构型与化合物b2的阻转构型相同,所述的化合物b2为在以下条件下后出峰的化合物:手性柱chiralart cellulose-sc,2×25厘米,5微米;流动相:a相为正己烷(0.5%,2摩尔/升氨甲醇),b相为乙醇;流速:20毫升/分钟;20%的b相进行洗脱;较佳地,在所述的条件下,所述的后出峰的化合物的保留时间为8.7min;
207、的一个阻转异构体,所述的阻转异构体中,的阻转构型与化合物c1的阻转构型相同,所述的化合物c1为在以下条件下先出峰的化合物:手性柱nb_chiralpak ad,3x25厘米,5微米;流动相:a相为超临界二氧化碳,b相为丙醇(0.1%2摩尔/升氨甲醇);流速:100毫升/分钟;50%流动相b洗脱;较佳地,在所述的条件下,所述的先出峰的化合物的保留时间为1.68min;
208、的一个阻转异构体,所述的阻转异构体中,的阻转构型与化合物c2的阻转构型相同,所述的化合物c2为在以下条件下后出峰的化合物:手性柱nb_chiralpak ad,3x25厘米,5微米;流动相:a相为超临界二氧化碳,b相为丙醇(0.1%2摩尔/升氨甲醇);流速:100毫升/分钟;50%流动相b洗脱;较佳地,在所述的条件下,所述的后出峰的化合物的保留时间为3.63min;
209、的一个阻转异构体,所述的阻转异构体中,的阻转构型与如上所述的化合物c1的阻转构型相同;
210、的一个阻转异构体,所述的阻转异构体中,的阻转构型与如上所述的化合物c2的阻转构型相同;
211、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物b1的阻转构型相同;
212、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物b2的阻转构型相同;
213、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物b1的阻转构型相同;
214、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物b2的阻转构型相同;
215、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物b1的阻转构型相同;
216、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物b2的阻转构型相同;
217、的一个阻转异构体,所述的阻转异构体中,的阻转构型与化合物d1的阻转构型相同,所述的化合物d1为在以下条件下先出峰的化合物:手性柱chiral art cellulose-sc,2×25厘米,5微米;流动相:a相为正己烷(0.5%2摩尔/升氨-甲醇),b相为乙醇;流速:20毫升/分钟;50%的b相洗脱;较佳地,在所述的条件下,所述的先出峰的化合物的保留时间为4.5min;
218、的一个阻转异构体,所述的阻转异构体中,的阻转构型与化合物d2的阻转构型相同,所述的化合物d2为在以下条件下后出峰的化合物:手性柱chiral art cellulose-sc,2×25厘米,5微米;流动相:a相为正己烷(0.5%2摩尔/升氨-甲醇),b相为乙醇;流速:20毫升/分钟;50%的b相洗脱;较佳地,在所述的条件下,所述的后出峰的化合物的保留时间为9.5min;
219、的一个阻转异构体,所述的阻转异构体中,的阻转构型与化合物e1的阻转构型相同,所述的化合物e1为在以下条件下先出峰的化合物:chiral art cellulose-sz,3x25厘米,5微米;流动相:a相为正己烷(0.1%2摩尔/升氨甲醇),b相为乙醇;流速:20毫升/分钟;10%流动相b洗脱;较佳地,在所述的条件下,所述的先出峰的化合物的保留时间为8.1min;
220、的一个阻转异构体,所述的阻转异构体中,的阻转构型与化合物e2的阻转构型相同,所述的化合物e2为在以下条件下后出峰的化合物:chiral art cellulose-sz,3x25厘米,5微米;流动相:a相为正己烷(0.1%2摩尔/升氨甲醇),b相为乙醇;流速:20毫升/分钟;10%流动相b洗脱;较佳地,在所述的条件下,所述的后出峰的化合物的保留时间为10.4min;
221、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物c1的阻转构型相同。
222、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物c2的阻转构型相同。
223、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物b1的阻转构型相同;
224、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物b2的阻转构型相同;
225、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物c1的阻转构型相同;
226、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物c2的阻转构型相同;
227、一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物c1的阻转构型相同;
228、一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物c2的阻转构型相同;
229、一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物c1的阻转构型相同;
230、一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物c2的阻转构型相同;
231、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物b1的阻转构型相同;
232、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物b2的阻转构型相同;
233、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物b1的阻转构型相同;
234、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物b2的阻转构型相同;
235、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物c1的阻转构型相同;
236、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物c2的阻转构型相同;
237、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物b1的阻转构型相同;
238、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物b2的阻转构型相同;
239、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物c1的阻转构型相同;
240、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物c1的阻转构型相同。
241、某一实施方案中,所述的如式ii所示的化合物为以下化合物中的任一种:
242、的一个阻转异构体,所述的阻转异构体中,的阻转构型与化合物f1的阻转构型相同,所述的化合物f1为在以下条件下先出峰的化合物:手性柱chiralpak id,2x25厘米,5微米;流动相:a相为正己烷/甲基叔丁基醚(1/1)(0.5%2摩尔/升氨甲醇),b相为甲醇;10%流动相b洗脱;较佳地,在所述的条件下,所述的先出峰的化合物的保留时间为5.05min;
243、的一个阻转异构体,所述的阻转异构体中,的阻转构型与化合物f2的阻转构型相同,所述的化合物f2为在以下条件下后出峰的化合物:手性柱chiralpak id,2x25厘米,5微米;流动相:a相为正己烷/甲基叔丁基醚(1/1)(0.5%2摩尔/升氨甲醇),b相为甲醇;10%流动相b洗脱;较佳地,在所述的条件下,所述的后出峰的化合物的保留时间为6.47min;
244、的一个阻转异构体,所述的阻转异构体中,的阻转构型与化合物g1的阻转构型相同,所述的化合物g1为在以下条件下先出峰的化合物:手性柱chiralpak id,2x25厘米,5微米;流动相:a相为正己烷/甲基叔丁基醚(0.5%2摩尔/升氨甲醇)其中正己烷与甲基叔丁基醚(0.5%2摩尔/升氨甲醇)的体积比为1:1,b相为甲醇;流速:20毫升/分钟;10%流动相b洗脱;较佳地,在所述的条件下,所述的先出峰的化合物的保留时间为7.73min;
245、的一个阻转异构体,所述的阻转异构体中,的阻转构型与化合物g2的阻转构型相同,所述的化合物g2为在以下条件下后出峰的化合物:手性柱chiralpak id,2x25厘米,5微米;流动相:a相为正己烷/甲基叔丁基醚(0.5%2摩尔/升氨甲醇)其中正己烷与甲基叔丁基醚(0.5%2摩尔/升氨甲醇)的体积比为1:1,b相为甲醇;流速:20毫升/分钟;10%流动相b洗脱;较佳地,在所述的条件下,所述的后出峰的化合物的保留时间为13.395min;
246、的一个阻转异构体,所述的阻转异构体中,的阻转构型与化合物h1的阻转构型相同,所述的化合物h1为在以下条件先出峰的化合物:手性柱chiralpak ie,3x25厘米,5微米;流动相:a相为正己烷(10毫摩尔/升氨甲醇溶液),b相为乙醇;流速:35毫升/分钟;30%的b相进行洗脱;较佳地,在所述的条件下,所述的先出峰的化合物的保留时间为32.5min;
247、的一个阻转异构体,所述的阻转异构体中,的阻转构型与化合物h2的阻转构型相同,所述的化合物h2为在以下条件后出峰的化合物:手性柱chiralpak ie,3x25厘米,5微米;流动相:a相为正己烷(10毫摩尔/升氨甲醇溶液),b相为乙醇;流速:35毫升/分钟;30%的b相进行洗脱;较佳地,在所述的条件下,所述的先出峰的化合物的保留时间为42min;
248、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物h1的阻转构型相同;
249、的一个阻转异构体,所述的阻转异构体中,的阻转构型与所述的化合物h2的阻转构型相同。
250、以上保留时间的测试条件并非对化合物的限定,只要采用上述测试条件进行测定,得到的保留时间与上述记载的相同或在误差范围内,且该化合物为上述用保留时间限定的化合物中的一个立体异构体,则落入本发明的保护范围内。
251、某一实施方案中,所述的如式i所示的化合物药学上可接受的盐优选为如式i所示的化合物的甲酸盐或如式i所示的化合物的三氟醋酸盐。
252、某一实施方案中,所述的如式i所示的化合物药学上可接受的盐优选为如式i所示的化合物的甲酸盐或如式i所示的化合物的盐酸盐。
253、某一实施方案中,所述的如式ii所示的化合物药学上可接受的盐优选为如式ii所示的化合物的甲酸盐、盐酸盐或三氟醋酸盐,优选为甲酸盐或三氟醋酸盐。
254、某一实施方案中,所述的如式i所示的化合物药学上可接受的盐的个数优选为1个、2个、3个或4个。
255、某一实施方案中,所述的如式ii所示的化合物药学上可接受的盐的个数优选为1个、2个、3个或4个。
256、某一实施方案中,所述的如式i所示的化合物药学上可接受的盐为以下化合物中的任一种:
257、
258、的三氟乙酸盐、
259、的三氟乙酸盐、
260、的三氟乙酸盐、
261、的甲酸盐、
262、的甲酸盐、
263、的甲酸盐、
264、的甲酸盐或
265、的甲酸盐;
266、优选:
267、
268、
269、的三氟乙酸盐、
270、的三氟乙酸盐、
271、的三氟乙酸盐、的甲酸盐、的甲酸盐、的甲酸盐、的甲酸盐或的甲酸盐。
272、某一实施方案中,所述如式ii所示的化合物药学上可接受的盐为以下化合物中的任一种
273、
274、优选:
275、
276、本发明化合物存在立体构型的,其立体构型与实施例中对应编号化合物的立体构型相同。
277、以上化合物中,化合物55a’与化合物55a的构型相同,化合物55b’与化合物55b的构型相同,化合物56a’与化合物56a的构型相同,化合物56b’与化合物56b的构型相同,化合物63a’与化合物63的构型相同,化合物化合物60a’与化合物60的构型相同,化合物61a’与化合物61的构型相同,化合物62’与化合物62a的构型相同,化合物62”与化合物62b的构型相同,化合物65a与化合物65的构型相同。
278、本发明还提供了一种药物组合物,其包括物质x’和一种或多种药用辅料,所述的物质x’为上述的如式i所示的化合物或其药学上可接受的盐、如式ii所示的化合物或其药学上可接受的盐。
279、在本发明一实施方案中,所述的药物组合物,其包括物质x和一种或多种药用辅料,所述的物质x为上述的如式i所示的化合物或其药学上可接受的盐。
280、在本发明某一实施方案中,所述的药物组合物,其包括物质x”和一种或多种药用辅料,所述的物质x”为上述的如式ii所示的化合物或其药学上可接受的盐。
281、本发明还提供一种物质y’在制备用于治疗或预防与kras突变所介导的癌症的药物中的应用;所述的物质y’为上述的如式i所示的化合物、其药学上可接受的盐、如式ii所示的化合物、其药学上可接受的盐或上述的药物组合物。
282、所述的应用中,所述的kras突变蛋白优选为kras_g12d突变蛋白。
283、所述的应用中,所述的与kras突变所介导的癌症优选为血液癌症、胰腺癌、myh相关性息肉病、结肠直肠癌或肺癌等。
284、本发明还还提供一种物质y在制备用于治疗或预防与kras突变所介导的癌症的药物中的应用;所述的物质y为上述的如式i所示的化合物、其药学上可接受的盐或上述的药物组合物。
285、所述的应用中,所述的kras突变蛋白优选为kras_g12d突变蛋白。
286、所述的应用中,所述的与kras突变所介导的癌症优选为血液癌症、胰腺癌、myh相关性息肉病、结肠直肠癌或肺癌等。
287、本发明还提供了一种物质y’在制备用于治疗或预防癌症的药物中的应用;所述的物质y’为上述的如式i所示的化合物、其药学上可接受的盐、如式ii所示的化合物、其药学上可接受的盐或上述的药物组合物;所述的癌症例如为血液癌症、胰腺癌、myh相关性息肉病、结肠直肠癌或肺癌。
288、本发明还提供了一种物质y在制备用于治疗或预防癌症的药物中的应用;所述的物质y为上述的如式i所示的化合物、其药学上可接受的盐或上述的药物组合物;所述的癌症例如为血液癌症、胰腺癌、myh相关性息肉病、结肠直肠癌或肺癌。
289、本发明还提供了一种治疗预防或治疗kras突变所介导的癌症的方法,其包括向患者施用治疗有效量的物质y’;所述的物质y’为上述的如式i所示的化合物、其药学上可接受的盐、如式ii所示的化合物、其药学上可接受的盐或上述的药物组合物。
290、在本发明一实施方案中,所述的应用中,还提供了一种治疗预防或治疗kras突变所介导的癌症的方法,其包括向患者施用治疗有效量的物质y;所述的物质y为上述的如式i所示的化合物、其药学上可接受的盐或上述的药物组合物。
291、所述的kras突变所介导的癌症例如血液癌症、胰腺癌、myh相关性息肉病、结肠直肠癌或肺癌等。
292、所述的kras突变可为kras_g12d突变。
293、本发明还提供了一种治疗预防或治疗癌症的方法,其包括向患者施用治疗有效量的物质y’;所述的物质y’为上述的如式i所示的化合物、其药学上可接受的盐、如式ii所示的化合物、其药学上可接受的盐或上述的药物组合物;所述的癌症为血液癌症、胰腺癌、myh相关性息肉病、结肠直肠癌或肺癌。
294、本发明还提供了一种治疗预防或治疗癌症的方法,其包括向患者施用治疗有效量的物质y;所述的物质y为上述的如式i所示的化合物、其药学上可接受的盐、或上述的药物组合物;所述的癌症为血液癌症、胰腺癌、myh相关性息肉病、结肠直肠癌或肺癌。本公开还涉及治疗哺乳动物过度增殖性疾病的方法,该方法包括向所述哺乳动物施用治疗有效量的本公开的化合物或药学上可接受的盐。
295、ras突变,包括但不限于已经在血液系统癌症或恶性肿瘤(例如影响血液,骨髓和/或淋巴结的癌症)中鉴定出的k-ras,h-ras或n-ras突变的ras突变。因此,某些实施方案涉及向需要治疗血液癌症或恶性肿瘤的患者施用所公开的化合物(例如,以药物组合物的形式)。
296、在某些特定实施方案中,本公开涉及用于治疗肺癌的方法,所述方法包括将有效量的任何上述化合物(或包含所述化合物的药物组合物)施用于需要其的受试者。
297、本发明中,所述的癌症或恶性肿瘤包括但不限于白血病和淋巴瘤。在某些实施方案中,所述的血病又例如急性淋巴细胞白血病(all),急性骨髓性白血病(aml),慢性淋巴细胞性白血病(cll),小淋巴细胞性淋巴瘤(sll),慢性骨髓性白血病(cml),急性单核细胞白血病(amol)和/或其他白血病。在某些实施方案中,所述的淋巴瘤,例如霍奇金淋巴瘤或非霍奇金淋巴瘤的所有亚型。
298、本发明中,在某些实施方案中,所述的肺癌是非小细胞肺癌(nsclc),例如腺癌,鳞状细胞肺癌或大细胞肺癌。在其他实施方案中,肺癌是小细胞肺癌。其他肺癌包括但不限于腺瘤,类癌和未分化癌。
299、本发明中,在一些实施方案中,所述癌症,例如急性髓细胞性白血病,青少年癌症,儿童肾上腺皮质癌,与艾滋病相关的癌症(例如淋巴瘤和卡波济氏肉瘤),肛门癌,阑尾癌,星形细胞瘤,非典型类畸形,基底细胞癌,胆管癌,膀胱癌,骨癌,脑干神经胶质瘤,脑肿瘤,乳腺癌,支气管肿瘤,伯基特淋巴瘤,类癌,非典型类畸形,胚胎肿瘤,生殖细胞肿瘤,原发性淋巴瘤,宫颈癌,儿童期癌症,脊索瘤,心脏肿瘤,慢性淋巴细胞性白血病(cll),慢性粒细胞性白血病(cml),慢性骨髓增生性疾病,结肠癌,大肠癌,颅咽管瘤,皮肤t细胞淋巴瘤,肝外导管原位癌(dcis),胚胎肿瘤,中枢神经系统癌,子宫内膜癌,室管膜瘤,食管癌,肉芽肿性神经母细胞瘤,尤文氏肉瘤,颅外生殖细胞瘤,性腺外生殖细胞瘤,眼癌,骨纤维组织细胞瘤,胆囊癌,胃癌,胃肠道类癌,胃肠道间质瘤(gist),生殖细胞肿瘤,妊娠滋养细胞肿瘤,毛细胞白血病,头颈癌,心脏病,肝癌,霍奇金淋巴瘤,下咽癌,眼内黑色素瘤,胰岛细胞肿瘤,胰腺神经内分泌肿瘤,肾癌,喉癌,嘴唇和口腔癌,肝癌,小叶原位癌(lcis),肺癌,淋巴瘤,转移性鳞状鳞癌,隐匿性原发性,中线癌,口腔癌,多发性内分泌肿瘤综合征,多发性骨髓瘤/浆细胞瘤,真菌病,蕈样肉芽肿,骨髓增生异常综合征,骨髓增生异常/骨髓增生性肿瘤,多发性骨髓瘤,默克尔细胞癌,恶性间皮瘤,骨和骨肉瘤的恶性纤维组织细胞瘤,鼻腔和副鼻窦,鼻腔和鼻窦神经母细胞瘤,非霍奇金淋巴瘤,非小细胞肺癌(nsclc),口腔癌,嘴唇和口腔癌,口咽癌,卵巢癌,胰腺癌,乳头状瘤病,副神经节瘤,鼻旁窦和鼻腔癌,甲状旁腺癌,阴茎癌,咽喉癌,胸膜肺母细胞瘤,原发性中枢神经系统(cns)淋巴瘤,前列腺癌,直肠癌症,移行细胞癌,视网膜母细胞瘤,横纹肌肉瘤,唾液腺癌,皮肤癌,胃(胃)癌,小细胞肺癌,小肠癌,软组织肉瘤,t细胞淋巴瘤,睾丸癌,喉癌,胸腺瘤和胸腺癌癌,甲状腺癌,肾盂和输尿管的移行细胞癌,滋养细胞肿瘤,儿童期不常见的癌,尿道癌,子宫肉瘤,阴道癌,外阴癌或病毒性癌。在一些实施方案中,所述非癌性过度增殖性疾病,例如皮肤的良性增生(例如牛皮癣),再狭窄或前列腺(例如良性前列腺肥大(bph))。
300、本发明还提供一种如式i-a、式i-b或式ii-a所示的化合物:
301、
302、其中,上述各式中,xa独立地为或卤素;
303、h1独立地为0、1或2;pg1独立地为羟基保护基,pg2独立地为氨基保护基;t1独立地为-l1-t2、被一个或多个oh取代的c1~c4的亚烷基或-(ch2)h2-cho,h2为0、1、2、3或4,t2为-ch=ch2或cooh;
304、r1-1、x、l1、x’、n1’、r2’、r4’、r9’和r10’的定义如前任一方案所述;或者r1-1为
305、在本发明一实施方案中,如式i-a所示的化合物为如式i-a-1所示的化合物,如式i-b所示的化合物为如式i-b-1所示的化合物,如式ii-a所示的化合物为如式ii-a-1所示的化合物:
306、
307、本发明还提供如下所示的任一化合物:
308、
309、
310、
311、
312、
313、
314、
315、术语定义
316、术语“药学上可接受的”是指盐、溶剂、辅料等一般无毒、安全,并且适合于患者使用。所述的“患者”优选哺乳动物,更优选为人类。
317、术语“药学上可接受的盐”指的是本文所定义的药学上可接受的盐,并且具有母体化合物所有的作用。药学上可接受的盐可以通过在有机碱的合适的有机溶剂中加入相应的酸,根据常规方法处理来制备药学上可接受的盐。
318、成盐实例包括:对于碱加成盐,有可能通过在水性介质中使用碱金属或碱土金属氢氧化物或醇盐(例如乙醇盐或甲醇盐)或适当碱性有机胺(例如二乙醇胺、胆碱或葡甲胺)处理具有适当酸性质子的本发明化合物来制备碱金属(如钠、钾或锂)或碱土金属(如铝、镁、钙、锌或铋)的盐。
319、或者,对于酸加成盐,与无机酸成盐,如盐酸、氢溴酸、硫酸、硝酸、磷酸;和有机酸所形成的盐,如甲酸、醋酸、苯磺酸、苯甲酸、樟脑磺酸、柃檬酸、乙磺酸、富马酸、葡庚糖酸、谷氨酸、乙醇酸、羟基萘甲酸、2-羟基乙磺酸、乳酸、马来酸、苹果酸、草酸、丙酮酸、丙二酸、扁桃酸、甲磺酸、黏糠酸、2-萘磺酸、丙酸、水杨酸、琥铂酸、酒石酸、柠檬酸、肉桂酸、对甲苯磺酸或三甲基乙酸。
320、术语“药用辅料”可为药物生产领域中广泛采用的那些辅料。辅料主要用于提供一个安全、稳定和功能性的药物组合物,还可以提供方法,使受试者接受给药后活性成分以所期望速率溶出,或促进受试者接受组合物给药后活性成分得到有效吸收。所述的药用辅料可以是惰性填充剂,或者提供某种功能,例如稳定该组合物的整体ph值或防止组合物活性成分的降解。所述的药用辅料可以包括下列辅料中的一种或多种:粘合剂、助悬剂、乳化剂、稀释剂、填充剂、成粒剂、胶粘剂、崩解剂、润滑剂、抗粘着剂、助流剂、润湿剂、胶凝剂、吸收延迟剂、溶解抑制剂、增强剂、吸附剂、缓冲剂、螯合剂、防腐剂、着色剂、矫味剂和甜味剂。
321、本发明的药物组合物可根据公开的内容使用本领域技术人员已知的任何方法来制备。例如,常规混合、溶解、造粒、乳化、磨细、包封、包埋或冻干工艺。
322、本发明所述的药物组合物可以任何形式给药,包括注射(静脉内)、粘膜、口服(固体和液体制剂)、吸入、眼部、直肠、局部或胃肠外(输注、注射、植入、皮下、静脉内、动脉内、肌内)给药。本发明的药物组合物还可以是控释或延迟释放剂型(例如脂质体或微球)。固体口服制剂的实例包括但不限于粉末、胶囊、囊片、软胶囊剂和片剂。口服或粘膜给药的液体制剂实例包括但不限于悬浮液、乳液、酏剂和溶液。局部用制剂的实例包括但不限于乳剂、凝胶剂、软膏剂、乳膏剂、贴剂、糊剂、泡沫剂、洗剂、滴剂或血清制剂。胃肠外给药的制剂实例包括但不限于注射用溶液、可以溶解或悬浮在药学上可接受载体中的干制剂、注射用悬浮液和注射用乳剂。所述的药物组合物的其它合适制剂的实例包括但不限于滴眼液和其他眼科制剂;气雾剂:如鼻腔喷雾剂或吸入剂;适于胃肠外给药的液体剂型;栓剂以及锭剂。
323、“治疗”意味着对哺乳动物体内疾病的任何治疗,包括:(1)防止疾病,即造成临床疾病的症状不发展;(2)抑制疾病,即阻止临床症状的发展;(3)减轻疾病,即造成临床症状的消退。
324、“有效量”是指当向需要治疗的患者给予化合物时,其量足以(i)治疗相关疾病,(ii)减弱、改善或消除特定疾病或病症的一种或多种症状,或(iii)延迟本文所述的特定疾病或病症的一种或多种症状的发作。对应于该量的所述的如式ii所示的羰基杂环类化合物或其药学上可接受的盐或者如上所述的药物组合物的量将根据例如特定化合物、疾病状况及其严重性、需要治疗的患者的特征(例如体重)等因素而变化,但是尽管如此仍然可以由本领域技术人员常规地确定。
325、本发明所述的“预防”是指获得或发生疾病或障碍的风险降低。
326、术语“芳基”是指具有指定碳原子数(例如,c6~c14)的、环状的、不饱和的一价烃基,其为单环或多环(例如,2个),为多环时,单环之间共用两个原子和一根键,且(至少一个环/每个环均)具有芳香性,例如苯基、萘基。
327、术语“杂芳基”是指含有杂原子的芳香基团,优选含有1个、2个或3个独立选自氮、氧和硫的芳族6-14元或5-10元单环(例如6元单环)、6-14元或5-10元双环(例如9-10元双环),例如呋喃基、吡啶基、哒嗪基、嘧啶基、吡嗪基、噻吩基、异唑基、噁唑基、二唑基、咪唑基、吡咯基、吡唑基、三唑基、四唑基、噻唑基、异噻唑基、噻二唑基、苯并咪唑基、吲哚基、吲唑基、苯并噻唑基、苯并异噻唑基、苯并唑基、苯并异唑基、喹啉基、异喹啉基等。
328、术语“烷基”是指具有指定的碳原子数的直链或支链烷基。烷基的实例包括甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基、仲丁基、正戊基、正己基、正庚基、正辛基及其类似烷基。若非特别指明取代基,否则烷基是非取代的。
329、术语“环烷基”是指具有指定数目(例如c3~c8)环碳原子数的非芳香族的饱和的一价环烃基,其为单环,环烷基的例子包括但不限于环丙基、环丁基、环戊基。
330、术语“卤素”是指f、cl、br、i。
331、术语“亚杂环烷基”是指具有指定数目环原子数(例如3~10元)的且至少一个环碳原子被选自n、o和s的杂原子代替形成的非芳香族的饱和二价环烃基。亚杂环烷基可以通过其中的杂原子或碳原子连接到分子中的其他部分。单环的亚杂环烷基的例子包括但不限于并环的亚杂环烷基的例子包括但不限于
332、在本发明中,术语“亚杂烷基”是指具有指定数目链原子数(例如2~9个)的饱和的直链的二价烃基,其中至少有一个链原子为选自n、o和s的杂原子,其余链原子为碳。亚杂烷基可以通过其中的杂原子或碳原子连接到分子中的其他部分。具有2个链原子的亚杂烷基例如-o-ch2-、-ch2-o-等,具有3个链原子的亚杂烷基例如-ch2-ch2-o-、-ch2-o-ch2-等,具有4个链原子的亚杂烷基例如-ch2-o-ch2-ch2-等,具有5个链原子的亚杂烷基例如-ch2-ch2-o-ch2-ch2-等,具有6个链原子的亚杂烷基例如-ch2-ch2-ch2-o-ch2-ch2-等。
333、在本发明中,术语“亚烷基”是指具有指定数目碳原子的饱和的直链或支链的二价烃基。亚烷基的实例包括但不限于-ch2-、-ch2ch2-。
334、在本发明中,术语“饱和杂环”是指具有指定环原子数(例如,3~5元)的、指定杂原子数(例如,1个或2个)的、指定杂原子种类(n、o和s中的一种或多种)的饱和环,脂杂环的例子包括但不限于:
335、本发明的化合物可以存在特定的几何或立体异构体形式。本发明设想所有的这类化合物,包括顺式和反式异构体、(-)-和(+)-对对映体、(r)-和(s)-对映体、非对映异构体、(d)-异构体、(l)-异构体,及其外消旋混合物和其他混合物,例如对映异构体或非对映体富集的混合物,所有这些混合物都属于本发明的范围之内。
336、除非另有说明,术语“对映异构体”或者“旋光异构体”是指互为镜像关系的立体异构体。
337、除非另有说明,术语“顺反异构体”或者“几何异构体”系由因双键或者成环碳原子单键不能自由旋转而引起。
338、除非另有说明,术语“非对映异构体”是指分子具有两个或多个手性中心,并且分子间为非镜像的关系的立体异构体。
339、除非另有说明,用楔形实线键和楔形虚线键表示一个立体中心的绝对构型,用直形实线键和直形虚线键表示立体中心的相对构型,用波浪线表示楔形实线键或楔形虚线键或用波浪线表示直形实线键或直形虚线键用“*”标注的碳是指s构型手性碳、r构型手性碳或非手性碳。
340、可以通过的手性合成或手性试剂或者其他常规技术制备光学活性的(r)-和(s)-异构体以及d和l异构体。如果想得到本发明某化合物的一种对映体,可以通过不对称合成或者具有手性助剂的衍生作用来制备,其中将所得非对映体混合物分离,并且辅助基团裂开以提供纯的所需对映异构体。或者,当分子中含有碱性官能团(如氨基)或酸性官能团(如羧基)时,与适当的光学活性的酸或碱形成非对映异构体的盐,然后通过本领域所公知的常规方法进行非对映异构体拆分,然后回收得到纯的对映体。此外,对映异构体和非对映异构体的分离通常是通过使用色谱法完成的,所述色谱法采用手性固定相,并任选地与化学衍生法相结合(例如由胺生成氨基甲酸盐)。
341、用表示相应的基团通过该位点与化合物中的其它片段、基团进行连接。
342、在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
343、本发明所用试剂和原料均市售可得。
344、本发明的积极进步效果在于:本发明的化合物对kras蛋白具有降解作用或对krasg12d突变蛋白具有良好的抑制作用。
- 还没有人留言评论。精彩留言会获得点赞!