基于多肽自组装的自噬降解纳米复合物及其制备与应用的制作方法
本发明属于生物,涉及靶向蛋白降解,尤其涉及一种基于多肽自组装的自噬降解纳米复合物及其制备与应用。
背景技术:
1、蛋白质在多种生理过程中扮演着不可替代的作用,“如何实现对蛋白质含量的精准调控”一直是生物科学界的重要研究方向。
2、近年来兴起了以protac(proteolysis targeting chimeras)为代表的多种靶向蛋白降解技术,基于分子伴侣介导的自噬的降解剂(chaperone-mediated autophagytargets protein degradation,cma-tpd)便是其中一种。这类降解剂包含两种核心组分,分别是“能与目标蛋白结合的配体”以及“发挥cma途径活性所必须的kferq motif”,此外,研究人员还必须利用合适的“连接子linker”将不同部分连接起来。
3、基于上述策略,此前已有研究者开发出了可特异实现pd-l1、dapk1、cdk5等蛋白降解的降解剂。然而,目前这一策略还存在以下几点不足之处:(1)连接子linker的筛选缺乏普适性原则;(2)两种配体之间的比例往往只能固定为1:1;(3)以往基于cma靶向序列开发的蛋白质降解剂本身穿膜性不佳,不得不加入“穿膜肽序列”以辅助其穿膜。
技术实现思路
1、本发明所要解决的技术问题在于提供一种基于多肽自组装的自噬降解纳米复合物及其制备与应用,以避免现有技术存在的linker筛选缺乏普适性原则、配体比例固定以及需要借助穿膜肽序列实现穿膜的问题。
2、本发明采用以下技术方案解决上述技术问题:
3、一种基于多肽自组装的自噬降解纳米复合物,由化合物i与化合物ii之间自组装形成;
4、并且,所述化合物i的结构式为:
5、lys-phe-glu-arg-gln-ahx-phg-phg-arg-arg;
6、所述化合物ii的结构通式为:
7、ra-linker-phg-phg-arg-arg;
8、所述化合物ii的结构通式中,ra为目标蛋白(poi)配体,linker为琥珀酸酐基、戊二酸酐基、-co-r1-co-或-nh-r2-co-中的一种,r1、r2各自独立地选自任意取代的c1-c6亚烷基。
9、作为本发明的优选方式之一,所述化合物i与化合物ii结构中的phg-phg-arg-arg为四肽核心基序;所述化合物i和化合物ii在所述四肽核心基序的介导下发生自组装,形成纳米球;所述纳米球即为所述的自噬降解纳米复合物,具有通过自噬途径实现靶蛋白特异性降解的生物学活性。
10、作为本发明的优选方式之一,所述纳米球的直径不超过500nm。
11、一种上述基于多肽自组装的自噬降解纳米复合物的制备方法,其特征在于,先分别制备化合物i、化合物ii,再将其冻干成粉末;将冻干形式的化合物i、ii溶于极性溶剂,获得储备溶液;将储备溶液在超声状态下溶于预热的ddh2o中,最终获得目标所需的自组装纳米球。
12、作为本发明的优选方式之一,通过固相合成法制备所述化合物i、化合物ii。
13、作为本发明的优选方式之一,在极性溶剂中加入所述化合物i和化合物ii后,二者在储备溶液中的终浓度为50mg/ml。
14、作为本发明的优选方式之一,所述极性溶剂为1,1,1,3,3,3-六氟-2-丙醇。
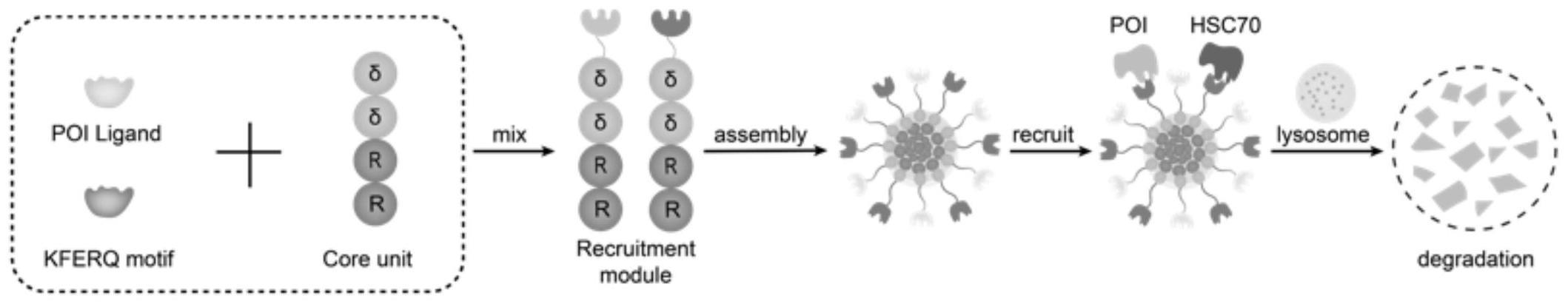
15、作为本发明的优选方式之一,所述化合物i、ii间的物质的量之比为3:1、2:1、1:1、1:2或1:3。
16、作为本发明的优选方式之一,所述ddh2o为70℃预热的ddh2o。
17、一种上述基于多肽自组装的自噬降解纳米复合物在制备抗肿瘤药物中的应用,即在肿瘤细胞中实现对目标蛋白的特异性降解。
18、设计思路与原理:
19、本发明设计涉及到以下几个重要部分:δδrr、kferq motif、配体。其中,δδrr(苯基甘氨酸phg-苯基甘氨酸phg-精氨酸arg-精氨酸arg)来源于本发明此前关于sm-protac的工作中筛选出的可自组装成纳米球的多肽序列。kferq motif(lys-phe-glu-arg-gln)是一种天然存在于特定蛋白质中的保守的结构基序,细胞内的分子伴侣可以识别这一基序,进而将携带这一基序的蛋白质运送到溶酶体内部进行降解。配体主要是其他文献中已报道过的被证明可以与目标蛋白以高亲和力结合的配体分子poi ligand。
20、本发明核心化合物i、ii分别是指将kferq motif以及靶向目标蛋白的配体通过化学键与δδrr四肽核心基序连接起来形成的化合物分子;对应地,化合物i可表示为:kferqmotif-ahx-δδrr;化合物ii表示为:poi ligand-linker-δδrr;二者自组装形成目标所需的自噬降解纳米复合物。此处,linker为琥珀酸酐基、戊二酸酐基、-co-r1-co-或-nh-r2-co-中的一种,r1、r2分别选自任意取代的c1-c6亚烷基,linker的设置是为了便于合成,不添加linker也可行。
21、本发明自噬降解纳米复合物的设计原理如图1所示。图1中:虚线框里展示的是化合物i、ii的组成成分,其中δδrr四肽基序是二者共有的,poi ligand是化合物ii特有,kferq motif是化合物i特有。分别将poi ligand与kferq motif与δδrr连接后便得到完整的化合物i、ii(mix右侧图),之后按本本发明所述的方式诱导化合物i、ii进行自组装,形成纳米球(assembly右侧图),纳米球可以同时招募poi(目标蛋白)和hsc70(分子伴侣),(recruit右侧),之后将poi运送到溶酶体(lysosome)进行降解。
22、本发明自噬降解纳米复合物的设计,可克服目前cma-tpd开发所存在的问题:(1)使用本发明方法进行基于分子伴侣介导的自噬的降解剂的构建,研究人员只需将配体分子直接或者通过本发明linker连接在δδrr四肽核心基序的n端,无需进行linker的复杂筛选;(2)使用本发明方法进行基于分子伴侣介导的自噬的降解剂的构建,研究人员在化合物i、ii自组装的过程中可以任意控制其不同配体的比例,进而找到最适比例;(3)使用本发明构建的基于分子伴侣介导的自噬的降解剂,可以在不携带“穿膜肽序列”的情况下穿过细胞膜。
23、本发明相比现有技术的优点在于:
24、(1)首先,本发明巧妙地将多肽自组装和分子伴侣介导的自噬联系在了一起,设计上巧妙避开了多数蛋白降解嵌合体所需要的复杂的连接子的筛选步骤;其次,该设计还可随意调整目标蛋白的结合配体和招募分子伴侣的配体比例,而传统靶向蛋白降解嵌合体的两种配体分子通常被设置为1:1;最后,使用本专利中描述的方法构建的基于分子伴侣介导的自噬的降解剂可以在不携带“穿膜肽序列”的情况下穿过细胞膜;
25、(2)本发明设计具有通用性,使用者可根据需求随意更换目标蛋白的结合配体,进而可以靶向不同的目标蛋白并诱导其降解,为sm-cma-tpd(split and mix chaperone-mediated autophagy targets protein degradation)设计提供了一种十分简便的通用型技术平台;
26、(3)本发明纳米复合物可以在体外培养的细胞中实现对目标蛋白的特异性降解,并进一步转化为对于肿瘤细胞生长的抑制。
- 还没有人留言评论。精彩留言会获得点赞!