宿主细胞残留DNA检测样本前处理试剂盒及其使用方法与流程
本发明涉及分子生物学,c12n15/10,尤其涉及宿主细胞残留dna检测样本前处理试剂盒及其使用方法。
背景技术:
1、宿主细胞中dna的残留量决定着宿主细胞生物产品的杂质含量和安全性能等,如何精准高效地定量宿主细胞中残留的dna显得非常重要。对于生物制品中微量的dna进行分析,不但要保证去除样品本身的基质干扰物,还要避免操作过程中的交叉污染,并保证提取方法的准确性和精密度。
2、现有对残留dna样品进行前处理的方法存在着众多问题,如(1)对样品数量和质量要求高,(2)dna片段长度和质量差异大,后续重复实验的准确性不高,(3)操作时间长,操作过程繁琐,(4)前处理成本高等等。中国专利cn109957561a公开了一种提取残留dna的方法,该方法中使用了裂解液、糖原、碘化钠、异丙醇等对dna进行处理,其中不涉及有机试剂洗涤步骤,降低了对环境的污染,并解决了试剂盒成本高的问题。但是该方法中dna的提取纯度仍然不高。
3、现有技术在dna提取方面仍然存在很多缺点,因此需要在提高提取效率和纯度,简化操作步骤,降低安全风险等方面进行改进以适应更广泛的需求。
技术实现思路
1、为了解决上述技术问题,本发明首先提供了一种宿主细胞残留dna检测样本前处理试剂盒,所述试剂盒包括:裂解液、洗涤液、洗脱液、磁珠悬液、蛋白酶k、糖原、酵母trna。
2、进一步地,所述裂解液包括以下浓度的组分:15-30mmol/l的tris-hcl、110-150mmol/l的磷酸酶抑制剂、15-30mmol/l的硫醇类物质、0.5-5mmol/l的na3vo4。
3、进一步地,所述磷酸酶抑制剂选自nacl、naf、na4p2o7、β-甘油磷酸中的至少一种。
4、优选地,所述磷酸酶抑制剂为nacl和/或naf。
5、进一步地,所述裂解液还包括蛋白酶抑制剂。
6、进一步地,所述蛋白酶抑制剂选自aprotinin、leupetin、bestatin、pepstatin、pmsf中的至少一种。
7、优选地,所述蛋白酶抑制剂为aprotinin、leupetin和pmsf。
8、进一步地,所述裂解液的组分还包括0.05-4ug/ml的aprotinin、0.5-3ug/ml的leupetin、0.5-3mmol/l的pmsf。
9、优选地,所述裂解液包括以下浓度的组分:18-25mmol/l的tris-hcl、125-145mmol/l的磷酸酶抑制剂、16-23mmol/l的硫醇类物质、1-4mmol/l的na3vo4、0.05-2.5ug/ml的aprotinin、0.5-2ug/ml的leupetin、0.5-2mmol/l的pmsf。
10、在一种优选的实施方式中,所述裂解液包括以下浓度的组分:20mmol/l的tris-hcl、137mmol/l的磷酸酶抑制剂、20mmol/l的硫醇类物质、2mmol/l的na3vo4、1ug/ml的aprotinin、1ug/ml的leupetin、1mmol/l的pmsf。
11、进一步地,所述硫醇类物质为β-巯基乙醇、二硫苏糖醇、二硫代赤藓醇中的至少一种。
12、优选地,所述硫醇类物质为二硫苏糖醇。
13、进一步地,所述裂解液还包括np-40,所述np-40在裂解液中的质量分数为0.5-3%,优选为1%。
14、在一种更优选的实施方式中,所述裂解液包括以下浓度的组分:20mmol/l的tris-hcl、137mmol/l的nacl、20mmol/l的二硫苏糖醇、2mmol/l的na3vo4、1ug/ml的aprotinin、1ug/ml的leupetin、1mmol/l的pmsf、质量分数为1%的np-40。其中的mmol/l、ug/ml和1%指相应的组分在裂解液中的摩尔浓度、质量浓度和质量分数。
15、本技术的裂解液中,na3vo4和nacl可抑制磷酸化蛋白的去磷酸化,维持蛋白质的磷酸化状态;aprotinin、leupetin和pmsf了有效抑制细胞裂解中产生的蛋白酶,以保持蛋白质不被降解,但不同的蛋白酶抑制剂对蛋白质的敏感性不同,只有在裂解液中使用0.05-2.5ug/ml的aprotinin、0.5-2ug/ml的leupetin、0.5-2mmol/l的pmsf的裂解液并配合0.5-3%质量分数的np-40使用时才能最有效地使蛋白酶活力下降、消失,并不使其变性;二硫苏糖醇可还原dna中的二硫键,抑制dna形成二聚体的倾向,提高磁珠对dna的固定效率,另外还促进了蛋白酶k消化组织的作用。通过优化裂解液的组分和浓度,使本技术的试剂盒对dna的提取效率更高,所取得的dna纯度更好。
16、进一步地,所述洗涤液为0.2-3.0mol/l的na2hpo4溶液,优选为0.4-1.0mol/l的na2hpo4溶液;更优选为0.5mol/l的na2hpo4溶液。
17、进一步地,所述洗脱液包括但不限于te buffer、pb buffer中的至少一种。
18、进一步地,所述洗脱液为te buffer;所述te buffer指tris-edta缓冲液,其中tris浓度为10mmol/l,edta浓度为1mmol/l,ph为7.9-8.1。
19、进一步地,所述磁珠悬液中磁珠的浓度为0.8-2mg/ml,优选为1mg/ml。
20、进一步地,所述磁珠为羟基修饰的磁珠,购自himat,型号为hydroxy01-200。
21、进一步地,所述试剂盒中裂解液、洗涤液、洗脱液、磁珠悬液、蛋白酶k需保存在2-8℃的环境下,糖原和酵母trna需保存在-20℃以下的环境中。
22、其次,本发明还提供了一种宿主细胞残留dna检测样本前处理试剂盒的使用方法,包括以下步骤:
23、s1、将待处理样本加入体积比为(1-3.5):1的裂解液和蛋白酶k的混合液中,于离心管内漩涡震荡后离心,在50-70℃下孵育10-30min;
24、s2、对s1孵育后的混合体系离心处理,之后依次加入糖原和酵母trna、裂解液、异丙醇、磁珠悬液,漩涡震荡后快速离心;移去上清液后向离心管中加入洗涤液,漩涡震荡将磁珠分散,快速离心;再次移去上清液后,向离心管内加入75-85wt%的乙醇,漩涡震荡、快速离心,静置0.5-2min后移去上清液;
25、s3、对s2离心后的混合体系再次快速离心处理,吸取出残留的乙醇后,对离心管内剩余的物质进行干燥;
26、s4、向s3的离心管中加入洗脱液,漩涡震荡后,在65-80℃下孵育3-12min,孵育期间每2-3min涡旋混匀一次;
27、s5、将s4的离心管高速离心,收集出上清液即可。
28、进一步地,所述待测样本为液体或者干粉。当待测样本为液体,且含有较高dna含量时,可使用pbs对样本稀释后再进行处理,稀释倍数可根据实际情况进行调整,如100倍、1000倍。当待测样本为干粉时,将其稀释成10mg/ml-100mg/ml再进行前处理操作。
29、进一步地,所述待处理样本的ph为6.0-8.0。
30、进一步地,所述s1中待处理样本的体积为50-200μl,优选为100μl。
31、进一步地,所述裂解液和蛋白酶k的体积比为2.5:1。
32、进一步地,所述s1具体为:将100μl待处理样本加入体积比为2.5:1的20-40μl蛋白酶k的混合液中,于离心管内漩涡震荡后离心,在60-68℃下孵育12-20min。
33、在一种更优选的实施方式中,所述s1具体为:将100μl待处理样本加入25μl裂解液和10μl蛋白酶k的混合液中,于离心管内漩涡震荡后离心,在65℃下孵育15min。
34、进一步地,所述s2中糖原、酵母trna、裂解液、异丙醇、磁珠悬液的体积比为(7-10):(0.1-0.5):(40-60):(120-180):(15-25)。
35、优选地,所述s2中糖原、酵母trna、裂解液、异丙醇、磁珠悬液的体积比为(8.5-9.5):(0.1-0.3):(45-55):(140-160):(18-22)。
36、更优选地,所述s2中糖原、酵母trna、裂解液、异丙醇、磁珠悬液的体积比为9.0:0.2:50:150:20。
37、进一步地,所述磁珠悬液的体积为待测样本体积的1/3-1/6,优选为1/5。
38、进一步地,所述洗涤液和乙醇的使用体积均为待测样本体积的3-8倍,优选为5倍。
39、进一步地,所述s2具体为:对s1孵育后的混合体系离心处理,之后依次加入9.0μl糖原和0.2μl酵母trna的混合液、50μl裂解液、150μl异丙醇、20μl磁珠悬液,漩涡震荡后快速离心8-15s;移去上清液后向离心管中加入500μl洗涤液,漩涡震荡将磁珠分散,快速离心;再次移去上清液后,向离心管内加入500μl、75-85wt%的乙醇,漩涡震荡、快速离心,静置0.5-2min后移去上清液。
40、进一步地,本技术所采用的移去上清液的方式为:将离心管置于磁力架,轻轻左右转动,待磁珠聚集于贴近磁力架的管壁后,保持离心管固定于磁力架上,用移液枪吸取上清液,过程中不能触碰到磁珠。
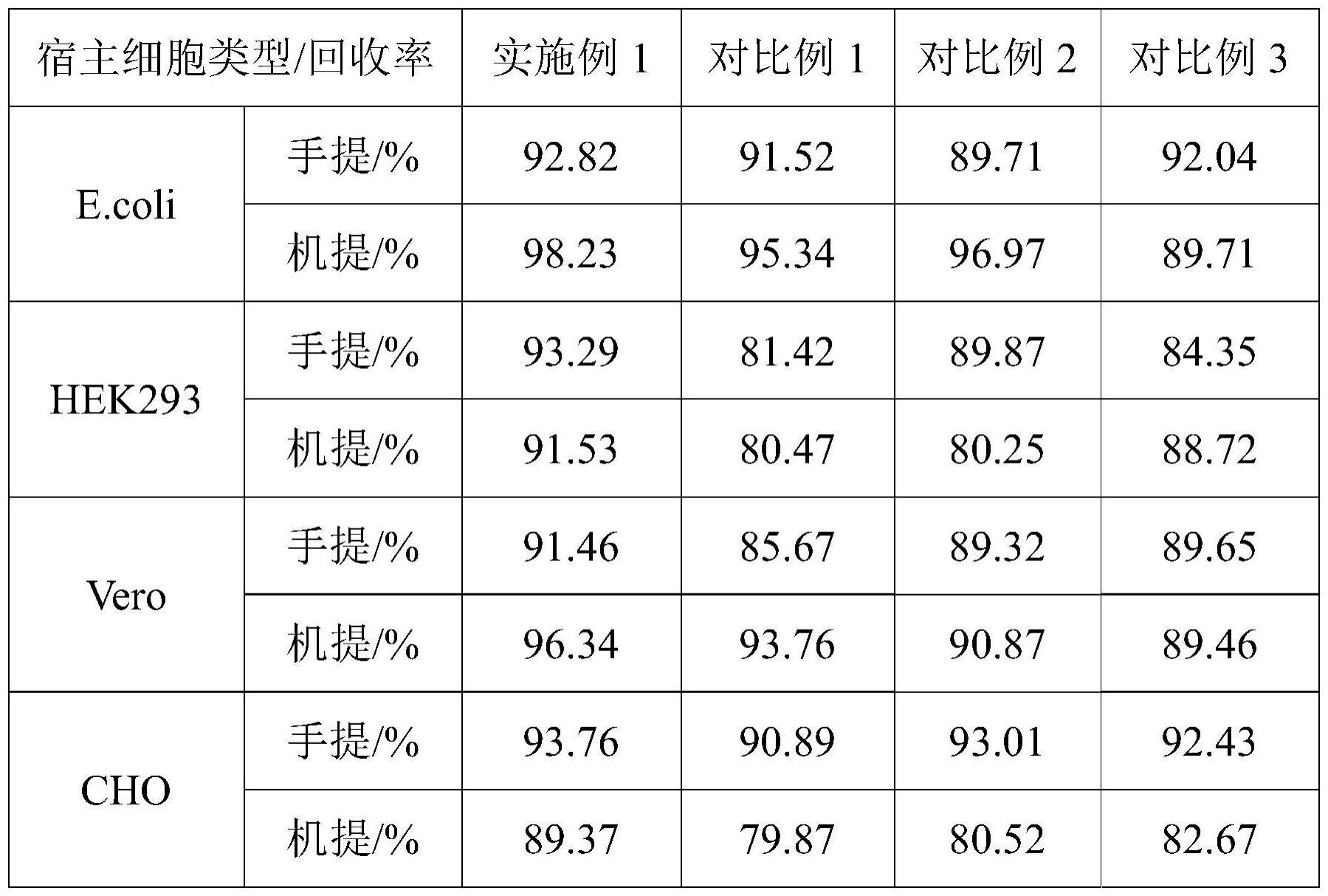
41、进一步地,所述s3的干燥采用室温干燥或鼓风干燥,干燥时间可适应性调整,但避免磁珠干燥过重。
42、进一步地,所述s3的干燥为室温干燥时,干燥时间为2-6min;若采用鼓风干燥时,干燥时间为1-3min。
43、进一步地,所述s4中洗脱液的添加体积为待处理样本体积的0.8-3倍,优选为1-1.5倍;优选为1倍。
44、在一种优选的实施方式中,所述s4具体为:向s3的离心管中加入100μl洗脱液,漩涡震荡0.5-2min后,在70℃下孵育7min,孵育期间每2-3min涡旋混匀一次。
45、进一步地,所述s5具体为:将s4的离心管高速离心0.5-2min,之后静置于磁力架上,待磁珠分离后,转移出上清液到新的试剂管中即可。
46、进一步地,所述s1-s5中,离心转速为1000-5000r/min。
47、进一步地,所述试剂盒用于cho细胞、e.coli细胞、vero细胞、human细胞、质粒等中的dna的提取和纯化过程中。
48、有益效果
49、1、相对于传统dna提取方法,本技术dna样本前处理试剂盒大大精简了实验操作,避免了繁琐的步骤和复杂的操作流程,降低了实验难度;
50、2、本技术的dna样本前处理试剂盒利用了表面修饰的磁珠对dna分子进行特异性结合,提高了dna提取的效率,使得提取的dna量更高,更稳定;进一步规定使用具有特定组分和浓度的裂解液,结合过程中规定糖原、酵母trna、裂解液、异丙醇、磁珠悬液的体积比为(7-10):(0.1-0.5):(40-60):(120-180):(15-25),有效地减少dna损失和样品残留,提高纯度,从而得到更纯净、更可靠的dna样品;
51、3、本技术的dna样本前处理试剂盒可适用于各种类型的样品如血液、组织、体液、唾液、细胞培养液等,具有很强的适用性和灵活性;且检测快速、专一性强、性能可靠。
- 还没有人留言评论。精彩留言会获得点赞!