一种检测恶性疟原虫的LAMP引物组、微流控芯片及检测方法
本发明涉及一种检测恶性疟原虫的lamp引物组、试剂盒及检测方法,属于生物检测领域。
背景技术:
1、疟疾是严重危害人类健康的重要传染病之一,主要经按蚊叮咬传播。已知5种疟原虫可以引起人类疟疾:恶性疟原虫、间日疟原虫、三日疟原虫、卵形疟原虫、诺氏疟原虫。在全世界范围内引起疾病传播的主要是间日疟原虫和恶性疟原虫。
2、目前,疟原虫感染常用检测方法主要包括:光学显微镜检查、快速诊断试纸条法(rapid diagnostic tests,rdts)、聚合酶链式反应(polymerase chain reaction,pcr)、实时荧光pcr法(quantitative real-time pcr,qpcr)等。光学显微镜检查在很大程度上依赖于专家和技术人员的专业知识技能,存在镜检时间长、评判标准不统一等问题。rdt检测方法操作简易、检测迅速,但目前仅限于检测患者血清样本,无法检测蚊虫样本。pcr和qpcr方法具有较高的敏感性,但操作流程复杂,对于实验设备和条件有较高的要求,在蚊媒监测现场难以实施,需要将样本保存后携带至中心实验室检测。这一过程大大延长了病原体的检测周期,对检出率也有影响,从而限制了现场检测的应用。
3、环介导等温扩增(loop-mediated isothermal amplification,lamp)是一种等温扩增核酸的技术。针对靶基因区域设计2-3对引物,利用具有链置换性质的嗜热dna聚合酶在一个恒定的温度下实现一步核酸扩增的高效方法。微流控芯片则提供了一种精确控制和处理微量样本的方法。将lamp与微流控芯片结合成微流控等温扩增技术,可以实现对病原体的高效、精确检测,具有操作简便、设备需求低、检测快速等特点,适合在现场环境中实施。
4、lamp微流控芯片中,最主要的成分为lamp引物组。lamp引物组决定了芯片的特异性、灵敏性和检测结果的精准性。因此,需要设计并筛选出高效的检测恶性疟原虫的lamp引物组。
技术实现思路
1、本发明提供了检测恶性疟原虫的lamp引物组、微流控芯片及检测方法,本发明基于lamp微流控芯片方法的检测技术,拟用于现场检测媒介携带恶性疟原虫,为疟疾防控提供新的技术工具。
2、为达此目的,本发明提供如下的技术方案:
3、本发明的第一个方面,提供了一种检测恶性疟原虫的lamp引物组,包括检测18srdna的lamp引物组和/或检测emp1基因的lamp引物组;所述检测18s rdna的lamp引物组包括18g2f3引物、18g2b3引物、18g2fip引物和18g2bip引物,所述18g2f3引物的核苷酸序列如seq id no.5所示、所述18g2b3引物的核苷酸序列如seq id no.6所示、所述18g2fip引物的核苷酸序列如seq id no.7所示和所述18g2bip引物的核苷酸序列如seq id no.8;所述检测emp1基因的lamp引物组包括2ag1f3引物、2ag1b3引物、2ag1fip引物和2ag1bip引物,所述2ag1f3引物的核苷酸序列如seq id no.17所示、所述2ag1b3引物的核苷酸序列如seq idno.18所示、所述2ag1fip引物的核苷酸序列如seq id no.19所示和所述2ag1bip引物的核苷酸序列如seq id no.20。
4、在本发明中,
5、seq id no.5的序列为:acgattaataggagtatctttgg;
6、seq id no.6的序列为:acattccctaagaaatgctaca;
7、seq id no.7的序列为:gcagtagtccgtctccagaaggcattcgtattcag atgtca;
8、seq id no.8的序列为:aagaacgaaagttaagggagtgaatcatccaacaccta gtcgg;
9、seq id no.17的序列为:tgcaaatacccaaaagtgatt;
10、seq id no.18的序列为:atatttaggactacctggtaca;
11、seq id no.19的序列为:ccgtttgcctctgtatttaccacgacaaaactttcac ccaat;
12、seq id no.20的序列为:ccttgaaggagatagtggaactgatttcttcatactcactttcggaag。
13、本发明的第二个方面,提供了本发明所述的lamp引物组在制备检测恶性疟原虫的试剂中的应用。
14、在本发明中,试剂包括检测试剂、试纸或者检测仪器自带的检测药液。
15、在本发明中,应用包括不以诊断和治疗目的的恶性疟原虫检测。包括但不限于实验室检测、环境评测。
16、本发明的第三个方面,提供了一种检测恶性疟原虫的lamp微流控芯片,包括lamp引物组、lamp核酸扩增试剂exo-nat,所述lamp引物组包括检测18s rdna的lamp引物组和/或检测emp1基因的lamp引物组。
17、优选的,所述检测18s rdna的lamp引物组包括18g2f3引物、18g2b3引物、18g2fip引物和18g2bip引物,所述18g2f3引物的核苷酸序列如seq id no.5所示、所述18g2b3引物的核苷酸序列如seq id no.6所示、所述18g2fip引物的核苷酸序列如seq id no.7所示和所述18g2bip引物的核苷酸序列如seq id no.8。
18、优选的,所述检测emp1基因的lamp引物组包括2ag1f3引物、2ag1b3引物、2ag1fip引物和2ag1bip引物,所述2ag1f3引物的核苷酸序列如seq id no.17所示、所述2ag1b3引物的核苷酸序列如seq id no.18所示、所述2ag1fip引物的核苷酸序列如seq id no.19所示和所述2ag1bip引物的核苷酸序列如seq id no.20。
19、优选的,18g2f3引物和18g2b3引物的终浓度为0.1-0.3μm,18g2fip引物和18g2bip引物的终浓度为1-3μm。
20、优选的,2ag1f3引物和2ag1b3引物的终浓度为0.1-0.3μm,2ag1fip引物和2ag1bip引物的终浓度为1-3μm。
21、本发明的第四个方面,提供了一种快速检测恶性疟原虫的方法,包括以下步骤:
22、s1、制备lamp微流控芯片,
23、s2、提取待测样本的核酸;
24、s3、将步骤s2提取的待测样本的核酸与lamp核酸扩增试剂exo-nat混合,然后将混合样液加入步骤s1制备的lamp微流控芯片的加样孔中;
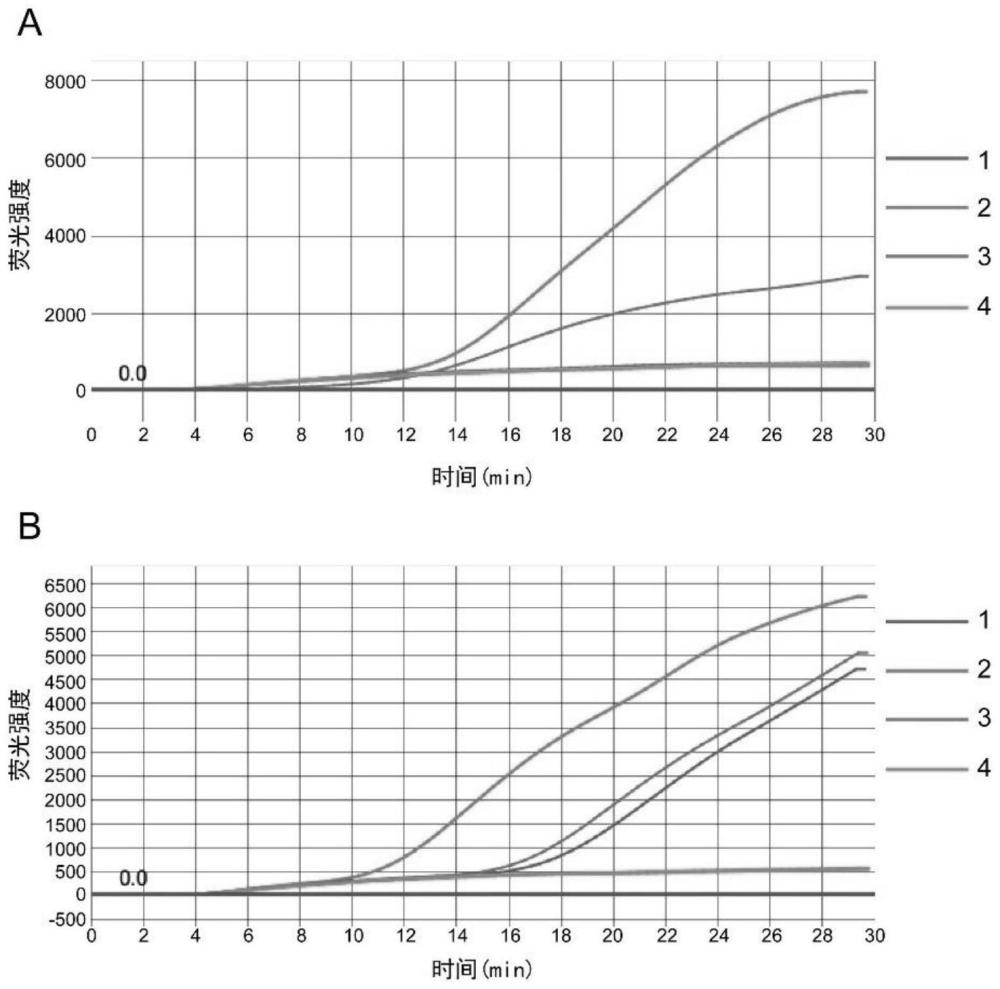
25、s4、预处理后置于55-70℃下,进行等温扩增反应;
26、s5、检测步骤s4扩增后的产物是否扩增出恶性疟原虫;
27、其中,lamp微流控芯片的lamp引物组包括检测18s rdna的lamp引物组和/或检测emp1基因的lamp引物组;所述检测18s rdna的lamp引物组包括18g2f3引物、18g2b3引物、18g2fip引物和18g2bip引物,所述18g2f3引物的核苷酸序列如seq idno.5所示、所述18g2b3引物的核苷酸序列如seq id no.6所示、所述18g2fip引物的核苷酸序列如seq idno.7所示和所述18g2bip引物的核苷酸序列如seq id no.8;所述检测emp1基因的lamp引物组包括2ag1f3引物、2ag1b3引物、2ag1fip引物和2ag1bip引物,所述2ag1f3引物的核苷酸序列如seq id no.17所示、所述2ag1b3引物的核苷酸序列如seq id no.18所示、所述2ag1fip引物的核苷酸序列如seq id no.19所示和所述2ag1bip引物的核苷酸序列如seq id no.20
28、优选的,步骤s1还包括,将lamp引物组与0.5%海藻糖和水混合加入芯片的引物包埋孔中。
29、优选的,步骤s1中,18g2f3引物和18g2b3引物的终浓度为0.1-0.3μm,18g2fip引物和18g2bip引物的终浓度为1-3μm;2ag1f3引物和2ag1b3引物的终浓度为0.1-0.3μm,2ag1fip引物和2ag1bip引物的终浓度为1-3μm。
30、优选的,步骤s5包括但不限于:扩增产物进行琼脂糖凝胶电泳检测。
31、与现有技术相比,应用本发明的技术方案的有益效果及显著进步在于:
32、1、本发明筛选得到的最优引物组合emp1 g2与18s rdna g2在微流控等温扩增中最低检测限分别为125copies/μl和6562copies/μl;
33、2、本发明筛选的引物组合对于疟原虫传播媒介及形态类似的节肢动物基因组没有观察到非特异性扩增现象,并且与寨卡病毒、流行性乙型脑炎病毒、登革病毒ⅰ型以及黄热病毒核酸无交叉反应;
34、3、相比国家标准pcr方法,本发明的方法表现出更高的灵敏度,在模拟现场检测中,成功地检测到了稀释10000倍的基因组样本;
35、4、本发明的方法无需依赖大型仪器设备,操作简单,检测时间短,适合用于现场检测,有望为疟疾防控提供新的检测技术。
- 还没有人留言评论。精彩留言会获得点赞!