一种特异性靶向细胞内脂滴的荧光染料及其制备方法和用途与流程
本发明属于合成与技术应用领域,具体涉及一种特异性靶向细胞内脂滴的荧光染料及其制备方法和用途。
背景技术:
脂滴是由内质网产生的一种细胞内高度运动的细胞器,它不仅在细胞代谢过程中起着脂质储存的作用,而且参与多种生理过程,包括膜转运、膜和脂蛋白形成以及细胞内信号转导等。脂滴是由表面嵌有多种功能蛋白的磷脂单分子层围裹而成,内含中心脂质-甘油三酯和少量胆甾醇酯。不同细胞内脂滴的组成虽然相似,但是其数量和大小却存在明显的差异,这些差异不仅能够反映细胞的代谢状态,同时也能区分细胞类型。正常状态下,细胞严格控制脂滴中脂肪酸的储存和消耗,维持生命体的正常运转和健康。然而,当脂滴及其相关蛋白产生功能障碍时,则会导致肥胖、糖尿病和动脉粥样硬化等疾病。因此,发展非侵害性、长时程的荧光染料对脂滴进行特异性成像并实时监测细胞内脂滴的形成、生长、融合和裂分,对进一步了解脂滴的生理学和病理学作用具有重要意义。
虽然透射电子显微镜技术能够清晰地观察到细胞内的脂滴,但是这种侵害式显微技术难以追踪脂滴的动态变化及其与其它细胞器之间关联性。然而,高时空分辨的荧光成像技术为研究脂滴在生物体内的动态过程和相关生理功能提供了理想的解决方案。目前,已经发展了多种用于细胞内脂滴特异性标记的荧光染料,这些荧光染料成为监测细胞内脂滴行为的有力工具。但是,多数脂滴类荧光染料仍存在很大不足:1)染料合成过程复杂,纯化困难,费时、耗力、成本高等;2)斯托克斯位移小易造成染料的自吸收现象;3)细胞毒性大使细胞处于应激状态,难以实现自然状态下对脂滴生理过程的示踪。为了能够在复杂生物体中实现对脂滴参与的分子事件进行特异性成像以及实时动态监测,亟需发展大斯托克斯位移、低细胞毒性和光稳定性的脂滴定位染料。发展构建性能优越的特异性靶向细胞内脂滴的荧光染料,将会对探索细胞内脂滴的生理功能及与其他细胞器之间的关联系起到极大的推动作用。
技术实现要素:
本发明针对现有脂滴染料中存在的技术问题,提供了一种特异性靶向细胞内脂滴的荧光染料及其制备方法和用途。本发明荧光染料斯托克位移大、荧光背景低、生物兼容性好,能够特异性靶向细胞内的脂滴,可实现长时程观察细胞内脂滴的运动过程,并且能够从hela、a549和hff-1三种细胞中特异性识别a549细胞。该类探针用于细胞染色后,无需清洗,可直接用于激光共聚焦成像。
本发明特异性靶向细胞内脂滴的荧光染料,是以5-(二甲氨基)萘-1-磺酸(dns)作为荧光母体,在母体分子结构上引入不同种类的胺或醇类化合物,其结构如下所示:
其中r选自如下基团中的一种:
r1为氧或碳,r2、r3分别独立地选自氢、c1-8的烷基或苯基。
本发明特异性靶向细胞内脂滴的荧光染料的制备方法,包括如下步骤:
将胺或醇类化合物和碱溶于10-100ml有机溶剂中,室温下搅拌反应10-90min,然后将0.4-30ml溶有化合物dns-cl的溶液缓慢滴加到上述反应液中,并于室温下继续搅拌反应1-24h;抽滤,除去不溶碱,用真空旋转蒸发仪除去有机溶剂,粗产物纯化后得到目标产物。
所述化合物dns-cl的结构式如下:
所述胺或醇类化合物为如下结构化合物中的一种:
其中r1为氧或碳,r2、r3分别独立地选自氢、c1-8的烷基或苯基。
所述碱为碳酸钾、三乙胺或4-n,n-二甲基吡啶等。
所述化合物dns-cl、胺或醇类化合物和碱三者之间的摩尔比为0.5:1:1-1:3:3。
所述有机溶剂为二氯甲烷或无水乙腈。
所述纯化是采用硅胶柱色谱分离的方法进行纯化,洗脱剂由二氯甲烷和甲醇按体积比10:1-150:1的比例混合构成。
本发明特异性靶向细胞内脂滴的荧光染料的用途,是在特异性标记细胞内的脂滴时作为检测试剂使用,且能够实时示踪脂滴在细胞内的运动行为;所述细胞包括腺癌人类肺泡基底上皮细胞a549和人正常乳腺上皮细胞mcf10a。
本发明特异性靶向细胞内脂滴的荧光染料的用途,是作为荧光探针对多种细胞内的脂滴进行荧光成像并能区别不同细胞内脂滴的大小和数量;所述细胞包括a549细胞、人正常乳腺上皮细胞mcf10a、小鼠单核巨噬细胞raw264.7、人正常肝细胞qsg7701和子宫颈癌细胞hela。
本发明特异性靶向细胞内脂滴的荧光染料的用途,是作为检测试剂在子宫颈癌细胞(hela)、人皮肤成纤维细胞(hff-1)和腺癌人类肺泡基底上皮细胞(a549)三种混合细胞中特异性识别a549细胞。
本发明设计合成了荧光背景低、斯托克位移大和生物兼容性好的脂滴靶向型荧光染料。该荧光染料具有合适的脂溶性和低细胞毒性,能够快速跨越细胞膜到达脂滴内。通过与商业脂滴染料nilered的共定位实验,证明本发明中的荧光染料能够特异性标记细胞内的脂滴,并且是一种普适性脂滴定位染料。与商业染料nilered相比,该染料的斯托克位移可达210nm以上,其良好的光稳定性和脂滴标记专一性使其适用于实时观察脂滴的动态变化过程。另外,将hela、hff-1和a549三种细胞混合,本发明中的荧光染料可以特异性识别出a549细胞。目前,这一类基于丹磺酰和氨基或醇类用于细胞内脂滴标记的荧光染料的制备方法及其应用还未见报道。
与现有技术相比,本发明的有益效果体现在:
1、本发明合成的荧光染料是通过磺酰化反应获得的,反应为一步合成法、用料便宜、合成简单、反应条件温和、容易纯化。
2、本发明合成的荧光染料结构中的氨或醇类化合物能够使探针具有合适的亲脂性,使其能够快速穿越细胞膜并特异性标记细胞内的脂滴。
3、本发明合成的荧光染料耐光性好并能长时间标记脂滴,能够实时观察脂滴在活细胞内的运动。
4、本发明合成的荧光染料成功用于特异性识别hela、hff-1和a549三种混合细胞中的a549细胞。
5、本发明中的荧光染料斯托克位移大、光稳定性好、细胞毒性小,为实时监测细胞内脂肪滴的生理活动奠定了基础。
附图说明
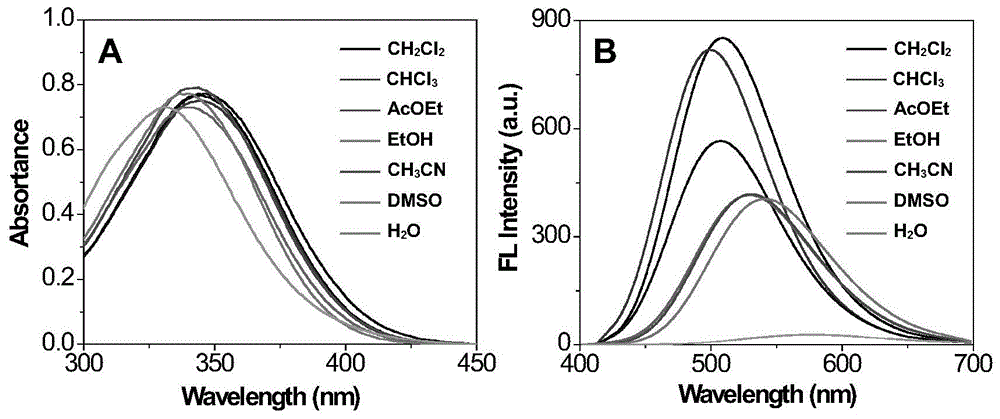
图1为本发明的荧光染料dns-m在极性不同的溶剂中的紫外-可见吸收光谱和荧光光谱。
图2为本发明荧光染料dns-m分别与不同的商业细胞器染料在a549细胞内的共定位:例如细胞膜染料celltrackerdeepred、溶酶体染料lysotrackerdeepred、线粒体染料mitotrackerdeepred和脂滴染料nilered。商业细胞器荧光染料分别加入到不同皿细胞中孵育30min后,更换新鲜培养基后加入dns-m继续培养30min后进行共聚焦成像。绿色通道(dns-m):激发波长405nm,收集的发射峰范围为499-678nm;红色通道(脂滴染料):激发波长543nm,收集发射峰范围为548-680nm;红色通道(线粒体、溶酶体和细胞染料):激发波长633nm,收集发射峰范围为638-747nm。标尺:10μm。
图3为本发明的荧光染料dns-m实时示踪脂滴在细胞内的运动轨迹。在不同时间点采集的细胞荧光图像分别用不同的伪彩表示,然后将相近时间点采集的荧光图像进行叠加后,观察脂滴在细胞内的实时运动。激发波长为405nm,收集的发射峰波长范围分别为499-678nm。标尺为10μm。
图4为本发明荧光染料dns-m的光稳定性试验。然后将dns-m加入细胞孵育30min后,进行共聚焦荧光成像。对细胞进行多次成像,分别统计扫描次数为1、10、20、30、40、50、60次的荧光图像中细胞相同区域的荧光强度平均值,并作荧光变化曲线。激发波长为405nm,收集的发射峰波长范围分别为499-678nm。标尺为10μm。
图5为本发明的荧光染料dns-m从hela、hff-1和a549三种混合细胞中特异性识别a549细胞。首先,将上述三种细胞接种在同一共聚焦玻璃皿中,培养24h后,更换无小牛血清的新鲜培养基,然后加入10μmdns-m后培养30min进行共聚焦成像。激发波长为405nm,收集的发射峰波长范围为499-678nm。标尺为20μm。
图6为本发明中的荧光染料dns-m与nilered在不同细胞内的共定位成像。向a549、mcf10a、raw264.7、qsg7701和hela细胞中分别添加nilered(1μm)孵育30min后更换新鲜的dmem,然后加入dns-m(10μm)继续培养30min后进行共聚焦荧光成像。绿色通道(dns-m):激发光波长405nm,收集的发射峰范围:499-678nm;红色通道(nilered):激发光波长543nm,收集的发射峰范围为548-680nm。标尺为10μm。
具体实施方式
实施例1:染料丹磺酰-吗啉(dns-m)的合成
将81.0mg吗啉(0.927mmol)和128.1mg无水碳酸钾(0.927mmol)溶于10ml无水乙腈中,于室温下搅拌30min。溶有250mg丹磺酰氯(0.927mmol)的10ml无水乙腈溶液逐滴加入到上述反应体系中,于室温下继续搅拌反应3h。待反应完成后,抽滤除去碳酸钾粉末,并用真空旋转蒸发仪除去乙腈。得到的绿色粉末用柱层析纯化得目的产物dns-m,洗脱剂为ch2cl2/ch3oh(v/v=70:1)。1hnmr(400mhz,cdcl3):δ8.58(d,1h),8.41(d,1h),8.21(dd,1h),7.54(m,2h),7.20(d,1h),3.69(t,4h),2.89(s,6h).13cnmr(100mhz,cdcl3):δ151.8,132.3,130.9,130.8,130.5,130.1,128.1,123.2,119.7,115.4,66.3,45.4,45.4.hr-ms(m/z,esi)calculatedforc16h20n2o3s:[m+na]+=343.1092,found343.1073;[2m+na]+=663.2287,found663.2296.
实施例2:染料dns-m在极性不同的溶剂中的紫外-可见吸收光谱和荧光光谱
将dns-m溶于乙醇中,配置成浓度为10mm的储备液。从储备液中取出2μldns-m浓度为10mm的储备液加入到2ml的二氯甲烷、三氯甲烷、乙酸乙酯、乙腈、乙醇、dmf和水中,测定荧光染料在上述溶剂中的紫外-可见吸收和荧光光谱曲线。如图1a所示,染料dns-m在有机溶剂中的吸收峰和吸收度基本相同,仅在水溶液中染料的吸收峰发生了约15nm的蓝移,说明溶剂的极性基本不影响染料的吸收。然而,溶剂的极性不仅对染料的荧光强度具有非常明显的影响,同时也造成染料发生峰波长发生了明显的红移~45nm。此外,其荧光强度随溶剂极性的增加明显变弱,在水中仅能观察到微弱的荧光。但是由于脂滴内包含的物质主要是中性脂质,因此上述光谱变化有助于提高染料在细胞脂滴成像中的信噪比。
实施例3:染料dns-m与不同商业细胞器染料在a549细胞中的共定位
将商业溶酶体染料lysotrackerdeepred(1μm)、线粒体染料mitotrackerdeepred(0.3μm)、细胞膜染料celltrackerdeepred(1μm)和脂滴染料nilered(1μm)分别加入到不同皿的a549细胞中,于37℃、5%co2条件下培养30min后,更换新鲜培养基。随后将实施例1制备的荧光染料dns-m,加入到上述细胞中使其最终浓度10μm,培养30min后,进行激光共聚焦成像,成像结果见图2。由图可以看出,来自染料dns-m的绿色斑点几乎与来自溶酶体、线粒体和细胞膜染料的红色斑点不重叠,说明染料dns-m不具备溶酶体、线粒体或细胞膜定位能力。而来染料dns-m的绿色斑点几乎与来自脂滴染料的nilered完全重叠,说明染料dns-m可以特异性靶向细胞内的脂滴。虽然染料中含有溶酶常用的靶向基团-吗啉,但是染料dns-m不标记溶酶体反而特异性标记脂滴,极大可能是因为染料母体分子中的磺酸基团直接与吗啉中的仲胺相连,削弱了胺的碱性同时也提高了其脂溶性,使染料更加倾向于累积在细胞内的脂滴而非溶酶体。
实施例4:染料dns-m的光稳定性
将hela细胞种在激光共聚焦专用玻璃皿中,培养24h后,更换无血清的新鲜培养基后,向细胞中加入10μm的染料dns-m,继续培养30min后直接进行激光共聚焦荧光成像。对同一视野内的细胞进行多次成像,统计成像次数为1、10、20、30、40、50和60次时的荧光照片固定部位的荧光强度的平均值,然后作其平均荧光强度的变化曲线。由图3a可以看出,探针经过60次连续成像后,细胞内仍然保有明亮的荧光,表明探针具有很好的光稳定性。由其荧光强度变化曲线(图3b)可以直观看出细胞内染料经过不同次数扫描后其荧光强度的变化情况,对细胞进行连续60次成像后,其探针的荧光强度基本保持稳定,表明探针具有非常好的光稳定性,适用于长时间观察脂滴在细胞内的变化情况。
实施例5:染料dns-m实时示踪脂滴在细胞内的运动轨迹
将肿瘤细胞a549和正常细胞mcf10a分别接种在不同的激光共聚焦专用玻璃皿中,培养24h后,更换新鲜培养基后,向细胞中加入10μm的染料dns-m,培养30min后直接进行激光共聚焦荧光成像。选择具有合适脂滴的细胞,然后采集细胞在不同时间点的荧光图像,选取的时间分别为0、2、4和6min,并采用不同的伪彩对其成像,用软件imagej将相近时间点的荧光图像进行叠加,通过比较不同颜色的荧光斑点,可实时观察脂滴在细胞内的运动轨迹。如图4a所示,在0+2min、2+4min和4+6min的细胞叠加图中,我们发现不同伪彩着色的荧光斑点基本上是不重合的,说明a549细胞中脂滴发生非常明显的移动。相反,在mcf10a细胞的荧光叠加图中(图4b所示),绝大多数不同伪彩着色的荧光斑点是重叠在一起,说明mcf10a中脂滴移动的位移和速度相对缓慢。图4a和4b右下角的放大图具体展示了脂滴在两种细胞中的运动轨迹。上述结果表明,脂滴是一种快速转动的细胞器,不同细胞类型、细胞的代谢速率及病变程度等均可导致脂滴运动行为的显著差异。
实施例6:在hela、hff-1和a549三种混合细胞中特异性识别a549细胞
分别将hela+a549、hff-1+a549和hela+hff-1+a549细胞混合均匀后接种到不同的激光共聚焦专用玻璃皿中,培养24h后,分别向上述细胞中加入10μm的染料dns-m,继续培养30min后直接进行激光共聚焦荧光成像,成像结果见图5。由图所示,探针在hela和hff-1细胞中只显示非常微弱的荧光,表明这两种细胞中脂滴的体积小且数量少。与此相反,探针在a549细胞中的边缘处呈现明量且较大的绿色荧光斑点,表明a549细胞的边缘处分布较多的脂滴,并且脂滴的体积相对较大。在三种混合细胞中,探针仅能点亮a549细胞,表明探针能够在上述三种细胞中特异性识别a549细胞(红色虚线框内所示)。
实施例8:染料dns-m与脂滴染料nilered在不同细胞中的共定位
将a549、mcf10a、raw264.7、qsg7701和hela细胞分别接种到共聚焦专用皿中培养24h后,加入1μmnilered培养30min后,更换新鲜培养基后加入10μm染料dns-m继续培养30min后,进行共聚焦成像。如图6所示,来自于染料dns-m的绿色荧光和来自nilered的红色荧光在所有细胞中均能很好的重叠,表明染料dns-m是一种普适性的脂滴染料。并且,由染料在不同细胞中荧光斑点的亮度、大小和数量均存在明显的差异,表明脂滴的数量和大小在不同类型的细胞中是不同。例如,a549和mcf10a细胞中脂滴的数量很多,而gsq7701和raw264.7细胞中脂滴的数量偏少,但是脂滴的体积较大。而hela细胞中微小的弱荧光斑点则表明其细胞内的脂滴体积偏小。来自dns-m的绿色斑点与来自nilered的红色斑点重叠的程度,同样也能反映出不同细胞中脂滴的运动速率。mcf10a、raw264.7和qsg7701细胞中绿色和红色斑点重叠的概率明显高于a549细胞,表明a549细胞中脂滴的运动速率比其他细胞中脂滴的运动速率大。
上述虽然结合附图对本发明的具体实施方式进行了描述,但并非是对发明保护范围的限制。对本发明所属技术领域的技术人员来说,在不脱离本发明构思的前提下,所作出的若干简单的推演和替换,都应当视为属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!