用于温度和压力控制的低温保存的方法和装置与流程
相关申请的交叉引用
本申请要求35u.s.c.§119下于2017年8月11日提交的临时申请no.62/544219的优先权,此处通过引用将该申请的公开并入。
本公开提供了用于通过使用等容系统对样品进行温度和压力控制的低温保存的方法。
背景技术:
生物材料在冰点以下的温度的长期保存(低温保存)已经变得对许多医学应用必不可少;从临床应用(诸如冷冻卵母细胞的保存)到诺贝尔奖启用的研究(诸如秀丽隐杆线虫(c.elegans)的低温保存)。
技术实现要素:
开发用于在低温温度长期保存生物器官的低温保存技术越来越受关注。迄今为止,温度测量被认为是低温保存方案的设计和控制中最重要的热力学变量。在单相系统中,需要两个热力学性质来定义系统。在低温保存中,通常假设压力是等压的(恒定的),并且体积是恒定的。然而,该假设未得到验证,并且在低温保存方案中,不监测压力和体积。压力和体积可能根据容器的构造和所用的容器材料而变化。
此处提供了指示更可靠手段的研究结果,该手段用于通过测量并监测系统的温度和压力这两者,来设计并控制低温保存方案。具体地,使用装有监测压力和温度的装置的等容(恒定体积)系统,检查纯水到-180℃的冷冻和解冻。结果表明,在冷冻和解冻期间测量温度和压力提供冰的热力学状态的精确洞悉。例如,出乎意料地发现,在-30℃下的压力显著高于三相点,并且从-40℃到-180℃形成的冰是冰i,而不是冰ii或iii。
通过玻璃化(玻璃形成)进行低温保存是低温保存的极大关注领域。通过测量具有不同浓度的二甲亚砜(dmso)(低温保存中受关注的化合物)的纯水的压力和温度,发现压力测量可以提供一种简单的手段,该手段获取有关低温保存过程期间的玻璃化和反玻璃化的发生信息。此处提出的数据提供了明显的证据,证明将压力测量添加到温度测量是低温保存方案和方法的设计、优化以及控制中的重要工具。
本公开提供了用于冷冻样品的方法和系统。本公开提供了一种用于样品的低温保存的过程,该过程包括:将生物样品放置在等容系统中;降低等容系统的温度,直到达到生物样品的冰点以下的温度为止,其中,温度以受控方式来降低,该受控方式包括:
(i)冷却生物样品,直到达到第一温度为止;(ii)将样品在第一温度维持特定时间段,使得在第一温度达到压力和温度的热力学平衡;(iii)在x个温度重复步骤(i)和(ii),直到达到生物样品的冰点以下的温度为止,其中,x为2或更大的整数。在一个实施方式中,x为4或更大的整数。在另一个实施方式中,x为6或更大的整数。在前述实施方式中的任意一个的又一个实施方式中,对于(ii),将样品在温度下维持从约1分钟至约1小时选择的时间段。在另外实施方式中,对于(ii),将样品在温度下维持约30分钟。在前述实施方式中的任意一个的又一个实施方式中,生物样品的冰点以下的温度是-20℃或更低。在另外实施方式中,生物样品的冰点以下的温度是-80℃或更低。在又一个实施方式中,生物样品的冰点以下的温度为-135℃或更低。在又一个实施方式中,生物样品的冰点以下的温度为-135℃至-210℃。在前述实施方式中的任意一个的另外实施方式中,生物样品是一种或多种生物分子、一种或多种细胞成分、一种或多种细胞、一种或多种病毒、一种或多种胚胎、一种或多种组织、一个或多个器官或整个生物体。在另外实施方式中,一种或多种生物分子选自氨基酸、寡肽、多肽、蛋白质、核碱基、核苷酸、核苷、寡核苷酸、多核苷酸、核酸、单糖、寡糖、多糖、碳水化合物、脂肪酸、蜡、固醇、单甘酯、甘油二酯、甘油三酯、磷脂质、代谢物、维生素、激素、类固醇或前述的任意组合,其中,一种或多种生物分子可以是天然存在的生物分子、可以是合成制造的、或其组合。在又一个实施方式中,一种或多种细胞是雄性生殖细胞或雌性生殖细胞。在另一个实施方式中,整个生物体是原核生物体。在又一个实施方式中,整个生物体是真核生物体。在前述实施方式中的任意一个的另一个实施方式中,生物样品还包括一种或多种低温防护剂。
本公开还提供了一种方法,该方法用于识别低温防护剂或其溶液是否防止在玻璃化和/或反玻璃化低温保存过程中的样品中的冰晶形成,该方法包括:将包括低温防护剂或其溶液的样品置于等容系统中;在将等容系统的温度降低至冰点以下的温度的同时测量等容系统的压力;和/或在从冰点以下的温度加温等容系统的同时测量等容系统的压力,其中,压力在等容系统的冷却或加温期间的变化指示低温防护剂或其溶液未能防止样品中冰的形成,并且其中,如果在等容系统的冷却或加热期间等容系统中的压力没有变化,则指示该低温防护剂或溶液已经防止冰晶形成,并且适于在玻璃化和/或反玻璃化低温保存过程中与样品一起使用。
本公开还提供了一种方法,该方法用于识别生物样品是否已经经历玻璃化和/或反玻璃化低温保存过程,该方法包括:将生物样品置于等容系统中;在将等容系统的温度降低至冰点以下的温度的同时测量等容系统的压力;和/或在从冰点以下的温度加温等容系统的同时测量等容系统的压力,其中,压力在等容系统的冷却和/或加温期间的变化指示冰晶形成,并且生物样品尚未经历玻璃化和/或反玻璃化低温保存过程。在一个实施方式中,生物样品包括一种或多种生物分子、一种或多种细胞成分、一种或多种细胞、一种或多种病毒、一种或多种胚胎、一种或多种组织、一个或多个器官或整个生物体。在又一个实施方式中,一种或多种生物分子选自氨基酸、寡肽、多肽、蛋白质、核碱基、核苷酸、核苷、寡核苷酸、多核苷酸、核酸、单糖、寡糖、多糖、碳水化合物、脂肪酸、蜡、固醇、单甘酯、甘油二酯、甘油三酯、磷脂质、代谢物、维生素、激素、类固醇或前述的任意组合,其中,一种或多种生物分子可以是天然存在的生物分子、可以是合成制造的,或其组合。在另一个实施方式中,一种或多种细胞是雄性生殖细胞或雌性生殖细胞。在又一个实施方式中,整个生物体是原核生物体。在一个实施方式中,整个生物体是真核生物体。
本公开还提供了用于在冰点以下的温度保存生物材料的方法和装置,该方法和装置采用压力传感器,该压力传感器附接到包含生物材料的封闭体积室,以监测并控制保存过程。在一个实施方式中,室是恒定体积室。
本公开还提供了用于在被设计为通过玻璃化(玻璃形成)引起保存的过程中保存生物材料的方法和装置,该玻璃化采用压力传感器,该压力传感器附接到包含生物材料的封闭体积室,以监测并控制保存过程。在一个实施方式中,室是恒定体积室。
本公开提供了一种用于在冰点以下的温度保存生物材料的系统,该系统包括:等容室;压力传感器,该压力传感器测量等容室内的压力;加热/冷却系统,该加热/冷却系统与等容室热连通;温度计,该温度计与等容室的内部温度热连通;以及计算机,该计算机耦合到压力传感器、温度计以及加热/冷却系统,该计算机控制冷却或加热的速率,以便维持恒定的压力来促进玻璃化。在一个实施方式中,计算机包括指令,这些指令使得装置:冷却或加温等容室;经由温度计测量温度;经由压力传感器测量压力;并且当等容室中的压力对于室中存在的样品改变预定量时,经由冷却系统调节或抑制等容室的冷却或加温,其中,压力的变化指示冰晶的形成。在前述的另一个或另外的实施方式中,当压力变化时,计算机使冷却或加热保持,直到压力和温度都达到热力学平衡为止。在前述任意一个的又一个实施方式中,系统将样品保持在稳定的压力和温度下,以便进行等容玻璃化。在前述任意一个的又一个实施方式中,等容室包括刚性壁和恒定体积,用于从大气压到2500巴的压力。
附图说明
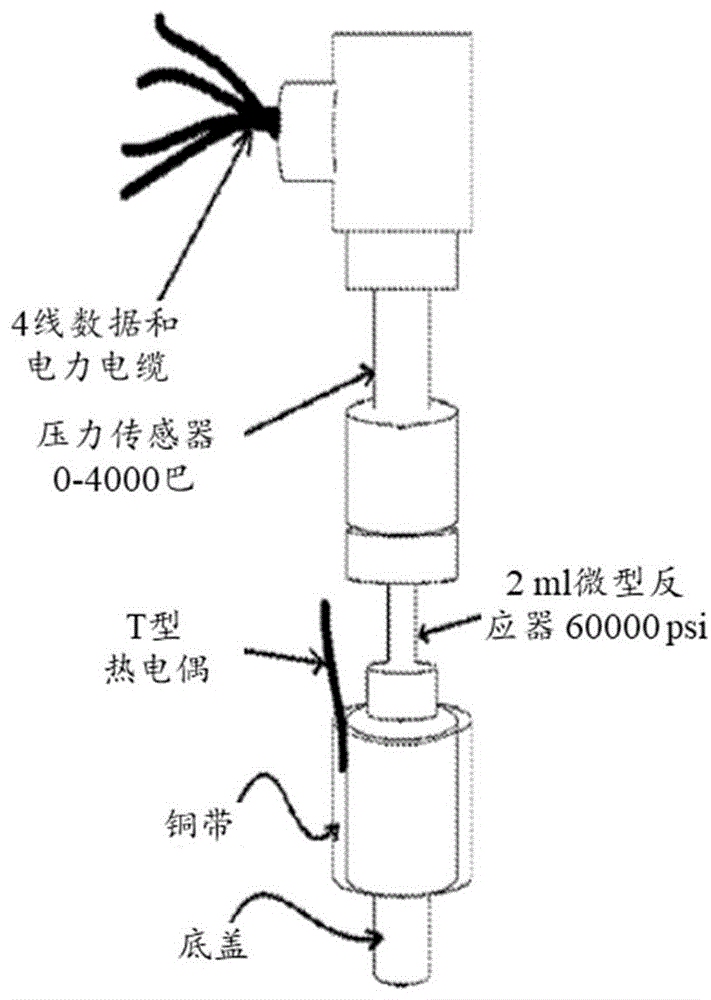
图1a至图1b呈现了本公开的实验系统的实施方式。(a)等容室的照片、以及(b)planerkryo10系列iii受控速率冷冻仪的冷却室中的两个等容装置。
图2提供了压力随时间变化的曲线图。在实验的某些阶段期间,温度保持恒定30分钟。图上列出了恒定温度。
图3提供了使用各种预定数据点实验确定的压力和温度的比较。
图4呈现了指示来自图3的数据点的相位图。
图5提供了压力随时间变化的曲线图。在实验的某些阶段期间,温度保持恒定30分钟。图上列出了恒定温度。箭头指向冷却至-40℃期间的压力尖峰。
图6呈现了指示来自图5的数据点的相位图。
图7呈现了冷却至液氮温度和从液氮温度冷却期间温度随时间变化的曲线图。
图8提供了水和dmso的各种溶液冷冻到液氮温度和从该液氮温度解冻期间压力随时间变化的一系列曲线图。图7中给出了温度历史。
图9提供了水和dmso的各种溶液冷冻到液氮温度和从该液氮温度解冻期间压力随时间变化的一系列曲线图。图7中给出了温度历史。
图10是本公开的系统的示意图。
具体实施方式
如此处和所附权利要求中使用的,单数形式“一(a)”,“一个(an)”以及“所述”包括复数指示对象,除非上下文明确另外规定。由此,例如,对“一装置”的指代包括多个这种装置,而对“所述室”的指代包括对一个或多个室及其为本领域技术人员所知的等同物的指代,等等。
而且,除非另外陈述,否则“和”的使用意指“和/或”。类似地,“包括”、“包含”可互换,而不旨在限制。
还将理解,在各种实施方式的描述使用术语“包括”的情况下,本领域技术人员将理解,在一些特定情况下,可以另选地使用语言“基本上由...构成”或“由...构成”来描述实施方式。
除非另外限定,否则此处所用的所有科技术语具有与本公开属于的领域中的一个普通技术人员通常理解的相同含义。虽然许多方法和试剂与此处所述的方法和试剂类似或等同,但此处公开了示例性的方法和材料。
为了描述并公开可能与此处的描述结合使用的方法,此处以引证的方式将此处提及的所有公报全部并入。提供这些公报仅是为了在本申请的提交日期之前进行公开。此处的任何内容均不得解释为承认发明人无权凭借在先公开而早于这种公开。而且,关于在一个或多个公报中呈现的与本公开中已经明确定义的术语类似或相同的任何术语,将以本公开中明确提供的术语定义为准。
低温保存的研究可以追溯到上世纪低温工程的进展。这些进展使得液化气体和低温可商购。1938年,鲁耶特(luyet)率先报道了活生物物质在液氮和液态空气中的成功低温保存。鲁耶特的低温保存研究主要集中在由小体积的快速冷却启用的水的玻璃化(玻璃形成)。1949年,波巨(polge)、史密斯(smith)以及帕克斯(parkes)报道了低温生物学领域的重大突破。他们发现,当以低冷却速率和更大体积冷冻时,向保存溶液添加某些化学物质(现在称为低温防护剂)有助于活生物物质的存活。低温保存领域中随后的大量研究引起对由于冷冻引起的细胞死亡和存活的机制的基本了解。马祖尔(mazur)在1970年的开创性论文中总结了这种理解。该论文陈述了影响低温保存的主要机制是:(i)冷冻期间的冷却速率、(ii)保存温度和保存时间、(iii)解冻期间的加温速率、以及(iv)各种低温防护剂的浓度和性质。今天,这些仍然被认为是设计低温保存方案的重要参数。
在所有研究中,低温保存方案的某些属性大部分都保持相同。首先,低温保存方案在恒定压力(等压)下进行。除了少数例外,在绝大多数低温保存研究和应用中,等压过程发生在大气压下。在该少数例外中,等压条件是高压的。常规的低温保存方案监测并控制冷冻、存储(以及有时解冻)期间的温度历史以及溶液的组成。然而,仅以相对模糊的术语描述了体积。通常,指定热力学系统的初始体积并描述容器的类型;例如,如挠性吸管、玻璃毛细管、盖上盖或打开盖的低温小瓶。没有关于容器的刚性和体积变化的信息。如前所述,假定压力为大气压或高压。然而,根据室的构造、室的制造材料以及例如室是否被密封,系统中的压力可能变化。此外,没有用于在低温保存方案的不同阶段评估系统中的实际体积的手段。虽然如此,但低温保存是一种热力学过程,该过程由热力学参数的值定义,诸如:温度、压力、体积以及组成。因此,不精确指定并控制热力学参数的热力学过程是不可重复和可控制的。例如,需要两个热力学特性来指定一相热力学系统。在冷冻系统中,冷冻溶液的热力学状态由压力和温度这两者确定,不仅仅由温度确定。仅温度、恒定或不恒定的体积或假定恒定的压力并不指定低温保存方案的热力学。在尝试开发采用玻璃化(玻璃形成)的低温保存方案时,热力学准确度特别重要。
组织工程学的进展以及对器官移植的增长需求,引起了对开发新的和改进的低温保存技术的关注。当前,没有用于大器官的低温保存的技术。虽然可以在不精确控制低温保存方案的所有热力学参数的情况下完成小体积细胞的保存,但是保存大器官(诸如肝脏或心脏)需要控制所有热力学参数。
大气等压系统中的冷冻过程沿着相图的垂直线发生。相反,恒定体积系统中的冷冻过程沿着液相线发生,到达冰i、冰iii以及水之间的三相点。对于纯水,三相点的压力和温度分别为-21.985℃和209.9mpa。在等压条件下,系统中的全部量的水将在三相点温度下冷冻。等容系统中的冷冻程度不同。热力学分析预测:在等容冷冻中,系统中45%的水将在三相点下保持不冻。等容冷冻在维持恒定体积的同时,导致压力增加到三相点。
在某个实施方式中,此处公开的方法和装置将等容(恒定体积)热力学的概念用于低温保存。此处提供了具有监测并控制温度和压力能力的等容系统。此处呈现的数据清楚地指示了在冷冻至低温温度期间测量压力和温度的重要性。
在某些实施方式中,本公开提供了一种用于样品的低温保存的方法,该方法包括以下步骤:将生物样品放置在等容系统中;降低等容系统的温度,直到达到生物样品的冰点以下的温度为止,其中,温度由一过程降低到冰点以下的温度,该过程包括以下步骤:(i)冷却生物样品,直到达到第一温度为止;(ii)将样品在第一温度维持特定时间段,使得在第一温度达到压力和温度这两者的热力学平衡;(iii)对于x个温度重复步骤(i)和(ii),直到达到生物样品的冰点以下的温度为止,其中,x为2或更大的整数。在另外的实施方式中,在4、5、6、7、8、9、10、12、15、20、30个指定温度或包括前述指定温度中的任何两个或其间的温度范围内在特定时间段降低生物样品,以允许等容系统的压力和温度这两者的热力学平衡。关于将样品维持在指定温度的时间长度,时间量应足以使等容系统的压力和温度达到热力学平衡。在特定的实施方式中,将生物样品在指定温度维持约1分钟、约2分钟、约5分钟、约10分钟、约20分钟、约30分钟、约40分钟、约50分钟或约60分钟或包括前述指定时间中的任何两个或其间的任何时间范围。应注意,将生物样品维持在特定温度的时间段独立于生物样品维持在的所有其他温度,例如,样品可以在0℃下维持30分钟,在-5℃下维持5分钟,在-10℃下维持10分钟,等。另选地,可以将生物样品在每个指定温度维持相同的时间段,例如,30分钟。
关于温度,应将生物样品冷却至冰点以下的温度,在该温度,生物样品不易受到未受控制的化学动力学的损坏。虽然通常至少-80℃的冰点以下的温度适用于大多数生物样品,但存在可能分别在更高或更低的冰点以下的温度低温保存的生物样品。在某些实施方式中,此处公开的低温保存过程要求将等容系统中的生物样品冷却至约-20℃、-40℃、-60℃、-80℃、-100℃、-110℃、-120℃、-130℃、-135℃、-140℃、-150℃、-160℃、-170℃、-180℃、-190℃、-200℃、-210℃或包括前述指定温度中的任何两个或其间的任何温度范围的冰点以下的温度。
关于生物样品,可以被细胞遗传学地保存的任何生物样品可以用于此处公开的方法中。在特定实施方式中,生物样品可以包括但不限于:一种或多种生物分子、一种或多种细胞成分、一种或多种细胞、一种或多种病毒、一种或多种胚胎、一种或多种组织、一个或多个器官或整个生物。生物分子的示例包括但不限于:氨基酸、寡肽、多肽、蛋白质、核碱基、核苷酸、核苷、寡核苷酸、多核苷酸、核酸、单糖、寡糖、多糖、碳水化合物、脂肪酸、蜡、固醇、甘油单酯、甘油二酯、甘油三酯、磷脂、代谢物、维生素、激素、类固醇或前述的任意组合,其中,一种或多种生物分子可以是天然存在的生物分子,可以是合成制造的,或其组合。在特定的实施方式中,生物样品是雄性生殖细胞(例如,精细胞)或雌性生殖细胞(例如,卵细胞)。在另一个实施方式中,生物样品是胚胎。在另外实施方式中,胚胎来自哺乳动物。在又一个实施方式中,胚胎是人胚胎。在其他实施方式中,生物样品是整个生物体,例如,原核生物体或真核生物体。
在此处公开的方法中的任意一个中,样品(例如,生物样品)可以包括或还包括一种或多种低温防护剂化合物。低温防护剂是一种用于保护生物组织免受冻害(即,由于冰的形成)的物质。北极和南极的昆虫、鱼类以及两栖动物在其体内产生低温防护剂(防冻化合物和防冻蛋白),以使寒冷冬季的冻害最小化。低温防护剂还用于保存生物学研究中的活材料和保存食品。低温防护剂通过增加细胞中的溶质浓度来起作用。然而,为了在生物学上可行,它们必须易于渗透细胞并且必须对细胞没有毒性。一些低温防护剂通过降低溶液或材料的玻璃化转变温度来起作用。这样,低温防护剂防止实际冷冻,并且溶液在玻璃相下维持一些挠性。许多低温防护剂还通过随着水分子被置换而与生物分子形成氢键来起作用。水溶液中的氢键对于适当的蛋白质和dna功能很重要。由此,随着低温防护剂代替水分子,生物材料保留了其天然的生理结构和功能,但它们不再浸入水性环境中。该保存策略最常用于低湿休眠中。可以与此处提出的方法一起使用的低温防护剂的示例包括但不限于:甲酰胺、二甲亚砜(dmso)、丙二醇、甘油、乙二醇、海藻糖、蔗糖、多元醇、葡萄糖或前述的任意组合。
而且,使用此处提出的方法,可以容易地识别并优化样品的玻璃化温度。玻璃化(即,以水形成玻璃的这种方式冷却至低温温度)已经成为低温生物学研究的重要领域。使用纯水和各种浓度的二甲亚砜(dmso)(常用的低温防护剂)的溶液,将等容系统中的压力和温度历史监测到液氮温度。结果表明,压力测量和压力传感器是识别并控制最佳玻璃化方案以及反玻璃化过程的简单且非常易懂的装置和方法。
在特定实施方式中,本公开提供了一种过程,该过程用于识别低温防护剂或其溶液是否防止在玻璃化和/或反玻璃化低温保存过程中的样品中的冰晶形成,该过程包括以下步骤:将包括低温防护剂或其溶液的样品置于等容系统中;在将等容系统的温度降低至冰点以下的温度的同时测量等容系统的压力;和/或在从冰点以下的温度加温等容系统的同时测量等容系统的压力,其中,压力在等容系统的冷却或加温期间的变化指示低温防护剂或其溶液未能防止样品中冰的形成,并且其中,如果在等容系统的冷却或加热期间等容系统中的压力没有变化,则指示该低温防护剂或溶液已经防止冰晶形成,并且适于在玻璃化和/或反玻璃化低温保存过程中与样品一起使用。
在另一个实施方式中,本公开还提供了一种方法,该方法用于识别生物样品是否已经经历玻璃化和/或反玻璃化低温保存过程,该过程包括以下步骤:将生物样品置于等容系统中;在将等容系统的温度降低至冰点以下的温度的同时测量等容系统的压力;和/或在从冰点以下的温度加温等容系统的同时测量等容系统的压力,其中,压力在等容系统的冷却和/或加温期间的变化指示冰晶形成,并且生物样品尚未经历玻璃化和/或反玻璃化低温保存过程。
如此处所用的等容系统是能够执行等容过程(也称为恒定体积过程、等体积过程或等距过程)的一个或多个装置。等容过程是一种热力学过程,在该过程期间,经历这种过程的封闭系统的体积保持恒定。等容过程通过加热或冷却密封的无弹性容器的内容物来例示。热力学过程是热量的增加或去除;容器的内容物的隔离建立了封闭系统;并且容器无法变形强加恒定体积的情况。
图10描绘了本公开的系统。描绘了等容室10,该等容室包括刚性壁,该刚性壁通常由可以承受(无变形)大气压至2500巴的压力的材料制成。温度控制单元(例如,冷却,或冷却和加热)50与等容室10接触。注意,温度控制单元本身可以是可适应等容室的室(例如,井、炉、冷冻仪等)。描绘了要冷冻的样品20。如以上和此处其他地方提及的样品可以是生物样品。压力传感器30与等容室10接触,并且被设计为连续地或以期望的间隔测量等容室10内的压力变化。温度计/温度传感器40也连接到等容室,并且连续地或以期望的间隔测量室内的温度。计算机60从温度计/温度传感器40和压力传感器30接收温度和压力信息,并且基于来自30和40的输入,控制温度控制单元50或等容室10的内部温度。例如,在操作期间,计算机60借助温度控制单元50引起等容室10的冷却。随着冷却发生,温度计40和压力传感器30向计算机60提供温度和压力值。如果压力增大到指示冰形成(即,无玻璃化)的值,那么计算机60使温度控制单元停止冷却(或加热),直到达到压力和温度的热力学平衡。
等容热力学过程的特征在于恒定的体积,即δv=0。该过程不做压力体积功,因为这种功由下式来定义:
δw=pδv
其中,p是压力。符号法则是使得系统对环境做正功。如果该过程不是准静态的,则该功也许可以在体积恒定的热力学过程中进行。
对于可逆过程,热力学第一定律给出了系统内能的变化:
du=dq-dw
用体积变化代替功给出:
du=dq-pdw
由于该过程是等容的,dv=0,因此之前的方程现在给出:
du=dq
使用恒定体积下的比热容的定义,
dq=mcvdt
微分两侧产生:
其中,cv是恒定体积下的比热容,t1是初始温度,并且t2是最终温度。
以下式结束:
δq=mcvδt
以下示例旨在例示而非限制本公开。虽然它们是可能使用的典型,但另选地可以使用为本领域技术人员所知的其他过程。
示例
等容系统。等容冷冻系统是一个简单的恒定体积室,该室能够以最小变形承受系统中形成的压力。该室装有压力传感器。等容室是由高压设备公司(美国宾夕法尼亚州伊利)定制设计的2ml316不锈钢微型反应器ms-1(带配件的总内体积为3ml,工作压力为60000psi)。使用管道密封胶带来密封装置。ms-1微型反应器的内径为3/16英寸,外径为9/16英寸,内部深度为4英寸,并且总长度为7英寸(参见图1a)。等容微型反应器连接到esi技术有限公司hp11000-4000巴(0-60000psi)压力传感器,该压力传感器借助0-5vdc电缆连接到dataq仪器的型号di-245电压和热电偶daq4通道数据记录器,该记录器连接到运行dataq仪器硬件管理器的膝上型电脑。可以从在膝上型电脑上安装的windaqwaveform浏览器查看并导出所存储的数据。压力传感器由蓝宝石上硅传感器结合由单片钛合金加工的膜片组成。在这些实验中,为了使穿过压力传感器的流入热通量最小化,使用用电工胶带固定的聚乙烯管道绝缘材料来使压力传感器绝缘。同时在等容室上未使用压力安全装置(即,爆破片),以便使热质量最小化。为了安全起见,推荐将等容系统与装备有极限压力为400mpa的爆破片的安全头一起使用。连接到extech仪器的easyviewtm15温度计数据记录器的omegat型热电偶也附接到等容室的外部,作为验证设置温度的第二次检查。
用该设置对等容室进行三个不同的实验。在第一个实验中,将等容系统浸入通过neslabrt-140冷却系统(美国马萨诸塞州沃尔瑟姆市的赛默科技(thermoscientific))冷却的水-乙二醇浴(50/50)中。该装置可以将温度控制在-35℃。在第二个实验中,将等容系统放置在planerkryo10系列iii控制速率的冷冻仪中,该冷冻仪可以达到液氮温度(参见图1b)。在第三个实验中,将等容系统浸入-196℃的液氮的2l不锈钢保温瓶(赛默科技thermoflask2123)中,以实现更高的冷却速率。
材料。蒸汽蒸馏水(alhambra)用于此处提出的第一和第二实验。对于第三个实验,使用蒸汽蒸馏水(alhambra)和二甲亚砜(dmso,mw为78.13g/摩尔,来自赛默科技,prod.#20688)的几种溶液。dmso的浓度以w/v(g/ml)表达。各种溶液通过在50ml容量瓶中称量期望的dmso质量且然后添加一定体积的水以获得期望的浓度并混合来制备。在两种液体组合时放热,因此将容纳混合溶液的容量瓶在冷水浴中冷却几秒钟。通常将更多的水添加到混合瓶,以获得期望的体积,因为体积在混合时通常缩小。
实验方案。对于第一个实验,将纯净蒸馏水(3ml)装入两个相同的微型反应器并将其封闭。重要的是强调,必须小心操作,以从系统消除空气。然后将两个等容系统浸入0℃的冷却浴(neslab)中。然后将冷却浴的温度设置在-5℃下30分钟,然后,将该温度降低-5℃并在-10℃下再保持30分钟。温度以-5℃的减量降低到-30℃,并在每个所设温度保持30分钟。在-30℃下30分钟后,将温度以5℃的增量增加到0℃,并在每个所设温度保持30分钟。贯穿实验测量等容系统中的压力。将该实验进行三次。
对于第二个实验,将纯净蒸馏水(3ml)装入两个相同的微型反应器并将其封闭。重要的是强调,必须小心操作,以从系统消除空气。然后将两个等容系统放入受控速率的冷冻仪(planer)中。冷冻仪用于遵循预先编程的温度曲线来冷却和加热室。将室以-20℃/分的速率从20℃冷却至-40℃,并且在-40℃下保持30分钟。接着,将室以-20℃/分的速率以-40℃的减量降低至-160℃,并且在各个温度保持30分钟。然后,将室以-20℃/分的速率从-160℃冷却至-180℃,并且在-180℃下保持30分钟。在-180℃下30分钟后,以与冷却相反的方式将室加温。从-180℃开始,将室以20℃/分加热至-160℃,并在-160℃下保持30分钟。然后将室以20℃/分的速率以40℃的增量加热到-40℃,并在各个温度保持30分钟。从-40℃开始,然后将室以20℃/分的速率加温到-20℃,此时程序停止。贯穿实验测量压力。将该实验重复三次。
对于第三个实验,在将新溶液装入微型反应器之前,用水冲洗并用纸巾清洁微型反应器及其所有部件。对于各个浓度,将溶液注入反应器(3ml)内部,并封闭反应器。重要的是强调,必须小心操作,以从系统消除空气。然后将容纳溶液的等容系统浸入装有液氮的thermoflask(赛默科技)中15分钟。将额外的液氮添加到瓶中,以便在整个15分钟的时段内维持所需的液氮水平。15分钟后,取出等容系统,并且在空气中加热45分钟或使压力恢复到初始值所花费的时间,以更大者为准。在将装置浸入液氮中并且在加温它的同时测量压力。对于纯水中的几种浓度的dmso重复该实验。对于各种溶液,将实验重复3次。从数据记录器下载所收集的数据,并将其导出到微软优越试算表(microsoftexcel),以便后处理。
结果和讨论。图2示出了从第一组实验获得的典型结果。该图示出了冷却至-30℃和从-30℃升温期间贯穿实验测得的压力。系统在预选的恒定温度维持30分钟,以促进在这些温度和压力下的热力学平衡。对于相关压力,图上列出了恒定温度。从该图显现几个有趣的观察结果。首先,很明显,在一定温度下30分钟后达到压力和温度的稳态值。这表明测量针对热力学平衡的状态。另一个有趣的观察结果是在冷冻和解冻期间获得了相同的压力和温度值,即,没有滞后。这进一步支持热力学平衡的证据。由于存在确定热力学状态的两种热力学措施,因此前述内容证实了在低温保存方案期间测量温度和压力这两者的价值。虽然温度在热力学系统中可能变化,并且温度测量装置提供来自单个点的数据,但压力是静液压的并且提供贯穿系统的数据。显然,在两相系统中,和第一个实验一样,热力学状态仅从一个变量(温度或压力)确定。然而,除了冰i、水以及冰iii的三相点之外,必须测量两个热力学变量,以定义系统的热力学状态。
图3显示了与来自preciado等人(cryobiology60(1):23-29(2016年))和hobbspv(icephysics.oxford:clarendonpress(1974年)的数据相比的、冷冻至-30℃期间的压力/温度数据。实验结果与来自这些参考文献的数据一致。与参考文献不同,进行超出三相点的测量。图3演示了对于低于三相点的温度,压力增大。这是出乎意料的,因为冰iii和冰ii的密度高于冰i,因此,预计压力将降低。该方面从图4更佳地理解,图4显示了相图上的数据点。首先,很明显,到三相点的所有数据点落在液相线上。然而,低于三相点的温度下的数据点处于比三相点更高的压力下。热力学平衡将预计,随着温度进一步下降,温度压力线将遵循冰i-冰iii边界。然而,并非如此。一种可能的解释是形成了亚稳形式的冰i-冰iii混合物。
图5呈现了关于用在-40℃至-180℃温度范围内的纯水进行的第二组实验通常看到的结果。显现了几个有趣的观察结果。首先,随着系统朝向-40℃冷却,压力尖峰达到约250mpa。尖峰在图中用箭头标记。该压力尖峰出现在所有实验中。在此测得的压力尖峰值与到-30℃的第一组实验中测得的值类似。这证明在低于三相点的温度下的压力升高是真实现象。然而,在-40℃下,压力下降。压力在降低到-180℃的温度下保持下降。随着温度降低然后升高,系统在预选的恒定温度下维持30分钟,以促进在这些温度和压力下的热力学平衡。从该图显现几个有趣的观察结果。首先,很明显,在一定温度下30分钟后达到压力和温度的稳态值。这表明测量针对热力学平衡的状态。另一个有趣的观察结果是在冷冻和解冻期间获得了相同的压力值和温度值,即,没有滞后。这进一步支持在热力学平衡下测量值的思想。
当在图6中的相图上绘制时,可以更佳地理解图5中测量的重要性。系统的热力学状态完全由温度和压力指定(与体积无关)。图6示出了形成的冰是i型,首先是六角形,然后是立方形。该信息可能对设计最佳的低温保存方案有价值,并且为了获得有关冷冻介质的热力学状态的信息,测量温度和压力均很重要。在单相系统中,在不测量两个热力学变量的值的情况下,无法确定热力学状态。该图还示出了压力随着温度的降低而降低。这是预期的,因为在冰i中,密度随着温度降低至-243℃而增大。
系统的几何构造产生图7中显示的、冷冻和解冻期间的温度历史。未尝试优化或控制温度历史。该实验的主要目标是检查在冷却至液氮温度和从液氮温度加温期间,各种浓度的dmso对测得的压力的影响。图8和图9描绘了第三组实验的结果。前图中的结果示出,等容系统中的冰的形成与静液压力的增大关联。在该组实验中,在浸入液氮中的等容系统中测量压力随时间的变化。图8左上方示出了在冷却至-180℃并升温至环境温度期间,由纯水和49%w/vdmso组成的系统中的压力随时间的变化。选择该成分是因为它在冷却至液氮温度(即,无冰形成)时产生玻璃态溶液。(图7中给出了温度历史)。假定在等容系统中没有冰形成时,也没有压力增大。实际上,针对49%的dmso的结果,证明在冷却和加热期间均没有压力增大。有趣的是,右上图示出了对于40%w/vdmso的溶液,在冷却和加温期间没有压力增大。这表明在该系统中也不形成冰。针对35%dmso的浓度,获得了图8中的底部两个面板,并示出了另一个有趣的观察结果。左侧图示出了冷冻期间的压力尖峰。这表明溶液中的某部分水已经冷冻。然而,对于相同的成分,右侧面板未示出压力尖峰。玻璃形成(玻璃化)是统计事件。结果表明,在该实验中使用的35%w/vdmso和冷却速率在玻璃形成域的余裕处是可能的,该余裕被定义为冷却速率曲线与ttt曲线之间的交点。图8中的两个底部面板演示了另一个有趣的观察结果。在该过程的加温阶段期间,压力增大。压力的增大与冰形成有关。图8中的左下侧面板示出了在冷却期间没有冰形成,但已经在加温期间形成冰。这表明加温期间的反玻璃化和冰晶形成的过程。图8例示了等容系统中的测量压力的值。它表明压力测量可用于识别经历玻璃化的溶液以及玻璃化和反玻璃化的条件。这可以使玻璃化对于大型生物样品保存的研究和应用更有效且受控。
图9呈现了实验结果,其中,dmso以30%和20%的浓度使用。在30%dmso和20%dmso的溶液中的冷冻期间的压力尖峰,证明在这些系统中已经形成冰晶。加温期间的压力的大幅增大也提供了证据,证明已经发生重结晶过程,并且系统中已经形成低密度冰。
图2至图9一起演示了在等容冷冻期间的测量压力的值,以便控制和设计最佳的低温保存方案。压力是易于测量的热变量。与温度不同,由于压力是静液压的,因此它提供来自整个体积的数据。因此,低温保存方案(尤其是玻璃化方案)的设计和控制应控制并监测温度和压力这两者。
此处已经描述了许多实施方式。然而,将理解,在不脱离本公开的精神和范围的情况下,可以进行各种修改。因此,其他实施方式在所附权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!