降解多环芳烃的根瘤菌-豆科植物共生体系、构建及降解方法与流程
本发明属于多环芳烃降解技术领域,具体涉及一种降解多环芳烃的根瘤菌-豆科植物共生体系、构建及降解方法。
背景技术
多环芳烃(pahs)是环境中广泛存在的一类难降解有机污染物。由于其具有致癌、致畸、致突变效应,还会产生光致毒效应,且其在土壤中具有隐蔽性大、潜伏期长、涉及面广、治理困难等特点,尤其是高环pahs,不仅化学结构复杂、电子云密度高、很难被氧化,而且水溶性差、热稳定性强、固水分配系数高、生物可利用性低,带来的环境污染问题日益突出,从而倍受环境科学家的关注,对人类健康和生态环境具有很大的潜在危害。
微生物修复相对于物理修复和化学修复还具有诸多优点,如费用低、效果好、不产生二次污染等,是一类低耗、高效和环境安全的环境生物技术,具有良好发展潜力。因此,对多环芳烃污染的生物修复进行研究是非常具有实际意义的。已有研究表明微生物修复技术能有效的去除污染土壤中的低环pahs。然而仅以微生物作用于污染土壤中的低环pahs的降解,尽管有一定的降解效果,微生物用量较大,不利于天然土壤微生物菌群的维护。目前尚未发现豆科植物-根瘤菌共生固氮体系在pahs降解中的应用。
技术实现要素:
本发明提供的一种降解多环芳烃的根瘤菌-豆科植物共生体系、构建及降解方法,构建的根瘤菌-豆科植物对土壤中的pahs具有很好的降解效果,为制定高效实用的土壤多环芳烃污染修复技术提供基础性的研究数据和针对性的防治办法。
本发明提供了一种降解多环芳烃的根瘤菌-豆科植物共生体系,所述根瘤菌-豆科植物共生体系是由根瘤菌和豆科植物构建而成的。
优选的,上述降解多环芳烃的根瘤菌-豆科植物共生体系中,所述根瘤菌-豆科植物共生体系是将根瘤菌接种于豆科植物根系中构建而成的。
优选的,上述降解多环芳烃的根瘤菌-豆科植物共生体系中,所述根瘤菌为豇豆慢生根瘤菌bradyrhizobiumvignabncc337085。
优选的,上述降解多环芳烃的根瘤菌-豆科植物共生体系中,所述豆科植物为豇豆。
优选的,上述降解多环芳烃的根瘤菌-豆科植物共生体系中,所述多环芳烃为菲或者芘。
本发明还提供了一种根瘤菌-豆科植物共生体系的构建方法,包括以下步骤:
s1,培养根瘤菌种子液;
s2,将豆科植物种子或者发芽的豆科植物种子浸泡于根瘤菌种子液中10-30min,获得侵染后豆科植物;通过测定侵染后豆科植物在石油污染土壤和pahs污染土壤中的生长情况,筛选出能高效修复有机污染土壤的侵染后豆科植物,该侵染后豆科植物即为降解多环芳烃的根瘤菌-豆科植物共生体系。
优选的,上述构建方法中,根瘤菌种子液的菌体浓度为108cfu/ml。
优选的,上述构建方法中,通过测定侵染后豆科植物在石油污染土壤和pahs污染土壤中的生物量和豆科植物上的结瘤数量来判断生长状况,生物量≥2.5g和结瘤数量≥15/株的侵染后豆科植物为能高效修复有机污染土壤的侵染后豆科植物。
本发明还提供了一种利用所述的根瘤菌-豆科植物共生体系降解多环芳烃的方法,将所述根瘤菌-豆科植物共生体系种植于被多环芳烃污染的土壤中,然后进行常规田间管理。
与现有技术相比,本发明提供的一种降解多环芳烃的根瘤菌-豆科植物共生体系、构建及降解方法,具有以下有益效果:
本发明通过构建根瘤菌-豆科植物共生体系,从机理和实验两方面验证了其降解土壤中多环芳烃的效果。机理方面:通过egfp绿色荧光蛋白标记示踪其侵染定殖过程。进一步通过高通量测序横向对比四种特殊微域(根系表面、根系内部、根瘤表面、根瘤内部)降解菌种群差异,进而从多样性水平阐明其响应机制。最后使用抑制差减杂交ssh分析根瘤微域菌群在pahs污染胁迫下基因差异表达,并利用real-timepcr对降解基因进行定量分析,进而从基因水平揭示其响应机制。本研究将在土壤根际微生物修复的基础上拓展一个根瘤微域菌群修复的新方向,从而为制定高效、实用、绿色的土壤有机污染修复技术提供新的理论依据。
实验方面:由于土壤表层16种优先控制pahs的平均含量达2.22mg/kg,亚表层为0.75mg/kg;无论表层还是亚表层,多环芳烃均以3环和4环为主,其在总pahs中所占比例均在34%以上,还存在许多5环和6环的多环芳烃。本发明进行了共生体系和单独微生物修复的盆栽试验,试验证明本发明构建的根瘤菌-豆科植物对土壤中的pahs具有很好的降解效果,优于单独的微生物修复技术,为制定高效实用的土壤多环芳烃污染修复技术提供基础性的研究数据和针对性的防治办法。
附图说明
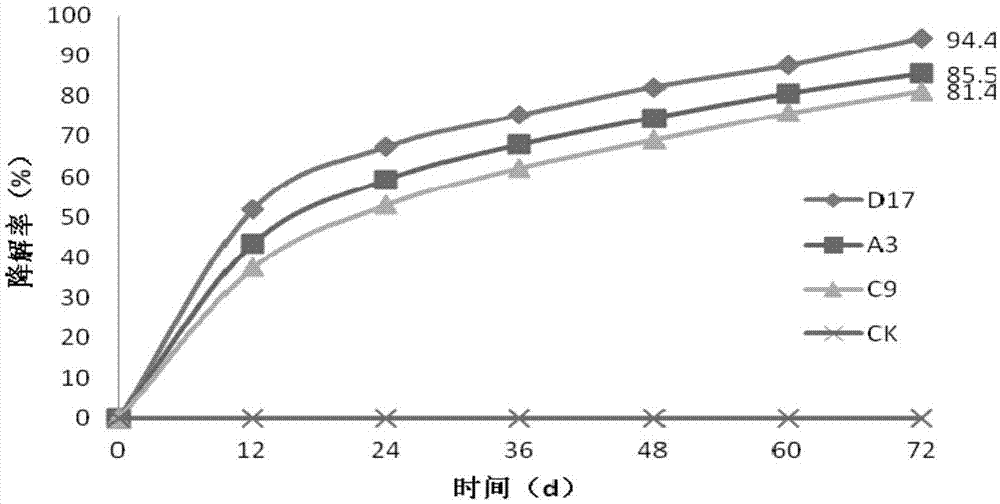
图1是不同根瘤菌降解pahs的结果;
图2是发出绿色荧光的标记根瘤菌;
图3是侵染宿主豇豆植物根部5天后的标记根瘤菌;
图4是四部分微域菌群otuvenn图分析结果;
图5基于out丰度的pca分析结果;
图6是不同方式降解土壤中pahs污染物的结果。
具体实施方式
下面结合具体实施例对本发明进行详细说明,但不应理解为本发明的限制。下述实施例中的实验方法,如无特殊说明,均为常规方法,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
本发明提供了一种降解多环芳烃的根瘤菌-豆科植物共生体系,所述根瘤菌-豆科植物共生体系是由根瘤菌和豆科植物构建而成的。优选的,所述根瘤菌-豆科植物共生体系是将根瘤菌接种于豆科植物根系中构建而成的。
本发明实施例中,所采用的根瘤菌为豇豆慢生根瘤菌bradyrhizobiumvignabncc337085,购自北纳生物。
本发明还提供了一种降解多环芳烃的根瘤菌-豆科植物共生体系的构建方法,包括以下步骤:
s1,培养根瘤菌种子液;
s2,将豆科植物浸泡于根瘤菌种子液中10-30min,用根瘤菌种子液侵染豆科植物,获得侵染后豆科植物;通过测定侵染后豆科植物在石油污染土壤和pahs污染土壤中的生长情况,筛选出能高效修复有机污染土壤的侵染后豆科植物,该侵染后豆科植物即为降解多环芳烃的根瘤菌-豆科植物共生体系,也是豇豆-根瘤菌共生体系优势修复模型。
优选的,本发明提供的一种降解多环芳烃的根瘤菌-豆科植物共生体系的构建方法,包括以下实施例。
实施例1
一种降解多环芳烃的根瘤菌-豆科植物共生体系的构建方法,包括以下步骤:
s1,培养根瘤菌种子液,所述根瘤菌为豇豆慢生根瘤菌bradyrhizobiumvignabncc337085,根瘤菌种子液的菌体浓度≥108cfu/ml;
s2,将豆科植物种子浸泡于根瘤菌种子液中30min,用根瘤菌种子液侵染豆科植物,获得侵染后豆科植物;通过测定侵染后豆科植物在石油污染土壤和pahs污染土壤中的生长情况,筛选出能高效修复有机污染土壤的侵染后豆科植物,该侵染后豆科植物即为降解多环芳烃的根瘤菌-豆科植物共生体系,也是豇豆-根瘤菌共生体系优势修复模型。
实施例2
一种降解多环芳烃的根瘤菌-豆科植物共生体系的构建方法,包括以下步骤:
s1,培养根瘤菌种子液,所述根瘤菌为豇豆慢生根瘤菌bradyrhizobiumvignabncc337085,根瘤菌种子液的菌体浓度≥108cfu/ml;
s2,将发芽的豆科植物种子浸泡于根瘤菌种子液中10min,用根瘤菌种子液侵染豆科植物,获得侵染后豆科植物;通过测定侵染后豆科植物在石油污染土壤和pahs污染土壤中的生长情况,筛选出能高效修复有机污染土壤的侵染后豆科植物,该侵染后豆科植物即为降解多环芳烃的根瘤菌-豆科植物共生体系,也是豇豆-根瘤菌共生体系优势修复模型。
为了验证该根瘤菌-豆科植物共生体系降解多环芳烃的效果,我们进行了如下实验:
一、根瘤菌的pahs降解能力检测
首先制备污染土壤:选择三环菲phe作为多环芳烃代表污染物,浓度为100mg/kg土壤。将不同菌株种子液接种到污染土壤中,每千克土壤中接种1ml浓度为108cfu/ml的菌株种子液,然后测定土壤中三环菲phe的降解率。
采用高效液相色谱(hplc)测定phe的降解率。高效液相色谱仪型号agilent1100,色谱柱为美国agilent公司的eclipsepahc18柱(4.6mm×150mm,3.5μm),流动相为甲醇/水(体积比为9:1),流速为1mlmin-1,检测器为mwd,检测波长为245nm,样品上样量为25μl,测定时间为10min。
检测结果如图1所示,图1是不同根瘤菌降解pahs的结果,其中,d17为豇豆慢生根瘤菌bradyrhizobiumvigna(bncc337085),a3为温带中慢生根瘤菌mesorhizobiumtemperatum(bncc224889),c9为中华根瘤菌sinorhizobiumsp.(bncc223955)降解pahs的结果,ck为空白对照;结果发芽种子移栽至污染土壤中降解72d之后,豇豆慢生根瘤菌d17对phe的降解效果最好。
二、根瘤菌的侵染定殖实验
材料:placz-egfp质粒pmp2444(takara公司),该质粒大小为5.6kb,含有庆大霉素抗性基因,宿主菌为大肠杆菌e.colis17-1。利用增强型绿色荧光蛋白(enhancedgreenfluorescentprotein,egfp)基因对分离到的根瘤菌进行荧光标记。
将placz-egfp质粒pmp2444导入受体菌豇豆慢生根瘤菌bradyrhizobiumvigna(bncc337085),egfp标记基因在该菌体内高效表达并使菌体在激发光下发出绿色荧光,得到标记根瘤菌,图2是发出绿色荧光的标记根瘤菌。将标记根瘤菌回接入宿主豇豆植物根部,用荧光显微镜观察其对根部的侵染过程,初步阐释根瘤菌入侵定殖途径。图3是侵染宿主豇豆植物根部5天后的标记根瘤菌(箭头所指的位置)。图2和图3的结果表明本发明使用的豇豆慢生根瘤菌bradyrhizobiumvigna(bncc337085)可以与宿主豇豆植物共生。
三、四种微域菌群(根系表面、根系内部、根瘤表面、根瘤内部)多样性差异高通量测序分析
1、四种微域菌群采集
(1)根系表面菌群:将根系挖出,抖落大土块,收集附着在根系上的土壤,然后称取1g土壤置于5ml灭菌高纯水试管中100rpm振荡20min。所得悬液即为根系表面微生物菌群。
(2)根系内部菌群:称取(1)中1g根系组织,将根系组织进行表面消毒:用75%乙醇浸泡30s,然后用5%hclo表面灭菌5min,用无菌水清洗10次,去除消毒剂残余,得到消毒根系。然后用无菌镊子将消毒根系捣碎,置于5ml灭菌高纯水试管中100rpm振荡20min。所得悬液即为根系内部微生物菌群。
(3)根瘤表面菌群:将从(1)中收集的附着在根系上的土壤中分离出的根瘤组织1g置于5ml灭菌高纯水试管中100rpm振荡20min。所得悬液即为根瘤表面微生物菌群。
(4)根瘤内部菌群:取从(1)中收集的附着在根系上的土壤中分离出的根瘤组织1g,将其进行表面消毒:用75%乙醇浸泡30s,然后用5%hclo表面灭菌5min,用无菌水清洗10次,去除消毒剂残余,得到消毒根瘤。然后用无菌镊子将消毒根瘤夹破捣碎,置于5ml灭菌高纯水试管中100rpm振荡20min。所得悬液即为根瘤内部微生物菌群。
2、基因组dna的提取和pcr扩增
提取根系表面菌群、根系内部菌群、根瘤表面菌群、根瘤内部菌群样本基因组dna,然后以基因组dna为模板,使用带barcode的特异引物,newenglandbiolabs公司的
3、pcr产物纯化
pcr产物使用2%浓度的琼脂糖凝胶进行电泳检测,对目的条带使用qiagen公司提供的胶回收试剂盒回收产物。
4、基因文库构建和测序
使用
5、信息分析部分
根据所扩增的16sv4区域特点,基于illuminahiseq测序平台,利用双末端测序(paired-end)的方法,构建小片段文库进行双末端测序。通过对reads拼接过滤,otus(operationaltaxonomicunits)聚类,并进行物种注释及丰度分析,可以揭示样品物种构成;进一步的α多样性分析(alphadiversity),β多样性分析(betadiversity)可以挖掘样品之间的差异。
首先对原始数据进行拼接、过滤,得到有效数据(cleandata)。然后基于有效数据进行otus(operationaltaxonomicunits)聚类和物种分类分析。根据otus聚类结果,一方面对每个otu的代表序列做物种注释,得到对应的物种信息和基于物种的丰度分布情况。同时,对otus进行丰度、alpha多样性计算、venn图和花瓣图等分析,得到样品内物种丰富度和均匀度信息、不同样品或分组间的共有和特有otus信息等。另一方面,对otus进行多序列比对并构建系统发生树,并进一步得到不同样品和分组的群落结构差异,通过pcoa和pca、nmds等降维图和样品聚类树进行展示。进一步挖掘分组样品间的群落结构差异,对分组样品的物种组成和群落结果进行差异显著性检验。
图4是四部分微域菌群otuvenn图分析结果;其中,ck_3726:土壤菌群,c_4927:根系表面菌群,f_3956:根系内部菌群,g_4277:根瘤表面菌群,h_42:根瘤内部菌群;图4中非重叠部分为每个组特有,图4中重叠部分为重叠各组共有,并将数字标示在该范围内;如h_42处理中797代表仅在根瘤内部特有的otu数量;而中间的1014代表在5个处理组中均共有的otu数量。图5基于otu丰度的pca分析结果;其中,ck:土壤菌群,c:根系表面菌群,f:根系内部菌群,g:根瘤表面菌群,h:根瘤内部菌群;图5结果显示c处理和f处理聚为一组,说明根系表面菌群和根系内部菌群相似度较高。g处理和h处理聚为一组,说明根瘤表面菌群和根瘤内部菌群相似度较高。
四、抑制差减杂交(ssh)分析根瘤菌在pahs污染胁迫下基因表达差异
抑制差减杂交(ssh)是一种高效鉴定和分离克隆差异表达基因的新技术,通过构建差减基因文库研究微生物逆境胁迫下有关基因的差异表达及相关基因的分子克隆和基因功能。以pahs污染处理根瘤微域菌为检测样本(tester)(参考上述“三”中方法采集四种微域菌群,采集自被pahs污染的土壤,每千克污染土壤中含有100mg的菲),以无污染处理根瘤微域菌为驱动样本(driver)(参考上述“三”中方法采集四种微域菌群,采集自未被pahs污染的土壤),抑制差减杂交使用clontech的pcr-selecttmbacterialgenomesubtractionkit试剂盒,引物序列如下:
pcrprimer1(5’-ctaatacgactcactatagggc-3’)
nestedpcrprimer1(5’-tcgagcggccgcccgggcaggt-3’)
nestedpcrprimer2r(5’-agcgtggtcgcggccgaggt-3’)
23srnaforwardprimer(5’-ctaccttaggaccgttatagttac-3’)
23srnareverseprimer(5’-gaaggaactaggcaaaatggtgcc-3’)
分别提取两组样本的全基因组dna;将限制内切酶rsaι酶切后的testerdna分成2个部分,分别与2种接头连接;将这2个部分序列于过量酶切的driverdna杂交,当这2个部分dna被最终混合杂交后,就允许了同源性的单链dna分子杂交;通过pcr扩增,进行抑制消减杂交基因片段的克隆,构建差减文库即可分析所差减的序列。测序结果通过ncbiblastx和blastn程序在genbank中进行同源检索,应用dnastar软件对序列进行分析。一共获得了11个差异基因片段,结果如表1所示,其中(sp3、sp24、sp31)这3个片段可能与dna的修饰及转录有关,片段(sp17)可能与糖代谢有关,剩余(sp4、sp5、sp29、sp34、sp77、sp79)这6个片段则都是未知功能的基因,这些基因可能与pahs的降解作用有关。
表1样品的差异基因片段结果
五、豆科植物-根瘤菌共生体系的降解试验
将所述根瘤菌-豆科植物共生体系中的豆科植物种植于被多环芳烃污染的土壤中,然后进行常规田间管理(浇水、施肥),即可降解土壤中的多环芳烃。本实验为了尽快获得降解结果,盆栽试验设置两个处理:
a1方式:pahs污染土壤+豇豆-根瘤菌共生体系一,即每千克土壤中添加100mg的pahs污染物、1ml浓度为108cfu/ml的根瘤菌种子液,拌匀,然后将发芽的豇豆种子移栽至土壤中。
b1方式:pahs污染土壤+根瘤菌,即每千克土壤中添加100mg的pahs污染物、1ml浓度为108cfu/ml的根瘤菌种子液。
c1方式:pahs污染土壤+豇豆-根瘤菌共生体系二,先用1ml浓度为108cfu/ml的根瘤菌种子液浸种发芽的豇豆种子30min;每千克土壤中添加100mg的pahs污染物,拌匀,然后将浸种后发芽的豇豆种子移栽至土壤中。
control1:pahs污染土壤。
a2方式:pahs污染土壤+豇豆-根瘤菌共生体系一,即每千克土壤中添加100mg的pahs污染物、1ml浓度为108cfu/ml的根瘤菌种子液,拌匀,然后将发芽的豇豆种子移栽至土壤中。
b2方式:pahs污染土壤+根瘤菌,即每千克土壤中添加100mg的pahs污染物、1ml浓度为108cfu/ml的根瘤菌种子液。
c2方式:pahs污染土壤+豇豆-根瘤菌共生体系二,先用1ml浓度为108cfu/ml的根瘤菌种子液浸种发芽的豇豆种子30min;每千克土壤中添加100mg的pahs污染物,拌匀,然后将浸种后发芽的豇豆种子移栽至土壤中。
control2:pahs污染土壤。
其中,a1方式、b1方式、c1方式和control1中添加的pahs污染物为phe(三环菲),a2方式、b2方式、c2方式和control2中添加的pahs污染物为pyr(四环芘)。
上述方式处理后的土壤置人工光照培养温室(28℃,80%相对湿度)中培养35天,试验期间对各处理浇去离子水以确保土壤含水量为田间最大持水量的60%左右,并随机调换各处理位置,以确保去除边缘效应。培养周期为35天。试验结束后,检测土壤中phe或者pyr的降解率。图6是不同方式降解土壤中pahs污染物的结果,图6中小写字母a、b、c表示不同处理方式之间的数据存在显著差异(duncan’stest,p<0.01,n=3)。
由图6中可以看出当pahs污染物为phe时,添加了豇豆-根瘤菌共生体系的土壤中,phe的含量仅为33.0mg/kg土壤,仅添加根瘤菌,则phe的含量为74.2mg/kg土壤,相比于对照control1的91.7mg/kg土壤,豇豆-根瘤菌共生体系(a1)对phe的降解率最高。同样的,当pahs污染物为pyr时,也是豇豆-根瘤菌共生体系(a2)对pyr的降解率最高。说明豇豆-根瘤菌共生体系对土壤中的pahs具有显著的降解能力。另外,c1方式处理后,土壤中phe的含量为40.4mg,c2方式处理后,土壤中pyr的含量为19.7mg,c1和c2两个体系也具有很好的降解能力。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- 还没有人留言评论。精彩留言会获得点赞!