包括单细胞移液器手柄和单细胞移液器尖端的单细胞移液器组件的制作方法
The Methodist Hospital
发明人
Lidong Qin
Kai Zhang。
对未决的在先专利申请的引用
本专利申请要求由Methodist Hospital和Lidong Qin等人对于“SINGLE CELL PIPETTE(SCP) AND SINGLE CELL PIPETTE TIP(SCP-TIP)(单细胞移液器和单细胞移液器尖端)”(律师卷号No. METHODIST-9 PROV)在2014年1月28日提交的序列号为No. 61/932,493的未决在先美国临时专利申请的权益,特此将该专利申请通过引用并入本文。
技术领域
本发明总体上涉及细胞操纵,并且更具体地涉及从一组细胞分离出单个细胞并将分离出的细胞转移到期望位置。
背景技术:
当前的生物研究和临床细胞分析经常需要从一组细胞中分离单个细胞并且将该分离出的细胞转移到期望位置(例如,常用的96-孔板或384-孔板、细胞培养皿、小瓶、显微镜载片等)。理想地,这样的分离和转移应当是良好地受控的、非常高效的、操作简单的、执行快速且廉价的。然而,出于各种原因,目前可用的方法都不完全令人满意。
因此,需要一种用于从一组细胞分离出单个细胞并将该分离出的细胞转移到期望位置的新方法。
技术实现要素:
本发明提供了一种用于从一组细胞分离出单个细胞并将该分离出的细胞转移到所需位置的新方法。
更具体地,本发明提供了一种用于从一组细胞分离出单个细胞并将该分离出的细胞转移到期望位置的新颖的单细胞移液器组件。
在本发明的一种优选形式中,单细胞移液器组件包括单细胞移液器手柄和单细胞移液器尖端。单细胞移液器手柄包括第一压力通道和第二压力通道。单细胞移液器尖端包括Y形微通道,其具有基础微通道、第一分支微通道和第二分支微通道。基础微通道延伸到单细胞移液器尖端的远端部。Y形微通道的第一分支微通道连接到单细胞移液器手柄的第一压力通道。Y形微通道的第二分支微通道连接到单细胞移液器手柄的第二压力通道。单细胞捕集器(trap)布置在Y形微通道的基础微通道中,在基础微通道与第一分支微通道和第二分支微通道会聚处的远端。
考虑到前述构造,当基础微通道、第一分支微通道和第二分支微通道装填有引物溶液(primer solution),且基础微通道布置在细胞浆料中,且负压力被施加到第一压力通道时,细胞浆料被向上抽吸至基础微通道内并进入第一分支微通道内,且来自浆料的单个细胞在单细胞捕集器中被捕获。接下来,基础微通道被布置在清洗溶液中,并且向第一压力通道施加负压力,使得清洗溶液将细胞浆料冲出基础微通道,且被捕获的细胞保留在单细胞捕集器内。其后,当被捕获在单细胞捕集器内的单细胞将被转移到期望位置时,向第二压力通道施加正压力,使得引物溶液被冲洗通过第二分支微通道,进入基础微通道且之后冲出单细胞移液器尖端的远端部,由此将被捕获的细胞冲出单细胞捕集器,通过基础微通道且然后离开单细胞移液器尖端的远端部。
在本发明的一种优选形式中,提供用于从一组细胞分离单个细胞并将该分离出的细胞转移到期望位置的设备,所述设备包括:
单细胞移液器尖端,所述单细胞移液器尖端包括:
具有远端部的结构;
形成在所述结构中的Y形微通道,所述Y形微通道包括基础微通道、第一分支微通道和第二分支微通道,其中所述基础微通道延伸到所述结构的所述远端部,所述第一分支微通道能够连接到第一压力通道,所述第二分支微通道能够连接到第二压力通道,并且单细胞捕集器布置在所述基础微通道中,在所述基础微通道与所述第一分支微通道和所述第二分支微通道会聚处的远端。
在本发明的另一种优选形式中,提供一种用于从一组细胞分离单个细胞并将该分离出的细胞转移到期望位置的方法,所述方法包括:
提供单细胞移液器尖端,所述单细胞移液器尖端包括:
具有远端部的结构;
形成在所述结构中的Y形微通道,所述Y形微通道包括基础微通道、第一分支微通道和第二分支微通道,其中所述基础微通道延伸到所述结构的所述远端部,所述第一分支微通道能够连接到第一压力通道,所述第二分支微通道能够连接到第二压力通道,并且单细胞捕集器布置在所述基础微通道中,在所述基础微通道与所述第一分支微通道和所述第二分支微通道会聚处的远端;
用引物溶液装填所述基础微通道、所述第一分支微通道和所述第二分支微通道;
将所述基础微通道定位在细胞浆料中;
向所述第一分支微通道和所述基础微通道施加负压力,使得所述细胞浆料被抽吸至所述基础微通道内并进入所述第一分支微通道,且来自所述浆料的单细胞被捕获在所述单细胞捕集器中;
将所述基础微通道定位在清洗溶液中;
向所述第一分支微通道和所述基础微通道施加负压力,使得所述清洗溶液将所述细胞浆料冲出所述基础微通道,且被捕获的细胞保留在所述单细胞捕集器中;并且
此后,当被捕获在所述单细胞捕集器中的单个细胞将被转移到期望位置时,向所述第二压力通道施加正压力,使得所述引物溶液被冲洗通过所述第二分支微通道,进入所述基础微通道且之后冲出所述单细胞移液器尖端的所述远端部,由此将被捕获的细胞冲出所述单细胞捕集器,通过所述基础微通道且然后离开所述单细胞移液器尖端的所述远端部。
附图说明
以下对本发明的优选实施例的详细描述将更加全面地公开本发明的这些和其它目的和特征,或者使其变得显而易见,应当结合附图一起来考虑以下的详细描述,其中同样的附图标记指代同样的零件,并且进一步地,附图中:
图1是示出根据本发明形成的新颖的单细胞移液器组件的示意图,其中单细胞移液器组件包括单细胞移液器手柄和单细胞移液器尖端;
图2是示出图1的新颖的单细胞移液器组件的单细胞移液器手柄的示意图;
图3是示出用于将图1的新颖的单细胞移液器组件的单细胞移液器手柄连接到图1的新颖的单细胞移液器组件的单细胞移液器尖端的连接管的示意图;
图4和图5是示出图1的新颖的单细胞移液器组件的单细胞移液器尖端的细节的示意图,其包括布置在单细胞移液器尖端内的单细胞捕集器;
图6-8是示出图5中所示的单细胞捕集器的进一步细节的示意图,其包括示出保持被捕获的细胞和释放该被捕获的细胞的单细胞捕集器;
图9A-9D是示出单细胞移液器尖端的单细胞捕集器可以怎样使细胞浆料流动、单个细胞怎样被捕获在单细胞捕集器中,以及此后单个细胞怎样从单细胞捕集器释放的示意图;
图10是示出单细胞移液器尖端的基础微通道可以被构造成有助于单细胞捕集器捕获单个细胞的各种方式的示意图;
图10A是示出由单细胞捕集器捕获单细胞的简单模型的示意图;
图10B是示出各种流体阻力比Rc/Rb下的单细胞捕获效率的图表;
图10C是示出各种吸取时间和细胞浓度下的单细胞捕获效率的图表;
图10D是示出各种旁通路径宽度的情况下的单细胞捕获效率的表格;
图10E是示出各种旁通路径长度的情况下的单细胞捕获效率的表格;
图11-19是示出图1的新颖的单细胞移液器组件可以怎样被用于从一组细胞分离出单个细胞并将该分离出的细胞转移到期望位置的示意图;
图20-28是类似于图11-19的示意图,除了其示出从一组细胞分离出单个细胞并将该分离出的细胞转移到期望位置的单细胞移液器组件的修改形式;
图28A是示出单细胞移液器组件的另一新颖形式的示意图,其中单细胞移液器尖端包括多个单细胞捕集器;
图29是示出单细胞移液器组件的另一新颖形式的示意图,其中单细胞移液器组件包括多个单细胞移液器尖端;
图30是类似于图29的示意图,除了其示出单细胞移液器手柄的修改形式;
图31是示出单细胞移液器组件的另一新颖形式的示意图,其中单细胞移液器组件包括多个单细胞移液器尖端;
图32是类似于图31的示意图,除了其示出单细胞移液器手柄的修改形式;
图33是示出根据本发明形成的单细胞移液器尖端的另一形式的示意图,其中所述单细胞移液器尖端的主体包括多个Y形微通道,每个Y形微通道均包括单细胞捕集器,并且进一步地,其中所述多个Y形微通道共享一个公共的远端部入口/出口;以及
图34是示出被捕获在Y形微通道的单细胞捕集器中的细胞在从Y形微通道释放之前可以被怎样培养的示意图。
具体实施方式
本发明提供一种用于从一组细胞分离出单个细胞并将该分离出的细胞转移到期望位置的新方法。
更具体地,本发明包括提供和使用一种用于从一组细胞分离出单个细胞并将该分离出的细胞转移到期望位置的新颖的单细胞移液器组件。
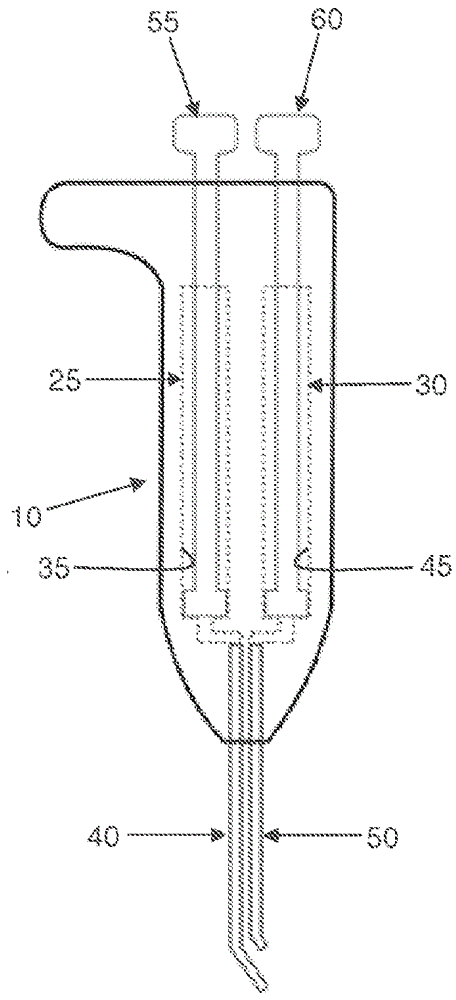
在本发明的一种优选形式中,且现在观察图1-5,提供单细胞移液器组件5。单细胞移液器组件5包括单细胞移液器手柄10和单细胞移液器尖端15。单细胞移液器手柄10和单细胞移液器尖端15优选地形成为在使用前由用户组装的单独的元件,不过如果期望,它们也可以形成为单个一体式构件。出于本发明的目的,单细胞移液器手柄10和单细胞移液器尖端15将在形成为在使用前由用户组装的单独的元件的背景下被讨论。
单细胞移液器手柄10包括主体20、第一压力通道25和第二压力通道30。在本发明的一种优选形式中,第一压力通道25包括延伸通过主体20且与第一连接管40连通的第一通路35 ;并且第二压力通道30包括延伸通过主体20且与第二连接管50连通的第二通路45。在本发明的一种优选形式中,第一塞55被活动地布置在第一通路35中,使得第一塞55在第一通路35中的运动能够向第一连接管40施加正压力或负压力;并且第二塞60被活动地布置在第二通路45中,使得第二塞60在第二通路45中的运动能够向第二连接管50施加正压力或负压力。应该理解的是,如果期望,则单细胞移液器手柄10可以包括本领域中众所周知的类型的传统的排气移液器(ADP)来提供通过使第一机构(例如,第一塞55)运动来操作的负压力通道(例如,第一压力通道25),以及通过使第二机构(例如,第二塞60)运动来操作的正压力通道(例如,第二压力通道30)。也应该理解的是,第一连接管40和第二连接管50优选地能够从单细胞移液器手柄10的主体20拆卸,使得第一连接管40和第二连接管50可以在使用后被丢弃(或者根据需要被适当地清洁和消毒以便后续再次使用)。
单细胞移液器尖端15包括主体65,其具有形成在其中的Y形微通道70。主体65具有远端尖端75。Y形微通道70包括基础微通道80、第一分支微通道85和第二分支微通道90,并且基础微通道80、第一分支微通道85和第二分支微通道90在会聚点95处会聚。基础微通道80从会聚点95延伸至远端尖端75。第一分支微通道85从会聚点95延伸至第一联接部100,在该处第一分支微通道85连接到第一连接管40。第二分支微通道90从会聚点95延伸至第二联接部105,在该处第二分支微通道90连接到第二连接管50。
单细胞捕集器110布置在基础微通道80中,在会聚点95远端。如将在下文讨论的那样,单细胞捕集器110允许捕获单个细胞并由此将单个细胞从一组细胞分离,并且此后选择性地释放该单个细胞以便转移到期望位置。
更具体地,并且现在观察图5-8,单细胞捕集器110作为“岛”布置在基础微通道80中,由此将基础微通道划分为宽路径115和窄路径120。宽路径115的大小适合于使得细胞和流体从中通过。窄路径120的大小适合于使得仅流体从中通过。单细胞捕集器110包括主体125,其包括偏流器(flow diverter)130和井(well)135。偏流器130与基础微通道80的侧壁间隔开并且使流过单细胞捕集器110的流动转向进入宽路径115或窄路径120中的任一者内。井135布置在主体125的远端侧上,在偏流器130外侧(并且在偏流器130的最远端部分的近端),并且与偏流器130和基础微通道80的侧壁一起为一个单个细胞提供座(seat)。
在本发明的一种优选形式中,单细胞移液器尖端15可以具有5 mm的长度和300 μm的远端尖端宽度。基础微通道80可以具有40 μm的宽度,宽路径115可以具有22 μm的宽度,窄路径120可以具有3 μm的宽度,偏流器130可以具有6 μm的宽度,并且井135可以具有12 μm的宽度和10 μm的深度。
优选地通过首先用CAD软件来设计单细胞移液器尖端且之后利用光刻和聚二甲基硅氧烷(PDMS)模制技术来制造单细胞移液器尖端来提供单细胞移液器尖端15。
考虑到前述构造,并且现在观察图9A-9D,当细胞C的浆料向近端通过基础微通道80(即,从远端尖端75朝向会聚点95)时,偏流器130引起一些流动沿宽路径115通过并且一些流动沿窄路径120通过。明显地,当浆料中的细胞C遇到单细胞捕集器110的偏流器130时,大部分细胞C沿循宽路径115并且经过单细胞捕集器110。见图9A和图9B。然而,在一些情况下,单个细胞C将转向到单细胞捕集器110的井135内。见图9C。注意,当细胞C试图运动通过宽路径115时,其可以邻近偏流器130聚积在宽路径115中,并且这种细胞的聚积可以辅助单个细胞被转向到井135内。之后,并且现在观察图9D,通过使流体通过基础微通道80向远端流动(即,通过使流体从会聚点95向远端尖端75流动),可以使被捕获的细胞C从单细胞捕集器110选择性地释放(例如,以便转移到期望位置)。
注意,单细胞捕集器110周围存在两个潜在的流动路径:捕获路径(即,窄路径120)和旁通路径(即,宽路径115)。流动分布模拟示出沿旁通路径(即,宽路径115)的流动速率远大于沿捕获路径(即,窄路径120)的流动速率,从而表明单个细胞优选地沿旁通路径流动而不是沿捕获路径流动,从而通常导致捕获失败。已经发现,当细胞浓度低于大约105个细胞/毫升时仅能够偶尔发生单细胞捕获。然而,当细胞浓度高于大约106个细胞/毫升时,单细胞捕获能够远为更频繁地发生,这是因为在这种浓度水平下旁通路径(即,宽路径115)频繁地被其它细胞占据。换言之,在这种更高浓度水平下,更可能的是在细胞尝试运动通过旁通路径(即,宽路径115)时,细胞可以聚积在旁通路径(即,宽路径115)中,并且这种细胞的聚积可以辅助单个细胞被转向到单细胞捕集器110的井135内。
已经确认了能够影响单细胞捕获效率的多种因素,包括流体阻力比、吸取时间和细胞浓度。实验结果表明,当旁通路径(即,宽路径115)的宽度近似是待捕获的细胞的直径的1.67倍大时,实现最高捕获效率。沿捕获路径的流体阻力(Rc)与沿旁通路径的流体阻力(Rb)之比的减小也能够增加单细胞捕集器110捕获单细胞的可能性。换言之,且现在观察图10,通过相对于窄路径120增加宽路径115的长度,从而相对于窄路径120的流体阻力Rc增加宽路径115的流体阻力Rb,能够增加单细胞捕获的可能性。
也已经发现,更长的吸取时间有益于改进单细胞捕获效率。
单细胞捕获效率能够高达96.7%,此时沿捕获路径的流体阻力与沿旁通路径的流体阻力之比(Rc/Rb)是36,吸取时间是5秒,且细胞悬液具有107/mL的浓度。
以进一步示例的方式但不是限制性的,图10A示出由单细胞捕集器110捕获单细胞的简单模型;图10B示出各种流体阻力比Rc/Rb下的单细胞捕获效率;图10C示出各种吸取时间和细胞浓度下的单细胞捕获效率;图10D示出各种旁通路径宽度的情况中的单细胞捕获效率;且图10E示出各种旁通路径长度的情况下的单细胞捕获效率。
图11-19示出新颖的单细胞移液器组件5可以怎样被用于从一组细胞分离出单个细胞并将该分离出的细胞转移到期望位置。
更具体地,在一种优选的使用方法中,第一连接管40和第二连接管50被首先安装到单细胞移液器手柄10的主体20(如果它们尚未被安装于主体20),使得第一连接管40与第一压力通道25流体连通,且第二连接管50与第二压力通道30流体连通。见图11和图12。将理解的是,当第一连接管40与第一压力通道25流体连通且第二连接管50与第二压力通道30流体连通时,第一连接管40有效地构成第一压力通道25的延长部且第二连接管50有效地构成第二压力通道30的延长部。
然后,用引物溶液装填第一连接管40和第二连接管50,即,通过将第一连接管40和第二连接管50的远端部定位在引物溶液140中,且之后缩回第一通路35内的第一塞55和第二通路45内的第二塞60。见图13。注意,引物流体不被吸入单细胞移液器手柄10的主体20的第一通路35或者第二通路45中的任一者内。因此,单细胞移液器手柄10的主体20的第一通路35和第二通路45均未被污染。然后,将第一连接管40和第二连接管50的远端部从引物溶液140撤回。见图14。
接着,通过将第一连接管40连接到单细胞移液器尖端15的第一联接部100并且将第二连接管50连接到单细胞移液器尖端15的第二联接部105,将单细胞移液器尖端15安装到单细胞移液器手柄10。见图15。然后,利用第一连接管40和第二连接管50中的引物溶液(即,通过使第一塞55在第一通路35内前进和使第二塞60在第二通路45内前进)装填单细胞移液器尖端15中的Y形微通道70。见图16。优选地,第一塞55在第一通路35内充分地前进以便将至少一些引物溶液排出单细胞移液器尖端15的远端部,并且第二塞60在第二通路45内充分地前进以便将至少一些引物溶液排出单细胞移液器尖端15的远端部,从而确保Y形微通道70完全被引物溶液填充。
接着,单细胞移液器15的远端尖端75被布置在细胞浆料145中,并且向第一压力通道25施加负压力,即,通过拉出第一通路35内的第一塞55,由此将细胞浆料向近端抽吸到基础微通道80内且进入第一分支微通道85内。见图17。这个动作引起来自浆料的单个细胞例如以图9A-9C所示的方式被捕获在单细胞捕集器110中。注意,引物流体140和细胞浆料145中的任一者均不被吸入单细胞移液器手柄10的主体20的第一通路35或者第二通路45中的任一者内。因此,单细胞移液器手柄10的主体20的第一通路35和第二通路45均保持未被污染。然后,将单细胞移液器15的远端尖端75从细胞浆料145撤回并且将其定位在清洗溶液150中。向第一压力通道25施加负压力,即通过撤回第一通路45中的第一塞55,使得清洗溶液将细胞浆料冲出基础微通道80,且被捕获的细胞保留在单细胞捕集器110中。见图18。再次注意,引物流体140和细胞浆料145以及清洗溶液150中的任一者均不被吸入单细胞移液器手柄10的主体20的第一通路35或者第二通路45中的任一者内。因此,单细胞移液器手柄10的主体20的第一通路35和第二通路45均保持未被污染。
此后,当被捕获在单细胞捕集器110内的单个细胞将被转移到期望位置时,向第二压力通道30施加正压力,即,通过使第二塞60通过第二通路45向远端前进,使得第二连接管50内的引物溶液被冲刷通过第二分支微通道90、进入基础微通道80,且之后离开单细胞移液器尖端15的远端尖端75,从而将被捕获的细胞冲出单细胞捕集器110(例如,以图9D中所示的方式),并且因此冲出单细胞移液器尖端15的远端尖端75且冲至适当的容器(或者支撑件)155(例如,常用的96-孔板或384-孔板、细胞培养皿、小瓶、显微镜载片等等)内(或上)。
整个过程能够在10秒内完成。
因此,将看到的是,单细胞移液器组件5可以被用于从细胞悬液直接获得单个细胞。单细胞移液器组件5的特征在于操作简便性、高效率和低成本。
重要地,单细胞移液器组件5不破坏由单细胞捕集器110捕获的单个细胞,使得单细胞移液器组件5能够用于活体单细胞分离和转移。
也重要的是,在本发明的情况下,利用大体上类似于用排气移液器(ADP)转移液体的操作的操作来实现单细胞分离和转移,由此显著地使操作训练和成本最小化。
通过重复前述过程可以使用单细胞移液器组件5来分离和转移额外的单个细胞。在这方面,应该理解的是,在期望避免细胞样品之间的交叉污染的情况下,第一连接管40、第二连接管50和单细胞移液器尖端15可以从单细胞移液器手柄10的主体20被拆下并且被更换。注意,由于引物溶液140、细胞浆料145和清洗溶液150均从不被抽吸至单细胞移液器手柄10的主体20的第一通路35或者第二通路45内,所以单细胞移液器手柄10的主体20的第一通路35和第二通路45均保持未被污染。因此,即使可以重复使用相同的单细胞移液器手柄10,也需在细胞样品之间更换第一连接管40、第二连接管50和单细胞移液器尖端15来防止交叉污染。
图1-19中示出的单细胞移液器组件5包括用于分别向第一压力通道25和第二压力通道30施加正压力或负压力的第一塞55和第二塞60。然而,如果期望,也可以提供其它手段以便分别向第一压力通道25和第二压力通道30施加正压力或负压力。以示例的方式但不限制,并且现在观察图20-28,可以提供第一螺杆驱动器55和第二螺杆驱动器60以便分别向第一压力通道25和第二压力通道30施加正压力或负压力。
如果期望,则单细胞移液器手柄10可以由替代性的施加压力/施加真空的设备(例如,适当的多通道压力/真空源)取代,该设备包括能够向单细胞移液器尖端15的第一联接部100施加正压力和负压力的第一压力通道,以及能够向细胞移液器尖端15的第二联接部105施加正压力和负压力的第二压力通道。
在本发明的另一形式中,单细胞移液器组件5能够被构造成在单细胞移液器组件的每个周期内分离和转移多于一个的细胞。更具体地,在期望在单细胞移液器组件5的每个周期内转移N个细胞的情况中,将N个单细胞捕集器110定位在单细胞移液器尖端15的基础微通道80中。因此,在单细胞移液器组件5的每个周期内,N个细胞被捕获并转移。见图28A。
此外,如果期望,则单细胞移液器组件5可以被构造成将多个单细胞移液器尖端15安装于单细胞移液器手柄10,使得单细胞移液器组件5可以同时捕获,且之后同时转移多个细胞,且这些细胞在空间上彼此分开。在这种情形下,单细胞移液器手柄10被构造成接收多对第一连接管40、第二连接管50,并且针对每对第一连接管40、第二连接管50,分别将第一连接管40连接到第一压力通道25并且将第二连接管50连接到第二压力通道30。见图29至图32。
在图29和图30中,单细胞移液器组件5包括安装于单细胞移液器手柄10的四个单细胞移液器尖端15,且单细胞移液器尖端15被设置成呈线性构造(当在端视图中观察时);并且在图31和图32中,单细胞移液器组件5包括安装于单细胞移液器手柄10的八个单细胞移液器尖端15,且单细胞移液器尖端15被设置成呈线性构造(当在端视图中观察时)。
将理解的是,可以将更多或者更少的单细胞移液器尖端15安装于单细胞移液器手柄10。
也将理解的是,安装于单细胞移液器手柄10的多个单细胞移液器尖端15可以被设置成呈线性构造之外的其它构造(当在端视图中观察时)。以示例的方式但不限制,(安装于单细胞移液器手柄10的)多个单细胞移液器尖端15可以被设置成呈二维矩阵构造(当在端视图中观察时),例如8×12矩阵构造或者16×24矩阵构造等等。以进一步的示例的方式但不限制,多个单细胞移液器尖端15可以被设置成呈环形构造(当在端视图中观察时)。
如果期望,则多个单细胞移液器尖端15可以被固定到彼此,或者与彼此一体地形成,以便形成单一的构造。
在本发明的又一优选形式中,并且现在观察图33,提供一个单细胞移液器尖端15,其包括主体65,该主体65具有形成在其中的多个Y形微通道70,其中所述多个Y形微通道70共享一个公共的远端部入口/出口。更具体地,在本发明的这种形式中,主体65具有通向远端尖端(在图33中未示出,但是类似于图4和图5中所示的远端尖端75)的中心开口160。如上文讨论的,每个Y形微通道70均包括基础微通道80、第一分支微通道85和第二分支微通道90,且基础微通道80、第一分支微通道85和第二分支微通道90在会聚点95处会聚。基础微通道80从会聚点95延伸至中心开口160且之后延伸至远端尖端75。第一分支微通道85从会聚点95延伸到第一联接部100,该第一联接部100被构造成连接到单细胞移液器手柄10的第一压力通道25(或者连接到提供正/负压力源的另一第一压力通道)。第二分支微通道90从会聚点95延伸到第二联接部105,该第二联接部100被构造成连接到单细胞移液器手柄10的第二压力通道30(或者连接到提供正/负压力源的另一第二压力通道)。同样,单细胞捕集器110(出于比例的原因在图33中示意地示出)布置在每个基础微通道80内,在会聚点95远端。如上文讨论的,每个单细胞捕集器110与Y形微通道70和适当的正/负压力源一起结合工作,以适当的方式(包括顺序)操作,其允许从一组细胞捕获单个细胞并且因而将其分离,且此后将被捕获的细胞选择性地释放,以便转移到期望位置。
因此将看到的是,图33中所示的单细胞移液器尖端15提供作为单一构造被安装在一起且被修改以便共享一个公共的远端部入口/出口的多个单细胞移液器尖端15的等价物。
图33中所示的单细胞移液器尖端15能够是非常有利的,因为单个远端尖端(图33中未示出,但是类似于图4和图5中所示的远端尖端75)和单个中心开口160能够被用作用于提供在单细胞移液器尖端15中的每个Y形微通道70的远端部入口/出口。因此,如果期望,则对于单细胞移液器尖端15的主体65中的每个Y形微通道70,利用公共的引物溶液140源、公共的细胞浆料145源和/或公共的清洗溶液150源,能够同时实现前述装填步骤(用引物溶液140)、单细胞捕获步骤(用细胞浆料145和单细胞捕集器110)和清洗步骤(用清洗溶液150);并且之后,前述细胞释放步骤(通过用引物溶液140冲刷)能够针对每个Y形微通道70单独地实现(即,通过向每个第二联接部105选择性地施加正压力,每次一个)。
也可能的是,在细胞已经被捕获在单细胞捕集器110中之后且在细胞从单细胞捕集器110被释放之前培养细胞。以示例的方式但不限制,在图33中所示的单细胞移液器尖端的情况下,在单个细胞已经安置在单个Y形微通道70的单细胞捕集器110中之后,可以培养细胞(例如,培养一至三小时)且此后从该Y形微通道的单细胞捕集器110释放该细胞。见图34。在本发明的这种形式中,引物溶液140可以优选地包括胰蛋白酶,因为胰蛋白酶能够促进将培养后的细胞从单细胞捕集器110释放。
优选实施例的改型
应当理解的是,本领域技术人员可以做出细节、材料、步骤和零件的设置中的许多额外变化(其已经在本文中描述和说明以便解释本发明的本质),同时仍然保持在本发明的原理和范围内。
- 还没有人留言评论。精彩留言会获得点赞!