分离线粒体的产品和方法与流程
本申请要求于2014年6月13日提交的美国申请号62/012,045的权益,其通过引用并入本文。
联邦资助的研究或开发
本发明是在美国政府支持下在由国立卫生研究院授予的拨款号HL104642下作出的。政府对本发明享有一定的权利。
技术领域
本发明涉及用于分离可用于临床环境中的完整的,有活力的线粒体的过滤装置,试剂盒和方法。
发明背景
除了红细胞以外,线粒体存在于体内的每个细胞中,并且参与大量重要的细胞和代谢过程(van Loo et al.,Cell Death Differ 9:1031-1042,2002;Szabadkai et al.,Physiology(Bethesda)23:84-94doi:0.1152/physiol.00046.2007,2008;Chan,Cell 125:1241-1252,2006;Picard et al.,PLoS ONE 6,e18317,doi:10.1371/journal.pone.0018317,2011)。由于这些许多功能,线粒体损伤可具有有害作用(Chan,Cell 125:1241-1252,2006)。为了研究线粒体功能和功能障碍,已经描述了几种线粒体分离方法。线粒体分离的最早公开的报道似乎回溯到20世纪40年代(Bensley et al.,Anat Rec 60:449–455,1934;Claude,J Exp Med 84:61–89,1946;Hogeboom et al.,J Biol Chem 172:619–635,1948;Ernster et al.,J Cell Biol 91(3Pt 2),227s-255s,1981)。一种尝试通过在研钵中研磨肝组织,然后在盐溶液中以低速离心表明线粒体分离(Bensley et al.,Anat Rec 60:449–455,1934;Ernster et al.,J Cell Biol 91(3Pt 2),227s-255s,1981)。其它组在原始程序的基础上扩展,并且基于差速离心显示组织分级(Claude,J Exp Med 84:61–89,1946;Hogeboom et al.,J Biol Chem 172:619–635,1948;Ernster et al.,J Cell Biol 91(3Pt 2),227s-255s,1981)。这些早期方法形成了当前技术已知的技术的基础,其通常掺入均化和/或差速离心(Pallotti et al.,Methods Cell Biol 80:3-44,2007;Schmitt et al.,Anal Biochem 443:66-74,doi:10.1016/j.ab.2013.08.007,2013;Fernández-Vizarra et al.,Mitochondrion10:253-262,doi:10.1016/j.mito.2009.12.148,2010;Graham et al.,Curr Protoc Cell Biol Chapter 3,Unit 3.3,doi:10.1002/0471143030.cb0303s04,2001;Frezza et al.,Nat Protoc 2:287-295,2007;Wieckowski et al.,Nat Protoc 4:1582-1590,doi:10.1038/nprot.2009.151,2009;Gostimskaya et al.,J Vis Exp(43),pii:2202,doi:10.3791/2202,2010)。均化和离心步骤的数目根据方案而变化。这些重复步骤增加了线粒体分离的时间并最终降低了存活力。此外,如果不适当控制,则手动匀化可导致线粒体损伤和不一致的结果(Schmitt et al.,Anal Biochem 443:66-74,doi:10.1016/j.ab.2013.08.007,2013;Gross et al.,Anal Biochem 418:213-223,doi:10.1016/j.ab.2011.07.017,2011)。
发明概述
本公开至少部分基于如下的发现,即可通过差异过滤以高产率和高纯度分离有活力的、有呼吸能力的线粒体(viable,respiration-competent mitochondria)。特别地,申请人已经发现孔径为约5μm至约20μm,例如约6μm,8μm,10μm,12μm,15μm或约18μm的滤器允许在滤液中收集线粒体,而细胞碎片和其它细胞器由滤器保留。因此,本说明书提供了例如分离有活力的、有呼吸能力的线粒体的过滤装置,试剂盒和方法。
在一个方面,本公开提供了过滤装置,其可以具有管状主体,该管状主体配制为被接收在离心管中并且具有腔和第一和第二末端,每个末端具有开口;布置并固定在所述腔内的第一滤器,其中所述滤器具有约30μm至约50μm,例如约33μm,35μm,38μm,40μm,42μm,45μm或约48μm的孔径;以及布置并固定在所述腔内的第二滤器,其与所述第一滤器相邻,并且具有约5μm至约20μm,例如约6μm,8μm,10μm,12μm,15μm或约18μm的孔径。在一些实施方案中,过滤装置可以具有布置并固定在腔内的第三滤器,其与第一滤器和第二滤器相邻并且具有约15μm至约50μm,例如约18μm,20μm,22μm,25μm,28μm,30μm,33μm,35μm,38μm,40μm,42μm,45μm或约48μm的孔径。在一些实施方案中,第一滤器和第三滤器具有相同的孔径,例如30μm,33μm,35μm,38μm,40μm,42μm,45μm,48μm或约50μm。在一些实施方案中,第二滤器和第三滤器具有相同的孔径,例如15μm,16μm,17μm,18μm,19μm或约20μm。在一个实施方案中,过滤装置可以是无菌的。在一些实施方案中,第一,第二和第三滤器包括尼龙,聚酯薄膜(mylar),不锈钢,金属丝网(wire mesh),铝,合成网(synthetic mesh),Spectra,凯夫拉尔(Kevlar),塑料,纸或其任何组合。在另一个实施方案中,离心管是50mL离心管。
在另一方面,本公开提供了具有至少一个,例如两个,三个,五个或十个或更多个上述过滤装置的试剂盒,例如具有管状主体的装置,该管状主体配置成接收在离心管中,并且具有腔和第一和第二末端,每个末端具有开口;布置并固定在所述腔内的第一滤器,其中所述滤器具有约30μm至约50μm,例如约33μm,35μm,38μm,40μm,42μm,45μm或约48μm的孔径;以及布置并固定所述腔内的第二滤器,其与所述第一滤器相邻,并且具有约5μm至约20μm,例如约6μm,8μm,10μm,12μm,15μm或约18μm的孔径。在一个实施方案中,试剂盒可以包括第一溶液,所述第一溶液具有300mM蔗糖;10mM K+HEPES,pH 7.2;和1mM K+EGTA,pH 8.0;第二溶液,所述第二溶液具有每1mL所述第一溶液的2mg枯草杆菌蛋白酶A;第三溶液,所述第三溶液具有每1mL所述第一溶液的10mg BSA;第四溶液,所述第四溶液具有每1mL所述第一溶液的1mg BSA;50mL离心管;和1.5mL微量离心管。在一些实施方案中,50mL离心管和1.5mL微量离心管是无菌的。
在另一方面,本公开提供了分离有活力的,有呼吸能力的线粒体的方法。所述方法可以包括提供具有有活力的线粒体的细胞匀浆;提供上述过滤装置,例如具有管状主体的装置,所述管状主体配置成接收在离心管中并具有腔和第一和第二末端,每个末端具有开口;布置并固定在所述腔内的第一滤器,其中所述滤器具有约30μm至约50μm,例如约33μm,35μm,38μm,40μm,42μm,45μm或约48μm的孔径;以及布置并固定所述腔内的第二滤器,其与所述第一滤器相邻,并且具有约5μm至约20μm,例如约6μm,8μm,10μm,12μm,15μm或约18μm的孔径;任选地,将所述过滤装置布置在相对直立的位置;将细胞匀浆引入第一末端的开口中,使得细胞匀浆接触第一滤器并过滤通过第一滤器及随后地第二滤器过滤,从而形成滤液;并收集滤液,从而分离有活力的线粒体。
在一个实施方案中,所述方法包括在包含300mM蔗糖;10mM K+HEPES,pH 7.2;和1mM K+EGTA,pH 8.0的溶液中匀化组织,例如哺乳动物组织,例如来自组织活检的哺乳动物组织;从而提供细胞匀浆。在一些实施方案中,所述方法可包括在引入细胞匀浆之前,用1mL包含300mM蔗糖;10mM K+HEPES,pH 7.2;和1mM K+EGTA,pH 8.0的溶液中的1mg BSA的溶液润湿所述第二滤器。在一个实施方案中,该方法可包括在收集滤液之前将装置以约1x g离心3分钟。在一些实施方案中,将滤液在4℃以9000rpm离心5分钟。在一个实施方案中,可以通过在无菌玻璃研磨容器中匀化组织来提供细胞匀浆。
除非另有定义,本文使用的所有技术术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。本文描述了用于本发明的方法和材料;也可以使用本领域已知的其它合适的方法和材料。材料,方法和实施例仅是说明性的,而不是意图为限制性的。本文提及的所有出版物,专利申请,专利和其它参考文献通过引用整体并入。在冲突的情况下,应当以本说明书(包括定义)为准。
从下面的详细描述和附图以及权利要求书中,本发明的其它特征和优点将是显而易见的。
附图简述
图1是显示示例性过滤装置的示意图。
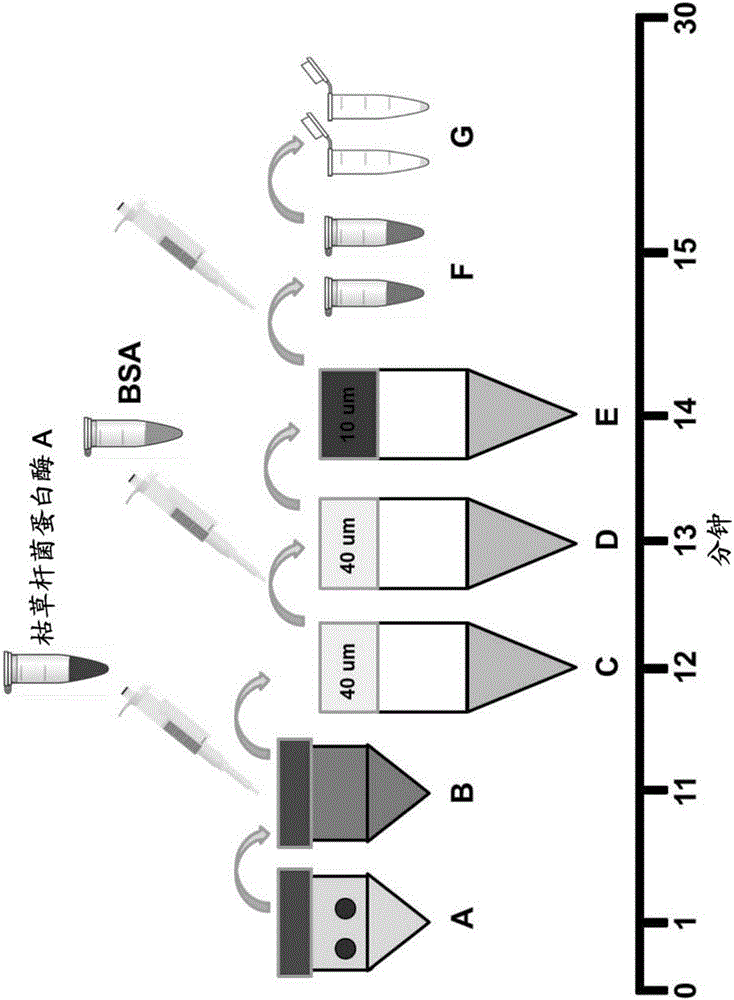
图2显示在小于30分钟的总程序时间内使用组织解离和差异过滤分离线粒体的方案。
图3A是条形图,其显示从骨骼肌和肝脏的0.18±0.04g组织(湿重)分离的血细胞计数和粒径计数器线粒体数。
图3B是显示如通过粒度计数器检测的线粒体大小分布的线图。
图3C是显示骨骼肌和肝脏的线粒体蛋白(mg/g)组织湿重的条形图。
图3D是分离的线粒体的透射电子显微术图像。比例尺为100nm。箭头指示可能被非线粒体颗粒和受损的线粒体污染。
图4A是在相差照射下分离的线粒体的显微照片。比例尺为25μm。
图4B和4C是在荧光照射下分离的线粒体的显微照片,线粒体用MitoTracker Red CMXRos标记。比例尺是25μm(图4B)和5μm(图4C)。
图4D是描述如通过ATP测定法测定的ATP含量nmol/mg线粒体蛋白的柱状图。
图4E是显示如由Clark电极测定的呼吸控制指数(RCI)(状态3/状态4)的柱状图。
图5是显示ATP测定法的平板图的表。
发明详述
先前描述的使用差速离心和/或Ficoll梯度离心的线粒体分离方法通常需要60至100分钟来完成。本文描述了用于从组织快速分离线粒体的过滤装置,试剂盒和方法。本文所述的某些方法采用组织解离器(tissue dissociator)和差异过滤。在该方法中,可以用组织解离器的标准化均化循环代替手动匀化,所述标准化均化循环允许组织的均匀且一致的均化,这不容易通过手动均化实现。组织解离后,通过尼龙筛网滤器过滤细胞匀浆,这消除了重复的离心步骤。结果,线粒体分离可以在少于30分钟内进行。使用本文所述的过滤装置,试剂盒和方法的典型分离可从0.18±0.04g(湿重)的组织样品产生约2x1010个有活力的且有呼吸能力的线粒体。
本文所述的过滤装置可用于在30分钟或更短,例如28分钟,25分钟或20分钟或更短时间内快速分离完整的,有活力的线粒体。在分离线粒体的方法中使用差异过滤代替标准差速离心显著减少了程序时间,并且使线粒体比使用标准差速离心方案经受更小的机械应力。例如,掺入若干离心步骤的方案可以花费60分钟至100分钟来分离线粒体(Frezza et al.,Nat Protoc 2:287-295,2007;Wieckowski et al.,Nat Protoc 4:1582-1590,doi:10.1038/nprot.2009.151,2009;Gostimskaya et al.,J Vis Exp(43),pii:2202,doi:10.3791/2202,2010;Gross et al.,Anal Biochem 418:213-223,doi:10.1016/j.ab.2011.07.017,2011;Masuzawa et al.,Amer J Physiol Heart Circ Physiol 304:H966-H982,doi:10.1152/ajpheart.00883.2012,2013)。本过滤装置,试剂盒和分离方法的另一个优点是组织匀化是标准化的。组织解离器提供标准化的循环并产生一致的和可重复的结果。这与遭受用户可变性和不一致性的手动均化相反。本方法提供的分离时间框与临床和外科治疗干预相容(Masuzawa et al.,Amer J Physiol Heart Circ Physiol 304:H966-H982,doi:10.1152/ajpheart.00883.2012,2013;McCully et al.,Amer J Physiol Heart Circ Physiol 296:H94-H105,doi:10.1152/ajpheart.00567.2008,2009)。
装置
本文所述的过滤装置的特征在于主体(例如,管状主体),其配置为容纳多个滤器,其在下面进一步描述并在图1中示出。主体(10)可以成形为配合到离心管(90)中。主体(10)和离心管(90)可以是任何尺寸。主体(10)具有第一和第二末端(20)和(80),每个末端具有开口(30)和(70)。主体具有腔(40),使得样品可以在一末端放置到主体内,行进通过腔(40),并且在样品前进通过布置在主体内的至少两个滤器体(例如通过重力,毛细作用和/或离心)后,在相反末端取回。技术人员将理解,一个或两个末端(20和/或80)(虽然每个具有开口)在一些实施方案中可以可逆地加盖,例如以保持无菌性和/或提供收集滤液的区域。通常,主体将具有沿着主体的长度的大致圆形的横截面。然而,熟练从业人员将理解,主体的横截面可以是任何期望的形状,例如椭圆形,正方形,矩形,三角形等。在一些实施方案中,横截面大致为圆形,使得主体可以接收在商品化的离心管(90),例如50mL离心管内。熟练从业人员将理解,管状体(10)可以由任何本领域已知的材料构造,例如聚丙烯或聚苯乙烯。主体的一个末端,例如末端(80),可以具有锥形配置(如图1所示),以便于将主体插入离心管中和/或帮助将滤器保持在主体内。
该装置包括布置并固定在腔内的第一滤器(50),其中滤器具有约30μm至约50μm的孔径,例如约30μm,33μm,35μm,38μm,40μm的孔径,42μm,45μm,48μm或约50μm。第一滤器可以由任何本领域已知的过滤材料构造,例如尼龙,聚酯薄膜,不锈钢,金属丝网,铝,合成网,Spectra,凯夫拉尔,塑料,纸或其任何组合。该装置还包括布置并固定在腔内的第二滤器(60),其与第一滤器相邻,并具有约5μm至约20μm的孔径,例如约5μm,6μm,8μm,10μm,12μm,15μm,18μm或约20μm。第二滤器可以由任何本领域已知的过滤材料构造,例如尼龙,聚酯薄膜,不锈钢,金属丝网,铝,合成网,spectra,凯夫拉尔,塑料,纸或其任何组合。第一和第二滤器可以位于主体内,使得它们彼此接触或者间隔开一定距离。例如,第一和第二滤器可以以至少或约0.5mm,例如至少或约1mm,2mm,3mm,4mm,5mm,8mm,1cm,2cm,5cm,或至少或约10cm的距离间隔布置在主体内,这取决于预期用途和/或主体的长度。
装置可以可选地包括布置并固定在腔内的第三滤器,所述第三滤器与第一滤器和第二滤器相邻,并且具有约15μm至约50μm的孔径,例如约15μm,18μm,20μm,22μm,25μm,28μm,30μm,33μm,35μm,38μm,40μm,42μm,45μm,48μm或约50μm。第三滤器可以由任何本领域已知的过滤材料构造,例如尼龙,聚酯薄膜,不锈钢,丝网,铝,合成网,spectra,凯夫拉尔,塑料,纸或其任何组合。第三滤器可以布置在第一和第二滤器之间。在一些实施方案中,第三滤器布置在第一滤器和第一开口之间,即,比第一滤器更靠近第一开口。在其它实施方案中,第三滤器布置在第二滤器和第二开口之间,即,比第二滤器更靠近第二开口。第三滤器可以布置成使得其接触第一滤器和/或第二滤器,或者三个滤器可以均匀地间隔开或不均匀地间隔开。例如,当第三滤器布置在第一和第二滤器之间时,第一和第三滤器可以彼此接触,或者相隔至少或约0.5mm,例如至少或约1mm,2mm,3mm,4mm,5mm,8mm,1cm,2cm,5cm,或至少或约10cm;并且第三和第二滤器可彼此接触,或相隔至少或约0.5mm,例如至少或约1mm,2mm,3mm,4mm,5mm,8mm,1cm,2cm,5cm,或至少或约10cm。
熟练从业人员将理解,根据预期的用途,在一些情况下可以添加其它滤器(例如,第四滤器,第五滤器,第六滤器等)。在一些实施方案中,所述装置是无菌的。熟练从业人员将理解,滤器可以使用任何本领域已知的方法固定在主体内,例如使用粘合剂,压力配合和/或以如下的方式配置腔壁,使得引起滤器保持在腔中(例如,通过设计具有脊,槽或其它保持元件的腔壁)。
试剂盒
本公开还提供了试剂盒,其特征在于本文所述的过滤装置以分离有活力的线粒体。所述试剂盒包括至少一个,例如两个,三个,五个或十个上述过滤装置。试剂盒可以进一步包括可用于进行本文所述的线粒体分离方法的一种或多种溶液。例如,试剂盒可以包括第一溶液,所述第一溶液包含300mM蔗糖;10mM K+HEPES,pH 7.2;和1mM K+EGTA,pH 8.0。或者/另外,试剂盒可包括每1mL第一溶液包含2mg枯草杆菌蛋白酶A的第二溶液。或者/另外,试剂盒可包括第三溶液,其相对于每1mL第一溶液包含10mg BSA。或者/另外,试剂盒可以包含溶液,所述溶液包含无活性的人血清白蛋白或乙酰化的人血清白蛋白。或者/另外,试剂盒可包括第四溶液,其相对于每1mL第一溶液包含1mg BSA。在一些情况下,试剂盒可包括50mL离心管,可以对其安装过滤装置。或者/另外,试剂盒可包括1.5mL微量离心管。在一些实施方案中,50mL离心管和1.5mL微量离心管是无菌的。
分离线粒体的方法
在一个示例性方法中,从组织,例如哺乳动物组织,例如来自组织活检的哺乳动物组织中分离完整的,有活力的线粒体。例如,可以例如用手术刀来自哺乳动物的组织切碎,并在无菌玻璃研磨容器(Thomas,Philadelphia,PA)中用发动机驱动的杵在4℃在第一溶液中均化5至10秒钟,所述第一溶液含有300mM蔗糖;10mM K+HEPES,pH 7.2;和1mM K+EGTA,pH 8.0。然后,将含有2mg枯草杆菌蛋白酶A/1mL第一溶液的溶液加入匀浆中,并在冰上温育10分钟。
在冰上温育后,将细胞匀浆引入相对直立定位的无菌过滤装置,如本文所述。在一些实施方案中,将细胞匀浆的体积,例如约100μL,200μL,300μL,400μL,500μL,600μL,700μL,800μL,900μL,1mL,1.5mL,2.5mL,3mL,4mL,5mL,6mL,7mL,10mL,15mL,20mL,25mL,30mL,35mL,40mL,45mL或约50mL引入第一末端处的开口,使得细胞匀浆接触第一滤器,之后接触第二滤器,并且在通过两个滤器之后,例如通过重力或通过离心,在管中,例如离心管,小瓶,微量离心管或试管中收集滤液,以分离完整的,有活力的,有呼吸能力的线粒体。或者/另外,过滤装置可以在第二末端上具有能够收集滤液的盖,并且可以打开或拧开盖以在滤液已经流过第一滤器,第二滤器,和(若存在的话)第三滤器(通过重力或离心之后)收集滤液。在一些实施方案中,细胞匀浆的体积可以通过孔径为约30μm至约50μm,例如约33μm,35μm,38μm,40μm,42μm,45μm,或约48μm的滤器,并且任选地,滤液通过孔径为约15μm至约50μm的另一滤器,例如约18μm,20μm,22μm,25μm,28μm,30μm,33μm,35μm,38μm,40μm,42μm,45μm或约48μm,然后通过孔径为约5μm至约20μm的滤器,例如约6μm,8μm 10μm,12μm,15μm或约18μm。
在将细胞匀浆引入过滤装置之前,可以用包含在1mL包含300mM蔗糖;10mM K+HEPES,pH 7.2;和1mM K+EGTA,pH 8.0的溶液中的包含1mg BSA的溶液润湿孔径为约5μm至约20μm,例如约6μm,8μm,10μm,12μm,15μm或约18μm的滤器。尽管在本文的方法中不总是需要,但是熟练从业人员将理解,可以通过将装置离心(例如以1x g离心3分钟)来促进滤液收集。熟练从业人员将理解可以通过在4℃以9000rpm离心滤液5分钟来浓缩线粒体。
实施例
下面描述了几种通用方案,其可以用于本文所描述的任何方法中,并且不限制权利要求书中描述的本发明的范围。
实施例1:储备溶液
制备以下溶液以分离完整的,有活力的,有呼吸能力的线粒体。为了使用本方法成功分离线粒体,所有溶液和组织样品应保持在冰上以保持线粒体存活力。即使当保持在冰上时,分离的线粒体将随时间表现出功能活性的降低(Olson et al.,J Biol Chem 242:325-332,1967)。所有溶液应尽可能预先准备。
1M K-HEPES储备溶液(用KOH调节pH至7.2)。
0.5M K-EGTA储备溶液(用KOH调节pH至8.0)。
1M KH2PO4储备液。
1M MgCl2储备液。
匀化缓冲液(pH7.2):300mM蔗糖,10mM K-HEPES和1mM K-EGTA。贮存于4℃。
呼吸缓冲液:250mM蔗糖,2mM KH2PO4,10mM MgCl2,20mM K-HEPES缓冲液(pH7.2)和0.5mM K-EGTA(pH 8.0)。贮存于4℃。
10X PBS储备溶液:将80g NaCl,2g KCl,14.4g Na2HPO4和2.4g KH2PO4溶解在1L双蒸H2O(pH7.4)中。
通过将100mL 10X PBS移液到1L双蒸H2O中制备1X PBS。
通过将4mg枯草杆菌蛋白酶A称量到1.5mL微量离心管中制备枯草杆菌蛋白酶A储液。贮存于-20℃直至使用。
通过将20mg BSA称量到1.5mL微量离心管中制备BSA。贮存于-20℃直至使用。
实施例2:线粒体分离
图2中显示了使用组织解离和差异过滤分离线粒体中的程序步骤的概述图。将两份6mm活检样品冲空转移到解离C管中的5mL匀化缓冲液中,并使用组织解离器的1分钟匀化程序匀化样品(A)。将枯草杆菌蛋白酶A储备溶液(250μL)加入到解离C管中的匀浆中,并在冰上温育10分钟(B)。在冰上在50mL锥形离心管中通过预润湿的40μm筛孔滤器过滤匀浆,然后向滤液中加入250μL BSA储备溶液(C)。将滤液再过滤通过在冰上的50mL锥形离心机中的新的预润湿的40μm筛网滤器(D)。将滤液再过滤通过在冰上的50mL锥形离心管中的新的预润湿的10μm筛网滤器(E)。将滤液转移到1.5mL微量离心管中,并在4℃(F)以9000xg离心10分钟。除去上清液,并且将含有线粒体的沉淀物重悬,并在1mL呼吸缓冲液中组合(G)。
在分离前立即将枯草杆菌蛋白酶A溶解在1mL均化缓冲液中。在分离之前立即将BSA溶解在1mL均化缓冲液中。使用6mm活检样品冲孔器收集两份新鲜组织样品,并在冰上在50mL锥形离心管中在1X PBS中贮存。将两份6mm组织冲孔转移到含有5mL冰冷的匀化缓冲液的解离C管中。通过将解离C管装配到组织分离器上并选择预设线粒体分离周期(60秒均化)来均化组织。
将解离C管移至冰桶。将枯草杆菌蛋白酶A储备溶液(250μL)加入匀浆中,通过倒置混合,将匀浆在冰上温育10分钟。将40μm筛网滤器放置在冰上的50mL锥形离心管中,并且用匀化缓冲液预湿润滤器,并将匀浆在冰上过滤到50mL锥形离心管中。
将新鲜制备的BSA储备溶液(250μL)加入到滤液中,通过倒置混合。(如果需要线粒体蛋白质测定,则省略此步骤。)将40μm筛网滤器置于冰上的50mL锥形离心管中,并且将滤器用匀化缓冲液预润湿,在冰上将匀浆过滤到50mL锥形离心管中。在冰上将10μm滤器置于50mL锥形离心管上,并且用均化缓冲液预润湿滤器,并将匀浆在冰上过滤到50mL锥形离心管中。将滤液转移到两个预冷的1.5mL微量离心管中,并在4℃以9000xg离心10分钟。除去上清液,并且将沉淀重悬浮并在1mL冰冷的呼吸缓冲液中组合。
实施例3:ATP测定法
为了测定分离的线粒体的代谢活性,使用ATP测定试剂盒进行ATP发光测定法。在测定试剂盒中提供方案,试剂和标准品。下面描述该过程的概要。
将试剂盒试剂平衡至室温。通过将冻干的ATP沉淀物溶解在1170μL双蒸水中制备10mM ATP储备溶液。在冰上贮存ATP标准储备溶液和制备的线粒体样品。
将底物缓冲溶液(5mL)加入到一瓶冻干的底物溶液中,轻轻混合,并置于黑暗中。将呼吸缓冲液(100μL)加入黑色不透明底部96孔板的所有孔中。将来自制备的样品的线粒体(10μL)加入96孔板的每个孔中。将样品一式三份分配,并且包括用于标准品的一行和用于阴性对照(呼吸缓冲液)的三个孔。将哺乳动物细胞裂解溶液(50μL)加入到所有孔中,包括标准品和对照。将96孔板在轨道摇动器上以125rpm在37℃温育5分钟。在温育期间,从10mM ATP储备溶液制备浓度为0.1mM,0.05mM,0.01mM,0.005mM,0.001mM和0.0001mM ATP的ATP标准品,并在冰上贮存。温育后,将10μL ATP标准品加入相应的孔中,如平板图上所示(图5)。该平板图显示了如何为ATP测定法设置标准品(A1-A12),线粒体样品(B1-C6)和阴性对照(C7-C9)。在测定法期间,向所有孔中加入100μL呼吸缓冲液,50μL哺乳动物细胞裂解溶液和50μL重建底物溶液(A1-C9)。将重建的底物溶液(50μL)加入到每个孔中,并将96孔板在轨道摇动器上在37℃以125rpm温育5分钟。
用由Open Gen5 1.11软件控制的分光光度计读板。较高的数值与增加的ATP水平和较高的代谢活性相关。
实施例4:代表性结果
使用6mm活检穿孔器获得组织样品。组织重量为0.18±0.04g(湿重)。如通过粒度计数测定的分离的线粒体的数目对于骨骼肌为2.4×1010±0.1×1010个线粒体,对于肝制备物为2.75×1010±0.1×1010个线粒体(图3A)。为了容许比较,还通过血细胞计数器测定线粒体数。如通过血细胞计数器测定,低估线粒体数目,对于骨骼肌为0.11×1010±0.04×1010个线粒体和对于肝脏制备物为0.34×1010±0.09×1010个线粒体(图3A)。如通过基于尺寸的颗粒计数器测定的线粒体直径显示在图3B中。代表性示踪显示分离的线粒体位于一个峰下,平均直径为0.38±0.17μm,与先前的报道(Hogeboom et al.,J Biol Chem 172:619–635,1948)一致。
如通过双金鸡宁酸双金鸡宁酸(BCA)测定法测定的线粒体蛋白/g(湿重)起始组织对于骨骼肌和肝脏样品分别为4.8±2.9mg/g(湿重)和7.3±3.5mg/g(图3C)。
通过透射电子显微术测定线粒体纯度,并且示于图3D中。线粒体显示为电子密集的,小于0.01%被破坏或损伤。非线粒体颗粒的污染小于0.001%。
如先前所述(Masuzawa et al.,Amer J Physiol Heart Circ Physiol 304:H966-H982,doi:10.1152/ajpheart.00883.2012,2013;McCully et al.,Amer J Physiol Heart Circ Physiol 296:H94-H105,doi:10.1152/ajpheart.00567.2008,2009),通过MitoTracker Red测定线粒体存活力。本发明的方法产生保持膜电位的分离的线粒体(图4A-C)。这些图像指示线粒体保持膜电位。箭头表示缺乏膜电位的线粒体或碎片(图4A)。
使用发光测定试剂盒测定ATP。ATP测定法的板图显示在图5中。将ATP标准品一式两份铺板。将线粒体样品和阴性对照一式三份铺板。对于骨骼肌和肝脏样品,ATP含量分别为10.67±4.38nmol/mg线粒体蛋白和14.83±4.36nmol/mg线粒体蛋白(图4D)。
使用如前所述的克拉克(Clark)型电极(Masuzawa et al.,Amer J Physiol Heart Circ Physiol 304:H966-H982,doi:10.1152/ajpheart.00883.2012,2013;McCully et al.,Amer J Physiol Heart Circ Physiol 296:H94-H105,doi:10.1152/ajpheart.00567.2008,2009)评估线粒体呼吸。线粒体氧消耗速率对于骨骼肌为178±17nM O2/min/mg线粒体蛋白和对于肝脏制备物为176±23nM O2/min/mg线粒体蛋白。对于骨骼肌和肝脏样品制备物,呼吸控制指数(RCI)值分别为2.45±0.34和2.67±0.17(图4E)。这些结果与使用手动匀化和差速离心以分离线粒体的先前研究中报道的那些相似(Masuzawa et al.,Amer J Physiol Heart Circ Physiol 304:H966-H982,doi:10.1152/ajpheart.00883.2012,2013;McCully et al.,Amer J Physiol Heart Circ Physiol 296:H94-H105,doi:10.1152/ajpheart.00567.2008,2009)。
其它实施方案
应当理解,虽然本发明已经结合其详细描述进行了描述,但是前面的描述旨在说明而不是限制由所附权利要求书的范围限定的本发明的范围。其它方面,优点和修改在所附权利要求书的范围内。
- 还没有人留言评论。精彩留言会获得点赞!