一种基于尺寸检测循环肿瘤细胞的微流控装置及方法与流程
本发明涉及生物检测领域,更具体地涉及一种基于尺寸检测循环肿瘤细胞的微流控装置及方法。
背景技术:
目前癌症仍旧是全球死亡率极高的疾病之一。2008年,死于癌症的人群达到760万(占死亡总人数的13%),而且到2030年可能会超过1300万。原发癌症的早期诊断和治疗以及转移癌症的有效治疗是对抗癌症的关键。
循环肿瘤细胞(CTC)是一类来自原发肿瘤的,进入血液循环系统的肿瘤细胞。这类细胞可以通过血液循环系统进行转移,到达其他器官实现肿瘤的转移,所以CTCs与肿瘤的发生发展以及转移有着密切的关系。鉴于CTCs在肿瘤转移中起到的重要作用,我们可以通过检测CTCs的变化来实时监控肿瘤治疗的效果和复发。
正常人1mL外周血液中平均含有5×1010红细胞、7×106白细胞和2.95×106血小板。从成分如此复杂的血液中分析肿瘤细胞是一个巨大的挑战。如果能实现CTCs的分离和富集,就可以对CTC的数目和分子特征进行分析,为肿瘤诊断分型和目标药物治疗提供依据。
CTCs的富集主要是根据目标细胞的特异的物理化学性质实现的。传统的富集方法有密度梯度离心法、膜过滤法、微流体芯片法和依赖于抗体的分离方法等。其中,美国FDA批准的商业化的CellSearchTM系统(Veridex LLC)就属于一种依赖于抗体的循环肿瘤细胞分离方法。该系统是利用抗体修饰的磁珠与上皮细胞表面表达的标志物,上皮细胞粘附分子(Epithelial cell adhesion molecule,EpCAM)特异性结合来富集CTCs。但是这种检测方法目前只应用于乳腺癌、结肠癌和前列腺癌中[Miller MC,Doyle GV,Terstappen LW Significance of CirculatingTumor Cells Detected by the CellSearch System in Patients with MetastaticBreast Colorectal and Prostate Cancer.J Oncol,2010,617421],在肺癌中的检测率却比较低。Tanaka等通过CellSearch系统检测125例肺癌患者,只在38例患者外周血中检测到CTCs(30.6%)[Tanaka F,Yoneda K,et al.Circulating tumor cell as a diagnostic marker in primary lung cancer.J Clin Cancer Res,2009,15(22):6980-6986]。免疫磁珠检测方法的捕获效率主要依赖于CTC标志物EpCAM,可是EpCAM抗原在不同类型的肿瘤中表达具有异质性,甚至在一些非表皮来源的肿瘤中表达是缺失的。所以这种检测方法存在检测灵敏度低,应用范围窄,成本高,耗费时间长等不足。
为了解决这些不足,一种利用循环肿瘤细胞与正常血细胞物理特性的差异来分离目标细胞的方法应运而生。近年来,随着微流控和微机械加工技术的不断完善和发展,实现精确尺寸的微流控芯片通道和孔径成为可能。这样基于细胞尺寸的微流控芯片方法就能够获得更高的捕获效率,除此之外,微流控芯片还具有体积小、分析速度快、成本低等优点。这些都有利于将微流控芯片方法应用于临床应用,以弥补现有临床检测方法的不足。目前出现的基于微流控芯片方法检测循环肿瘤细胞的方法很多,专利文献1(CN103642756A)公布了一种在微流控芯片微通道表面修饰单链核苷酸与标记有互补核苷酸的抗体结合来捕获循环肿瘤细胞的方法。这种微流控芯片法的原理是基于细胞表达抗原特性差异来捕获循环肿瘤细胞,捕获效率最高只能达到85%。
专利文献2(CN 104805011A)公布了一种微流控芯片与磁珠捕获相结合的检测循环肿瘤细胞的方法。该方法是利用间距为5-7μm的微柱来拦截尺寸大的CTCs以及与免疫磁珠特异性结合的CTCs。该方法克服了靠免疫磁珠捕获CTCs会漏选一些细胞的缺点。在检测过程中,微流控芯片利用磁场和细胞的重力作用来提供动力使细胞分离。但是,该方法目前还存在以下缺陷:(1)检测过程复杂,耗费时间长等不足;(2)捕获到的循环肿瘤细胞需要收集起来,再进行后续的免疫化学检测。
技术实现要素:
本发明的目的是提供一种基于尺寸检测循环肿瘤细胞的微流控装置及方法,从而解决现有技术中循环肿瘤细胞的检测灵敏度低,检测过程复杂,成本高,检测耗时长的缺陷。
为了解决上述技术问题,本发明采用以下技术方案:
根据本发明的第一方面,提供一种基于尺寸检测循环肿瘤细胞的微流控装置,包括:依次连接的溶液存储室,微流控芯片,废液收集针筒以及提供动力的动力系统;所述微流控芯片由玻璃基底层和聚二甲基硅氧烷(PDMS)芯片层贴合而成,其中,所述PDMS芯片层包括依次连通的:进样口;由柱子阵列形成的团块过滤区域;目标细胞筛选区域,包括彼此平行间隔延伸的若干主管道和侧管道,所述主管道和侧管道之间通过过滤通道连通,所述主管道的前端敞开供溶液进入,末端设置过滤通道,所述侧管道的前端封闭,末端敞开供溶液流出,其中,所述主管道和侧管道分别具有第一高度,所述过滤通道具有第二高度,其中,所述第一高度大于循环肿瘤细胞的尺寸,所述第二高度小于循环肿瘤细胞的尺寸;以及出样口。
本发明微流控芯片上的主管道和侧管道的数量可以根据实际需求改变。
根据本发明提供的微流控芯片上的目标细胞筛选区域,主管道和侧管道以及过滤通道的高度是根据目标细胞和其他细胞的尺寸大小差异优化而来的,可以根据实际需求改变。利用过滤通道的高度来截留尺寸大的循环肿瘤细胞,尺寸小的白细胞和红细胞能够通过过滤通道到达侧通道,流出芯片。现有技术中公开的文献中一般是利用通道宽度来筛选细胞,而本发明创造性地采用高度来筛选使得模具工艺对精度要求低,制作成本低,步骤简单易行。
所述第一高度优选为40μm~60μm,最优选为50μm,所述第二高度优选为8μm~12μm,最优选为10μm。
优选地,所述过滤通道内设有彼此间隔延伸的用于支撑所述过滤通道的圆柱形柱子。
所述团块过滤区域包括自进样口朝向目标细胞筛选区域依次排列的初级团块过滤区域和次级团块过滤区域,所述初级团块过滤区域的六边形柱子之间的最小间距大于所述次级团块过滤区域的六边形柱子之间的最小间距。通过该团块过滤区域只允许单细胞通过,大团细胞团和杂质会被截留在这个区域,从而避免芯片阻塞。
所述初级团块过滤区域的六边形柱子之间的最小间距为40μm~60μm,所述次级团块过滤区域的六边形柱子之间的最小间距为15μm~25μm。
所述PDMS芯片层进一步包括分别设置于所述进样口和团块过滤区域之间以及所述团块过滤区域和目标细胞筛选区域之间的分支进样管道,所述分支进样管道通过逐级分支的管道保证从一个入口进入的溶液从若干出口流出。
所述PDMS芯片层进一步包括设置于所述目标细胞筛选区域和出样口之间的分支出样管道,所述分支出样管道通过逐级分支的管道保证从若干入口进入的溶液从一个出口流出。
所述动力系统为连接在所述废液收集针筒下游的进样泵,采用负压进样方式,样品不与进样泵接触,避免交叉污染。
根据本发明的第二方面,提供一种基于尺寸检测循环肿瘤细胞的方法,主要包括以下步骤:1)提供一种如上所述的基于尺寸检测循环肿瘤细胞的微流控装置,将处理过的血液样本以10mL/h~18mL/h的流速导入所述微流控芯片中进行分离;2)导入洗液对所述微流控芯片进行冲洗,再依次将通透液、封闭液以及染色液导入所述微流控芯片,在所述微流控芯片中对细胞进行免疫荧光染色;3)冲洗掉未结合的抗体,对所述微流控芯片进行观察和分析。
所述流速优选为10mL/h~15mL/h。
本发明提供的循环肿瘤细胞检测的方法中,需要在检测循环肿瘤细胞之前,先用溶液冲洗芯片,再以一定流速进样,整个检测过程仅需87min。检测中用到的进样泵有两个平行的通道,因此可以同时处理两个样本,而整个检测过程也仅需要87min。因此,根据实际需求,在一个芯片中集成多个相同的结构以及使用更多通道的进样泵来实现多个样本同时检测。
本发明将基于尺寸筛选循环肿瘤细胞的微流控芯片与免疫荧光染色鉴定相结合构建了循环肿瘤细胞的检测方法,大大提高了循环肿瘤细胞的检测速度和灵敏度。与现有的循环肿瘤细胞检测系统相比,本发明提供的基于尺寸检测循环肿瘤细胞的微流控装置及方法在循环肿瘤细胞的分离、检测速度和成本方面具有很大的优势,一方面,硅片模具做好之后,可以重复利用,微流控芯片结构简单,制作方便;另一方面,微流控芯片结构小,一次检测只需抗体混合液15μL,大大降低了检测的成本。另外本发明提供的微流控装置是一种循环肿瘤细胞的分离和鉴定一体化的装置,在循环肿瘤细胞在芯片中得到富集之后,直接对其进行免疫荧光染色处理以及扫描鉴定,不需要将富集的细胞转移之后再鉴定,避免了目标细胞的损失,从而增加了细胞分离检测的灵敏度。总之,根据本发明,提供了一种检测灵敏度高,操作简单,成本低,通量大,检测耗时短的基于尺寸检测循环肿瘤细胞的微流控装置及方法。
附图说明
图1是根据本发明的一个优选实施方式的微流控装置的结构示意图;
图2是如图1所示的微流控装置中的微流控芯片的结构示意图;
图3是如图2所示的微流控芯片的团块过滤区域的结构示意图;
图4A是如图2所示的微流控芯片的目标细胞筛选区域的部分细节放大示意图;
图4B是如图4A所示的目标细胞筛选区域的横截面示意图;
图5是实施例3中的流速与捕获效率曲线图;
图6是实施例4中微流控芯片法与EpCAM磁珠法检测病人样本结果对比图;
图7A是实施例5中通过本发明的微流控装置实际检测样本的结果散点图;
图7B是实施例5中检测循环肿瘤细胞的ROC曲线图。
具体实施方式
以下结合具体实施例,对本发明做进一步说明。应理解,以下实施例仅用于说明本发明而非用于限制本发明的范围。
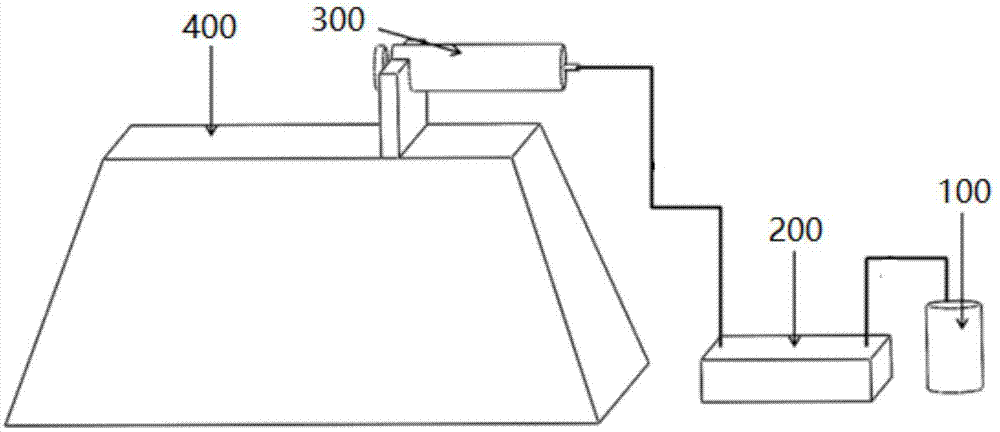
如图1所示,是根据本发明的一个优选实施例的微流控装置,该装置主要包括:通过管道依次连接的溶液存储室100,微流控芯片200,废液收集针筒300以及进样泵400。其中,溶液存储室100用于存储待检测样本以及各种功能溶液,微流控芯片200作为样本溶液的主要检测和分析场所,废液收集针筒300用于收集自微流控芯片200中流出的废液,进样泵400用于提供一负压以保证各种溶液顺利从溶液存储室100流入微流控芯片200。
其中,根据本发明一个最优选实施例的微流控芯片200的详细结构如图2所示,整个微流控芯片200的外观尺寸为2cm(宽)*3.5cm(长),该微流控芯片200由PDMS芯片层10和玻璃基底层20贴合而成,PDMS芯片层10上设有依次连通的进样口1,初级分支进样管道2,团块过滤区域3,3’,次级分支进样管道2’,目标细胞筛选区域4,分支出样管道5,以及出样口6。
具体参见图2,该初级分支进样管道2和次级分支进样管道2’的布置和工作原理相同,均是通过将管道逐级分支的原理,保证溶液从一个入口进入,随着逐级分流而最终从八个出口流出,而不是始终集中在中间一根管道,实现了溶液在随后管道中的均匀分布。然而,应当理解,具体的分支方式可以根据芯片大小做适应的变化。
如图3所示,团块过滤区域由初级团块过滤区域3和次级团块过滤区域3’两部分组成,这两部分均由柱子阵列形成,其中,初级团块过滤区域3的六边形柱子31之间的最小间距大于次级团块过滤区域3’的六边形柱子31’之间的最小间距,优选地,初级团块过滤区域3的六边形柱子31之间的最小间距约为50μm,次级团块过滤区域3’的六边形柱子31’之间的最小间距约为20μm,通过这样两级团块过滤,使得大团细胞团和杂质被截留在这个区域,而只允许单细胞通过,从而避免芯片阻塞。
结合图2、图4A、图4B所示,目标细胞筛选区域4包括在次级分支进样管道2’和分支出样管道5之间彼此平行间隔延伸的若干条主管道41和若干条侧管道42,在本实施例中,优选为30条主管道41和31条侧管道42,但是,应当理解,该主管道41和侧管道42的数量可以根据实际需求改变,并不局限于当前优选的实施例。主管道41和侧管道42之间通过过滤通道43连通(参见图4B,需要注意的是,过滤通道43在图4A中被简化成直线表示),主管道41的前端敞开供溶液进入,末端设置过滤通道43,侧管道42的前端封闭,末端敞开供溶液流出,其中,主管道41的尺寸为80μm(宽)*50μm(髙),侧管道42的尺寸为50μm(宽)*50μm(髙),过滤通道43尺寸为40μm(宽)*10μm(髙)。
根据本发明提供的上述目标细胞筛选区域4,由于主管道41和侧管道42的高度(50μm)大于循环肿瘤细胞的尺寸,过滤通道43的高度(10μm)小于循环肿瘤细胞的尺寸,因此使得尺寸较大的循环肿瘤细胞C1无法进入过滤通道43而被截留在主管道41中,而尺寸较小的红细胞C2和白细胞C3通过过滤通道43进入侧管道42中,进而从侧管道42敞开的末端处流入分支出样管道5,从出样口6流出。
根据本发明的另一优选实施例,过滤通道43内还设有彼此间隔延伸的用于支撑该过滤通道43的圆柱形柱子(图未示出),该圆柱形柱子直径优选为40μm,各柱子之间保持100μm的间距。
分支出样管道5如图2所示,与初级分支进样管道2和次级分支进样管道2’的布置和工作原理基本相同,区别仅在于该分支出样管道5是通过逐级分支的管道保证从若干入口进入的溶液从一个出口流出。
实施例1微流控芯片的制备
1.1根据本发明设计的上述芯片结构,利用AutoCAD软件绘制出所需的图形,制作胶片掩膜版;以四寸单晶硅片为衬底,进行热氧化形成一层2μm的氧化层,再进行光刻,反应离子刻蚀,去胶清洗,光刻,深反应离子刻蚀,刻蚀出过滤通道43的高度。对硅片进行浓H2SO4和双氧水清洗,去除光刻胶,再次按照二氧化硅图形进行深反应离子刻蚀,刻蚀出芯片其他通道的高度,最后就得到具有微结构的硅片模具。
1.2将硅片模具和装有10μL氟硅烷的敞口离心管置于真空干燥箱中,抽真空至负压,使氟硅烷汽化,模具在氟硅烷蒸汽中静置5-6个小时。在通风处中,将干燥箱打开,通风1个小时后,将硅片取出。这一步的目的是在硅片表面沉积一层有机物,便于后续PDMS芯片的制作。
1.3按照重量比10:1分别称量PDMS预聚物和固化剂,然后混合并搅拌均匀,置于真空干燥箱中抽真空,负压下静置30min。待PDMS基本没有气泡后,将其浇注在硅片模具上,静置30min,然后,将其放入65℃烘箱加热2h。最后将固化好的PDMS层从模具上剥离下来,按照图形上的进出样口进行打孔,并将结构以外的多余部分切割掉。最后将PDMS芯片10结构面朝上和玻璃基底20放入等离子清洗机中清洗45s,取出后迅速贴合在一起,即完成了微流控芯片200的封装。
实施例2采用实施例1制备的微流控芯片进行循环肿瘤细胞的检测
先对2mL血液样本进行离心,吸掉上层血浆,再对剩余部分进行红细胞裂解处理两次,然后用500μL4%多聚甲醛溶液重悬剩余细胞,对细胞进行固定,最后置于4℃冰箱备用。检测时,先吸取250μL处理好的细胞悬液稀释到1mL备用。将进样泵400的流速设置为15mL/L,直径设置为19mm,废液收集针筒300的一端与微流控芯片200的出样口6相连,利用进样泵400提供的负压从微流控芯片200的进样口1将样本抽入到微流控芯片200中;然后用PBS(含0.05%Tween)洗液200μL冲洗芯片,尺寸较小的红细胞和白细胞即被冲出微流控芯片200进入废液收集针筒300中;冲洗之后,将20μL0.02%Triton-PBS溶液导入到芯片中,室温孵育10min,应当理解,该溶液根据后续染色所用的抗体类型而定,如果免疫荧光抗体不是针对细胞内的细胞质类抗原,可以省略;然后用PBS(含0.05%Tween)洗液200μL冲洗芯片,从而将Triton-PBS溶液冲出芯片,中止反应;再将20μL1%BSA导入到芯片中,封闭细胞,减少免疫反应的非特异吸附,室温孵育5min;然后将15μL免疫荧光抗体(包括细胞角蛋白抗体、波形蛋白抗体和白细胞特异性抗体)和细胞核荧光染料混合液DAPI导入到芯片中,作用是对捕获到的细胞进行免疫荧光染色,进一步分析细胞类型,原理是利用循环肿瘤细胞与白细胞表达抗原的不同,采用免疫荧光染色的方法对细胞做更准确的分析,避免假阳性的出现,应当理解,根据目标细胞的不同,可以更换不同的免疫荧光抗体,将微流控芯片200放入湿盒中,37℃恒温箱中轻轻摇晃孵育40min;最后,用PBS(含0.05%Tween)洗液200μL冲洗芯片,以冲洗未反应的免疫荧光抗体,中止免疫反应。分离及染色完成后,将微流控芯片200置于荧光显微镜下进行扫描分析。
实施例3
采用实施例1提供的装置和实施例2提供的检测方法,将进样泵流速分别设置为10mL/h、15mL/h、17mL/h,对已知浓度的肺癌细胞株H446悬液进行实验,计算不同流速下的H446细胞的捕获效率,实验结果见图5,从图中可以看出,该微流控芯片在15mL/h流速下的捕获效率最高,高达94%。
实施例4
采用实施例1提供的装置和实施例2提供的检测方法,对19个肺癌病人的血液样本进行检测,分析其循环肿瘤细胞数目。另外,用标记EpCAM抗体的磁珠对这19个病人血液样本进行循环肿瘤细胞的检测,与微流控芯片检测的结果进行对比,见图6。实验结果表明,该基于尺寸分离循环肿瘤细胞的方法捕获到的CTCs比EpCAM抗体磁珠法更多,检测更灵敏。
实施例5
采用实施例1提供的装置和实施例2提供的检测方法,对41个肺癌病人和17个正常人血液样本进行检测,统计其CTCs数目水平,对比分析,见图7A和图7B。肺癌病人样本中的CTCs数目显著高于正常人,检测灵敏度能够达到87.8%,说明该装置在肺癌病人样本中检测出CTCs异常的比例达到87.8%。
以上所述的,仅为本发明的较佳实施例,并非用以限定本发明的范围,本发明的上述实施例还可以做出各种变化。即凡是依据本发明申请的权利要求书及说明书内容所作的简单、等效变化与修饰,皆落入本发明专利的权利要求保护范围。本发明未详尽描述的均为常规技术内容。
- 还没有人留言评论。精彩留言会获得点赞!