用于锂‑空气电池的可溶性催化剂的制作方法
本发明涉及催化剂,并且更具体地,涉及用于锂-空气电池的可溶性催化剂。可溶性催化剂可以包括氧化还原介体(RM),其具有在真空下约5.5~7.5eV的电离能或具有约3.0~4.0V的氧化电位并且很好地溶解在电解质中且不与电解质反应。另外,氧化还原介体(RM)具有的在初始状态(RM)下的HOMO(最高能量占据分子轨道)水平小于过氧化锂(Li2O2)的形成能,但最大地接近于该形成能,并且其具有的处于氧化态(RM+)的HOMO水平大于电解质的HOMO水平。
背景技术:
目前,诸如与高速增长相应的化石燃料的损耗、环境污染以及全球变暖的问题日益增加。作为对此的对策,已经开发出新的可再生能源,但还未实现显著的结果。因而,特别是在电池领域,对能量存储技术的兴趣不断增加。
例如,在锂离子电池中已经实现了先进发展。然而,常规锂离子电池由于其低能量密度而不足以替代矿物燃料。此外,近来,已经积极地开发出金属-空气电池,诸如锂-空气电池。
锂-空气电池没有任何限制地使用从空气供给的氧作为活性材料。理论上,可以从锂-空气电池中获得足够高的能量密度,例如,约3,200Wh/kg,这是常规锂离子电池能量密度的约10倍。另外,因为氧被用作活性材料,所以锂-空气电池是环境友好的。
然而,常规锂-空气电池由于高极化而具有短寿命和过电压的缺点。特别地,当电池放电时,可以生成过氧化锂(Li2O2),并且过氧化锂的离子电导率低。因此,当过氧化锂覆盖锂-空气电池的空气电极(阴极)时,发生高的极化并且因此能量效率显著降低。因而,在锂-空气电池中重要的研究课题可以是开发适当的分解过氧化锂的催化剂。
相关技术的早期的锂-空气电池使用固体氧产生催化剂。因为上述催化剂是固相的,所以难以使催化剂与同样为固相的过氧化锂接触。结果,因为催化剂的活性低,所以无法解决上述问题。近来,已经积极地进行了对于可溶性催化剂的研究。因为可溶性催化剂可以在电解质中自由地移动,所以可溶性催化剂可以更容易地接触到过氧化锂。
可溶性催化剂包括在被氧化和还原的同时分解过氧化锂的氧化还原介体。例如,在相关技术中已经报道了作为锂-空气电池用可溶性催化剂的氧化还原介体的四硫富瓦烯(TTF)。另外,本发明人曾建议碘化锂(LiI)作为另一种替代方案,其可用作氧化还原介体。因而,本发明人已经努力集中于研究开发解决锂-空气电池的问题的新型高级可溶性催化剂,由此完成了本发明。
在该背景技术部分中公开的以上信息仅仅是为了增强对本发明背景技术的理解,并且因此其可包括不形成对于本领域的普通技术人员而言在本国已经知道的现有技术的信息。
技术实现要素:
本发明提供可溶性催化剂,其可有效地分解在锂-空气电池放电时所产生的过氧化锂。此外,本发明提供可用作锂-空气电池用可溶性催化剂的化合物。
本发明的目的并不限于上述目的。本发明的目的将通过以下描述更加清楚并且可通过权利要求中所述的手段及其组合来实现。
本发明可包括以下构造,以便实现上述目的。
在一个方面,本发明提供一种用于锂-空气电池的催化剂。特别地,本发明的催化剂在用于锂-空气电池中的电解质中可以是可溶性的。如本文所用的术语“可溶性催化剂”是指催化剂或催化剂组合物,其溶解在各种类型的液体或半固体电解质(例如,固态凝胶电解质)、电解质的溶液或构成电解质的溶剂中。此外,电解质可以包括相关技术中用于制造电池(例如锂-空气电池)的各种溶剂,例如,质子隋性溶剂(极性或非极性的非水溶剂或有机溶剂)、质子溶剂或水性溶剂或它们的混合物。在下文中,除非另外指出,否则催化剂可以被称为可溶性催化剂。
另外,催化剂可包括氧化还原介体(RM),其可具有在真空下约5.5~7.5eV的电离能并且可以溶解在电解质中。如本文所用的术语“氧化还原介体”是指可接受或给出电子从而促进电子在基质或体系中的转移过程的分子或化合物,例如在锂-空气电池中的催化剂。
根据本发明的用于锂-空气电池的催化剂可包括氧化还原介体,其具有大于Li2O2的平衡电位的氧化电位。
氧化还原介体的氧化电位可以为约3.0~4.0V。
电解质可以为三乙二醇二甲醚(TEGDME)或二甲基亚砜(DMSO)。
氧化还原介体可以为不与电解质反应的有机化合物。
优选地,氧化还原介体的最高占据分子轨道(HOMO)水平可以小于Li2O2的形成能。
优选地,氧化还原介体的电离能在电解质中可以为约4.5~6.0eV。
优选地,处于氧化态的氧化还原介体的HOMO水平可以大于电解质的HOMO水平。
氧化还原介体可以选自5,10-二甲基吩嗪(DMPZ)、1,5-萘二胺(NDA)、4,N,N-三甲基苯胺(TMA)和1-苯基吡咯烷(PPD)。
在另一个方面,本发明提供可包括如本文所述的催化剂的锂-空气电池。
还提供可包括锂-空气电池的车辆,所述锂-空气电池包括如本文所述的催化剂。
根据各种示例性实施方式,本发明可提供有效地分解在锂-空气电池放电时所产生的过氧化锂以降低极化程度的催化剂。此外,可以提供可以作为催化剂即可溶性催化剂的化合物。
本发明的效果并不限于上述效果。应当理解,本发明的效果包括所有可以从下面描述中推断出的效果。
本发明的其它方面和优选实施方式在以下进行讨论。
附图说明
现在将详细参照附图所示的本发明的示例性实施方式描述本发明的以上和其它特征,所述附图在下文仅通过示例说明的方式给出,并且因此不是对本发明的限制,并且其中:
图1A示出了用于评估当根据本发明的示例性实施方式的氧化还原介体和电解质混合时示例性氧化还原介体化合物NDA的稳定性的FT-IR(傅里叶变换红外光谱)测量结果;
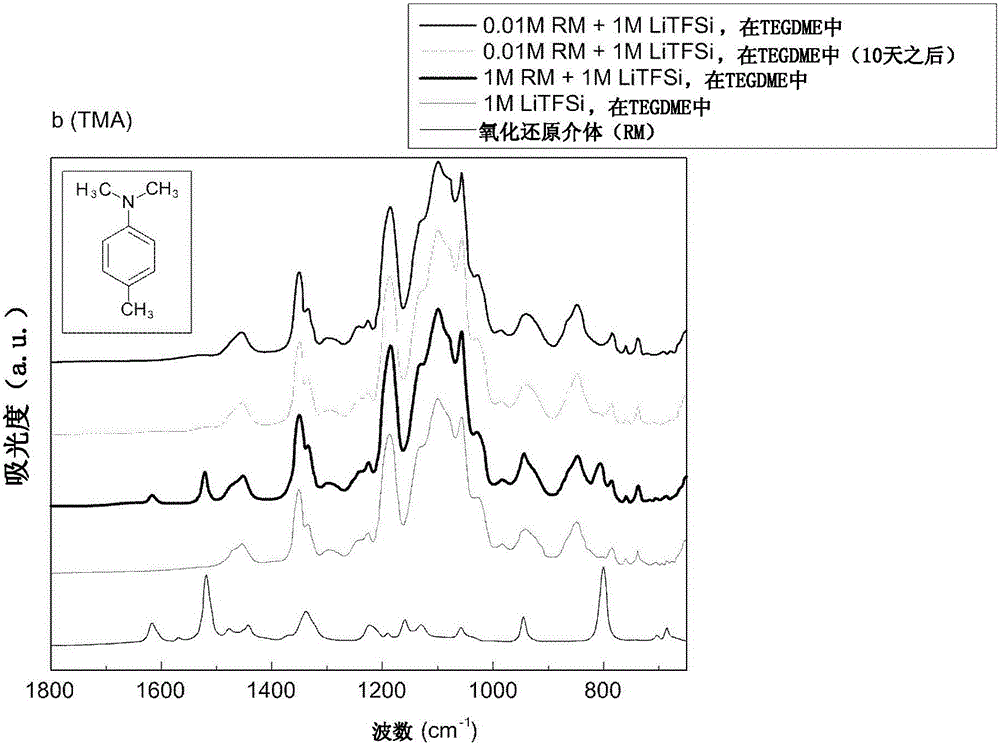
图1B示出了用于评估当根据本发明的示例性实施方式的氧化还原介体和电解质混合时示例性氧化还原介体化合物TMA的稳定性的FT-IR(傅里叶变换红外光谱)测量结果;
图1C示出了用于评估当根据本发明的示例性实施方式的氧化还原介体和电解质混合时示例性氧化还原介体化合物PPD的稳定性的FT-IR(傅里叶变换红外光谱)测量结果;
图1D示出了用于评估当根据本发明的示例性实施方式的氧化还原介体和电解质混合时示例性氧化还原介体化合物NC的稳定性的FT-IR(傅里叶变换红外光谱)测量结果;
图1E示出了用于评估当根据本发明的示例性实施方式的氧化还原介体和电解质混合时示例性氧化还原介体化合物DMPZ的稳定性的FT-IR(傅里叶变换红外光谱)测量结果;
图2示出了应用有根据本发明的示例性实施方式的包括示例性氧化还原介体的示例性可溶性催化剂的示例性单电池的充电和放电的评估结果;
图3示出了当使用三乙二醇二甲醚(TEGDME)作为示例性电解质时,根据本发明的示例性实施方式的示例性氧化还原介体的HOMO/LUMO水平的测量结果;
图4示出了当使用二甲基亚砜(DMSO)作为示例性电解质时,根据本发明的示例性实施方式的示例性氧化还原介体的HOMO/LUMO水平的测量结果;
图5示出了当使用5,10-二甲基吩嗪(DMPZ)作为示例性氧化还原介体时应用有根据本发明的示例性实施方式的包括DMPZ的示例性可溶性催化剂的示例性单电池的XRD(X-射线衍射)分析结果;且
图6示出了根据本发明的示例性实施例的图5的示例性单电池的示例性阴极(空气电极)的SEM(扫描电子显微镜)分析图像。
应当理解,附图未必按比例绘制,而是呈现出说明本发明的基本原理的各种示例性特征的稍微简化的表示。如本文所公开的本发明的特定设计特征,包括例如,特定尺寸、取向、位置和形状将部分地通过具体的预期应用和使用环境确定。在附图中,附图标记在贯穿附图的若干图中是指本发明的相同或等同部分。
具体实施方式
下面将详细地参照本发明的各个实施方式,其实施例图示在附图中,并在下文加以说明。尽管本发明将结合示例性实施方式进行描述,但应当理解,本说明书无意于将本发明局限于这些示例性实施方式。相反,本发明不仅要涵盖这些示例性实施方式,还要涵盖各种替换方式、变化方式、等同方式和其它实施方式,其均可以包括在所附权利要求限定的本发明的精神和范围之内。
如果判断公知构造或其功能的描述使本发明的要点不清楚,那么所述描述可以被省略。
本文使用的术语仅仅是为了说明具体实施方式的目的而不是意在限制本发明。如本文所使用的,单数形式“一个、一种”和“该”也意在包括复数形式,除非上下文中清楚指明。还可以理解的是,在说明书中使用的术语“包括”和/或“包含”是指存在所述特征、整数、步骤、操作、元件和/或部件,但是不排除存在或添加一个或多个其它特征、整数、步骤、操作、元件、部件和/或其群组。如本文所使用的,术语“和/或”包括一个或多个相关所列项目的任何和所有组合。
除非特别说明或从上下文明显得到,否则本文所用的术语“约”理解为在本领域的正常容许范围内,例如在均值的2个标准偏差内。“约”可以理解为在所述数值的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%或0.01%内。除非另外从上下文清楚得到,本文提供的所有数值都由术语“约”修饰。
应理解,本文使用的术语“车辆”或“车辆的”或其它类似术语包括通常的机动车,例如,包括多功能运动车(SUV)、公共汽车、卡车、各种商务车的客车,包括各种船只和船舶的水运工具,飞行器等等,并且包括混合动力车、电动车、插入式混合动力电动车、氢动力车和其它代用燃料车(例如,来源于石油以外的资源的燃料)。如本文所提到的,混合动力车是具有两种或多种动力源的车辆,例如,具有汽油动力和电动力的车辆。
锂-空气电池是使用锂作为阳极并且使用空气的氧作为阴极(空气电极)的活性材料的电池系统。在阳极处,发生锂的氧化和还原反应,并在阴极处,发生从外界流入的氧的还原和氧化反应。
以下化学式1和化学式2表示在锂-空气电池放电时在阳极和阴极处发生的反应。
[化学式1]
(阳极):Li→Li++e-
[化学式2]
(阴极):2Li++O2+2e-→Li2O2
阳极的锂金属被氧化以产生锂离子和电子。锂离子通过电解质移动,并且电子通过外部导线或者集电器移动到阴极。由于阴极是多孔的,所以外部空气可以流入到阴极中。外部空气中包括的氧在阴极处被电子还原,并且形成Li2O2。
充电反应的过程与上述反应相反。换句话说,如在以下化学式3中,Li2O2在阴极处分解以产生锂离子和电子。
[化学式3]
(阴极)Li2O2→2Li++O2+2e-
当Li2O2不适当分解时,可发生由于上述高极化现象造成的能量效率的降低问题。
在一个方面,根据本发明的用于锂-空气电池的可溶性催化剂(在下文中,称为“可溶性催化剂”)可通过促进化学式3的反应而有效地分解Li2O2。因而,可以增加电池的能量效率并且可以增加其寿命。
可溶性催化剂可通过氧化还原介体(RM)促进化学式3的反应。
氧化还原介体的机理将在下面简要描述。
[化学式4]
1.2RM→2RM++2e-
2.Li2O2+2RM+→2Li++O2+2RM
当锂-空气电池进行充电时,氧化还原介体可以首先被氧化。因为处于氧化态的氧化还原介体(2RM+)溶解在电解质中,所以氧化还原介体可更容易地接触到Li2O2。然后,处于氧化态的氧化还原介体可从Li2O2带来电子。结果,Li2O2可以高效地分解为2Li+和O2,并且处于氧化态的氧化还原介体可以被还原以返回到初始状态。
为了顺利运行上述机理,或者可选择地,为了促进Li2O2的分解,氧化还原介体可需要化学分解Li2O2。因此,氧化还原介体的氧化电位(或氧化电压)需要大于Li2O2的平衡电位。由于Li2O2的电化学分解的高过电位(例如,大于约1.5V),所以氧化还原介体可以在Li2O2之前被氧化。
然而,当该氧化电位与Li2O2的平衡电位之间的差值大大增加时,充电和放电效率(放电电压/充电电压)可能劣化,因为施加到电池的电压增加。因此,氧化还原介体的氧化电位需要大于Li2O2的平衡电位,并且优选地,氧化还原介体的氧化电位可以在预定的范围内接近于Li2O2的平衡电位。
特别地,因为Li2O2的平衡电位为约2.96V,所以氧化还原介体的氧化电位可以在约3.0V至4.0V的范围内。
上述条件可以通过电离能来描述,因为当氧化还原介体被氧化时,或换句话说,当氧化还原介体失去电子时,可开始化学式4的机理。
在相关技术中,诸如四硫富瓦烯(TTF)、二茂铁和四甲基对苯二胺(TMPD)的材料已被建议作为氧化还原介体。例如,这些化合物在真空下的电离能可以分别为6.8eV、6.7eV和6.7eV,并且当电离能为5.5eV至7.5eV时,氧化还原介体可起可溶性催化剂的作用。
因而,本发明人已经使用各种有机化合物作为氧化还原介体来制造锂-空气电池,所述有机化合物具有约3.0V至4.0V的氧化电位或具有在真空下约5.5eV至7.5eV的电离能。
结果,本发明可提供有效地分解在锂-空气电池放电时所产生的过氧化锂以降低极化程度的可溶性催化剂。此外,可以提供可以作为可溶性催化剂的化合物。
实施例
以下实施例示例说明本发明而并非旨在限制本发明。
所选的有机化合物可包括5,10-二甲基吩嗪(在下文中,称为DMPZ)、1,5-萘二胺(在下文中称为NDA)、4,N,N-三甲基苯胺(在下文中称为TMA)、1-苯基吡咯烷(在下文中简称为PPD)和并四苯(在下文中称为NC),并且其物理性质在以下表1中描述。
表1
*实际计算值
锂-空气单电池的制造
通过在镍网(Ni网)上施加科琴黑和聚四氟乙烯(PTFE)的混合物来制造阴极(空气电极)。使用锂金属作为阳极。
通过顺序地层压锂金属(阳极)、隔板和阴极来制造单电池。使用1M的LiTFSI-TEGDME(在四乙二醇二甲醚中的锂双(三氟甲烷)磺酰胺)作为电解质。
氧化还原介体的稳定性的评估
如本文所用的包括氧化还原介体的可溶性催化剂可以溶解在电解质中以被引入到单电池中。因此,氧化还原介体可以溶解在电解质中。另外,氧化还原介体可不需要与电解质反应,因为在其中较为稳定。
因而,在将NDA、TMA、PPD、NC和DMPZ与电解质以预定浓度混合之后,通过FT-IR(傅里叶变换红外光谱)评估稳定性。结果在图1A-1E中示出。
如图1A-1E中所示,当将氧化还原介体与电解质混合时,NDA(图1A)、TMA(图1B)、PPD(图1C)、NC(图1D)和DMPZ(图1E)的峰消失,这表明所有的NDA、TMA、PPD、NC和DMPZ都溶解在电解质中。此外,在10天之后峰未显示改变,这表明NDA、TMA、PPD、NC和DMPZ不与电解质反应而是稳定地存在。
锂-空气单电池的充电和放电的评估
将单电池放电至1mAh的有限电容,并且然后通过施加0.2mA/cm2的预定电流进行充电。充电电压和放电电压属于2.0V至4.5V的范围。调整单电池的内部以连续供给高纯度氧。
根据充电和放电的评估的结果在图2中示出。
其中未将包括氧化还原介体的可溶性催化剂添加到电解质中的单电池是参照。各个图显示出将包括NDA、TMA、PPD、NC和DMPZ的可溶性催化剂添加到电解质中的单电池的充电和放电的评价结果。
如图2所示,在参照的情况下,强烈发生极化,并且因此观察到约1.5V的高过充电现象。
另一方面,可以看出,在包括可溶性催化剂的单电池的情况下,上述过充电现象大大减少。如此,当对单电池进行充电时,可溶性催化剂中包括的NDA、TMA、PPD和DMPZ可促进Li2O2的分解反应。特别地,包括DMPZ的单电池最有效地减少极化现象。
然而,当单电池包括NC时,放电性能不稳定。当单电池在高纯度氧的气氛下放电并且NC对光和空气不稳定时,可能发生副反应。因此,NC可能最不适合于用作氧化还原介体。
氧化还原介体的HOMO/LUMO水平的测量
如图2所示,DMPZ可最有效地分解Li2O2。如上所述,Li2O2的分解反应的促进程度(例如,催化剂的活性)可以基于所使用的氧化还原介体的类型而改变。
为了鉴于电离能示出上述情形,测量在电解质中NDA、TMA、PPD、NC和DMPZ的HOMO(最高占据分子轨道)/LUMO(最低未占分子轨道)水平,并且结果在图3和图4中示出。
图3示出了当使用三乙二醇二甲醚(TEGDME)作为电解质时的结果,图4示出了当使用二甲基亚砜(DMSO)作为电解质时的结果。
图3和图4的Li2O2的能级表示Li2O2的形成能。Li2O2的形成能指示如化学式2所示(2Li++O2+2e-→Li2O2)的阴极处的反应的标准产生能(在标准条件下,在约25℃的温度并且在约1atm的压力下)。
因此,如图3和图4所示,所有在初始状态(RM)下的NDA、TMA、PPD、NC和DMPZ的HOMO水平小于Li2O2的形成能。
在初始状态(RM)下氧化还原介体的HOMO水平可以被认为是在电解质的存在下氧化还原介体的原始电离能。因而,当HOMO水平小于Li2O2的形成能时,氧化还原介体可化学分解Li2O2。由于Li2O2的电化学分解的高过电位(例如,大于约1.5V),所以氧化还原介体可以在Li2O2之前被氧化。如上所述,为了促进Li2O2的分解反应,氧化还原介体的氧化应领先并且化学分解Li2O2(参照化学式4)。
因此,为了使氧化还原介体行使其功能,在初始状态(RM)下的HOMO水平应小于Li2O2的形成能。
然而,由于充电电压在实际单电池中随着HOMO水平的降低而增加,所以当HOMO水平相当低时,充电和放电效率(放电电压/充电电压)可能降低。因此,可以选择电离能(在电解质中的初级电离能和在初始状态下的HOMO水平)可以在约4.5V至6.0V,或特别是在约4.5V至5.0V的范围内的氧化还原介体。
此外,如图3和图4所示,处于氧化形式(RM+)的TMA和PPD的HOMO水平小于电解质(TEGDME和DMSO)的HOMO水平。
因而,TMA和PPD的氧化形式(RM+)可从电解质而不是Li2O2带来或吸引电子。为了分解Li2O2,RM+应该与Li2O2接触以从Li2O2带来电子,如化学式4所示。然而,由于处于氧化形式(RM+)的TMA和PPD的HOMO水平小于电解质的HOMO水平,所以TMA和PPD可以不从Li2O2带来或吸引电子,而从电解质带来电子,从而被还原然后返回到初始状态(RM)。
因此,TMA和PPD作为氧化还原介体的效率可能不足。结果,处于氧化状态(RM+)的氧化还原介体的HOMO水平应高于电解质的HOMO水平。
氧化还原介体的选择和对Li2O2的实际分解的观察
下面将描述根据本发明的各种示例性实施方式的氧化还原介体。
1)根据本发明的各种示例性实施方式的氧化还原介体可具有在真空下可以为约5.5eV至7.5eV的电离能或具有可以为约3.0V至4.0V的氧化电位。
2)根据本发明的各种示例性实施方式的氧化还原介体可以很好地溶解在电解质中而不与电解质反应。
3)根据本发明的各种示例性实施方式的氧化还原介体在初始状态(RM)下的HOMO水平可以小于Li2O2的形成能,但最大地接近于形成能。
4)根据本发明的各种示例性实施方式的氧化还原介体在初始状态(RM+)下的HOMO水平可以大于电解质的HOMO水平。
如以上所讨论,在NDA、TMA、PPD、NC和DMPZ中,可较少地使用NC作为氧化还原介体,因为NC对光和氧较不稳定并且在放电期间可能发生副反应。另外,如上所述,由于TMA和PPD在氧化状态(RM+)下的HOMO水平低于电解质的HOMO水平,所以催化剂的效率可能不足。如图3和图4所示,由于NDA在初始状态(RM)下的HOMO水平较低,所以存在如下担心,即增加单电池的充电电压,这可导致充电和放电效率的降低。
结果,包括DMPZ作为氧化还原介体的可溶性催化剂可以是最高效的,因为包括DMPZ的可溶性催化剂在电解质中较为稳定,不发生副反应,极化和过电压现象可以在很大程度上降低,并且充电和放电效率是足够的。
因此,在制造应用有包括DMPZ作为氧化还原介体的可溶性催化剂的单电池之后,进行X-射线衍射(XRD)分析和扫描电子显微镜(SEM)分析。结果在图5和图6中示出。如图5所示,当单电池充电和放电时,Li2O2分解并形成。
比较在首先制备单电池时的图(如所制备的)和在单电池放电之后的图(放电),可以确认,在放电期间Li2O2的峰出现并且形成Li2O2。
比较在单电池放电之后的图(放电)和在单电池被再充电时的图(再充电),可以确认,在充电期间Li2O2的峰消失并且Li2O2完全分解。
如图6所示,可以更清楚地确认Li2O2的分解和形成。可以看出,在锂-空气电池放电时,在阴极(空气电极)的表面(A)上形成环形Li2O2。此外,当单电池完全放电并且然后再充电时(B),Li2O2完全分解并且因此没有再发现Li2O2。
如上所述,本发明提供了用作新型可溶性催化剂的化合物。特别地,本发明的可溶性催化剂可以有效地分解在锂-空气电池放电时所产生的Li2O2,由此降低极化并且增加充放电效率和寿命。另外,本发明通过发现和建议用于用作锂-空气电池的可溶性催化剂的条件而有助于后续研究。
本发明已经参照其各种示例性实施方式进行了详细描述。然而,本领域的技术人员应该理解,在不脱离本发明原理和精神的前提下,可以对这些示例性实施方式进行修改,本发明的范围在所附权利要求及其等同物中限定。
- 还没有人留言评论。精彩留言会获得点赞!