一种基于行波介电泳的细胞与颗粒分离芯片及其制备方法与应用与流程
本发明涉及微流控芯片及其制备方法与应用。
背景技术:
微流控芯片(microfludic chip)近年来在各个领域中获得了越来越多的关注,比如,化学分析、单细胞分析、医疗诊断和组织工程等领域。它的巨大优势在于简单快速的加工过程,缩短了分析时间,检测小容量样品的高灵敏度以及可实现多功能集成化等。而基于微流控芯片对生物颗粒或者细胞进行操纵和分离,在生物医疗、临床诊断、食物细菌检测以及环境监测等领域具有重要的影响,因而得到了众多学者的研究。
基于微流控进行颗粒或者细胞分离的方法通常包括光学、磁场、声场以及电场方法,而在电场方法中,介电泳(Dielectrophoresis,DEP)的方法被广泛应用于微纳米颗粒或者细胞的操纵。介电泳是指,基于颗粒和溶液的不同特性,颗粒在非均匀电场下的运动。介电泳具有众多优势,可基于细胞或者颗粒的介电特性以及尺寸,实现无标记的检测,易操作以及高精准度等。然而传统的介电泳(conventional DEP,cDEP)分离方法需要泵送流体运输颗粒或者细胞,因而需要消耗大量的样品或者细胞。
技术实现要素:
本发明要解决传统的介电泳对生物颗粒或者细胞分离需要泵送流体运输颗粒或者细胞,因而需要消耗大量的样品或者细胞的问题,而提供一种基于行波介电泳的细胞与颗粒分离芯片及其制备方法与应用。
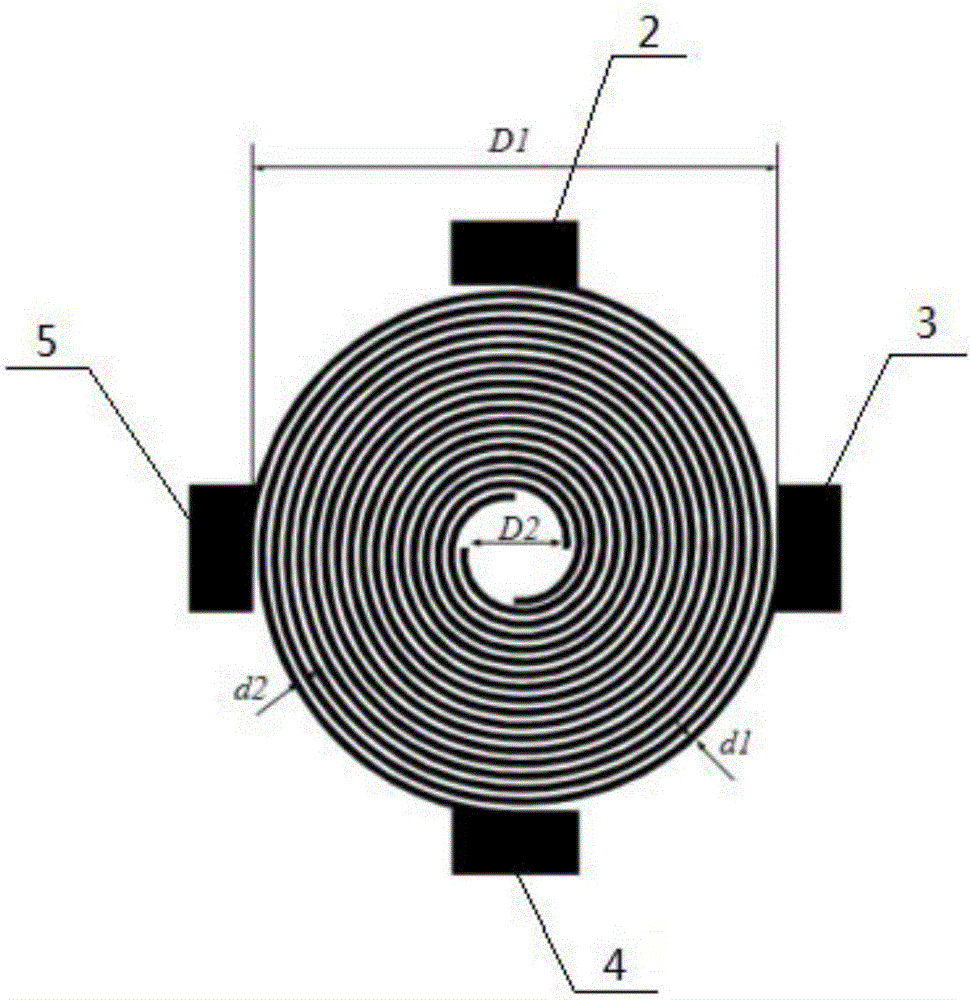
本发明的一种基于行波介电泳的细胞与颗粒分离芯片,基于行波介电泳的细胞与颗粒分离芯片由ITO玻璃基底和PDMS盖片组成;
所述的ITO玻璃基底的中心位置设有一个中心螺旋电极,在中心螺旋电极的后面设置激发电极a,在中心螺旋电极的左面设置激发电极b,在中心螺旋电极的前面设置激发电极c,在中心螺旋电极的右面设置激发电极d;
所述的中心螺旋电极、激发电极a、激发电极b、激发电极c及激发电极d由ITO玻璃基底表面的ITO导电膜腐蚀后留存得到;所述的中心螺旋电极、激发电极a、激发电极b、激发电极c及激发电极d的厚度均为200nm;
中心螺旋电极由四个极板螺旋卷绕组成,四个极板的起点分别与激发电极a、激发电极b、激发电极c及激发电极d的一端相连接,且每个极板的终点与起点的位置顺时针相差90°;所述的与激发电极a和激发电极c相连接的极板起点之间的距离为D1,所述的与激发电极b和激发电极d相连接的极板起点之间的距离为D1,D1=830μm;所述的与激发电极a和激发电极c相连接的极板终点之间的距离为D2,所述的与激发电极b和激发电极d相连接的极板终点之间的距离为D2,D2=148μm;所述的中心螺旋电极中极板之间的间隙d2为100μm,且极板的宽度d1为100μm;
所述的PDMS盖片的下表面设有粒子流道,粒子流道的中心位置设有方形中心空腔,粒子流道的一端设有圆形入口腔,在圆形入口腔的中心设有贯穿PDMS盖片的流道入口,粒子流道的另一端设有圆形出口腔,在圆形出口腔的中心设有贯穿PDMS盖片的流道出口;所述的方形中心空腔的边长为1200μm;
所述的粒子流道深500μm;所述的方形中心空腔深500μm;所述的圆形入口腔深500μm;所述的圆形出口腔深500μm;
ITO玻璃基底设有电极的一侧和PDMS盖片下表面相对密封,且中心螺旋电极置于方形中心空腔的中心位置,方形中心空腔范围把激发电极a、激发电极b、激发电极c及激发电极d的内端部包容在内。
本发明的一种基于行波介电泳的细胞与颗粒分离芯片的制备方法,是按以下步骤进行的:
一、PDMS流道加工:
①、流道结构的完整模子的制备:通过激光切割加工出PMMA流道模子,利用双面胶将PMMA流道模子粘贴在清洗干净的玻璃片基底上,得到流道结构模子;所述的PMMA流道模子的厚度为500μm;
②、硅烷化处理剂的配置:将PDMS与固化剂混合,搅拌均匀,然后置于真空泵中抽真空30min,得到硅烷化处理剂;
所述的PDMS与固化剂的质量比为10:1;
③、浇筑PDMS:用锡箔纸将流道结构模子包覆成一个方形开口槽,且流道一侧朝上放置,然后把锡箔纸包好的流道结构模子放置在真空泵中,将硅烷化处理剂注入锡箔纸包好的流道结构模子,抽真空2min~3min,静置10min~15min,再在硅烷处理后的流道结构模子上浇筑PDMS,抽真空20min,至无气泡后,置于温度为80℃下加热2h,固化;
④、PDMS流道处理:将固化后的PDMS从流道结构模子上揭下,并用刀片将其切割成规则的形状,然后用打孔器打好流道入口及流道出口,得到PDMS盖片;
二、电极的加工:
①、清洗ITO玻璃:首先将ITO玻璃依次置于丙酮和异丙醇中超声清洗5min~15min,再用等离子水冲洗,氮气吹干,然后将氮气吹干后的ITO玻璃置于温度为80℃~120℃下加热15min~30min,得到预处理后的ITO玻璃;
②、甩胶:在转速为3100r/s的条件下,利用甩胶机及光刻胶AZ4620对预处理后的ITO玻璃进行甩胶40s,然后在温度为100℃的条件下,加热6min,得到甩胶后的ITO玻璃;
③、曝光:将经AutoCAD软件辅助设计并打印好的ITO掩膜贴在甩胶后的ITO玻璃上,在紫外灯下曝光,得到曝光后的ITO玻璃;
④、显影:利用光刻胶AZ4620专用显影液对曝光后的ITO玻璃进行显影,显影时间为4min~5min,得到显影后的ITO玻璃;
⑤、腐蚀:将显影后的ITO玻璃置于质量百分数为60%的盐酸溶液与氯化铁催化剂的混合液中,浸泡40min,得到腐蚀后的ITO玻璃;
所述的质量百分数为60%的盐酸溶液的体积与氯化铁催化剂的质量比为1mL:(10~50)mg;
⑥、去除光刻胶:将腐蚀后的ITO玻璃置于质量百分数为5%的NaOH溶液中浸泡,去除光刻胶,得到ITO玻璃基底;
三、芯片的制备:
将ITO玻璃基底设有电极的一侧和PDMS盖片设有流道的一侧朝上,并列置于等离子机的腔室内,在腔室压力为700毫托及等离子发生器功率为20W的条件下,曝光32s,然后再在显微镜下,将ITO玻璃基底设有电极的一侧和PDMS盖片设有流道的一侧相对放置,且中心螺旋电极置于方形中心空腔的中心位置,方形中心空腔范围把激发电极a、激发电极b、激发电极c及激发电极d的内端部包容在内,按压3min~10min,将按压后的芯片置于温度为80℃下加热30min,得到基于行波介电泳的细胞与颗粒分离芯片。
本发明的一种基于行波介电泳的细胞与颗粒分离芯片的应用,芯片用于细胞与颗粒分离,具体是按以下步骤进行的:
一、颗粒准备:
①、缓冲液的配制:向去离子水中加入氯化钾,得到电导率为1mS/m的缓冲液II,然后将电导率为1mS/m的缓冲液II与PS微球混合,得到浓度为1000个/μL的PS微球溶液,将电导率为1mS/m的缓冲液II与酵母菌混合,得到浓度为1000个/μL的酵母菌溶液,将浓度为1000个/μL的PS微球溶液和浓度为1000个/μL的酵母菌溶液混合,得到实验溶液C;
所述的浓度为1000个/μL的PS微球溶液与浓度为1000个/μL的酵母菌溶液的体积比为1:1;
②、将无水乙醇与吐温溶液混合,得到A溶液,再将A溶液与实验溶液C混合,得到D溶液;
所述的无水乙醇与吐温溶液的体积比为9:1;所述的A溶液与实验溶液C的体积比为1:99;
二、细胞与颗粒分离:
①、打开与显微镜相连接的计算机、信号发生器、信号放大器、示波器、显微镜、CCD以及荧光灯开关,观察设备运转是否正常,然后打开Q-Capture Pro图像采集软件,实时观察显微镜载物台;
②、将基于行波介电泳的细胞与颗粒分离芯片固定在显微镜载物台上,调好芯片位置和焦距,在流道出口处滴入缓冲液II,至基于行波介电泳的细胞与颗粒分离芯片的流道润湿,然后将500μL的微量进样器固定在注射泵上,微量进样器吸入300μL D溶液,再将连接微量进样器的金属连接器插入流道入口,密封;
③、连接好基于行波介电泳的细胞与颗粒分离芯片的电极和信号放大器之间的导线,激发电极a施加电信号为Acos(ωt)的行波电场、激发电极d施加电信号为Acos(ωt+π/2)的行波电场,激发电极c施加电信号为Acos(ωt+π)的行波电场,激发电极b施加电信号为Acos(ωt+3π/2)的行波电场,施加的电信号频率范围为100KHz~800KHz,施加的电压范围为8Vpp~15Vpp;
④、启动注射泵,让D溶液以100微米/s~200微米/s的流速流入,当流道内D溶液灌满整个流道时,停止泵送,按下信号发生器上的施加信号按钮;
⑤、再次调整好焦距和基于行波介电泳的细胞与颗粒分离芯片的位置,直至PS微球和酵母菌清晰,进行视频的检测和录制;
⑥、重步骤二③~⑤步,不断调整电压、频率和流速,观察现象并记录;
⑦、数据的处理和分析。
本发明基于螺旋电极设计了一个简单、易于加工细胞和颗粒分离的微流控芯片。该微流控芯片通过调整传统介电泳力和行波介电泳力可以在静止的非常少量的样品中实现对PS微球和酵母菌的操纵与分离。
该简单细胞与颗粒分离芯片的中心螺旋电极,用于产生行波电场。当施加行波电场后,作用于颗粒上的时均介电泳力为公式1。可以看出介电泳力主要依赖于电场的非均匀性和Clausius-Mossotti因子(公式2)。公式1的第一项为传统介电泳力,当Re[K(w)]为正或者负时,颗粒将受正或者负介电泳力,从而使得颗粒被吸引或者远离强电场区域。公式1的第二项为行波介电泳(twDEP),当Im[K(w)]为正或者负时,颗粒将沿着电场相位增大或者减小方向移动:
其中,和为颗粒和溶液的复介电常数,ε为介电常数,σ为电导率,r为颗粒半径,E为电场强度,*为共轭复数,波浪线为复振幅,Im[K(w)]和Re[K(w)]分别为CM因子的虚部和实部。
本发明的有益效果是:1、利用传统介电泳和行波介电泳(正介电泳和负介电泳),在螺旋电极上,对静止的少容量的样品中的颗粒进行了操纵和分离,成功分离出酵母菌和PS微球。
2、通过Comsol仿真得到较好的酵母菌和PS微球的分离参数(频率,电导率等),与实验具有很好的一致性。
3、该芯片加工简单,易于操作。
附图说明
图1为本发明一种基于行波介电泳的细胞与颗粒分离芯片的俯视图;
图2为中心螺旋电极的结构示意图;
图3为基于行波介电泳的细胞与颗粒分离芯片分离酵母菌和PS微球时Clausisus-Mossotti因子随频率的变化关系图;1为酵母菌所对应的Re[K(w)];2为酵母菌所对应的Im[K(w)];3为PS微球所对应的Im[K(w)];4为PS微球所对应的Re[K(w)];
图4为激发信号之前,实施例一基于行波介电泳的细胞与颗粒分离芯片中电极表面酵母菌与PS微球混合的初始状态图;1为酵母菌,2为PS微球;
图5为施加电压3min时,实施例一基于行波介电泳的细胞与颗粒分离芯片中电极表面酵母菌与PS微球分离图;1为酵母菌,2为PS微球;
图6为施加电压3min时,实施例一基于行波介电泳的细胞与颗粒分离芯片中80微米高度处PS微球分离图;2为PS微球;
图7为施加电压5min时,实施例一基于行波介电泳的细胞与颗粒分离芯片中电极表面酵母菌与PS微球分离图。
具体实施方案
具体实施方案一:结合图1及2具体说明本实施方式,本实施方式是一种基于行波介电泳的细胞与颗粒分离芯片,基于行波介电泳的细胞与颗粒分离芯片由ITO玻璃基底1和PDMS盖片6组成;
所述的ITO玻璃基底1的中心位置设有一个中心螺旋电极10,在中心螺旋电极10的后面设置激发电极a2,在中心螺旋电极10的左面设置激发电极b5,在中心螺旋电极10的前面设置激发电极c4,在中心螺旋电极10的右面设置激发电极d3;
所述的中心螺旋电极10、激发电极a2、激发电极b5、激发电极c4及激发电极d3由ITO玻璃基底1表面的ITO导电膜腐蚀后留存得到;所述的中心螺旋电极10、激发电极a2、激发电极b5、激发电极c4及激发电极d3的厚度均为200nm;
中心螺旋电极10由四个极板螺旋卷绕组成,四个极板的起点分别与激发电极a2、激发电极b5、激发电极c4及激发电极d3的一端相连接,且每个极板的终点与起点的位置顺时针相差90°;所述的与激发电极a2和激发电极c4相连接的极板起点之间的距离为D1,所述的与激发电极b5和激发电极d3相连接的极板起点之间的距离为D1,D1=830μm;所述的与激发电极a2和激发电极c4相连接的极板终点之间的距离为D2,所述的与激发电极b5和激发电极d3相连接的极板终点之间的距离为D2,D2=148μm;所述的中心螺旋电极10中极板之间的间隙d2为100μm,且极板的宽度d1为100μm;
所述的PDMS盖片6的下表面设有粒子流道11,粒子流道11的中心位置设有方形中心空腔12,粒子流道11的一端设有圆形入口腔7,在圆形入口腔7的中心设有贯穿PDMS盖片6的流道入口8,粒子流道11的另一端设有圆形出口腔13,在圆形出口腔13的中心设有贯穿PDMS盖片6的流道出口9;所述的方形中心空腔12的边长为1200μm;
所述的粒子流道11深500μm;所述的方形中心空腔12深500μm;所述的圆形入口腔7深500μm;所述的圆形出口腔13深500μm;
ITO玻璃基底1设有电极的一侧和PDMS盖片6下表面相对密封,且中心螺旋电极10置于方形中心空腔12的中心位置,方形中心空腔12范围把激发电极a2、激发电极b5、激发电极c4及激发电极d3的内端部包容在内。
本实施方式的有益效果是:1、利用传统介电泳和行波介电泳(正介电泳和负介电泳),在螺旋电极上,对静止的少容量的样品中的颗粒进行了操纵和分离,成功分离出酵母菌和PS微球。
2、通过Comsol仿真得到较好的酵母菌和PS微球的分离参数(频率,电导率等),与实验具有很好的一致性。
3、该芯片加工简单,易于操作。
具体实施方式二:本实施方式与具体实施方式一的不同点是:所述的PDMS盖片6的厚度为5mm~7mm。其它与具体实施方式一相同。
具体实施方式三:本实施方式与具体实施方式一或二之一的不同点是:所述的PDMS盖片6的厚度为5mm。其它与具体实施方式一或二相同。
具体实施方式四:本实施方式所述的一种基于行波介电泳的细胞与颗粒分离芯片的制备方法,具体是按照以下步骤进行的:
一、PDMS流道加工:
①、流道结构的完整模子的制备:通过激光切割加工出PMMA流道模子,利用双面胶将PMMA流道模子粘贴在清洗干净的玻璃片基底上,得到流道结构模子;所述的PMMA流道模子的厚度为500μm;
②、硅烷化处理剂的配置:将PDMS与固化剂混合,搅拌均匀,然后置于真空泵中抽真空30min,得到硅烷化处理剂;
所述的PDMS与固化剂的质量比为10:1;
③、浇筑PDMS:用锡箔纸将流道结构模子包覆成一个方形开口槽,且流道一侧朝上放置,然后把锡箔纸包好的流道结构模子放置在真空泵中,将硅烷化处理剂注入锡箔纸包好的流道结构模子,抽真空2min~3min,静置10min~15min,再在硅烷处理后的流道结构模子上浇筑PDMS,抽真空20min,至无气泡后,置于温度为80℃下加热2h,固化;
④、PDMS流道处理:将固化后的PDMS从流道结构模子上揭下,并用刀片将其切割成规则的形状,然后用打孔器打好流道入口8及流道出口9,得到PDMS盖片6;
二、电极的加工:
①、清洗ITO玻璃:首先将ITO玻璃依次置于丙酮和异丙醇中超声清洗5min~15min,再用等离子水冲洗,氮气吹干,然后将氮气吹干后的ITO玻璃置于温度为80℃~120℃下加热15min~30min,得到预处理后的ITO玻璃;
②、甩胶:在转速为3100r/s的条件下,利用甩胶机及光刻胶AZ4620对预处理后的ITO玻璃进行甩胶40s,然后在温度为100℃的条件下,加热6min,得到甩胶后的ITO玻璃;
③、曝光:将经AutoCAD软件辅助设计并打印好的ITO掩膜贴在甩胶后的ITO玻璃上,在紫外灯下曝光,得到曝光后的ITO玻璃;
④、显影:利用光刻胶AZ4620专用显影液对曝光后的ITO玻璃进行显影,显影时间为4min~5min,得到显影后的ITO玻璃;
⑤、腐蚀:将显影后的ITO玻璃置于质量百分数为60%的盐酸溶液与氯化铁催化剂的混合液中,浸泡40min,得到腐蚀后的ITO玻璃;
所述的质量百分数为60%的盐酸溶液的体积与氯化铁催化剂的质量比为1mL:(10~50)mg;
⑥、去除光刻胶:将腐蚀后的ITO玻璃置于质量百分数为5%的NaOH溶液中浸泡,去除光刻胶,得到ITO玻璃基底1;
三、芯片的制备:
将ITO玻璃基底1设有电极的一侧和PDMS盖片6设有流道的一侧朝上,并列置于等离子机的腔室内,在腔室压力为700毫托及等离子发生器功率为20W的条件下,曝光32s,然后再在显微镜下,将ITO玻璃基底1设有电极的一侧和PDMS盖片6设有流道的一侧相对放置,且中心螺旋电极10置于方形中心空腔12的中心位置,方形中心空腔12范围把激发电极a2、激发电极b5、激发电极c4及激发电极d3的内端部包容在内,按压3min~10min,将按压后的芯片置于温度为80℃下加热30min,得到基于行波介电泳的细胞与颗粒分离芯片。
本具体实施方式步骤一③中硅烷处理后的流道结构模子,使流道结构模子表面沉积一层硅烷,有助于PDMS与流道结构模子不粘连,容易将PDMS流道从模子上脱离。
本具体实施方式步骤二②中利用甩胶机及光刻胶AZ4620对预处理后的ITO玻璃进行甩胶40s,由于此处的光刻胶只用来保护ITO层不被腐蚀,因而在本具体实施方式中采用的是安智光刻胶AZ4620。
本具体实施方式步骤二⑤腐蚀过程,固化的光刻胶起保护作用,没有覆盖的ITO层将被腐蚀掉。
本具体实施方式步骤三将加工好的ITO玻璃基底1和PDMS盖片6进行键合,键合是十分关键的一步,键合的好坏直接影响到最后的芯片中流道的密封效果,进而影响到实验结果的可靠性和准确性。键合前,注意保证先将PDMS盖片6上的流道入口8及流道出口9打好孔,一旦键合后,将无法再进行打孔,在显微镜下,进行对准,在对准的过程中需要微调整时,不要用力按压,尽量轻拿轻放,以免键合住无法移动。
具体实施方式五:本实施方式与具体实施方式四不同点是:步骤二⑥中所述的ITO玻璃基底1的中心位置设有一个中心螺旋电极10,在中心螺旋电极10的后面设置激发电极a2,在中心螺旋电极10的左面设置激发电极b5,在中心螺旋电极10的前面设置激发电极c4,在中心螺旋电极10的右面设置激发电极d3;
所述的中心螺旋电极10、激发电极a2、激发电极b5、激发电极c4及激发电极d3由ITO玻璃基底1表面的ITO导电膜腐蚀后留存得到;所述的中心螺旋电极10、激发电极a2、激发电极b5、激发电极c4及激发电极d3的厚度均为200nm;
中心螺旋电极10由四个极板螺旋卷绕组成,四个极板的起点分别与激发电极a2、激发电极b5、激发电极c4及激发电极d3的一端相连接,且每个极板的终点与起点的位置顺时针相差90°;所述的与激发电极a2和激发电极c4相连接的极板起点之间的距离为D1,所述的与激发电极b5和激发电极d3相连接的极板起点之间的距离为D1,D1=830μm;所述的与激发电极a2和激发电极c4相连接的极板终点之间的距离为D2,所述的与激发电极b5和激发电极d3相连接的极板终点之间的距离为D2,D2=148μm;所述的中心螺旋电极10中极板之间的间隙d2为100μm,且极板的宽度d1为100μm。其它与具体实施方式四相同。
具体实施方式六:本实施方式与具体实施方式四或五之一不同点是:步骤一④中所述的PDMS盖片6的下表面设有粒子流道11,粒子流道11的中心位置设有方形中心空腔12,粒子流道11的一端设有圆形入口腔7,在圆形入口腔7的中心设有贯穿PDMS盖片6的流道入口8,粒子流道11的另一端设有圆形出口腔13,在圆形出口腔13的中心设有贯穿PDMS盖片6的流道出口9;所述的PDMS盖片6的厚度为5mm~7mm;所述的方形中心空腔12的边长为1200μm;
所述的粒子流道11深500μm;所述的方形中心空腔12深500μm;所述的圆形入口腔7深500μm;所述的圆形出口腔13深500μm。其它与具体实施方式四或五相同。
具体实施方式七:本实施方式与具体实施方式四至六之一不同点是:步骤一②中所述的PDMS为美国道康宁DC184A组分;步骤一②中所述的固化剂为美国道康宁DC184B组分;步骤一③中所述的PDMS为美国道康宁DC184A组分。其它与具体实施方式四至六相同。
具体实施方式八:本实施方式所述的一种基于行波介电泳的细胞与颗粒分离芯片的应用,芯片用于细胞与颗粒分离,具体是按以下步骤进行的:
一、颗粒准备:
①、缓冲液的配制:向去离子水中加入氯化钾,得到电导率为1mS/m的缓冲液II,然后将电导率为1mS/m的缓冲液II与PS微球混合,得到浓度为1000个/μL的PS微球溶液,将电导率为1mS/m的缓冲液II与酵母菌混合,得到浓度为1000个/μL的酵母菌溶液,将浓度为1000个/μL的PS微球溶液和浓度为1000个/μL的酵母菌溶液混合,得到实验溶液C;
所述的浓度为1000个/μL的PS微球溶液与浓度为1000个/μL的酵母菌溶液的体积比为1:1;
②、将无水乙醇与吐温溶液混合,得到A溶液,再将A溶液与实验溶液C混合,得到D溶液;
所述的无水乙醇与吐温溶液的体积比为9:1;所述的A溶液与实验溶液C的体积比为1:99;
二、细胞与颗粒分离:
①、打开与显微镜相连接的计算机、信号发生器、信号放大器、示波器、显微镜、CCD以及荧光灯开关,观察设备运转是否正常,然后打开Q-Capture Pro图像采集软件,实时观察显微镜载物台;
②、将基于行波介电泳的细胞与颗粒分离芯片固定在显微镜载物台上,调好芯片位置和焦距,在流道出口9处滴入缓冲液II,至基于行波介电泳的细胞与颗粒分离芯片的流道润湿,然后将500μL的微量进样器固定在注射泵上,微量进样器吸入300μL D溶液,再将连接微量进样器的金属连接器插入流道入口8,密封;
③、连接好基于行波介电泳的细胞与颗粒分离芯片的电极和信号放大器之间的导线,激发电极a2施加电信号为Acos(ωt)的行波电场、激发电极d3施加电信号为Acos(ωt+π/2)的行波电场,激发电极c4施加电信号为Acos(ωt+π)的行波电场,激发电极b5施加电信号为Acos(ωt+3π/2)的行波电场,施加的电信号频率范围为100KHz~800KHz,施加的电压范围为8Vpp~15Vpp;
④、启动注射泵,让D溶液以100微米/s~200微米/s的流速流入,当流道内D溶液灌满整个流道时,停止泵送,按下信号发生器上的施加信号按钮;
⑤、再次调整好焦距和基于行波介电泳的细胞与颗粒分离芯片的位置,直至PS微球和酵母菌清晰,进行视频的检测和录制;
⑥、重步骤二③~⑤步,不断调整电压、频率和流速,观察现象并记录;
⑦、数据的处理和分析。
本具体实施方式步骤一②中A溶液作用主要是可以减少粒子在流道或者基底表面粘结。
步骤二②中在流道出口9处滴入缓冲液II,至基于行波介电泳的细胞与颗粒分离芯片的流道润湿,可以保证粒子不沾在通道壁上。
基于Comsol仿真,图3为基于行波介电泳的细胞与颗粒分离芯片分离酵母菌和PS微球时Clausisus-Mossotti因子随频率的变化关系图;1为酵母菌所对应的Re[K(w)];2为酵母菌所对应的Im[K(w)];3为PS微球所对应的Im[K(w)];4为PS微球所对应的Re[K(w)];酵母菌和PS微球的Clausisus-Mossotti因子(实部与虚部)随频率的变化关系,可以看出在频率fw的作用范围内,酵母菌受正介电泳力,PS微球受负介电泳力,同时PS微球将受到行波介电泳力并向相位减小的方向移动即向螺旋阵列内部移动。因此,在频率fw范围内,该芯片可实现较佳的分离效果。
具体实施方式九:本实施方式与具体实施方式八不同点是:步骤一①中所述的PS微球的粒径为4微米~5微米。其它与具体实施方式八相同。
具体实施方式十:本实施方式与具体实施方式八或九之一不同点是:步骤二②所述的金属连接器直径为1mm。其它与具体实施方式八或九相同。
采用下述试验验证本发明效果:
实施例一:
基于行波介电泳的细胞与颗粒分离芯片由ITO玻璃基底1和PDMS盖片6组成;
所述的ITO玻璃基底1的中心位置设有一个中心螺旋电极10,在中心螺旋电极10的后面设置激发电极a2,在中心螺旋电极10的左面设置激发电极b5,在中心螺旋电极10的前面设置激发电极c4,在中心螺旋电极10的右面设置激发电极d3;
所述的中心螺旋电极10、激发电极a2、激发电极b5、激发电极c4及激发电极d3由ITO玻璃基底1表面的ITO导电膜腐蚀后留存得到;所述的中心螺旋电极10、激发电极a2、激发电极b5、激发电极c4及激发电极d3的厚度均为200nm;
中心螺旋电极10由四个极板螺旋卷绕组成,四个极板的起点分别与激发电极a2、激发电极b5、激发电极c4及激发电极d3的一端相连接,且每个极板的终点与起点的位置顺时针相差90°;所述的与激发电极a2和激发电极c4相连接的极板起点之间的距离为D1,所述的与激发电极b5和激发电极d3相连接的极板起点之间的距离为D1,D1=830μm;所述的与激发电极a2和激发电极c4相连接的极板终点之间的距离为D2,所述的与激发电极b5和激发电极d3相连接的极板终点之间的距离为D2,D2=148μm;所述的中心螺旋电极10中极板之间的间隙d2为100μm,且极板的宽度d1为100μm;
所述的PDMS盖片6的下表面设有粒子流道11,粒子流道11的中心位置设有方形中心空腔12,粒子流道11的一端设有圆形入口腔7,在圆形入口腔7的中心设有贯穿PDMS盖片6的流道入口8,粒子流道11的另一端设有圆形出口腔13,在圆形出口腔13的中心设有贯穿PDMS盖片6的流道出口9;所述的方形中心空腔12的边长为1200μm;
所述的粒子流道11深500μm;所述的方形中心空腔12深500μm;所述的圆形入口腔7深500μm;所述的圆形出口腔13深500μm;
ITO玻璃基底1设有电极的一侧和PDMS盖片6下表面相对密封,且中心螺旋电极10置于方形中心空腔12的中心位置,方形中心空腔12范围把激发电极a2、激发电极b5、激发电极c4及激发电极d3的内端部包容在内;
所述的PDMS盖片6的厚度为5mm。
上述一种基于行波介电泳的细胞与颗粒分离芯片的制备方法,是按以下步骤进行的:
一、PDMS流道加工:
①、流道结构的完整模子的制备:通过激光切割加工出PMMA流道模子,利用双面胶将PMMA流道模子粘贴在清洗干净的玻璃片基底上,得到流道结构模子;所述的PMMA流道模子的厚度为500μm;
②、硅烷化处理剂的配置:将PDMS与固化剂混合,搅拌均匀,然后置于真空泵中抽真空30min,得到硅烷化处理剂;
所述的PDMS与固化剂的质量比为10:1;
③、浇筑PDMS:用锡箔纸将流道结构模子包覆成一个方形开口槽,且流道一侧朝上放置,然后把锡箔纸包好的流道结构模子放置在真空泵中,将硅烷化处理剂注入锡箔纸包好的流道结构模子,抽真空2min,静置10min,再在硅烷处理后的流道结构模子上浇筑PDMS,抽真空20min,至无气泡后,置于温度为80℃下加热2h,固化;
④、PDMS流道处理:将固化后的PDMS从流道结构模子上揭下,并用刀片将其切割成规则的形状,然后用打孔器打好流道入口8及流道出口9,得到PDMS盖片6;
二、电极的加工:
①、清洗ITO玻璃:首先将ITO玻璃依次置于丙酮和异丙醇中超声清洗5min,再用等离子水冲洗,氮气吹干,然后将氮气吹干后的ITO玻璃置于温度为80℃下加热15min,得到预处理后的ITO玻璃;
②、甩胶:在转速为3100r/s的条件下,利用甩胶机及光刻胶AZ4620对预处理后的ITO玻璃进行甩胶40s,然后在温度为100℃的条件下,加热6min,得到甩胶后的ITO玻璃;
③、曝光:将经AutoCAD软件辅助设计并打印好的ITO掩膜贴在甩胶后的ITO玻璃上,在紫外灯下曝光,得到曝光后的ITO玻璃;
④、显影:利用光刻胶AZ4620专用显影液对曝光后的ITO玻璃进行显影,显影时间为4min,得到显影后的ITO玻璃;
⑤、腐蚀:将显影后的ITO玻璃置于质量百分数为60%的盐酸溶液与氯化铁催化剂的混合液中,浸泡40min,得到腐蚀后的ITO玻璃;
所述的质量百分数为60%的盐酸溶液的体积与氯化铁催化剂的质量比为1mL:10mg;
⑥、去除光刻胶:将腐蚀后的ITO玻璃置于质量百分数为5%的NaOH溶液中浸泡,去除光刻胶,得到ITO玻璃基底1;
三、芯片的制备:
将ITO玻璃基底1设有电极的一侧和PDMS盖片6设有流道的一侧朝上,并列置于等离子机的腔室内,在腔室压力为700毫托及等离子发生器功率为20W的条件下,曝光32s,然后再在显微镜下,将ITO玻璃基底1设有电极的一侧和PDMS盖片6设有流道的一侧相对放置,且中心螺旋电极10置于方形中心空腔12的中心位置,方形中心空腔12范围把激发电极a2、激发电极b5、激发电极c4及激发电极d3的内端部包容在内,按压3min,将按压后的芯片置于温度为80℃下加热30min,得到基于行波介电泳的细胞与颗粒分离芯片;
步骤一②中所述的PDMS为美国道康宁DC184A组分;步骤一②中所述的固化剂为美国道康宁DC184B组分;步骤一③中所述的PDMS为美国道康宁DC184A组分;
上述一种基于行波介电泳的细胞与颗粒分离芯片的应用,芯片用于细胞与颗粒分离,具体是按以下步骤进行的:
一、颗粒准备:
①、缓冲液的配制:向去离子水中加入氯化钾,得到电导率为1mS/m的缓冲液II,然后将电导率为1mS/m的缓冲液II与PS微球混合,得到浓度为1000个/μL的PS微球溶液,将电导率为1mS/m的缓冲液II与酵母菌混合,得到浓度为1000个/μL的酵母菌溶液,将浓度为1000个/μL的PS微球溶液和浓度为1000个/μL的酵母菌溶液混合,得到实验溶液C;
所述的浓度为1000个/μL的PS微球溶液与浓度为1000个/μL的酵母菌溶液的体积比为1:1;
②、将无水乙醇与吐温溶液混合,得到A溶液,再将A溶液与实验溶液C混合,得到D溶液;
所述的无水乙醇与吐温溶液的体积比为9:1;所述的A溶液与实验溶液C的体积比为1:99;
二、细胞与颗粒分离:
①、打开与显微镜相连接的计算机、信号发生器、信号放大器、示波器、显微镜、CCD以及荧光灯开关,观察设备运转是否正常,然后打开Q-Capture Pro图像采集软件,实时观察显微镜载物台;
②、将基于行波介电泳的细胞与颗粒分离芯片固定在显微镜载物台上,调好芯片位置和焦距,在流道出口9处滴入缓冲液II,至基于行波介电泳的细胞与颗粒分离芯片的流道润湿,然后将500μL的微量进样器固定在注射泵上,微量进样器吸入300μL D溶液,再将连接微量进样器的金属连接器插入流道入口8,密封;
③、连接好基于行波介电泳的细胞与颗粒分离芯片的电极和信号放大器之间的导线,激发电极a2施加电信号为Acos(ωt)的行波电场、激发电极d3施加电信号为Acos(ωt+π/2)的行波电场,激发电极c4施加电信号为Acos(ωt+π)的行波电场,激发电极b5施加电信号为Acos(ωt+3π/2)的行波电场,施加的电信号频率范围为500KHz,施加的电压范围为12Vpp;
④、启动注射泵,让D溶液以200微米/s的流速流入,当流道内D溶液灌满整个流道时,停止泵送,按下信号发生器上的施加信号按钮;
⑤、再次调整好焦距和基于行波介电泳的细胞与颗粒分离芯片的位置,直至PS微球和酵母菌清晰,进行视频的检测和录制;
⑥、重步骤二③~⑤步,不断调整电压、频率和流速,观察现象并记录;
⑦、数据的处理和分析;
步骤一①中所述的PS微球的粒径为5微米;
步骤二②所述的金属连接器直径为1mm。
图3为基于行波介电泳的细胞与颗粒分离芯片分离酵母菌和PS微球时Clausisus-Mossotti因子随频率的变化关系图;1为酵母菌所对应的Re[K(w)];2为酵母菌所对应的Im[K(w)];3为PS微球所对应的Im[K(w)];4为PS微球所对应的Re[K(w)]。
图4为激发信号之前,实施例一基于行波介电泳的细胞与颗粒分离芯片中电极表面酵母菌与PS微球混合的初始状态图;1为酵母菌,2为PS微球;图5为施加电压3min时,实施例一基于行波介电泳的细胞与颗粒分离芯片中电极表面酵母菌与PS微球分离图;1为酵母菌,2为PS微球;图6为施加电压3min时,实施例一基于行波介电泳的细胞与颗粒分离芯片中80微米高度处PS微球分离图;2为PS微球;图7为施加电压5min时,实施例一基于行波介电泳的细胞与颗粒分离芯片中电极表面酵母菌与PS微球分离图。
实验分析:实验开始之前,如图4,混合有酵母菌细胞与PS微球的初始状态,其中比较明亮透明的细胞为酵母菌细胞,稍微呈暗黑色的颗粒为PS微球。随后对激发电极施加旋转电场信号(峰峰值电压12Vpp,频率为500KHz),加电3分钟后,如图3所示,酵母菌受到很强的正介电泳力,被吸引在了电场强度比较强的电极边缘。尽管此时酵母菌还会有受有行波介电泳力,但是由于此时正介电泳力主宰,因而行波介电泳力可以忽略,实验中无法观察到酵母菌沿径向移动,如图5。同时由图3可以看出,PS微球的CM因子实部为负,会受到负介电泳力,PS微球将被排斥到远离电场强度强的区域,实验中可以看出,大部分的PS微球都被排斥在了一定高度(80微米)的溶液中,远离了电极表面,如图6。图3还可以看到PS微球的CM因子虚部为负,PS微球将沿着电场相位减小的方向移动(即向螺旋电极中心移动)。加电五分钟后,如图7所示,大部分的PS微球都被驱动到了螺旋电极的中心位置,而酵母菌细胞则被吸引在了电极边缘位置。通过实验,验证了该结构可以对酵母菌和PS微球的有效分离。
- 还没有人留言评论。精彩留言会获得点赞!