一种用于细胞冷冻的微流控芯片及混合系统的制作方法
本实用新型涉及一种微流控芯片,尤其涉及一种用于细胞冷冻的微流控芯片及混合系统。
背景技术:
随着生物技术的发展以及生物医学、人类辅助生殖和畜牧业保种育种等方面的需求。细胞冻融技术经过60多年的发展,已经成为一项确实可行的细胞及生物组织保存方法。其中人类卵细胞的冷冻保存最受关注,且应用前景最广。中国的不孕不育率由1992年的3%提高到现在的约20%,而解决不孕不育的主要医学途径是试管婴儿。我国2009年共有138家是试管婴儿机构,截止2012年全国共有356家批准开展人类辅助生殖技术机构,17家精子库。虽然短短3年,机构数量增加1倍,但一线城市试管婴儿手术平均需排队半年以上,处于严重供不应求状态。造成这种状态其中的一个主要原因是目前细胞冷冻处理技术效率低。
目前卵子主要来自于:①IVF-ET病人经药物促排卵后获得的多个卵子,当不能进行胚胎冻存时,可冻存多余卵子;②捐卵或年轻妇女要求冻卵者,经药物超促排卵后获取卵子予冻存,但因冻卵成功率极低而不能普遍推广;③对卵巢良性疾病但因各种原因须切除卵巢而又希望日后生育者,可考虑经药物超促排卵后获取卵子予冻存。
常用冷冻保护剂包括渗透性保护剂,如甘油、丙二醇、二甲亚矾等,均为低分子中性物质,在溶液中发生水合作用,使溶液粘性增加和弱化水分子结晶过程。冷冻保护剂还包括非渗透性保护剂,如蔗糖、乙二 醇、白蛋白等,这类物质使溶液呈过冷状态,在特定温度下降低溶质浓度而起保护作用。目前加载保护剂,大多由人手工完成,效率低,一般一个熟悉的操作员一天也只能处理3-5个患者的卵细胞。且人为因素存在着巨大不确定性,自动化对卵细胞进行处理,也就十分必要了。
随着近几年细胞产业的蓬勃发展,以及市场需求的高速增长,传统手工操作的局限性日益凸显,Gabor Vajta就曾多次发表论文认为生殖细胞冻存自动化是未来发展趋势和必要手段。一些行业巨头推出了细胞工厂和冷冻设备,但这些设备的操作过程仍然基于传统手工操作流程,不具备对细胞进行精细操作的可能。
技术实现要素:
针对以上技术问题,本实用新型提供了一种用于细胞冷冻的微流控芯片及混合系统,更好的控制细胞冷冻的前处理过程,解决了人工细胞冷冻前处理操作的不确定性。
对此,本实用新型的技术方案为:
一种用于细胞冷冻的微流控芯片,所述微流控芯片本体包括反应腔、细胞流入流道、反冲流道、细胞混合液流出流道,所述反应腔设有试剂入口,所述细胞流入流道、反冲流道、细胞混合液流出流道分别与反应腔连通。
作为本实用新型的进一步改进,其包括微流控芯片本体,所述微流控芯片本体包括第一试剂流入流道、第二试剂流入流道、试剂混合流道、第三试剂流入流道、细胞流入流道、反冲流道、反应腔、细胞混合液流出流道,所述第一试剂流入流道、第二试剂流入流道分别与试剂混合流道的入口连通,所述试剂混合流道、第三试剂流入流道、细胞流入流道、反冲流道、细胞混合液流出流道分别与反应腔连通,所述反应腔、细胞流入流道、细胞混合液流出流道的内径大于细胞的外径。其中,所述内径为内切圆的直径。进一步的,所述反应腔的内壁为圆弧形。
采用此技术方案,用于细胞冷冻的冷冻液的各个组分分别从第一试剂流入流道、第二试剂流入流道进入到试剂混合流道进行充分混合,然后流入到反应腔中,细胞从细胞流入流道进入反应腔与混合好的试剂进行融合、反应,然后再第三试剂再从第三试剂流入流道中进入反应腔与细胞进行反应,反应完成后,细胞混合液从细胞混合液流出流道中流出;反应过程中多余的试剂从反冲流道流出,当需要将细胞混合液排除时,将多余的试剂从反冲流道进入到反应腔中,将细胞混合液冲出反应腔。
作为本实用新型的进一步改进,所述试剂混合流道为波纹形。采用此技术方案,方便试剂进行充分混合。
作为本实用新型的进一步改进,所述试剂混合流道的出口、第三试剂流入流道的出口、反冲流道的出口的内径均小于细胞的外径。优选的,所述试剂混合流道的出口、第三试剂流入流道的出口、反冲流道的出口的内径均小于150μm。
作为本实用新型的进一步改进,所述用于细胞冷冻的微流控芯片包括储液池,所述储液池与细胞流入流道通过连接管道连接,所述连接管道的内径大于150μm;所述储液池所处的高度高于所述微流控芯片所处的高度。此技术方案,采用的是静压力驱动,使细胞从高液位的储液池流向低液位的微流控芯片通道中。即先将细胞注入到高液位的储液池中,在重力的作用与流体运动作用下,细胞会进入到微流控芯片中。优选的,连接储液池与芯片的连接管道可以为PTFE管、毛细管,内径大于150um即可。
作为本实用新型的进一步改进,细胞还可以采用注射泵致压力进样。优选的,进样方式也可以分为两种水平进样和垂直进样。垂直进样即将细胞通过管道垂直注射进入到芯片中,管道可以为PTFE管、毛细管,内径大于150um即可。水平进样即将细胞通过管道水平注射进入到芯片中,管道可以为PTFE管、毛细管,内径大于150um即可。
作为本实用新型的进一步改进,所述试剂混合流道包括依次连接的第一混合流道、第二混合流道、第三混合流道和第四混合流道,所述第一混合流道、第二混合流道、第三混合流道和第四混合流道平行设置。采用此技术方案,方便试剂进行充分混合。
作为本实用新型的进一步改进,所述第一试剂流入流道、第二试剂流入流道、第三试剂流入流道、细胞流入流道、反冲流道、细胞混合液流出流道均设有阀门。采用此技术方案,可以通过控制阀门控制整个细胞冷冻前处理的过程,更加精准。
作为本实用新型的进一步改进,所述用于细胞冷冻的微流控芯片包括细胞混合液储存腔,所述细胞混合液储存腔与所述细胞混合液流出流道连接,所述细胞混合液储存腔的内径大于细胞混合液流出流道的内径。
作为本实用新型的进一步改进,所述细胞混合液储存腔、细胞混合液流出流道的内壁为圆弧形。优选的,所述细胞混合液储存腔与细胞混合液流出流道的连接处的内壁为圆弧形。采用此技术方案,有利于保护细胞不受损坏。
作为本实用新型的进一步改进,所述第三试剂流入流道为两个,分别位于所述反应腔的上下两侧。
作为本实用新型的进一步改进,所述试剂混合流道内设有用于充分混合的障碍物或斜形凹槽。
微混合可以看作冷冻液和细胞反应前接触的必经过程。在微流控芯片中又被称为微混合器和微反应器。微混合器通常分为两类:(1)被动式微混合器,又分为并行叠片为混合器,串联叠片微混合器,混沌对流微混合器;(2)主动式微混合器,又分为磁力搅拌型混合器,声场促进性微混合器,电场促进性微混合器。所述试剂混合流道设置为蛇形通道,或所述试剂混合流道内设有用于充分混合的障碍物采用的是高雷诺数混沌对流微混合原理;所述试剂混合流道内设有斜形凹槽采用的低雷诺数混沌对流微混合原理。
作为本实用新型的进一步改进,所述微流控芯片本体键合在ITO(Indium-Tin Oxide,氧化铟锡)玻璃基材上,所述ITO玻璃基材上设有可通电发热的薄膜电极。其中,所述ITO玻璃为氧化铟锡导电膜玻璃。采用此技术方案,对薄膜电极通电,利用电阻通电发热的原理,同时通过热电偶测温,方便进行控制温度,这样可以实现试剂与细胞在恒定的温度反应。
作为本实用新型的进一步改进,所述ITO玻璃基材上设有电压监测位点。采用此技术方案,通过检测电压的变化,便可以知道细胞的位置。
作为本实用新型的进一步改进,所述细胞流入流道、反应腔或细胞混合液流出流道设有用于细胞定位的共面电极或平行电极。此技术方案利用流体动力学陷阱捕获细胞,与电场力相比,流体压力比较温和,对细胞活性的影响更小,因此更有利于细胞的操作和捕获。优选的,所述细胞流入流道、反应腔、细胞混合液流出流道设有用于细胞定位的共面电极或平行电极。其中的共面电极为将把一对电极放置在一微孔的同侧,平行电极为将把一对电极放置在一微孔的两侧,当细胞随流体经过微孔时,可测出电极间电阻的改变,电阻变化的幅度与细胞体积有关。此技术方案利用Coulter原理测量细胞体积的方法相对于光学方法较简单。传统的Coulter计数器是基于微孔的,即把一对电极放置在一微孔的两侧,当细胞随流体经过微孔时,可测出电极间电阻的改变,电阻变化的幅度与细胞体积有关。但是,电解液进入微孔时,流场是有显著变化的。为了减少流场变化的影响,将微通道代替微孔,甚至直接把电极做在微通道壁面上的测量方案。电极在微通道的壁面上,可形成所谓共面电极或者平行电极。
作为本实用新型的进一步改进,所述细胞流入流道、细胞混合液流出流道的内径为0.1mm-2mm;所述细胞流入流道、细胞混合液流出流道为细胞在芯片中流经的通道,这样不会破坏细胞。优选的,所述细胞流入流道、细胞混合液流出流道的内径为0.25mm-1mm。
作为本实用新型的进一步改进,所述第一试剂流入流道、第二试剂流入流道、试剂混合流道、第三试剂流入流道、反冲流道为试剂流经通道,所述第一试剂流入流道、第二试剂流入流道、试剂混合流道、第三试剂流入流道、反冲流道的内径为0.1mm-1mm。优选的,所述第一试剂流入流道、第二试剂流入流道、试剂混合流道、第三试剂流入流道、反冲流道的内径为0.25mm-0.5mm。
本实用新型提供了一种用于细胞冷冻的混合系统,其包括如上任意一项所述的用于细胞冷冻的微流控芯片、注射泵、电磁阀,所述注射泵的出口分别与第一试剂流入流道、第二试剂流入流道、第三试剂流入流道、细胞流入流道、反冲流道连通,所述第一试剂流入流道、第二试剂流入流道、第三试剂流入流道、细胞流入流道、反冲流道、细胞混合液流出流道均设有电磁阀。
作为本实用新型的进一步改进,所述用于细胞冷冻的微流控芯片包括与所述细胞混合液流出流道连接的细胞混合液储存腔,所述细胞混合液流出流道的内壁设有用于细胞定位的共面电极或平行电极,所述反应腔通过细胞混合液流出流道与细胞混合液储存腔连接,所述细胞混合液流出流道与细胞混合液储存腔的连接处设有第一电磁阀,所述细胞混合液流出流道的出口设有第二电磁阀。这样,共面电极或平行电极可以监测细胞的位置,当细胞通过电极时,电压和电流会有明显的变化。在细胞反应完全后,从反应腔流出,此时第一电磁阀关闭,第二电磁阀打开,细胞通过电极时,第二电磁阀关闭,第一电磁阀打开,细胞会流入细胞混合液储存腔中,通过控制第一电磁阀开关的时间,可以控制在细胞混合液储存腔中的保护液的体积为1ul。
与现有技术相比,本实用新型的有益效果为:
采用本实用新型的技术方案,代替人工操作实现细胞的冷冻前处理,可以配合冷冻设备实现全自动一体化操作,以实现对卵细胞或其他细胞的自动冷冻处理,而且稳定性更好,收人为因素影响更小,更加精准;同时也有助于建立标准化的处理流程,提高和稳定细胞冷冻复苏成活率,满足日益增长的巨大产业需求。
附图说明
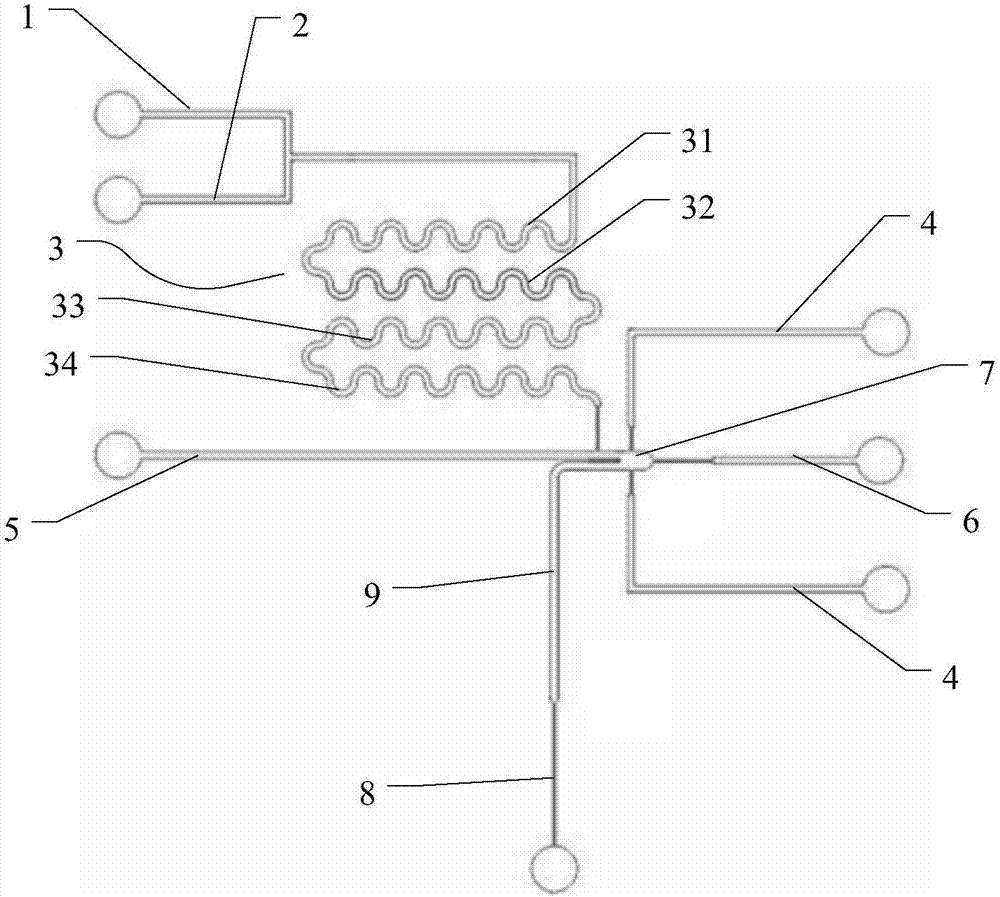
图1是本实用新型一种用于细胞冷冻的微流控芯片的结构示意图。
图2是本实用新型一种用于细胞冷冻的微流控芯片的反应腔的结构示意图。
图3是本实用新型一种用于细胞冷冻的微流控芯片的细胞混合液储存腔的结构示意图。
图4是本实用新型实施例2的一种用于细胞冷冻的微流控芯片的储液池的结构示意图。
图5是本实用新型实施例3的内置有障碍物的试剂混合流道的结构示意图。
图6是本实用新型实施例4的试剂混合流道内壁设有斜形凹槽的结构示意图。
图7是本实用新型实施例6的细胞混合液流出流道的结构示意图。其中,a)为共面电极的情况,b)为平行电极的情况。
图8是本实用新型实施例7的细胞混合液流出流道与细胞混合液储存腔的连接结构示意图。
具体实施方式
下面结合附图,对本实用新型的较优的实施例作进一步的详细说明。
如图1~图3所示,一种用于细胞冷冻的微流控芯片,其包括微流控芯片本体,所述微流控芯片本体包括第一试剂流入流道1、第二试剂流入流道2、试剂混合流道3、第三试剂流入流道4、细胞流入流道5、反冲流道6、反应腔7、细胞混合液流出流道8,所述第一试剂流入流道1、第二试剂流入流道2分别与试剂混合流道3的入口连通,所述试剂混合流道3的出口与反应腔7连通,所述反应腔7的内壁为圆弧形,所述反应腔7、细胞混合液流出流道8的内径大于细胞的外径。所述细胞混合液流出流道8连接有细胞混合液储存腔9,所述细胞混合液储存腔9的内径大于细胞混合液流出流道8的内径。如图2和图3所示,所述反应腔7、细胞混合液储存腔9、细胞混合液流出流道8的内壁为圆弧形,所述细胞混合液储存腔与细胞混合液流出流道8的连接处的内壁均为圆弧形。所述第三试剂流入流道4为两个,分别位于所述反应腔7的上下两侧。所述细胞流入流道5、细胞混合液流出流道8的内径为0.25mm-1mm;所述第一试剂流入流道1、第二试剂流入流道2、试剂混合流道3、第三试剂流入流道4、反冲流道6的内径为0.25mm-0.5mm。
如图1所示,所述试剂混合流道3为波纹形。所述试剂混合流道3包括依次连接的第一混合流道31、第二混合流道32、第三混合流道33和第四混合流道34,所述第一混合流道31、第二混合流道32、第三混合流道33和第四混合流道34平行设置。
优选的,所述微流控芯片本体键合在ITO玻璃基材上,所述ITO玻璃基材上设有可通电发热的薄膜电极,所述ITO玻璃基材上设有电压监测位点。
实施例2
在实施例1的基础上,如图4所示,所述用于细胞冷冻的微流控芯片包括储液池10,所述储液池10与细胞流入流道5通过连接管道11连接,所述连接管道11的内径大于150μm;所述储液池10所处的高度高于所述微流控芯片所处的高度。
实施例3
在实施例1的基础上,如图5所示,所述试剂混合流道3内设有用于充分混合的障碍物12。
实施例4
在实施例1的基础上,如图6所示,所述试剂混合流道3的内壁设有用于充分混合的斜形凹槽13。
实施例5
一种用于细胞冷冻的混合系统,在实施例1的基础上,其包括如实施例1所述的用于细胞冷冻的微流控芯片、注射泵、电磁阀,所述注射泵的出口分别与第一试剂流入流道1、第二试剂流入流道2、第三试剂流入流道4、细胞流入流道5、反冲流道6连通,所述第一试剂流入流道1、第二试剂流入流道2、第三试剂流入流道4、细胞流入流道5、反冲流道6、细胞混合液流出流道8均设有电磁阀。
如图1所示,其具体的控制过程可参考如下:
1.打开第一试剂流入流道1的阀门,通入第一试剂,打开反冲流道5的阀门,其他阀门关闭,注入第一试剂,让第一试剂充满整个芯片。
2. 关闭第一试剂流入流道1的阀门,切断第一试剂流入,打开细胞流入流道5的阀门,通入细胞,将细胞导入到反应腔7中。
3. 打开第一试剂流入流道1的阀门、第二试剂流入流道2的阀门,通入第一试剂、第二试剂。第一试剂、第二试剂两种反应试剂在试剂混合流道3进行充分混合,进入到反应腔7中,并与反应腔7中的细胞进行反应。
4. 关闭第一试剂流入流道1的阀门、第二试剂流入流道2的阀门,打开第三试剂流入流道4的阀门,通入第三试剂,并与反应腔7中的细胞进行反应。
5. 关闭第一试剂流入流道1的阀门、第二试剂流入流道2的阀门、第三试剂流入流道4的阀门,并打开细胞混合液流出流道8的阀门;此时,细胞混合液流出流道8的阀门作为出口,从反冲流道5中注入液体,将细胞混合液冲出反应腔7,进入到细胞混合液储存腔9中;
6. 将细胞混合液储存腔9中的细胞混合液排出,预处理完成。
实施例6
在实施例5的基础上,如图7所示,所述细胞混合液流出流道8的内壁设有共面电极81或平行电极82,用于监测细胞的位置,当细胞通过电极时,电压和电流会有明显的变化。
实施例7
在实施例6的基础上,如图8所示,所述用于细胞冷冻的微流控芯片包括与所述细胞混合液流出流道8连接的细胞混合液储存腔9,所述细胞混合液流出流道8的内壁设有用于细胞定位的平行电极82,所述反应腔7通过细胞混合液流出流道8与细胞混合液储存腔9连接,所述细胞混合液流出流道8的中部与细胞混合液储存腔9的连接处设有第一电磁阀100,所述细胞混合液流出流道8的出口设有第二电磁阀200。利用细胞混合液储存腔9,待细胞反应完全后,对细胞进行保存。对胚胎细胞取样的一个重点,保证保护液体积大概为0.5-2uL。共面电极81监测细胞的位置,当细胞通过共面电极81时,电压和电流会有明显的变化。在细胞反应完全后,从反应腔7流出,此时第一电磁阀100关闭,第二电磁阀200打开,细胞通过平行电极82时,第二电磁阀200关闭,第一电磁阀100打开,细胞会流入细胞混合液储存腔9中,通过控制第一电磁阀100开关的时间,可以控制在细胞混合液储存腔9的保护液的体积为0.5-2ul。
以上所述之具体实施方式为本实用新型的较佳实施方式,并非以此限定本实用新型的具体实施范围,本实用新型的范围包括并不限于本具体实施方式,凡依照本实用新型之形状、结构所作的等效变化均在本实用新型的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!