一种L-精氨酸改性氧化石墨烯海绵制备和铀吸附方法与流程
本发明属于材料技术领域,涉及一种l-精氨酸改性氧化石墨烯海绵制备和铀吸附方法。
背景技术
3d石墨烯材料不仅保留了石墨烯片的大的表面积,而且具有丰富的互连微孔或介孔。因此3d石墨烯水凝胶和海绵在许多方面都有着应用,例如,超级吸附剂,能量存储和转化,传感器和催化等。到目前为止,许多研究者已证明多价离子,生物分子,单体(未转化的),聚合物和其他有机小分子用于石墨烯或go的辅助凝胶化。
现有报道生物相容性分子技术,例如维生素c(也称为抗坏血酸),氨基酸和多巴胺成功地还原go并诱导其自组装成3d石墨烯材料。核苷、dna、氨基酸和肽等已证明可参与3d石墨烯的自组装。而氨基酸作为一种环境友好型材料,它含有对重金属离子有强结合作用的氨基和羧基。
adhikarib,biswasa,banerjeea.grapheneoxide-basedsupramolecularhydrogelsformakingnanohybridsystemswithaunanoparticles[j].langmuir,2011,28(2):1460-1469.研究了在少量蛋白质氨基酸(精氨酸/色氨酸/组氨酸)或核苷(腺苷/鸟苷/胞苷)存在下,氧化石墨烯(go)可形成超分子稳定的水凝胶。
现有技术中有关石墨烯、海绵、吸附的发明专利就有46项,其中13项授权,但尚未发现专门针对铀吸附的3d石墨烯吸附材料。
但石墨烯与l-精氨酸的复合材料也有不少,如cn201611220972.7《l-精氨酸/氧化石墨烯复合材料、制备方法及应用》,包括如下步骤:s1:将氧化石墨烯加入到四氢呋喃中,分散得到氧化石墨烯的四氢呋喃分散液;s2:向氧化石墨烯的四氢呋喃分散液中加入l-精氨酸、碳酸钾粉末和去离子水,常温下搅拌24h;s3:用水洗涤若干次,干燥后得到l-精氨酸/氧化石墨烯复合材料。本发明的l-精氨酸/氧化石墨烯复合材料的制备方法,通过酯化反应在氧化石墨烯表面接枝l-精氨酸,制备条件温和,步骤简单,且制备的l-精氨酸/氧化石墨烯复合材料展示出来良好的cr(vi)吸附性能。
又如cn201610937856.0《一种绿色制备银-氧化锌-石墨烯-泡沫镍材料的方法》,主要包括以下工艺步骤:1.用化学气相沉积法(cvd)在泡沫镍基体上生长一层石墨烯,制备出三维石墨烯-泡沫镍基体;2.将zncl2和氨水溶于去离子水中充分搅拌,并将混合溶液转移至聚四氟乙烯反应釜中,把制备出的三维石墨烯-泡沫镍基体浸入溶液中,将反应釜放置于干燥箱中在100℃-150℃保温1-3hrs;3.将硝酸银和l-精氨酸以一定的摩尔浓度比配制出银-精氨酸溶液,然后将氧化锌-石墨烯-泡沫镍复合物浸入银-精氨酸溶液中,自组装12-18hrs取出,用去离子水超声清洗后直接放入抗环血酸溶液中,20-50mins后取出冲洗,干燥,获得质量稳定的银-氧化锌-石墨烯-泡沫镍复合材料。
可见,石墨烯吸附材料的发展令人向往。
技术实现要素:
本发明通过l-精氨酸和氧化石墨烯水热反应制备出了石墨烯水凝胶,然后冷冻干燥得到l-精氨酸改性氧化石墨烯海绵(l-ar-gos)。利用sem、eds、ft–ir、xrd和xps等分析技术对l-ar-gos的物理化学性质进行分析。以l-ar-gos为吸附剂,通过静态吸附法,探究溶液初始ph值、铀初始浓度、吸附时间、温度和离子强度等因素对铀(vi)的吸附性能的影响。利用准一级和准二级动力学模型、langmuir和freundlich模型对吸附动力学和吸附等温线进行研究。另外,还考察了吸附反应热力学和吸附剂的循环使用能力,探究吸附反应中能量的变化和吸附机理。从而提供一种l-精氨酸改性氧化石墨烯海绵制备和铀吸附方法。
为解决上述技术问题,本发明采用如下技术方案实现:
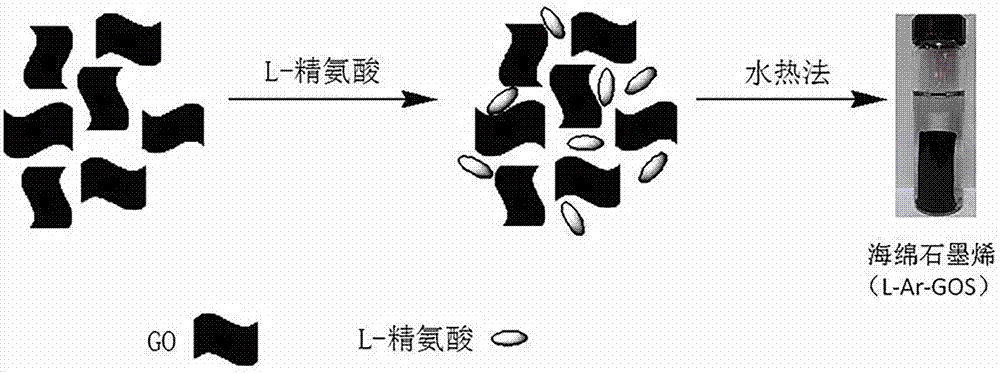
本发明目的之一是这样实现的:一种l-精氨酸改性氧化石墨烯海绵制备方法,以氧化石墨烯(go)为前驱体,以l-精氨酸为交联剂,通过水热法和冷冻干燥法分别制备出具有三维立体结构的l-精氨酸改性氧化石墨烯海绵(l-ar-gos);反应过程中,l-精氨酸在水热条件下诱导氧化石墨烯自组装成宏观的三维石墨烯材料,并且在这个过程中l-精氨酸和氧化石墨烯发生反应,反应后的材料具有大的比表面积和疏松多孔的结构,有利于吸附金属离子。
一种l-精氨酸改性氧化石墨烯海绵制备方法:
(1)氧化石墨烯的制备:在冰水浴条件下,将1.5-2.5份石墨粉、0.8-1.5份nano3加入到80-90份浓h2so4中,剧烈搅拌30分钟后,保持反应温度低于20℃的条件下缓慢加入5.5-6.5份kmno4,除去冰浴,将溶液温度缓慢升高至35℃,搅拌反应1h后缓慢加入一定量的去离子水并逐渐升温至98℃,保持30分钟,然后加入1.8-2.5份30%过氧化氢和一定量的去离子水,溶液变为亮黄色,趁热过滤,所得滤饼依次用5%盐酸和去离子水多次洗涤;
将洗涤至中性的氧化石墨超声分散在水中,超声震荡1h,离心分离,所得上层液即为氧化石墨烯分散液,然后将其在60℃下真空干燥,待用;
(2)l-精氨酸改性氧化石墨烯海绵的制备:首先将3.0-5.0份氧化石墨烯超声分散均匀;然后将11-13份l-精氨酸溶解在分散液中,超声10min后,将所得混合液转移至反应瓶中,密封放在烘箱中100℃加热8小时,反应产物冷却至室温后取出即可得到石墨烯水凝胶;
将其洗涤并用去离子水浸泡48h,最后将产物冷冻干燥即得到石墨烯海绵。
以上参数范围均可包括扩展后的两位以上有次数字,特别包括将2.0份石墨粉,1.0份nano3,85份浓h2so4,6.0份kmno4,2.0份30%过氧化氢,4.0份氧化石墨烯,12份l-精氨酸。
本发明目的之二是这样实现的:
利用l-精氨酸改性氧化石墨烯海绵吸附铀的时候,待吸附溶液的ph应该调至5.0
本发明制备一种对铀酰离子具有良好吸附效果的三维材料,(1).便于材料的回收和再生利用,(2).提高对铀酰离子的吸附容量和吸附选择性,3.增加了吸附材料的机械强度。
进一步,本发明方法创新之处在于:(1)本合成方法主要利用的是水热法,合成所用原料简单,反应条件不苛刻,且合成出来的氧化石墨烯海绵机械强度高。(2)本发明选择l-精氨酸,主要是利用了它的氨基和羧基官能团,这两种基团都是铀酰离子良好的配体,在合成得到的三维氧化石墨烯海绵材料中,羧基数量相较于原来氧化石墨烯的羧基数量增多,同时还增加了氨基数量,因而增加了对铀酰离子的吸附容量,并且由于协同作用(即几种吸附铀酰离子的官能团共同作用的结果)使海绵石墨烯的吸附效果和吸附选择性增强。(3)现有的《l-精氨酸/氧化石墨烯复合材料、制备方法及应用》合成的氧化石墨烯海绵虽然合成方法也比较简单,但是所得产物机械强度不高,且合成过程中加入的原料较多,且四氢呋喃具有一定毒性,相较于本发明方法还是有不同。
如sem、eds、ft-ir、xrd和xps分析结果表明l-精氨酸在水热条件下诱导go自组装成宏观的三维石墨烯材料,并且在这个过程中l-精氨酸和go发生了反应,该材料具有大的比表面积和疏松多孔的结构,有利于吸附金属离子。将l-ar-gos和go用于水溶液中铀(vi)的吸附,研究结果表明,l-ar-gos的吸附能力优于go。
附图说明
图1是本发明石墨烯海绵(l-ar-gos)合成示意图;
图2是sem和eds表征对比分析图;
图3是go、l-ar-gos和l-ar-gos-u的ft-ir谱图;
图4是go和l-ar-gos的xrd谱图。
图5是go、l-ar-gos和l-ar-gos-u的xps对比谱图;
图6是初始ph对go和l-ar-gos吸附铀(vi)的影响图;
图7是吸附时间对go和l-ar-gos吸附铀(vi)的影响图;
图8是go和l-ar-gos的准一级(a)和准二级(b)吸附动力学模型对比图;
图9是初始浓度对go和l-ar-gos吸附铀(vi)的影响图;
图10是go和l-ar-gos的langmuir(a)和freundlich(b)吸附等温线对比图;
图11是温度对go和l-ar-gos吸附铀(vi)的影响图;
图12是go和l-ar-gos吸附铀的热力学关系曲线图;
图13是离子强度对l-ar-gos吸附的影响图;
图14是go和l-ar-gos的重复使用性图;
图15是铀(vi)与共存离子在go和l-ar-gos上的竞争吸附和kd值图。
具体实施方式
下面结合具体实施例对本发明的技术方案做详细说明。
实施例1
表1试剂
续表1实验试剂
表2实验仪器
一、石墨烯海绵l-ar-gos制备。
1.1溶液的配制
1mg·ml-1铀标准储备液的配制:准确称取0.5896gu3o8于50ml烧杯中,加入2.5ml王水溶解后加热蒸发至湿盐状,然后停止加热,自然冷却至常温,加入5ml浓盐酸后转移到500ml容量瓶中,定容,摇匀,此时溶液浓度为1mg·ml-1。不同浓度的铀标准溶液可用此标准储备液稀释得到。
偶氮胂ⅲ溶液(ρ=0.5g·l-1)的配制:准确称取0.250g偶氮胂ⅲ,用水溶解,随后转入500ml容量瓶中,定容,摇匀即可。
氯乙酸–乙酸钠缓冲液(ph=2.50)的配制:用水将47.25g的氯乙酸超声溶解,在1000ml的容量瓶中定容即得到0.5mol·l-1氯乙酸溶液;用水将10.25g乙酸钠溶解,在250ml容量瓶中定容即得到0.5mol·l-1乙酸钠溶液。然后移取250ml氯乙酸溶液与150ml乙酸钠混合,用ph计调节ph为2.50,即得到所需缓冲液。
1.2l-精氨酸改性氧化石墨烯海绵(l-ar-gos)的制备
(1)氧化石墨烯(go)的制备:在冰水浴条件下,将2g石墨粉、1gnano3加入到46ml浓h2so4中,剧烈搅拌30分钟后,保持反应温度低于20℃的条件下缓慢加入6gkmno4,除去冰浴,将溶液温度缓慢升高至35℃,搅拌反应1h后缓慢加入一定量的去离子水并逐渐升温至98℃,保持30分钟,然后加入1.5ml30%过氧化氢和一定量的去离子水,溶液变为亮黄色,趁热过滤,所得滤饼依次用5%盐酸和去离子水多次洗涤。将洗涤至中性的氧化石墨超声分散在水中,超声震荡1h,离心分离,所得上层液即为氧化石墨烯分散液,然后将其在60℃下真空干燥,待用。
(2)l-精氨酸改性氧化石墨烯海绵(l-ar-gos)的制备:首先将40mggo超声分散均匀。然后将120mgl-精氨酸溶解在分散液中,超声10min后,将所得混合液转移至20ml反应瓶中,密封放在烘箱中100℃加热8小时,反应产物冷却至室温后取出即可得到石墨烯水凝胶。将其洗涤并用去离子水浸泡48h,最后将产物冷冻干燥即得到石墨烯海绵l-ar-gos。
二、吸附实验:
(1)静态吸附实验
将配制好的1mg·ml-1铀母液稀释至一定浓度的铀标准溶液用于后续的吸附实验。用一定浓度的hcl或naoh溶液将一定浓度的铀溶液调至所需ph值。移取50ml一定浓度的铀(vi)溶液于150ml具塞锥形瓶中,加入吸附剂go或l-ar-gos0.01g。随后将其置于水浴振荡器中,一定时间后取出,将吸附剂与溶液分离得到上清液。用偶氮胂ⅲ作为显色剂,用分光光度法测定上清液中剩余的铀浓度,通过公式1计算,得到吸附容量。
式中c0是吸附前铀(vi)溶液的浓度,mg·l-1;ce是吸附后上清液中的铀(vi)离子浓度,mg·l-1;v是吸附时铀溶液的体积,l;m是加入的吸附剂的质量,g。分配系数kd(ml·g-1)通过公式2计算:
式中qe是吸附达到平衡时的吸附量,mg·g-1;ce为吸附达到平衡后溶液的浓度,mg·l-1。
(2)选择性吸附实验
准确称取0.01g吸附剂,加入至150ml具塞锥形瓶中,加入50ml既定ph值的混合标准溶液含u(vi)、sm(iii)、nd(iii)、la(iii)、gd(iii)、ce(iii)、sr(ii)、ni(ii)、co(ii)和ba(ii)等10种离子,各离子浓度为100mg·l-1,置于振荡器中振荡9h,取出分离,收集上清液,采用icp-oes测定吸附后各个离子的浓度,根据公式(3)计算吸附量qe(mg·g-1)。
式中c0(mg·l-1)和cf(mg·l-1)分别是吸附前后金属离子的浓度;v(l)是吸附时溶液的体积;m(g)是加入的吸附剂的质量。
三、技术分析
3.1sem和eds表征分析
图2中.(a)go的sem图;(b)l-ar-gos的sem图;(c)l-ar-gos吸附铀的sem图;(d)l-ar-gos吸附铀后的eds谱图;
通过sem可以很明显地观察到go和l-ar-gos表面形态的差异。从图2(a)中可以看出go的表明光滑且有少量的褶皱,而图2(b)显示l-ar-gos具有互连的分层多孔结构,孔径范围从几百纳米到几微米。这种疏松的多孔结构减少了go片层的堆积从而使其表面积增加,并且有利于离子的扩散。在宏观上,如图2(b)中的插图所示,l-精氨酸和go水热反应形成的石墨烯水凝胶呈圆柱形固体,具有完整的三维结构。从图2(c)中可以看到l-ar-gos吸附u(vi)后的形态结构同吸附铀前的l-ar-gos相比没有显示出明显的结构变化,这反映了l-ar-gos具有良好的结构稳定性。
为进一步了解l-ar-gos吸附铀(vi)后的情况,我们对吸附铀(vi)后的l-ar-gos进行了eds分析。由图2(d)可知,l-ar-gos吸附铀(vi)后的x射线能谱图上出现了明显的n和u元素的特征峰,说明在水热过程中l-精氨酸和go之发生了相互作用,l-ar-gos的表面有铀(vi)存在。
3.2ft-ir表征分析
样品的红外光谱采用傅里叶变换红外光谱仪来测定,采用kbr压片法,扫描波数范围为4000~500cm-1。图3是go,l-ar-gos和l-ar-gos-u的ft-ir光谱。从图中可以看出,go的吸收峰主要出现在3275cm-1,1721cm-1,1624cm-1和1040cm-1处,这分别归因于o-h的伸缩振动,c=o的伸缩振动,c=c的伸缩振动和c-o的伸缩振动。这表明了go含有丰富的含氧官能团。与go相比,l-ar-gos在1721cm-1处的吸收峰基本消失,说明改性后go的含氧官能团大大减少。在1564cm-1处出现的吸收峰可能是由于l-精氨酸和go作用后c=c和n-h的位置发生了蓝移或红移而导致了特征峰的重叠。在1190cm-1处出现的吸收峰是c-n的伸缩振动引起的。含氮基团的存在表明l-精氨酸与go发生了反应。对于l-ar-gos吸附u(vi)后的红外光谱,在900cm-1处出现新的吸收峰,这是由[o=uvi=o]2+的反对称振动引起的,另外,c-n的吸收峰发生了红移,这可能是铀吸附在l-ar-gos表面造成的。这表明含氮基团为铀提供了吸附位点。
3.3xrd表征分析
由图4可知,go在10.6°处出现强的衍射峰,这对应于层状go的(001)特征衍射峰,根据布拉格公式2dsinθ=nλ(d(nm)为层间距;θ(°)为衍射角;λ(nm)为cu靶发射的x射线的波长;n=1)计算得出层间距为0.83nm。层间距d可用作判断氧化石墨的氧化程度的一个重要参数。氧化石墨的氧化程度越高,层间距d越大。对于l-ar-gos,该峰完全消失,这是由go发生还原以及表面改性造成的,可以推断l-精氨酸的氨基和go的环氧官能团发生了反应。相反,在24.6°出现了新的宽衍射峰,层间距变小,这表明有石墨烯片的形成。
3.4xps表征分析
采用x射线光电子能谱仪(xps)对go、l-ar-gos和l-ar-gos-u进行了表征,用于测定其表面化学成分和键合环境。go、l-ar-gos和l-ar-gos-u的xps谱图如图5所示。图5(a)表示的是go、l-ar-gos和l-ar-gos-u的xps全谱图。结合能的峰值分别出现在285ev,399.1ev和532ev,这分别对应的是c1s、n1s和o1s的特征峰。另外,在l-ar-gos-u中观察到[o=uvi=o]2+的反对称振动的新峰,表明铀通过化学键吸附在改性材料的表面上。l-ar-gos-u的u4fxps光谱如图5(d)所示,在结合能为392.8和382ev处的两个峰分别为u4f5/2和u4f7/2。对于go来说,在286.3ev和532.8ev处出现的特征峰分别是c1s和o1s的信号峰。在其c1sxps光谱图5(b)中,分别在结合能为284.9ev、286.9ev和288.1ev处出现了c-c/c=c、c-o和o-c=o的特征峰,与文献一致。相对原子的百分比结果示于表3中,可知go中氧的原子百分比为34.97%,这表明在原始go的表面上含有大量的含氧官能团。与go相比,在l-ar-gos的c1sxps谱图如图5(c)中出现了c-n的特征峰,说明go和l-精氨酸发生了相互作用。另外,从表3中可知l-ar-gos中o元素含量比go少,但c/o增大。这是因为在水热过程中,go与l-精氨酸中的-nh2发生交联反应的同时其自身部分发生了还原反应,导致l-ar-gos中o元素含量的降低,这与红外的分析结果一致。
表3go、l-ar-gos和l-ar-gos-u中元素的相对含量以及c/o比
3.5初始ph值对吸附的影响
酸度是控制u(vi)离子吸附的关键因素。我们进行了一系列的吸附实验以确定最佳ph。如图6所示(m=10mg;c0=50mg·l-1;v=50ml;t=298.15k),u(vi)离子的吸附容量随溶液ph值的增加而变化。在低ph值下,溶液中h+浓度较高,此时h+会与uo22+竞争吸附剂表面的活性位点,导致吸附量较小。随着ph增加,h+离子的浓度降低,l-ar-gos表面的更多活性位点被暴露,导致吸附能力也随之增加。u(vi)在go和l-ar-gos上的吸附容量在3至5的范围内急剧增加。然而,ph从5增加到7时,u(vi)在go和l-ar-gos上的吸附减少。因为,ph在5至7范围内,铀与氢氧化物结合并形成不同的络合物。ph=5.5时go对铀的吸附量最大为148.5mg·g-1,ph=5时l-ar-gos对铀的吸附量最大为201.8mg·g-1,l-ar-gos的吸附能力高于go。ph=5.5和ph=5分别是go和l-ar-gos吸附铀的最佳ph,并用于后续的吸附实验中。
3.6吸附动力学研究
分别在ph为5和5.5时进行吸附实验,研究了吸附时间对l-ar-gos和go吸附u(vi)的影响。如图7所示(go:ph=5.5;l-ar-gos:ph=5.0;c0=50mg·l-1;v=50ml;m=0.010g;t=298.15k),u(vi)在前60min被快速地吸附,吸附量急剧增加,然后缓慢增加,直至达到平衡。l-ar-gos和go对u(vi)的吸附分别在9h和90min左右达到平衡。u(vi)在开始时被快速吸附主要是因为go具有较大的比表面积和丰富含氧官能团,l-ar-gos具有大的比表面积和多孔的结构。在之后的吸附实验中分别选择9h和90min作为吸附时间,以保证实现吸附平衡。
采用准一级动力学模型和准二级动力学模型来研究u(vi)在l-ar-gos和go上的吸附动力学。两个模型的线性拟合方程如下:
ln(qe-qt)=lnqe-k1t(4)
式中,qe(mg·g-1)和qt(mg·g-1)分别为吸附平衡时和某时刻t时的吸附容量;k1(min-1)和k2(g·mg-1·min-1)分别为准一级和准二级动力学方程的吸附速率常数。
根据两个模型的线性方程,对吸附实验数据进行线性拟合,得到准一级动力学拟合曲线如图8(a)所示和准二级动力学拟合曲线如图8(b)所示。由图中拟合线性方程式的斜率与截距计算得到相关动力学参数,列于表4。
表4go和l-ar-gos的吸附动力学参数
go和l-ar-gos的准二级动力学模型线性拟合的相关系数r2均大于0.99,并且由准二级动力学方程拟合计算得到的平衡吸附量与实际吸附实验所得平衡吸附量相近,表明铀(vi)在go和l-ar-gos上的吸附行为均可用准二级动力学模型来描述,go和l-ar-gos对铀的吸附主要受化学作用控制。另外,从准二级吸附动力学的吸附速率常数k2可知,l-ar-gos的吸附速率比go小,但l-ar-gos的吸附容量比go大,所以在吸附铀的过程中l-ar-gos达到吸附平衡所需的时间要比go长,这与实际吸附实验结果一致。
3.7吸附等温线研究
图9(go:ph=5.5,t=90min;l-ar-gos:ph=5.0,t=9h;v=50ml;m=0.010g;t=298.15k)为铀初始浓度对go和l-ar-gos吸附铀(vi)性能的影响。从图中可看出,当铀浓度从10mg·l-1增加到60mg·l-1时,go和l-ar-gos对铀(vi)的吸附量显著增加,表明初始铀浓度产生了降低液相和固相之间的铀传质阻力的关键助动力。当初始铀浓度高于60mg·l-1时,go对铀(vi)的吸附量基本保持不变,l-ar-gos对铀(vi)的吸附量缓慢增大。这可能是因为go和l-ar-gos表面上的活性位点达到了饱和。
为了更充分地描述制备的吸附剂对铀(vi)的吸附特性和吸附机理,使用两种不同的等温模型langmuir模型和freundlich模型来评估吸附实验数据。langmuir等温模型假设吸附是单层吸附且发生均匀表面上,其线性方程式如下:
式中,ce是吸附平衡时铀(vi)溶液的浓度,mg·l-1;qe是吸附平衡时对铀(vi)的吸附量,mg·g-1;qm为langmuir单层吸附容量,mg·g-1;kl为与吸附能量相关的平衡常数。
freundlich模型基于可逆非均相吸附,因为其不限制单层吸附能力。它的线性方程式如下:
其中,kf和n分别为与吸附容量和吸附强度相关的freundlich常数。
表5go和l-ar-gos的langmuir和freundlich等温吸附参数
分别以ce/qe对ce和lnqe对lnce作图,得到langmuir和freundlich吸附等温方程的线性拟合曲线,如图10所示。根据线性拟合方程式的斜率与截距计算得到相关的参数,结果列于表5。根据表中langmuir和freundlich等温式的线性相关系数r2可知,go和对铀(vi)的吸附更符合langmuir吸附等温模型,说明铀(vi)在go和l-ar-gos上的吸附为单分子层吸附。由langmuir吸附等温式得到的go和l-ar-gos对铀(vi)的单层吸附容量分别为为238.66mg·g-1和202.43mg·g-1。
3.8吸附热力学研究
温度对go和l-ar-gos对u(vi)吸附的影响如图11所示(go:ph=5.5,t=90min;l-ar-gos:ph=5.0;t=9h;c0=50mg·l-1;v=50ml;m=0.01g)。随着温度的升高,go和lar-gos对铀(vi)的吸附量均逐渐增加,这表明较高的温度有利于u(vi)的吸附,go和lar-gos对铀(vi)的吸附可能为吸热过程。
为了进一步研究go和l-ar-gos对铀(vi)吸附的热力学本质,引入了gibbs自由能变(δg,kj·mol-1)、焓变(δh,kj·mol-1)和熵变(δs,j·k-1·mol-1)。δh和δs的值可通过van’thoff方程式(8)计算得到。δg通过公式(9)得到。
δg=δh-tδs(9)
其中,r为气体摩尔常数(r=8.314j·k-1·mol-1);kd为固液系统中金属离子的分配系数,计算公式如下:
式中ce是吸附平衡时溶液的浓度,mg·l-1;qe是平衡时的吸附量,mg·g-1。
以lnkd对1/t作图并进行线性拟合,如图12所示。根据线性方程的斜率和截距计算得到δh和δs的值,列于表6。根据公式9计算得到的不同温度下的δg列于表7。
由表6和表7可知,δh大于零和δg小于零,说明go和l-ar-gos对铀(vi)的吸附均为吸热和自发的过程,并且随着温度的升高,δg的绝对值不断增加,表明温度的升高在一定程度上有利于吸附的进行。另外,δs大于零,表明go和l-ar-gos对铀(vi)的吸附是熵增加的过程,在吸附过程中,铀酰离子在固-液界面的随机性增加。热力学研究表明,吸附剂材料对铀酰离子具有很强的亲和力。
表6go和l-ar-go的吸附热力学参数
表7go和l-ar-gos的吸附热力学参数δg
3.9离子强度对吸附的影响
在ph=5以及不同的nacl浓度(0-0.5mol)条件下,考察了离子强度对l-ar-gos吸附铀(vi)性能的影响。如图13所示(ph=5.0,t=9h,c0=50mg·l-1,v=50ml,m=0.01g),当离子浓度增大时,其吸附容量变化不大。说明l-ar-gos对铀(vi)的吸附基本不受离子强度的影响。进一步说明了l-ar-gos对铀(vi)具有很高的亲和力。ph值对l-ar-gos吸附铀(vi)的性能影响较大,但是不受离子强度的影响,证明l-ar-gos对铀(vi)的吸附受内层表面络合的控制。
3.10解吸及可重复使用性
在评估吸附剂的经济性和适用性时,重复利用性对于实际应用也是非常有价值的。在图14中,铀(vi)离子在较低的ph范围内很难被吸附在go和l-ar-gos上,这意味着负载的铀(vi)离子可能被酸性介质从吸附剂中解吸。因此,在本实验中,为了研究go和l-ar-gos的重复使用性,采用1.0mol·l-1hcl溶液作为go和l-ar-gos的解吸剂。根据公式11计算解吸率d(%)。
式中,cd为解吸后滤液中铀的浓度,mg·l-1;vd为解吸液的用量,l。从图14中可以看出,1.0mol·l-1hcl溶液对铀(vi)的解吸效果较好,经计算解吸率可达95%以上。为了评估吸附剂的可重复利用性,将再生的go和l-ar-gos用于连续吸附/解吸循环。循环5次后,从图中可观察到,go对铀(vi)的吸附量降低了26%,而l-ar-gos对铀(vi)的吸附量降低了18%,低于go。表明l-ar-gos具有较好的可重复使用性。go的可重复使用性低的原因可能是go在水中的分散性较好,分离时困难,损失大。
3.11对铀的选择性吸附性能
为了评估go和l-ar-gos的吸附选择性,我们模拟核工业流出物中含有的主要核素研究了竞争阳离子的影响。由图15(ph=5.0,t=9h,c0=100mg·l-1,v=50ml,m=0.01g),14(a)可知,l-ar-gos对铀的吸附能力明显高于go。l-ar-gos对所有阳离子的总吸附容量高达328.4mg·g-1,高于go(269.7mg·g-1)。同时吸附铀(vi)的容量从go的80.4mg·g-1提高到l-ar-gos的174.8mg·g-1。根据公式12计算得到的l-ar-gos对吸附铀(vi)的选择率su约为53.2%,而go吸附铀(vi)的选择率su为29.8%。这表明l-ar-gos对铀(vi)具有更好的选择性吸附性能。
另一方面,这种选择性可以通过分布系数进一步分析。如图15所示,对于u(vi),l-ar-gos的kd高达近2700ml·g-1高于go,对于其他共存离子,其值低于500ml·g-1,这表明l-ar-gos对于铀(vi)具有更高的亲和性,在其它共存离子存在的情况下对铀(vi)具有更好的选择性。
四.小结
本发明利用l-精氨酸和氧化石墨烯水热反应和冷冻干燥法得到一种三维石墨烯海绵l-ar-gos。sem、eds、ft-ir、xrd和xps分析结果表明l-精氨酸在水热条件下诱导go自组装成宏观的三维石墨烯材料,并且在这个过程中l-精氨酸和go发生了反应,该材料具有大的比表面积和疏松多孔的结构,有利于吸附金属离子。
将l-ar-gos和go用于水溶液中铀(vi)的吸附,研究结果表明,l-ar-gos的吸附能力优于go。溶液的初始ph值,吸附时间和铀初始浓度对两者的吸附性能有较大的影响,而均不受离子强度的影响。吸附动力学研究显示,go和l-ar-gos对铀(vi)的吸附均可用准二级动力学方程来描述,吸附过程主要是受化学作用控制。吸附等温线研究表明,go和l-ar-gos对铀(vi)的吸附均符合langmuir吸附等温模型,根据langmuir等温模型计算出的l-ar-gos对铀(vi)的单层吸附量为238.66mg·g-1。吸附热力学研究证明,go和l-ar-gos对铀(vi)的吸附是吸热和自发的过程。吸附/解吸循环实验结果表明,1.0mol·l-1hcl溶液对铀(vi)的解吸效果较好,l-ar-gos具有较好的可重复使用性。另外,l-ar-gos对铀具有更好的选择性吸附性能。
上述实施例仅用以说明本发明的技术方案,而非对本发明的构思和保护范围进行限定,本发明的普通技术人员对本发明的技术方案进行修改或者等同替换,而不脱离技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围中。
- 还没有人留言评论。精彩留言会获得点赞!