一种兼具高选择性高渗透性超滤膜的制备方法与流程
本发明涉及一种兼具高选择性高渗透性超滤膜的制备方法,属于超滤膜的制备技术领域。
背景技术:
膜分离是一门涵盖化学工程学、材料科学、过程工程学等多学科的高新技术,它是对混合物中某组分具有选择性的分离介质,在膜两侧施加某种推动力,使混合物中的组分有选择的从膜的一侧传递到另一侧。超滤膜是一种以压力为推动力以大分子和小分子的分离为目的的膜分离技术之一。在一定的压力下,当原液流过膜表面时,超滤膜表面密布的许多细小的微孔只允许水及小分子物质通过而成为透过液,而原液中体积大于膜表面微孔径的物质则被截留在膜的进液侧,成为浓缩液,因而实现对原液的净化、分离和浓缩的目的。超滤膜孔径约为2-50nm,只允许水分子、水中的有益矿物质和微量元素通过,而目前已知世界最小细菌的体积在0.2微米,因此细菌以及比细菌体积大得多的胶体、铁锈、悬浮物、泥沙、大分子有机物等都能被超滤膜截留下来,从而实现了净化过程。
超滤膜的结构有对称和非对称之分。前者是各向同性的,没有皮层,所有方向上的孔隙都是一样的,属于深层过滤;后者具有较致密的表层和以指状结构为主的底层,表层厚度为0.1微米或更小,并具有排列有序的微孔,底层厚度为200~250微米,属于表层过滤。工业使用的超滤膜一般为非对称膜。超滤膜的膜材料主要有纤维素及其衍生物、聚碳酸酯、聚氯乙烯、聚偏氟乙烯、聚醚砜、聚丙烯腈、聚酰胺、聚砜酰胺、磺化聚砜、交链的聚乙烯醇、改性丙烯酸聚合物等等。
非溶剂诱导相转化是一种制备非对称超滤膜的常见方法,具有操作简单,成本低廉,易工业化等优势。在成膜过程中,选择亲和性不同的溶剂和非溶剂,改变温度,选择不同种类致孔剂并改变致孔剂分子量、添加量等方法可以改变超滤膜孔参数,但总的来说,超滤膜孔密度和孔尺寸存在一定的耦合,即孔密度的提升经常伴随着孔尺寸的增大,限制了超滤膜渗透性和选择性的同步提升。
技术实现要素:
本发明的目的在于提供一种兼具高选择性高渗透性超滤膜的制备方法,该制备方法通过单宁酸和普朗尼克f127在成膜过程中的界面组装优化膜孔参数——增加孔密度并减少孔尺寸,使制备的超滤膜兼具高选择性和高渗透性。
为了解决上述技术问题,本发明提供的一种兼具高选择性高渗透性超滤膜的制备方法,包括以下步骤:
步骤一、铸膜液的配置:将聚醚砜、普朗尼克f127和二甲基甲酰胺按质量比20:20:85加入容器内,在70℃水浴中加热搅拌4h,然后静止脱泡2h,备用;
步骤二、凝固浴的配置:将质量体积浓度为10~50g/l的单宁酸水溶液加入容器内,室温下搅拌1h,备用;
步骤三、固化成膜:将步骤一配置的铸膜液冷却至室温后倒在玻璃板上刮成200μm厚的液膜,放入恒温至25℃的步骤二中配置的凝固浴中持续10分钟固化成膜;
步骤四、后处理:将步骤三得到的膜浸入ph值为12的氢氧化钠溶液中持续12h,然后浸入离子水中持续24h,得到兼具高选择性高渗透性超滤膜。
本发明中,所述聚醚砜选用6020p型的聚醚砜。
本发明的优点在于:该制备方法通过单宁酸和普朗尼克f127在成膜过程中的界面组装优化膜孔参数——增加孔密度并减少孔尺寸,使制备的超滤膜兼具高选择性和高渗透性。
附图说明
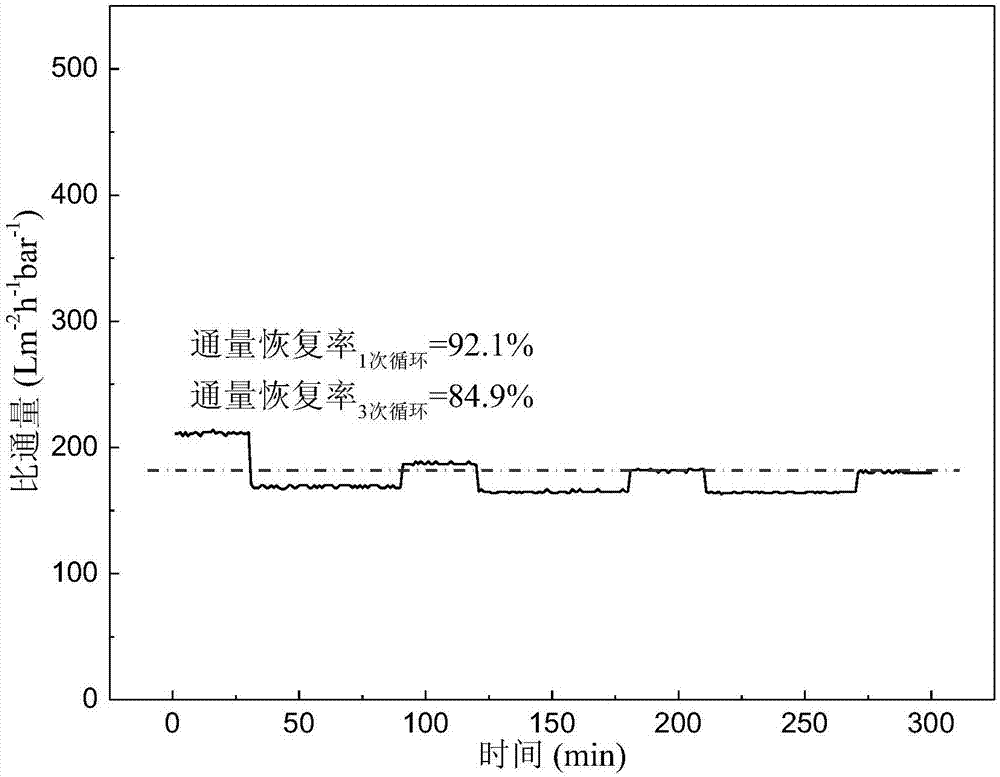
图1为对比例所制的对比超滤膜过滤1g/l牛血清蛋白水溶液的三次循环通量变化图。
图2为本发明实施例2所制的高选择性高渗透性超滤膜2过滤1g/l牛血清蛋白水溶液的三次循环通量变化图。
具体实施方式
下面结合具体实施例和附表对本发明技术方案作进一步详细描述,所描述的具体实施例仅对本发明进行解释说明,并不用以限制本发明。
对比例、制备对比超滤膜,其制备过程是:
将160mg聚醚砜(6020p型)、160mg普朗尼克f127和680mg二甲基甲酰胺加入圆底烧瓶,在70℃水浴中加热搅拌4h,然后静止脱泡2h,得到铸膜液;将铸膜液冷却至室温后倒在玻璃板上刮成约200μm后的液膜,放入恒温至25℃的1l去离子水进行凝固浴,持续10min固化成膜;将该膜浸入ph值为12的氢氧化钠溶液中持续12h,浸入离子水中持续24h,所得即为对比超滤膜。
图1为该对比超滤膜过滤1g/l牛血清蛋白水溶液的三次循环通量变化图,每次循环内容为:纯水(30min)-牛血清蛋白水溶液(60min)-清洗(10min,该时间在图中未标出)-纯水(30min)。
对比例所制得的对比超滤膜对牛血清蛋白(1g/l)的截留率为96.9%,对葡聚糖(1g/l,分子量150kda)的截留率为84.2%;过滤纯水的比通量为227lm-2h-1bar-1,过滤1g/l牛血清蛋白水溶液的比通量为171lm-2h-1bar-1,操作60min并用纯水剪切流清洗10min后通量恢复率为92.1%。
实施例1、制备兼具高选择性高渗透性超滤膜,步骤如下:
步骤一、铸膜液的配置:将160mg聚醚砜(6020p型)、160mg普朗尼克f127和680mg二甲基甲酰胺加入圆底烧瓶,在70℃水浴中加热搅拌4h,然后静止脱泡2h,待用。
步骤二、凝固浴的配置:将质量体积浓度为10g/l的单宁酸水溶液加入烧杯,室温下搅拌1h,待用。
步骤三、固化成膜:将步骤一中配置的铸膜液冷却至室温后倒在玻璃板上刮成约200μm厚的液膜,放入恒温至25℃的步骤二中配置的凝固浴中持续10分钟固化成膜。
步骤四、后处理:将步骤三得到的固体膜浸入酸碱度为12的氢氧化钠溶液中持续12h,浸入离子水中持续24h,得到兼具高选择性高渗透性超滤膜,记为超滤膜1。
实施例1所制得的超滤膜1对牛血清蛋白(1g/l)的截留率为98.1%,对葡聚糖(1g/l,分子量150kda)的截留率为86.9%;过滤纯水的比通量为277lm-2h-1bar-1,过滤1g/l牛血清蛋白水溶液的比通量为228lm-2h-1bar-1,操作60min并用纯水剪切流清洗10min后通量恢复率为93.7%。
实施例2、制备兼具高选择性高渗透性超滤膜,其制备过程与实施例1基本相同,不同仅在于:步骤二中,单宁酸水溶液的质量体积浓度为20g/l,最终制得超滤膜2。
图2为本发明实施例2所制的超滤膜2过滤1g/l牛血清蛋白水溶液的三次循环通量变化图。每次循环内容为:纯水(30min)-牛血清蛋白水溶液(60min)-清洗(10min,该时间在图中未标出)-纯水(30min)。
实施例2所制得的超滤膜2对牛血清蛋白(1g/l)的截留率为99.0%,对葡聚糖(1g/l,分子量150kda)的截留率为90.9%;过滤纯水的比通量为412lm-2h-1bar-1,过滤1g/l牛血清蛋白水溶液的比通量为287lm-2h-1bar-1,操作60min并用纯水剪切流清洗10min后通量恢复率为95.5%。
实施例3、制备兼具高选择性高渗透性超滤膜,其制备过程与实施例1基本相同,不同仅在于:步骤二中,单宁酸水溶液的质量体积浓度为30g/l,最终制得超滤膜3。
实施例3所制得的超滤膜3对牛血清蛋白(1g/l)的截留率为99.0%,对葡聚糖(1g/l,分子量150kda)的截留率为91.7%;过滤纯水的比通量为394lm-2h-1bar-1,过滤1g/l牛血清蛋白水溶液的比通量为281lm-2h-1bar-1,操作60min并用纯水剪切流清洗10min后通量恢复率为95.9%。
实施例4、制备兼具高选择性高渗透性超滤膜,其制备过程与实施例1基本相同,不同仅在于:步骤二中,单宁酸水溶液的质量体积浓度为40g/l,最终制得超滤膜4。
实施例4所制得的超滤膜4对牛血清蛋白(1g/l)的截留率为100%,对葡聚糖(1g/l,分子量150kda)的截留率为91.9%;过滤纯水的比通量为315lm-2h-1bar-1,过滤1g/l牛血清蛋白水溶液的比通量为243lm-2h-1bar-1,操作60min并用纯水剪切流清洗10min后通量恢复率为96.0%。
实施例5、制备兼具高选择性高渗透性超滤膜,其制备过程与实施例1基本相同,不同仅在于:步骤二中,单宁酸水溶液浓度为50g/l,最终制得超滤膜5。
实施例5所制得的超滤膜5对牛血清蛋白(1g/l)的截留率为100%,对葡聚糖(1g/l,分子量150kda)的截留率为91.6%;过滤纯水的比通量为277lm-2h-1bar-1,过滤1g/l牛血清蛋白水溶液的比通量为228lm-2h-1bar-1,操作60min并用纯水剪切流清洗10min后通量恢复率为95.8%。
本发明实施例1至4制得的高选择性高渗透性超滤膜与对比例制得的对比超滤膜的性能比较情况如下表所示:
综上,本发明提供的兼具高选择性高渗透性超滤膜的制备方法,该制备方法通过单宁酸和普朗尼克f127在成膜过程中的界面组装优化膜孔参数——增加孔密度并减少孔尺寸,使制备的超滤膜兼具高选择性和高渗透性。随着凝固浴中单宁酸浓度从0g/l提升至20g/l,所得超滤膜的选择性、渗透性和抗污染性能均有所提升,随着单宁酸浓度从20g/l继续提升至50g/l,所得超滤膜选择性继续提升,渗透性有所降低,抗污染性能保持稳定。
尽管上面结合附图、附表对本发明进行了描述,但是本发明并不局限于上述的具体实施方式,上述的具体实施方式仅仅是示意性的,而不是限制性的,本领域的普通技术人员在本发明的启示下,在不脱离本发明宗旨的情况下,还可以做出很多变形,这些均属于本发明的保护之内。
- 还没有人留言评论。精彩留言会获得点赞!