一种基于氧化石墨烯接枝脲酶的核壳结构类肝素微球及其制备方法和应用与流程
本发明属于血液净化领域,具体涉及一种基于氧化石墨烯接枝脲酶的核壳结构类肝素微球及其制备方法和应用。
背景技术:
慢性肾脏疾病(ckd)是一个世界性的健康问题,它不仅会引起肾衰竭,而且会导致心血管疾病(cvd)等并发症的发生。对于ckd患者来说,过量的尿毒症毒素积聚在体内,无法有效排出体外。血液灌流是清除尿毒症毒素的常用方法之一。虽然已经开发出活性炭、沸石等吸附剂来吸附尿素,但由于尿素在水溶液中具有较高的溶解性和稳定性,目前还没有发现有效的物理吸附材料来去除尿素。
脲酶是一种氨基水解酶,其活性部位含有两个镍(ii)离子,能催化尿素分解为氨和碳酸。游离脲酶和固定化脲酶都可以用来分解尿素,但游离脲酶很难直接被利用,因为它在血液中存留可能会产生负面影响。因此,脲酶应通过物理吸附、包埋和共价接枝等方法固定在合适的基材上。在一些研究中固定化脲酶已经被应用于生物传感器或净水领域,还有一些研究主要集中在温度和ph值对脲酶活性的影响,而利用固定化脲酶进行血液净化的研究还比较少。
氧化石墨烯(go)作为一种二维纳米片层材料,是可用于固定酶的很好的基材,因为其具有良好的物理化学性质,比如高的比表面积、在水溶液中良好的分散性、高的力学性能和丰富的官能团。例如,通过主-客体相互作用将辣根过氧化物酶固定到氧化石墨烯上来制作电化学生物传感器,通过共价接枝将脂肪酶固定化到氧化石墨烯上后用于有机催化,通过一锅法将漆酶固定后用于清除染料。但是很少有将脲酶固定到氧化石墨烯上后用于血液灌流清除血液毒素尿素的报道。所以,将氧化石墨烯作为脲酶固定的基材是可行的。然而,氧化石墨烯具有较差的血液相容性,当其直接和血液接触时会造成负面影响,且游离的二维纳米片层也不能轻易从血液中分离出来。
技术实现要素:
本发明的目的在于:提供一种基于氧化石墨烯接枝脲酶的核壳结构类肝素微球及其制备方法和应用,有效提高了氧化石墨烯的血液相容性和分离性,能在血液灌流中高效清除尿素。
本发明采用的技术方案如下:
一种基于氧化石墨烯接枝脲酶的核壳结构类肝素微球的制备方法,包括以下步骤:
s1.核心层制备:将氧化石墨烯分散于ph为7.4-7.6的pbs缓冲盐溶液中,再加入nhs和edc混合均匀,然后加入脲酶,在3-5℃下反应10-15h,得到脲酶固定化的氧化石墨烯溶液;
s2.壳层制备:将pes溶解在dmac中,然后加入aa、amps、aibn和mba,在氮气气氛下、75-80℃反应10-15h,得到类肝素聚合物溶液;
s3.微球制备:将s1步骤制得的脲酶固定化的氧化石墨烯溶液滴入s2步骤制得的类肝素聚合物溶液中,随即捞出放入pbs溶液中,即得。
本发明中,nhs为n-羟基琥珀酰亚,edc为1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐,pes为聚醚砜,dmac为二甲基乙酰胺,aa为丙烯酸,amps为2-丙烯酰胺-2-甲基丙磺酸,aibn为偶氮二异丁腈,mba为nn-亚甲基双丙烯酰胺。
本发明中,首先制备了氧化石墨烯,采用碳二酰亚胺法将脲酶固定在氧化石墨烯片上,得到核心溶液;采用原位交联聚合法制备了类肝素聚合物,得到了壳层溶液;再通过相转变得到了核壳结构微球。该微球具有多孔的壳层和核心结构,允许尿素扩散,同时脲酶固定化的氧化石墨烯不泄漏。通过相关试验表明,微球具有良好的血液相容性,低的溶血率,抑制的补体激活和接触激活,延长的凝血时间。
具体原理为:采用碳二酰亚胺法,将脲酶固定在氧化石墨烯薄片上,制备了核心溶液。向氧化石墨烯悬浮液中加入edc/nhs,活化氧化石墨烯的羧基;再采用原位交联聚合法合成了壳层溶液。选择aa和amps作为功能单体,分别引入了羧基和磺酸基。aibn和mba作为引发剂和交联剂。然后将核心溶液滴入壳层溶液中,用两相倒置法,3秒后将初制得的微球转移到pbs中。通过反向-正向相转化法得到核壳结构微球。
进一步地,s1步骤中分散后的氧化石墨烯溶液的浓度为0.8-1mg/ml。
进一步地,s1步骤中脲酶、nhs和edc的质量比为18-20:1:1.2-1.8。
进一步地,s1步骤中脲酶、nhs和edc的质量比20:1:1.5。
进一步地,s2步骤中pes与dmac的质量比为1:10-12。
进一步地,s2步骤中pes与dmac的质量比为1:11.1。
进一步地,s2步骤中aa、amps、aibn和mba的质量比为95-100:70-80:3-5:5-8。
进一步地,s2步骤中aa、amps、aibn和mba的质量比为96:72:4:6。
采用上述的制备方法制备得到的基于氧化石墨烯接枝脲酶的核壳结构类肝素微球。
上述的基于氧化石墨烯接枝脲酶的核壳结构类肝素微球在清除血液中尿素的应用。
综上所述,由于采用了上述技术方案,本发明的有益效果是:
1、本发明中,采用相转化法制备了脲酶固定化氧化石墨烯核壳型类肝素微球,具体采用碳二酰亚胺法将脲酶固定在氧化石墨烯片上,得到核心溶液;采用原位交联聚合法制备了类肝素聚合物,得到了壳层溶液;再通过相转变得到了核壳结构微球,该微球具有多孔的壳层和核心结构,允许尿素扩散,同时脲酶固定化的氧化石墨烯不泄漏;
2、本发明通过相关试验表明,微球具有良好的血液相容性,低的溶血率,抑制的补体激活和接触激活,延长的凝血时间;脲酶在氧化石墨烯上的固定化对尿素的去除起着至关重要的作用,尿素去除量高,去除率高,且该微球可重复使用,并具有持续的去除活性;
3、本发明的微球填充柱还可用于透析液再生,为可穿戴式人工肾的研究奠定基础。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
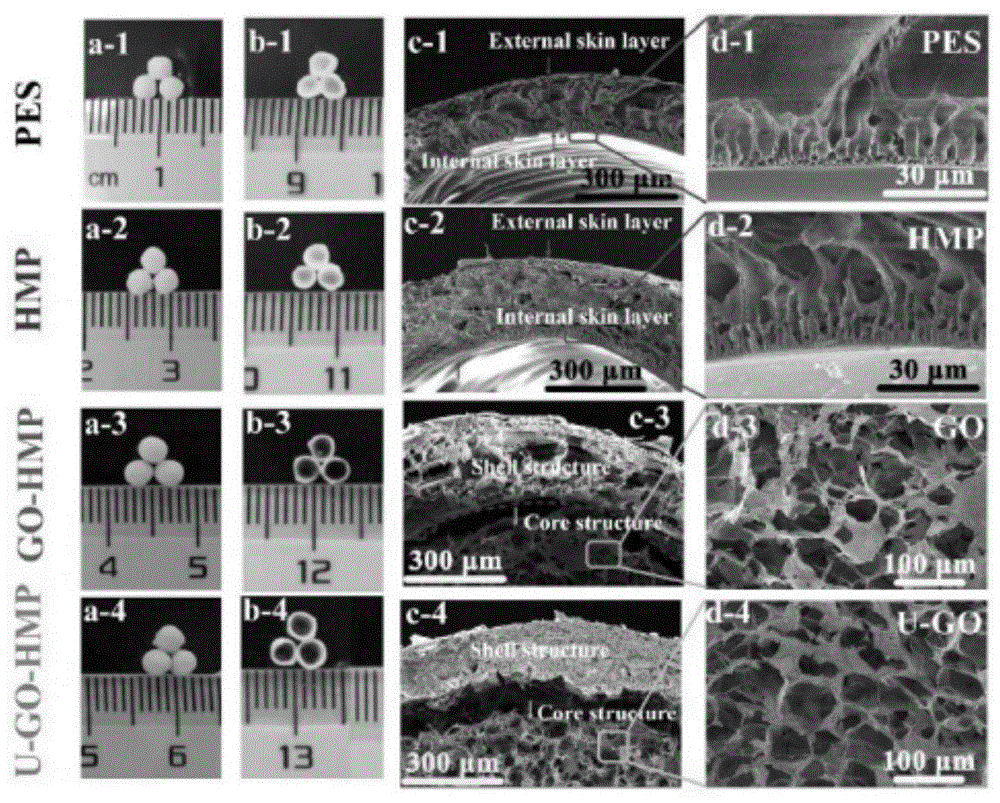
图1为pes、hmp、go-hmp和u-go-hmp微球的全视图(a)和横截面视图(b)以及横截面形貌sem图(c和d);
图2为atr-ftir谱(a和b)和xps(c和d)分析图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明,即所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。通常在此处附图中描述和示出的本发明实施例的组件可以以各种不同的配置来布置和设计。
因此,以下对在附图中提供的本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明的实施例,本领域技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
需要说明的是,术语“第一”和“第二”等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个……”限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本发明较佳实施例提供的一种基于氧化石墨烯接枝脲酶的核壳结构类肝素微球的制备方法,具体步骤如下:
s1.核心层制备:将氧化石墨烯分散于ph为7.4-7.6的pbs缓冲盐溶液中,得到溶液浓度为1mg/ml;再加入0.01gnhs和0.015gedc混合均匀,然后加入0.2g脲酶,在4℃下反应12h,得到脲酶固定化的氧化石墨烯溶液,使用前在4℃保存;
s2.壳层制备:将8gpes溶解在88.8gdmac中,得到均匀溶液,然后加入0.96gaa、0.72gamps、0.04gaibn和0.06gmba,在氮气气氛下、75℃反应12h,冷却至室温,得到类肝素聚合物溶液;
s3.微球制备:将s1步骤制得的脲酶固定化的氧化石墨烯溶液滴入s2步骤制得的类肝素聚合物溶液中,随即捞出放入pbs溶液中,即得。
实施例2
本发明较佳实施例提供的一种基于氧化石墨烯接枝脲酶的核壳结构类肝素微球的制备方法,具体步骤如下:
s1.核心层制备:将氧化石墨烯分散于ph为7.4-7.6的pbs缓冲盐溶液中,得到溶液浓度为1mg/ml;再加入0.01gnhs和0.015gedc混合均匀,然后加入0.18g脲酶,在4℃下反应12h,得到脲酶固定化的氧化石墨烯溶液,使用前在4℃保存;
s2.壳层制备:将8gpes溶解在89gdmac中,得到均匀溶液,然后加入0.97gaa、0.73gamps、0.04gaibn和0.06gmba,在氮气气氛下、75℃反应12h,冷却至室温,得到类肝素聚合物溶液;
s3.微球制备:将s1步骤制得的脲酶固定化的氧化石墨烯溶液滴入s2步骤制得的类肝素聚合物溶液中,随即捞出放入pbs溶液中,即得。
实施例3
本发明较佳实施例提供的一种基于氧化石墨烯接枝脲酶的核壳结构类肝素微球的制备方法,具体步骤如下:
s1.核心层制备:将氧化石墨烯分散于ph为7.4-7.6的pbs缓冲盐溶液中,得到溶液浓度为1mg/ml;再加入0.01gnhs和0.017gedc混合均匀,然后加入0.2g脲酶,在4℃下反应12h,得到脲酶固定化的氧化石墨烯溶液,使用前在4℃保存;
s2.壳层制备:将8gpes溶解在90gdmac中,得到均匀溶液,然后加入0.97gaa、0.75gamps、0.04gaibn和0.07gmba,在氮气气氛下、75℃反应12h,冷却至室温,得到类肝素聚合物溶液;
s3.微球制备:将s1步骤制得的脲酶固定化的氧化石墨烯溶液滴入s2步骤制得的类肝素聚合物溶液中,随即捞出放入pbs溶液中,即得。
实验例
实施例1制得的微球命名为u-go-hmp,分别按照本发明的制备方法,分别制备核心溶液为去离子水、游离脲酶和氧化石墨烯的微球,分别命名为hmp、u-hmp和go-hmp,再制备以去离子水为核心,8wt%的pes溶液为壳层的纯pes微球。
1、微球的表征
采用扫描电镜(sem,apreoshivac,fei,usa)、衰减全反射-傅里叶变换红外光谱(atr-ftir)(nicolet560)、x-射线电子光谱(xps,thermoescalab250xi光谱仪)对所制备微球进行表征。
由图1可知,制备的微球为球形,直径约为2-3mm。pes、hmp、go-hmp和u-go-hmp微球的壳结构均为多孔结构,允许小分子(如尿素)扩散到微球中。在壳体内外侧均可观察到表皮层,这是由于两相转化过程所致。因此,go-hmp和u-go-hmp微球的壳结构可以阻止氧化石墨烯扩散出去。此外,在壳体内侧可以观察到指状结构,这是典型pes结构,是由于氧化石墨烯在冻干过程中自组装而引起的。
由图2可知,对于壳层,hmp出现了一个新的峰值(1730cm-1),这是由于聚丙烯酸羰基伸缩振动引起的,而对于pes在此处则没有出现峰值。结果表明,原位交联聚合成功地引入了官能团。对go-hmp和u-go-hmp的atr-ftir扫描结果如图2b所示,在1634cm-1处和1546cm-1处观察到典型的双峰,为伯胺的特征峰。u-go-hmp在3273cm-1处也有一个宽的吸收峰,这是一个典型的羟基吸收峰。结果表明,脲酶可以固定在氧化石墨烯上。
此外,x射线光电子能谱结果显示,hmp中出现了新的峰n1s(图2c),氮元素的原子百分比增加,这可能与hmp中存在mba有关。u-go-hmp与go-hmp相比出现了一个新的峰值n1s(图2d),氮元素的原子百分比为9.25%。结果表明,go-hmp和u-go-hmp两种微球的核心均不含硫元素,而hmp壳层的硫原子含量为5.82%。
2、血液相容性
(1)血常规
作为血液接触材料,血液相容性非常重要。检测血常规,考察制备的微球的影响,血细胞计数实验表明,制备的微球对全血细胞(wbc)、红细胞(rbc)和血小板(plt)的计数几乎没有影响。红细胞体积分布和血小板体积分布结果表明,与制备的微球共培养后,体积分布无明显变化。因此,微球对血细胞的影响不大。
(2)细胞相容性
细胞相容性是考虑血液中接触材料的另一个关键因素。从实验结果可以看出,所有的微球溶血率都较低,远低于评价生物材料红细胞相容性的国际标准5%。u-go-hmp微球处理后的红细胞,其形态保持良好,未发生变形,且没有受损细胞。因此,所制备的微球与红细胞具有良好兼容性。
(3)补体激活以及血小板粘附和接触激活
补体激活被认为是宿主防御机制的触发机制,是由局部炎症介质产生的。补体的活化也可以反映生物材料的血液相容性。c3a和c5a是补体系统的活化产物,通常用于评价补体的活化。用elisa法对产生的c3a和c5a进行检测。与全血(对照组)相比,制备的微球c3a浓度略有下降。c5a的结果显示对照样品与制备的微球没有明显差异。因此,所制备的微球与全血接触时不引起炎症。
血小板粘附和聚集到生物界面被认为是血栓形成的一个关键步骤。因此,需要检测粘附在制备的微球上的血小板的形态和数量。实验结果显示,在pes微球上附着大量血小板,部分血小板变形,形状不规则,呈伪足状。而u-go-hmp微球几乎未见血小板,说明羧基和磺酸基功能化pes微球具有良好的血液相容性。接触激活是由激活因子xii启动的,激活因子xii将前激肽转化为血浆激肽,导致最终的内源性凝血。本研究采用凝血酶-抗凝血酶iii复合物(tat)测定凝血酶的产生。结果表明,微球中tat的浓度均低于对照样品。因此,制备的微球具有抑制接触激活的作用。
(4)凝血时间
凝血过程包括外在途径、内在途径和共同途径三种途径,是多个凝血因子依次被激活的连锁反应。本研究采用aptt和tt研究内在通路,pt用于外在通路,实验结果表明,所制备的微球aptt有所延长,而tt和pt结果差异不明显,因此,制备的微球不会加速血栓形成。
3、尿素清除能力
(1)尿素溶液中尿素去除能力
为了研究所制备的微球对尿素的去除能力,采用pbs溶解尿素法制备了一系列不同浓度的尿素溶液。在37℃将约10毫克hmp、go-hmp、u-go-hmp微球和333g游离脲酶分别加入10毫升尿素溶液(80mg/dl),不断轻微摇晃混匀。采用qc-u试剂盒检测尿素浓度,并对制备的微球对尿素的去除能力进行评价。
为了确定尿素浓度对去除率的影响,在37℃条件下,在40mg/dl、60mg/dl和80mg/dl的尿素溶液中分别加入约10mgu-go-hmp微球,在37℃条件下连续轻轻振荡,然后检测处理后溶液的浓度。
实验结果显示,hmp和go-hmp微球在240分钟后几乎没有尿素被清除,480分钟后清除率仅为10%。尿素水溶液为高度可溶和稳定的,很难被hmp或go-hmp微球清除。而u-go-hmp微球的清除率随时间的增加而明显增加。150分钟清除率超过50%,480分钟后达到83.8%。结果显示在尿素清除中固定化脲酶发挥了重要作用。
比较游离脲酶和固定化脲酶的尿素清除能力,结果表明,游离脲酶在开始时去除率较高,30min后去除率为76.9%,进一步达到95.2%,经过240分钟后,再随时间的增加而放缓。而对于u-go-hmp微球,虽然30min后去除率仅为11.7%,但240min后去除率可达67.1%,480min后去除率可达83.8%。这可能是由于壳层的扩散限制造成的。说明尿素只有在扩散到u-go-hmp微球中才能被去除,这需要一定的时间。
针对不同浓度的尿素,u-go-hmp微球的去除量不同。高浓度尿素的去除量增加。对于80mg/dl,60mg/dl和40mg/dl浓度的尿素溶液,其尿素清除量约635mg/g,475mg/g和312mg/g。
(2)透析液中尿素去除能力
对收集到的透析液进行尿素清除。大约10毫克hmp、go-hmpu-go-hmp微球和333g游离脲酶分别加入10毫升收集的透析液。均在37℃下振荡,每隔一定时间测定尿素浓度。
此外,还制备了u-go-hmp微球填充柱,研究了动态条件下收集到的透析液对尿素的去除能力。详细的实验步骤如下所示。u-go-hmp微球被紧密地装入注射器中,高度约为10毫米。然后将10ml收集到的透析液中的以1ml/min的流速导入柱中。将透析液回收5次,使用荧光定量法测定尿素浓度。
虽然传统的血液透析可以去除尿素,但每次透析需要大量的透析液,对环境不友好,也是一个昂贵的过程。因此,如果能有效地从透析液中去除尿素,就可以很容易地再生透析液;透析液用量也会减少。因此,测试了收集到的透析液对尿素的去除能力,结果表明,对于hmp和go-hmp两种微球,随着时间的推移,几乎没有尿素被去除。对于游离脲酶,30min后去除率为85%,480min后去除率随时间的增加而减缓,达到90%。而u-go-hmp微球,去除率随时间的增加而明显增加,与尿素溶液的尿素去除率结果相一致,480min后可达到61%。u-go-hmp填充柱动态去除尿素实验表明,虽然流量1ml/min下5周期后去除比例只有23%,但5个周期的总治疗时间很短(约50分钟),与此同时,去除比率持续增长。因此,u-go-hmp微球在透析液再生领域具有潜在的应用前景。
4、稳定性和可重用性
将约6mgu-hmp和u-go-hmp微球分别浸泡于5mlpbs中,37℃孵育不同时间。然后用micro-bca检测吸光度,探测泄漏到pbs中的脲酶的量。
u-go-hmp微球的可重用性测试,将制备好的微球约10mg加入10ml尿素溶液(80mg/dl)中,37℃振荡。150min后,取出处理过的尿素溶液,pbs洗涤3次,再转至新鲜10ml尿素溶液中重复使用。重复上述步骤5次。将第一次的相对活度设为100%,对于其他的循环,通过与第一次循环的比较,可以得出重复性。
脲酶泄露实验表明,u-hmp微球吸光度随着时间的推移而增加,而u-go-hmp微球的吸光度接近于零。这说明,游离脲酶(包埋于hmp壳内)随时间的推移会渗漏,而固定化脲酶(u-go)未从u-go-hmp微球中渗漏出。
对u-go-hmp微球的可重用性实验表明,经过5次循环后,u-go-hmp微球的相对活性几乎没有下降。因此,u-go-hmp微球具有良好的稳定性和可重复使用性。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!