一种复合微球及其制备和在磷酸化肽吸附中的应用的制作方法
1.本发明涉及一种可重复使用的复合微球的制备方法及磷酸化肽吸附应用。具体是以环氧树脂微球为基质,利用环氧-胺开环反应将表面带有氨基的纳米金刚石键合在微球表面。因其表面含有氨基,可以与2,3,4-三羟基苯甲醛发生氨醛缩合反应,将联苯三酚基团引入微球表面。以其作为配体螯合钛离子(ti
4+
),得到可以用作imac吸附剂的复合微球。
背景技术:
2.蛋白质的磷酸化是蛋白质翻译后修饰中常见的一种形式,它可以调节多种复杂的生物学过程如信号传导、分子识别和代谢等。然而,蛋白质磷酸化的异常会引发一些疾病的产生。因此,磷酸化多肽的分析对于疾病的治疗有着很重要的现实意义(文献1.q.sheng,et.al.“synthesis of al
3+-doping-tio
2 monodisperse microspheres and their application for phosphopeptides and glycopeptides enrichment”talanta,2021,223,1-8)。质谱技术因其灵敏度高、分析速度快等特点已被广泛用于磷酸化肽段的分析中。然而,由于非磷酸肽的干扰,未经预处理的磷酸肽丰度低,难以被检测到。所以在质谱分析前,从复杂生物样品中有效富集磷酸肽是必不可少的(文献2.j.arrington,et.al.“analytical challenges translating mass spectrometry-based phosphoproteomics from discovery to clinical applications”electrophoresis,2014,35,3430-3440)。此前发展了很多用于磷酸化多肽分离富集的方法。例如,金属氧化物亲和色谱法,免疫亲和捕获法,固定化金属离子亲和色谱法和离子交换色谱法等。其中,固定化金属离子亲和色谱法因对磷酸肽独特的选择性和良好的富集能力得到了广泛的应用(文献3.许静静等.“翻译后修饰蛋白质组学分离方法的研究进展”色谱,2016,34,1199-1205)。固定化金属离子亲和色谱法是利用固定在材料上的金属离子高选择性螯合带负电的磷酸根,从而实现对磷酸化肽段的富集(文献4.邓玉皎等.“磷酸化蛋白质组学在乳腺癌中的研究发展”医学新知,2020,30,449-456)。
3.近年来发展了很多富集磷酸化肽的材料。例如,qing等将一个能高效识别磷酸的单体-对羧基苯基硫脲与多孔硅胶基质进行复合,制备了一种可以识别多磷酸化肽的共聚物(文献5.g.qing,et.al.“hydrogen bond based smart polymer for highly selective and tunable capture of multiply phosphorylated peptides”nat.commun.2017,10,461)。zhang等通过水热法将乙烯基磷酸和葡萄糖合成一种碳质球材料,用于磷酸肽的富集(文献6.h.zhang,et.al.“one-step preparation of phosphate-rich carbonaceous spheres via a hydrothermal approach for phosphopeptide analysis”green chem.2019,21,2052-2060)。但这些材料均是一次性的,本发明中合成的复合微球材料选择性高且可重复使用。该复合材料中ti
4+
与2,3,4-三羟基苯甲醛之间的强作用力使得富集洗脱后ti
4+
不被破坏,因此,该材料能被重复使用。
技术实现要素:
4.本发明涉及一种可重复利用的复合微球的制备方法及磷酸化肽吸附应用。该材料以表面带有环氧基团的树脂微球为基质,通过环氧-胺开环反应将带氨基化纳米金刚石引入微球表面。微球表面引入的氨基与2,3,4-三羟基苯甲醛发生氨醛缩合反应,使其表面带有联苯三酚基团,此基团作为配体螯合ti
4+
。制备的复合微球材料用作imac吸附剂,用于复杂样品中磷酸化肽的分离富集。该复合微球材料结构如下:
[0005][0006]
该复合微球材料具体制备过程包括如下步骤:
[0007]
(1)制备表面带有氨基的微球:将50~100mg带氨基的纳米金刚石超声分散在20~30ml乙醇/乙二醇(1/2~2/1,体积比)混合溶液中,加入100~300mg环氧树脂微球。在50~80℃下,以100~200rpm的转速,机械搅拌4~10h,反应结束用10~50ml乙醇洗涤3~5次。
[0008]
(2)复合微球表面引入联苯三酚基团:将100~300mg上述步骤(1)中得到的表面带有氨基的微球分散在10~30ml浓度为1~3mg/ml的2,3,4-三羟基苯甲醛的乙醇溶液中,60~80℃下,机械搅拌100~200rpm反应4~10h,反应结束用乙醇洗涤3~5次。将洗涤后的产物分散在20~30ml浓度为1~3mg/ml的硼氢化钠水溶液中,20~30℃下,在旋转孵育器中以20~40rpm的转速,反应4~10h,反应结束用水洗至中性。
[0009]
(3)复合微球表面引入钛离子:用20~30ml乙二醇-水(1/4~1/2,体积比)溶液溶解硫酸钛,配制成浓度为1/5~1/2g/ml的溶液,加入上述产物中,以20~40rpm的速度孵育震荡12~24h,反应结束用水洗涤至中性,60~80℃真空干燥6~12h,得到复合微球。
[0010]
所述复合微球可用于生物样品中磷酸肽的分离富集。
[0011]
本发明具有如下优点:
[0012]
(1)制备的材料对磷酸肽的富集效率高,选择性能好。
[0013]
(2)材料可重复使用,绿色环保,有良好的应用前景。
附图说明
[0014]
图1.实施例中复合微球的制备与使用示意图。
[0015]
图2.实施例1中复合微球-1的x-射线光电子能谱图。
[0016]
图3.实施例中复合微球的氦离子扫描电镜图。(a)为未修饰的环氧树脂微球;(b)为实施例1中的复合微球-1;(c)为实施例2中的复合微球-2;(d)为实施例3中的复合微球-3。
[0017]
图4.实施例中复合微球的氮气吸附脱附等温线图和孔径分布图。(a)和(b)分别为实施例1中的复合微球-1;(c)和(d)分别为实施例2中的复合微球-2;
[0018]
(e)和(f)分别为实施例3中的复合微球-3。
[0019]
图5.实施例中复合微球富集β-酪蛋白酶解液的质谱分析图。(a)直接检测图;(b)实施例1中复合微球-1的第一次富集图;(c)实施例2中复合微球-2第一次富集图;(d)实施
例3中复合微球-3的第一次富集图。(*)代表磷酸肽,代表去磷酸化片段。
[0020]
图6.实施例中复合微球富集β-酪蛋白酶解液的循环使用图。(a)实施例1中复合微球-1循环10次结果;(b)实施例2中复合微球-2循环10次结果;(c)实施例3中复合微球-3循环10次结果。
[0021]
图7.实施例中复合微球循环使用第10次的β-酪蛋白酶解液富集图。(a)为实施例1中复合微球-1的富集结果;(b)实施例2中复合微球-2的富集结果;(c)实施例3中复合微球-3的富集结果。(*)代表磷酸肽,代表去磷酸化片段。
[0022]
图8.实施例中复合微球富集β-酪蛋白与牛血清白蛋白混合酶解液(1/100,m/m)前后的质谱分析对比图。(a)富集前图;(b)实施例1富集混合酶解液后图;(c)实施例2富集混合酶解液后图;(d)实施例3富集混合酶解液后图。(*)代表磷酸肽,代表去磷酸化片段。
[0023]
图9.商品化imac材料富集β-酪蛋白酶解液质谱分析图。
具体实施方式
[0024]
可重复使用的复合微球的制备及磷酸肽的分离富集
[0025]
实施例1
[0026]
可重复使用的复合微球-1的制备:
[0027]
1.制备表面带有氨基的微球:在圆底烧瓶中将100mg氨基化纳米金刚石(纳米金刚石(氨基修饰),供应商:tci,tci(东京化成工业株式会社,日本),cas:7782-40-3,产品编码:n0968生产批号:6c8ra-kp,粒径2~10nm,以下实施例中采用的氨基化纳米金刚石原料与此处相同)超声分散在25ml乙醇/乙二醇(1/2,体积比)混合溶液中,加入300mg环氧树脂微球(粒径2.7~3.0μm,以下实施例中采用的环氧树脂微球与此处相同),在80℃下,以120rpm的转速,机械搅拌4h,反应结束用50ml乙醇洗涤3次。
[0028]
2.复合微球表面引入联苯三酚基团:将300mg上述步骤(1)中得到的表面带有氨基的微球分散在20ml浓度为2mg/ml的2,3,4-三羟基苯甲醛的乙醇溶液中,60℃下,机械搅拌130rpm反应4h,反应结束用乙醇洗涤5次。将洗涤后的产物分散在20ml浓度为1.2mg/ml的硼氢化钠水溶液中,25℃下,在旋转孵育器中以40rpm的转速,反应4h,反应结束用水洗至中性。
[0029]
3.复合微球表面引入钛离子:用20ml乙二醇-水(1/4,体积比)溶液溶解硫酸钛,配制成浓度为1/5g/ml的溶液,加入上述步骤(2)中得到的产物中,以40rpm的速度孵育震荡16h,反应结束用水洗涤至中性,60℃真空干燥6h,得到复合微球。
[0030]
酶解样品的制备:将10mgβ-酪蛋白酶解液溶于含8m尿素和100mm的碳酸氢铵溶液中,调至ph值约为8.2。加入100μmol二硫苏糖醇,涡旋混匀,56℃恒温水浴反应1h后加入37mg碘代乙酰胺的水溶液,避光反应35min。加入50mm三羟甲基氨基甲烷盐酸盐缓冲溶液将尿素稀释至1m,按酶与蛋白质量比1:25加入胰蛋白酶,混匀后在37℃水浴中酶解18h。将所得酶解液用spe柱除盐后冻干,保存在-20℃冰箱中。牛血清白蛋白酶解同上。
[0031]
磷酸化肽的富集:称取3mg复合微球材料,用200μl乙腈-水溶液(acn/h2o/tfa,80/14/6,v/v/v)震荡平衡3次,每次15min,离心除去上清液。将沉淀加入200μl溶有10μgβ-酪蛋白的乙腈溶液中,震荡30min,离心弃去上清液。然后用含有200mm氯化钠的乙腈-水溶液(
acn/h2o/tfa
,50/44/6,v/v/v)洗去非磷酸化肽段,用30%乙腈溶液(
acn/h2o/tfa
,30/69.9/0.1,
v/v/v)除去盐。最后用100μl质量比为10%的氨水进行特异性洗脱,震荡15min,离心收集上清液进行maldi-tof/ms分析。
[0032]
maldi-tof/ms分析过程:
[0033]
取0.5μl磷酸肽洗脱液滴至madli靶,待自然晾干后,吸取0.5μl浓度为25mg/ml的2,5-二羟基苯甲酸溶液覆盖到样品点上。待完全晾干后,在质谱仪中进行分析。
[0034]
实施例2
[0035]
可重复使用的复合微球-2的制备:
[0036]
1.制备表面带有氨基的微球:在圆底烧瓶中将75mg氨基化纳米金刚石超声分散在25ml乙醇/乙二醇(1/2,体积比)混合溶液中,加入300mg环氧树脂微球,在80℃下,以120rpm的转速,机械搅拌4h,反应结束用50ml乙醇洗涤3次。
[0037]
2.复合微球表面引入联苯三酚基团:将300mg上述步骤(1)中得到的表面带有氨基的微球分散在20ml浓度为2mg/ml的2,3,4-三羟基苯甲醛的乙醇溶液中,60℃下,机械搅拌130rpm反应4h,反应结束用乙醇洗涤5次。将洗涤后的产物分散在20ml浓度为1.2mg/ml的硼氢化钠水溶液中,25℃下,在旋转孵育器中以40rpm的转速,反应4h,反应结束用水洗至中性。
[0038]
3.复合微球表面引入钛离子:用20ml乙二醇-水(1/4,体积比)溶液溶解硫酸钛,配制成浓度为1/5g/ml的溶液,加入上述产物中,以40rpm的速度孵育震荡16h,反应结束用水洗涤至中性,60℃真空干燥6h,得到复合微球。
[0039]
磷酸化肽的富集与分析:过程同实施例1(过程包括酶解样品的制备、磷酸化肽的富集、maldi-tof/ms分析过程)。
[0040]
实施例3
[0041]
可重复使用的复合微球-3的制备:
[0042]
1.制备表面带有氨基的微球:在圆底烧瓶中将50mg氨基化纳米金刚石超声分散在25ml乙醇/乙二醇(1/2,体积比)混合溶液中,加入300mg环氧树脂微球,在80℃下,以120rpm的转速,机械搅拌4h,反应结束用50ml乙醇洗涤3次。
[0043]
2.复合微球表面引入联苯三酚基团:将300mg上述步骤(1)中得到的表面带有氨基的微球分散在20ml浓度为2mg/ml的2,3,4-三羟基苯甲醛的乙醇溶液中,60℃下,机械搅拌130rpm反应4h,反应结束用乙醇洗涤5次。将洗涤后的产物分散在20ml浓度为1.2mg/ml的硼氢化钠水溶液中,25℃下,在旋转孵育器中以40rpm的转速,反应4h,反应结束用水洗至中性。
[0044]
3.复合微球表面引入钛离子:用20ml乙二醇-水(1/4,体积比)溶液溶解硫酸钛,配制成浓度为1/5g/ml的溶液,加入上述产物中,以40rpm的速度孵育震荡16h,反应结束用水洗涤至中性,60℃真空干燥6h,得到复合微球。
[0045]
磷酸化肽的富集与分析:过程同实施例1(过程包括酶解样品的制备、磷酸化肽的富集、maldi-tof/ms分析过程)。
[0046]
商品化imac材料用于磷酸化肽的分离富集
[0047]
对比例4
[0048]
磷酸化肽的富集:称取5mg商品化imac材料(购自sigma),用200μl乙腈-水溶液(acn/h2o/tfa,80/14/6,v/v/v)震荡平衡3次,每次15min,离心除去上清液。将沉淀加入200
μl溶有10μgβ-酪蛋白的80%乙腈-水溶液中,震荡30min,离心弃去上清液。然后用含有200mm氯化钠的乙腈-水溶液(acn/h2o/tfa,50/44/6,v/v/v)洗去非磷酸化肽段,用乙腈-水溶液(acn/h2o/tfa,30/69.9/0.1,v/v/v)除去盐。最后用100μl浓度为10%的氨水进行特异性洗脱,震荡15min,离心收集上清液进行maldi-tof/ms分析。
[0049]
磷酸化肽的富集与分析:过程同实施例1(过程包括酶解样品的制备、maldi-tof/ms分析过程)。
[0050]
材料表征
[0051]
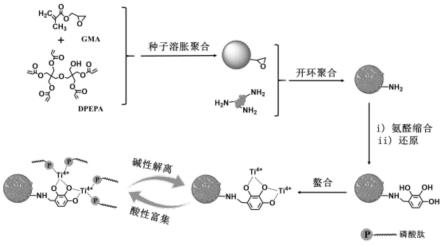
图1为实施例中复合微球的制备与重复使用示意图。首先,通过溶胀聚合法合成表面带有环氧的树脂微球,在其表面键合带有氨基的纳米金刚石,两者发生环氧-胺开环反应,使微球表面带上氨基。然后,微球表面的氨基与2,3,4-三羟基苯甲醛发生氨醛缩合反应,将联苯三酚基团引入微球表面。最后,以此基团为配体螯合金属ti,合成的复合微球材料用于磷酸肽的富集。该材料中的ti
4+
在酸性条件下与磷酸根结合,选择性富集样品中的磷酸肽。在碱性条件下,ti
4+
与磷酸根解离,收集上清液做质谱检测。
[0052]
图2为实施例1中复合微球-1的x-射线光电子能谱图,其用来表征材料中的ti元素。复合微球的全谱图中出现了ti元素的峰。ti元素来源于配体的螯合作用。这说明钛离子被成功固定了在材料表面。
[0053]
图3为扫描电镜图。(a)为未修饰的环氧树脂微球;(b)为实施例1中的复合微球材料-1;(c)为实施例2中的复合微球材料-2;(d)为实施例3中的复合微球材料-3。从图中可以看出,未修饰的树脂微球表面几乎无孔。其粒径为2.7~3.0μm,平均直径为3.9nm,比表面积为4.05m2/g。被修饰后微球表面变得粗糙,很明显可以看到表面修饰了一层纳米金刚石。其中,复合微球材料-1修饰的厚度约为135nm,复合微球材料-2修饰的厚度约为240nm,复合微球材料-3修饰的厚度约为300nm。氮气吸附脱附实验结果(图4)显示,三种材料的孔径分布均较宽。其中,复合微球-1的平均直径为14.4nm,比表面积为55.4m2/g;复合微球-2的平均直径为13.3nm,比表面积为27.0m2/g;复合微球-3的平均直径为12.4nm,比表面积为30.8m2/g。
[0054]
材料应用
[0055]
图5为实施例中复合微球材料富集β-酪蛋白酶解液前后的对比图。其中,a为富集前质谱分析图,几乎检测不出特征磷酸化肽段(2061、2556、3121,m/z)。b、c和d分别为实施例1、2和3中被复合微球材料富集β-酪蛋白酶解液后的质谱分析图。从图中可以看出,非磷酸肽基本被淋洗干净,其信号几乎检测不出。特征磷酸肽及其去磷酸化片段均被检测出。且微球表面修饰的金刚石越多,其磷酸肽富集结果相对越好。这可能是由于表面更加粗糙而能吸附更多的磷酸化肽。为了验证复合微球材料能被循环使用,设计了一个10次的循环实验。将3mg材料用于10μgβ-酪蛋白酶解液的富集,并且将富集过程循环10次。如图6中的结果可知,10次循环后,该材料仍能富集特征磷酸肽。但整体来说富集能力有所下降。从三个材料循环使用的最后一次富集图(图7)中可以看出,多次重复后,富集效果较第一次有所下降。这是由于多次洗脱导致微球上的纳米金刚石出现脱落,进而导致富集结果下降。总的来说,循环实验验证了复合微球材料具有很好的重复使用性。
[0056]
图8为实施例中复合微球富集β-酪蛋白与牛血清白蛋白混合酶解液前后的质谱分析对比图,其用来考察对磷酸化肽的特异性吸附。富集前(图8a),由于非磷酸化肽丰度太
高,无法检测出磷酸化肽的信号峰。使用复合微球材料富集后,几乎无非磷酸肽的信号峰,特征磷酸化肽段均被检测出。说明该材料对磷酸化肽有特异性吸附。
[0057]
图9为β-酪蛋白酶解液的商品化imac材料富集图,其用来对比复合微球材料的富集性能。图9a为材料的第一次富集结果,没有明显的非磷酸肽信号干扰。但是,其富集效率不如实施例1和2。为了验证商品化材料的重复性,第一次富集完成后,重新用于β-酪蛋白酶解液的新一轮富集。结果如图9b所示,未检测出特征磷酸化肽段,说明该材料不能被重复利用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1