制备高唾液酸化免疫球蛋白的方法与流程
制备高唾液酸化免疫球蛋白的方法
1.优先权要求
2.本技术要求2020年3月5日提交的美国临时申请序列号62/985,467和2020年5月19日提交的美国临时申请序列号63/026,805的权益。上述临时申请的全部内容以引用方式并入本文。
技术领域
3.本公开涉及使igg抗体半乳糖基化的方法;制备高唾液酸化(hsigg)的方法,例如使用固定化β1,4-半乳糖基转移酶i(β4galt1);以及包含与固体载体结合的β1,4-半乳糖基转移酶i(β4galt1)的多肽和包含多肽的组合物。
背景技术:
4.由人供体的混合血浆(例如,来自至少1,000个供体的混合血浆)制备的静脉内免疫球蛋白(ivig)用于治疗各种炎性疾病。然而,ivig制剂具有不同的限制,诸如功效可变、临床风险、高成本和供给有限。不同的ivig制剂在临床上经常被当作可互换的产品,但众所周知,存在产品制剂的显著差异,这可影响在所选临床应用中的耐受性和活性。在当前的最大给药方案中,在许多情况下仅获得部分且不持续性的响应。此外,与高体积ivig治疗相关联的长输注时间(4小时至6小时)会消耗输注中心的大量资源,并且不利地影响患者报告的结果,诸如生活的便利性和质量。
5.对fc结构域唾液酸化的重要抗炎作用的鉴定已经呈现出开发更有效的免疫球蛋白疗法的机会。可商购获得的ivig制剂通常在所存在的抗体的fc结构域上表现出低水平的唾液酸化。具体地讲,它们在fc区上表现出支链聚糖的低水平二唾液酸化。
6.washburn等人(《美国国家科学院院刊》(proceedings of the national academy of sciences),usa 112:e1297
–
e1306(2015))描述了一种受控的唾液酸化工艺,以生成高度四-fc-唾液酸化的ivig,并且表明该工艺得到具有一致增强的抗炎活性的产物。
技术实现要素:
7.本文描述了使igg抗体半乳糖基化的方法,其包括:(a)提供igg抗体的混合物;以及(b)将igg抗体的混合物在反应混合物中温育,该反应混合物包含:多肽,该多肽包含与固体载体结合的人β1,4-半乳糖基转移酶i(β4galt1)的酶活性部分;和udp-gal,从而产生半乳糖基化igg抗体。
8.本文还描述了制备高唾液酸化(hsigg)的方法,其包括:(a)提供如本文所述产生的半乳糖基化igg抗体;以及(b)将半乳糖基化igg抗体在反应混合物中温育,该反应混合物包含:
9.多肽,该多肽包含人st6gal1或其酶活性部分;和cmp-nana,从而产生hsigg。
10.在一些实施方案中,制备hsigg的方法还包括:(c)将包含与固体载体结合的人β1,4-半乳糖基转移酶i(β4galt1)的酶活性部分的多肽从反应混合物中分离,从而产生再循环
利用的β4galt1;以及重复步骤(a)-(b),其中该反应混合物中的β4galt1是在步骤(c)中分离的β4galt1。
11.本文还描述了制备高唾液酸化(hsigg)的方法,其包括(a)提供igg抗体的混合物;(b)将igg抗体的混合物在反应混合物中温育,该反应混合物包含:多肽,该多肽包含与固体载体结合的人β1,4-半乳糖基转移酶i(β4galt1)的酶活性部分;和udp-gal,从而产生半乳糖基化igg抗体;以及(c)将半乳糖基化igg抗体在反应混合物中温育,该反应混合物包含:多肽,该多肽包含人st6gal1或其酶活性部分;和cmp-nana,从而产生hsigg。
12.在一些实施方案中,制备hsigg的方法还包括(d)将包含与固体载体结合的人β1,4-半乳糖基转移酶i(β4galt1)的酶活性部分的多肽从反应混合物中分离,从而产生再循环利用的β4galt1;以及重复步骤(a)-(c),其中该反应混合物中的β4galt1是在步骤(d)中分离的β4galt1。
13.在一些实施方案中,在步骤(b)之后将与固体载体结合的人β1,4-半乳糖基转移酶i(β4galt1)与半乳糖基化igg抗体分离。
14.在一些实施方案中,人β4galt1的酶活性部分包含seq id no:8。在一些实施方案中,包含人β4galt1的酶活性部分的多肽与具有1、2、3、4、5、6、7、8、9或10个氨基酸取代、添加或减去的seq id no:37、38或39或其变体具有至少85%的同一性。
15.在一些实施方案中,人st6gal1或其酶活性部分包含seq id no:14。
16.在一些实施方案中,包含人β4galt1的酶活性部分的多肽还包含亲和标签,其中亲和标签与固体载体连接。
17.在一些实施方案中,亲和标签是c端的。
18.在一些实施方案中,至少一个标签选自包括以下的组:聚组氨酸、几丁质结合蛋白(cbp)、谷胱甘肽s-转移酶(gst)、麦芽糖结合蛋白(mbp)、血细胞凝集素(ha)、myc、链霉亲和素结合肽(sbp)、钙调蛋白标签、spot-tag、链霉亲和素标签、flag-tag、生物素以及它们的组合。
19.在一些实施方案中,聚组氨酸标签包含3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个组氨酸。
20.在一些实施方案中,聚组氨酸标签包含7或8个组氨酸。
21.在一些实施方案中,固体载体是磁珠。
22.在一些实施方案中,igg抗体包含从至少1000个供体中分离的igg抗体。
23.在一些实施方案中,igg抗体的至少70%w/w是igg 1抗体。
24.在一些实施方案中,供体受试者的至少90%已经暴露于病毒。
25.在一些实施方案中,hsigg制剂中igg抗体上的支链聚糖的约60%、65%、70%、75%、80%或85%在α1,3分支和α1,6分支两者上具有唾液酸。
26.在一些实施方案中,hsigg制剂中igg抗体的fab结构域上的支链聚糖的至少40%、50%、60%、65%、70%、75%、80%或85%在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸;并且hsigg制剂中igg抗体的fc结构域上的支链聚糖的至少60%、65%、70%、75%、80%或85%在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。
27.本文还描述了一种多肽,该多肽包含:人β1,4-半乳糖基转移酶i(β4galt1)的酶活
性部分;和亲和标签,其中多肽与固体载体结合。
28.在一些实施方案中,β4galt1的酶活性部分包含seq id no:8。
29.在一些实施方案中,亲和标签包含聚组氨酸标签,该聚组氨酸标签选自由以下组成的组:hhhh(seq id no:26)、hhhhh(seq id no:27)、hhhhhh(seq id no:28)、hhhhhhh(seq id no:29)、hhhhhhhh(seq id no:30)、hhhhhhhhh(seq id no:31)和hhhhhhhhhh(seq id no:32)。
30.在一些实施方案中,固体载体是琼脂糖磁珠。
31.本文还描述了一种组合物,该组合物包含:
32.本文所述的多肽,例如包含人β1,4-半乳糖基转移酶i(β4galt1)的酶活性部分的多肽;和亲和标签,其中多肽与本文的固体载体结合;st6gal1;
33.udp-gal;cmp-nana;和igg抗体。
34.本文还描述了用于制备具有非常高的fc唾液酸化水平的免疫球蛋白g(igg)的方法。本文描述的方法可以提供高唾液酸化igg(hsigg),其中fc结构域上大于70%的支链聚糖在两个分支上(即,在α1,3分支和α1,6分支上)均被唾液酸化。hsigg含有igg抗体亚型的多样性混合物,其中igg1抗体是最普遍的,接着是igg2。抗体的多样性很高。用于制备hsigg的免疫球蛋白可以例如从人类混合血浆(例如,来自至少1,000至30,000个供体的混合血浆)获得。免疫球蛋白可以从ivig获得,包括可商购获得的ivig。hsigg在fc区上的支链聚糖上的唾液酸水平远高于ivig。这产生在结构和活性两方面不同于ivig的组合物。hsigg可以如wo2014/179601或washburn等人(proceedings of the national academy of sciences,usa 112:e1297
–
e1306(2015))中所述制备,两者均据此以引用方式并入。
35.本文描述了用于制备hsigg的改进方法,例如通过固定酶。在一些实施方案中,本文特别描述了制备高唾液酸化(hsigg)的方法,该方法包括:(a)提供igg抗体的混合物,(b)将igg抗体的混合物在包含与固体载体结合的β1,4-半乳糖基转移酶i(β4galt1,也称为b4galt或b4gal)的反应混合物中温育,以产生半乳糖基化igg抗体;(c)将半乳糖基化igg抗体在包含st6gal1(也称为st6)和cmp-nana的反应混合物中温育,从而形成hsigg制剂。
36.固定酶的有益效果包括例如能够使用相同的酶对多个hs-ivig批次进行糖基化,并简化酶与hs-ivig产物的分离。
37.在一些实施方案中,β4galt1是人β4galt1。在一些实施方案中,β4galt1与seq id no:8、37或39具有至少85%的同一性。在一些实施方案中,st6gal1包含与seq id no:15或14具有至少90%同一性的氨基酸序列。
38.在一些实施方案中,β4galt1通过至少一个标签与固体载体结合。在一些实施方案中,至少一个标签位于n端、c端处或者位于n端和c末端两者处。在一些实施方案中,至少一个标签包括以下中的至少一种:聚(his)标签、几丁质结合蛋白(cbp)、麦芽糖结合蛋白(mbp)、谷胱甘肽-s-转移酶(gst)、flag-tag、血细胞凝集素(ha)、myc、ne-tag、sbp-tag、strep-tag、钙调蛋白标签、spot-tag、生物素、其变体以及它们的组合。在一些实施方案中,至少一个标签包含3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个组氨酸。
39.在一些实施方案中,β4galt1包含seq id no:8、37或39或其变体,其具有1、2、3、4、5、6、7、8、9或10个氨基酸取代、添加或减去。在一些实施方案中,st6gal1包含seq id no:15或其变体,其具有1、2、3、4、5、6、7、8、9或10个氨基酸取代、添加或减去。
40.在一些实施方案中,在步骤(b)之前将与固体结合的β1,4-半乳糖基转移酶i(β4galt1)与半乳糖基化igg抗体分离。
41.在一些实施方案中,固体载体是柱、阵列、微阵列或固相。在一些实施方案中,柱、阵列、微阵列或固相包含金属(例如金属螯合物)、镍(例如,ni2+)、钴(例如,co2+)、几丁质、麦芽糖、gsh、抗体或纳米抗体、flag结合抗体或纳米抗体、ha结合抗体或纳米抗体、myc结合抗体或纳米抗体、ne结合抗体或纳米抗体、链霉亲和素、生物素、钙调蛋白、spot结合抗体或纳米抗体、其变体以及它们的组合。
42.在一些实施方案中,igg抗体包含从至少1000个供体中分离的igg抗体。在一些实施方案中,igg抗体的至少70%w/w是igg 1抗体。在一些实施方案中,供体受试者的至少90%已经暴露于病毒。在一些实施方案中,hsigg制剂中igg抗体上的支链聚糖的约60%、65%、70%、75%、80%或85%在α1,3分支和α1,6分支两者上具有唾液酸。在一些实施方案中,hsigg制剂中igg抗体的fab结构域上的支链聚糖的至少40%、50%、60%、65%、70%、75%、80%或85%在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸;并且hsigg制剂中igg抗体的fc结构域上的支链聚糖的至少60%、65%、70%、75%、80%或85%在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。
43.在高唾液酸化igg中,fc区上至少70%(例如,75%、80%、82%、85%、87%、90%、92%、94%、95%、97%、98%至100%且包括100%)的支链聚糖通过neuac-α2,6-gal末端键进行二唾液酸化(即,在α1,3分支和α1,6臂两者上)。在一些实施方案中,fc区上少于50%(例如,少于40%、30%、20%、15%、10%、5%、4%、3%、2%、1%)的支链聚糖通过neuac-α2,6-gal末端键进行单唾液酸化(即,仅在α1,3分支上或仅在α1,6分支上唾液酸化)。
44.在一些实施方案中,多肽源自血浆,例如人血浆。在某些实施方案中,多肽绝大多数是igg多肽(例如,igg1、igg2、igg3或igg4或它们的混合物),但是可存在痕量的其它多肽,含有痕量的其它免疫球蛋白亚类。
45.如本文所用,术语“抗体”是指包括至少一个免疫球蛋白可变区,例如,提供免疫球蛋白可变结构域或免疫球蛋白可变结构域序列的氨基酸序列的多肽。例如,抗体可以包括重(h)链可变区(在本文中缩写为vh)和轻(l)链可变区(在本文中缩写为v
l
)。在另一个示例中,抗体包括两个重(h)链可变区和两个轻(l)链可变区。术语“抗体”涵盖抗体的抗原结合片段(例如,单链抗体、fab、f(ab')2、fd、fv和dab片段)以及完整抗体,例如,iga、igg、ige、igd、igm类型(以及它们的亚型)的完整免疫球蛋白。免疫球蛋白的轻链可以是κ型或λ型。
46.如本文所用,术语“恒定区”是指对应于或源自抗体的一个或多个恒定区免疫球蛋白结构域的多肽。恒定区可以包括以下免疫球蛋白结构域中的任何或所有免疫球蛋白结构域:ch1结构域、铰链区、ch2结构域、ch3结构域(源自iga、igd、igg、ige或igm)和ch4结构域(源自ige或igm)。
47.如本文所用,术语“fc区”是指两个“fc多肽”的二聚体,每个“fc多肽”包括除第一恒定区免疫球蛋白结构域之外的抗体恒定区。在一些实施方案中,“fc区”包括通过一个或多个二硫键、化学接头或肽接头连接的两个fc多肽。“fc多肽”是指iga、igd和igg的最后两个恒定区免疫球蛋白结构域,以及ige和igm的最后三个恒定区免疫球蛋白结构域,并且还可包括这些结构域的柔性铰链n-末端的部分或全部。对于igg,“fc多肽”包含免疫球蛋白结构域cgamma2(cγ2)和cgamma3(cγ3)以及cgamma1(cγ1)与cγ2之间的铰链的下部。虽然
fc多肽的边界可以变化,但通常将人igg重链fc多肽定义为包含从t223或c226或p230开始至其羧基末端的残基,其中根据如kabat等人(1991,国家卫生研究院出版(nih publication)91-3242,弗吉尼亚州斯普林菲尔德国家技术信息服务中心(national technical information services,springfield,va))的eu索引进行编号。对于iga,fc多肽包含免疫球蛋白结构域calpha2(cα2)和calpha3(cα3)以及calpha1(cα1)与cα2之间的铰链的下部。fc区可以是合成的、重组的或由天然来源诸如ivig生成。
48.如本文所用,“聚糖”是糖,其可以是糖残基的单体或聚合物,诸如至少三种糖,并且可以是直链或支链的。“聚糖”可包括天然糖残基(例如,葡萄糖、n-乙酰葡糖胺、n-乙酰神经氨酸、半乳糖、甘露糖、岩藻糖、己糖、阿拉伯糖、核糖、木糖等)和/或改性糖(例如,2'-氟核糖、2'-脱氧核糖、磷酸甘露糖、6'磺基n-乙酰葡糖胺等)。术语“聚糖”包括糖残基的均聚物和杂聚物。术语“聚糖”还涵盖糖缀合物(例如多肽、糖脂、蛋白聚糖等)的聚糖组分。该术语还涵盖游离聚糖,包括已从糖缀合物裂解或以其他方式释放的聚糖。
49.如本文所用,术语“糖蛋白类”是指含有共价连接到一个或多个糖部分(即,聚糖)的肽主链的蛋白质。糖部分可为单糖、二糖、低聚糖和/或多糖的形式。糖部分可包含糖残基的单条非支链,或者可包含一条或多条支链。糖蛋白可包含o连接的糖部分和/或n连接的糖部分。
50.如本文所用,“ivig”是从至少1,000个人供体的血浆中提取的混合的多价igg(包括所有四种igg亚组)的制剂。ivig被批准作为免疫缺陷患者的血浆蛋白替代疗法。ivig fc聚糖唾液酸化的水平在ivig制剂之间有所不同,但通常小于20%。二唾液酸化水平通常低得多。如本文所用,术语“源自ivig”是指通过操纵ivig产生的多肽。例如,从ivig纯化多肽(例如,富集唾液酸化igg或经修饰的igg(例如,酶促唾液酸化的ivig igg))。
51.如本文所用,“fc多肽的n-糖基化位点”是指聚糖与之n-连接的fc多肽内的氨基酸残基。在一些实施方案中,fc区包含fc多肽的二聚体,并且fc区包含两个n-糖基化位点,每个fc多肽上一个。
52.如本文所用,“支链聚糖的百分比(%)”是指聚糖x相对于所存在的聚糖总摩尔数的摩尔数,其中x表示感兴趣的聚糖。
53.术语“药物有效量”或“治疗有效量”是指在治疗患有本文所述的疾病或病症的患者有效的量(例如,剂量)。本文还应当理解,“药物有效量”可解释为赋予所需治疗效果的量,以单剂量或任何剂量或途径单独服用或与其他治疗剂组合服用。
[0054]“药物制剂”和“药物产品”可包括在含有该制剂或产品以及使用说明的试剂盒中。
[0055]“药物制剂”和“药物产品”通常是指其中已经实现最终预定水平的唾液酸化并且不含工艺杂质的组合物。为此,“药物制剂”和“药物产品”基本上不含st6gal唾液酸转移酶和/或唾液酸供体(例如,胞苷5'-单磷酸-n-乙酰神经氨酸)或其副产物(例如,胞苷5'-单磷酸)。
[0056]“药物制剂”和“药物产品”通常基本上不含其中产生糖蛋白的细胞的其他组分(例如内质网或细胞质蛋白和rna,如果是重组的话)。
[0057]
所谓“纯化的”(或“分离的”)是指多核苷酸或多肽从存在于其天然环境中的其他组分中去除或分离。例如,分离的多肽是与产生其的细胞的其他组分(例如,内质网或细胞质蛋白和rna)分离的多肽。分离的多核苷酸是与其他核组分(例如,组蛋白)和/或与上游或
下游核酸分离的多核苷酸。分离的多核苷酸或多肽可至少60%不含、或至少75%不含、或至少90%不含、或至少95%不含所指出的多核苷酸或多肽的天然环境中存在的其他组分。
[0058]
如本文所用,术语“唾液酸化”是指具有末端唾液酸的聚糖。术语“单唾液酸化”是指例如在α1,3分支或α1,6分支上具有一个末端唾液酸的支链聚糖。术语“二唾液酸化”是指在两个臂(例如α1,3臂和α1,6臂两者)上具有末端唾液酸的支链聚糖。
[0059]
除非另有定义,否则本文所用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。本文描述了用于本发明的方法和材料;也可使用本领域已知的其他合适的方法和材料。另外,材料、方法和示例仅为例示性的,而非旨在进行限制。本文提到的所有出版物、专利申请、专利、序列、数据库条目及其他参考文献均全文以引用方式并入。若有矛盾,应以本说明书及其定义为准。
[0060]
根据如下具体实施方式和附图以及权利要求书,本发明的其他特征和优点将显而易见。
附图说明
[0061]
图1示出了包含两个n-乙酰氨基葡萄糖和三个甘露糖残基的短的支链核心低聚糖。分支之一在本领域中被称为“α1,3臂”,并且第二分支被称为“α1,6臂”。正方形:n-乙酰氨基葡萄糖;深灰色圆圈:甘露糖;浅灰色圆圈:半乳糖;菱形:n-乙酰神经氨酸;三角形:岩藻糖。
[0062]
图2示出了ivig中存在的常见fc聚糖。正方形:n-乙酰氨基葡萄糖;深灰色圆圈:甘露糖;浅灰色圆圈:半乳糖;菱形:n-乙酰神经氨酸;三角形:岩藻糖。
[0063]
图3示出了免疫球蛋白(例如igg抗体)可如何通过进行半乳糖基化步骤,接着进行唾液酸化步骤而被唾液酸化。正方形:n-乙酰氨基葡萄糖;深灰色圆圈:甘露糖;浅灰色圆圈:半乳糖;菱形:n-乙酰神经氨酸;三角形:岩藻糖。
[0064]
图4示出了seq id no:38和对应的蛋白质结构的视觉表示。这两种二硫化物在标测图中标记为n-聚糖。亲和标签是c端处的his-tag。
[0065]
图5示出了对于以ivig开始的反应,igg-fc聚糖图谱的代表性示例的反应产物。左图是用以将igg转化为hsigg的酶促唾液酸化反应的示意图;右图是起始ivig和hsigg的igg fc聚糖图谱。从左至右的条形分别对应于igg1、igg2/3和igg3/4。
[0066]
图6是显示半乳糖基化后n-糖肽的相对丰度的条形图。游离/可溶性酶(1x)在每组中的柱2中,并且固定b4-galt的三个不同实验在每组中的柱3、4和5中。起始免疫球蛋白在每组中的柱1中。
[0067]
图7示出了示例性高唾液酸化igg制剂的示意图。正方形:n-乙酰氨基葡萄糖;深灰色圆圈:甘露糖;浅灰色圆圈:半乳糖;菱形:n-乙酰神经氨酸;三角形:岩藻糖。
[0068]
图8示出了b4-galt固定和分析的实验过程。
[0069]
图9示出了如何测量酶活性。
[0070]
图10a至图10d示出了b4-galt的酶固定。图10a示出了b4-galt的连接。图10b示出了用于固定的底物。图10c示出了游离和固定化酶的酶活性(n=3)。图10d示出了在37℃下随时间推移的酶稳定性。
[0071]
图11a至图11d示出了使用酶固定的b4-galt进行的ivigs的半乳糖基化。图11a示
出了各种聚糖结构。正方形:n-乙酰氨基葡萄糖;深灰色圆圈:甘露糖;浅灰色圆圈:半乳糖;菱形:n-乙酰神经氨酸;三角形:岩藻糖。图11b示出了ivig典型的丰富聚糖结构(从左至右的条形:igg1、igg2/3)。图11c示出了用磁珠固定的b4-galt进行半乳糖基化后igg1糖肽的相对丰度。1x=与游离酶反应相同数量的单元(从左至右的条形:游离、mag 1x、mag 2x)。图11d示出了用磁珠固定的b4-galt进行半乳糖基化后igg2/g3 n-糖肽的相对丰度。1x=与游离酶反应相同数量的单元(从左至右的条形:游离、mag 2x)。
[0072]
图12a至图12c示出了经由胺偶联化学反应固定的b4-galt。图12a示出了b4-galt的连接。图12b示出了用于固定的底物。图12c示出了游离和固定化酶的酶活性。
[0073]
图13a至图13c示出了经由多点环氧化学反应固定的b4-galt。图13a示出了b4-galt的连接。图13b示出了用于固定的底物。图13c示出了游离和固定化酶的酶活性。
具体实施方式
[0074]
抗体在其重链恒定区中和fab结构域上的保守位置处被糖基化。例如,人igg抗体在ch2结构域的asn297处具有单个n连接的糖基化位点。每种抗体同种型在恒定区中具有不同种类的n-连接的碳水化合物结构。对于人igg,核心低聚糖通常由具有不同数目的外部残基的glcnac2man3glcnac组成。各个igg之间的差异可经由半乳糖和/或半乳糖-唾液酸在一个或两个末端glcnac处的连接或经由第三glcnac臂的连接(平分glcnac)而发生。
[0075]
本公开部分地涵盖用于制备具有fc区的免疫球蛋白的方法,该fc区具有特定水平的支链聚糖,支链聚糖在支链聚糖的两个臂上被唾液酸化(例如,通过neuac-α2,6-gal末端键)。水平可基于单个fc区测量(例如,在fc区中的支链聚糖的α1,3臂、α1,6臂或两者上唾液酸化的支链聚糖数目),或基于多肽制剂的总体组成测量(例如,在多肽制剂的fc区中的支链聚糖的α1,3臂、α1,6臂或两者上唾液酸化的支链聚糖的数目或百分比)。
[0076]
可以用于制备高唾液酸化igg的天然来源的多肽包括例如人血清中的igg(特别是混合自超过1,000个供体的人血清)、静脉内免疫球蛋白(ivig)和源自ivig的多肽(例如,从ivig纯化的多肽(例如,富集唾液酸化igg)或经修饰的ivig(例如,酶促唾液酸化ivig igg))。
[0077]
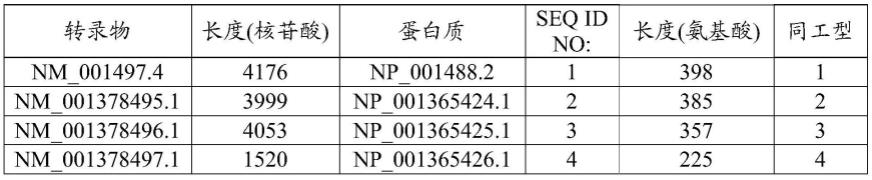
将n连接的低聚糖链添加到内质网的内腔中的蛋白质。具体地,将初始低聚糖(通常为14-糖)添加至asn-x-ser/thr的靶共有序列内包含的天冬酰胺残基的侧链上的氨基,其中x可以是除脯氨酸之外的任何氨基酸。该初始低聚糖的结构是大多数真核生物共有的,并且含有三个葡萄糖残基、九个甘露糖残基和两个n-乙酰葡糖胺残基。该初始低聚糖链可被内质网中的特定糖苷酶修剪,从而得到由两个n-乙酰葡糖胺残基和三个甘露糖残基构成的短支链核心低聚糖。分支之一在本领域中被称为“α1,3臂”,并且第二分支被称为“α1,6臂”,如图1所示。
[0078]
n-聚糖可细分成被称为“高甘露糖型”、“杂合型”和“复杂型”的三个不同组,其中在所有三个组中出现共同的五糖核心(man(α1,6)-(man(α1,3))-man(β1,4)-glcpnac(β1,4)-glcpnac(β1,n)-asn)。
[0079]
ivig中存在的更常见的fc聚糖示于图2中。
[0080]
除此之外或另选地,可将n-乙酰葡糖胺的一个或多个单糖单元添加至核心甘露糖亚基以形成“复杂聚糖”。可将半乳糖添加至n-乙酰葡糖胺亚基,并且可将唾液酸亚基添加
至半乳糖亚基,从而得到以唾液酸、半乳糖或n-乙酰葡糖胺残基中的任一者封端的链。另外,可将岩藻糖残基添加至核心低聚糖的n-乙酰葡糖胺残基。这些添加中的每一者均由特定糖基转移酶催化。
[0081]“杂合聚糖”包含高甘露糖和复杂聚糖两者的特征。例如,杂合聚糖的一个分支可主要包含或仅包含甘露糖残基,而另一个分支可包含n-乙酰葡糖胺、唾液酸、半乳糖和/或岩藻糖。
[0082]
唾液酸是具有杂环结构的9碳单糖家族。它们经由连接到环的羧酸基团以及包括n-乙酰基和n-乙醇酰基基团在内的其他化学修饰而带有负电荷。存在于哺乳动物表达系统中产生的多肽中的两种主要类型的唾液酸残基是n-乙酰神经氨酸(neuac)和n-羟乙酰神经氨酸(neugc)。它们通常作为在n-连接的聚糖和o-连接的聚糖两者的非还原末端处附接到半乳糖(gal)残基的末端结构出现。这些唾液酸基团的糖苷键构型可为α2,3或α2,6。
[0083]
fc区在保守的n连接糖基化位点处被糖基化。例如,igg抗体的每条重链在ch2结构域的asn297处具有单个n连接的糖基化位点。iga抗体在ch2和ch3结构域内具有n连接的糖基化位点,ige抗体在ch3结构域内具有n连接的糖基化位点,并且igm抗体在ch1、ch2、ch3和ch4结构域内具有n连接的糖基化位点。
[0084]
每种抗体同种型在恒定区中具有不同种类的n-连接的碳水化合物结构。例如,igg在fc区的每个fc多肽中在ch2结构域的asn297处具有单个n连接的双触角碳水化合物,其还包含c1q和fcγr的结合位点。对于人igg,核心低聚糖通常由具有不同数目的外部残基的glcnac2man3glcnac组成。各个igg之间的差异可经由半乳糖和/或半乳糖-唾液酸在一个或两个末端glcnac处的连接或经由第三glcnac臂的连接(平分glcnac)而发生。
[0085]
免疫球蛋白(例如igg抗体)可以通过进行半乳糖基化步骤,接着进行唾液酸化步骤而被唾液酸化。β-1,4-半乳糖基转移酶1(b4galt)是ii型高尔基体膜结合糖蛋白,其将半乳糖从尿苷5'-二磷酸半乳糖([[(2r,3s,4r,5r)-5-(2,4-二氧代嘧啶-1-基)-3,4二羟基氧杂环戊烷-2-基]甲氧基-羟基磷酰基][(2r,3r,4s,5r,6r)-3,4,5-三羟基-6-(羟甲基)环氧乙烷-2-基]磷酸氢盐;udp-gal)转移到glcnac作为β-1,4键。α-2,6-唾液酸转移酶1(st6)是ii型高尔基体膜结合糖蛋白,其将唾液酸从胞苷5'-单磷酸-n乙酰神经氨酸((2r,4s,5r,6r)-5-乙酰胺基-2-[[(2r,3s,4r,5r)-5-(4-氨基-2-氧代嘧啶-1-基)-3,4-二羟基氧杂环戊烷-2-基]甲氧基-羟基磷酰基]氧基-4-羟基-6-(1,2,3-三羟基丙基)环氧乙烷-2-羧酸;cmp-nana或cmp-唾液酸)转移到gal作为α-2,6键。示意性地,反应如图3所示进行。
[0086]
多肽的聚糖可使用本领域已知的任何方法进行评估。例如,聚糖组合物的唾液酸化(例如,在α1,3分支和/或α1,6分支上唾液酸化的支链聚糖的水平)可使用wo2014/179601中所述的方法来表征。
[0087]
在通过本文所述的方法制备的hsigg组合物的一些实施方案中,fc结构域上的支链聚糖的至少60%、65%、70%、75%、80%、85%或90%在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。另外,在一些实施方案中,fab结构域上的支链聚糖的至少40%、50%、60%、65%、70%、75%、80%或85%在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。总的来说,在一些实施方案中,支链聚糖的至少60%、65%、70%、75%、80%、85%或90%在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。
no:4)
[0099]
mrlrepllsgsaampgaslqracrllvavcalhlgvtlvyylagrdlsrlpqlvgvstplqggsnsaaaigqssgelrtggarpppplgassqprpggdsspvvdsgpgpasnltsvpvphttalslpacpeespllvgpmliefnmpvdlelvakqnpnvkmggryaprdcvsphkvaiiipfrnrqehlkywlyylhpvlqrqqldygiyvinqyekirrllw
[0100]
表2.b4galt1同工型1(seq id no:1)的拓扑结构
[0101][0102]
表3.b4galt1同工型1(seq id no:1)的结合位点
[0103][0104]
表4.b4galt1同工型1(seq id no:1)的翻译后氨基酸修饰
[0105][0106]
b4galt1的可溶形式通过蛋白水解加工源自膜形式。裂解位点位于b4galt1同工型1(seq id no:1)的位置77-78处。
[0107]
在一些实施方案中,对应于b4galt1同工型1(seq id no:1)的氨基酸113、130、172、243、250、262、310、343或355的b4galt1氨基酸中的一个或多个氨基酸与(seq id no:1)相比是保守的。
[0108]
在一些实施方案中,酶是例如b4galt1的酶活性部分。在一些实施方案中,酶是b4galt1同工型1(seq id no:1),或seq id no:1的直系同源物、突变体或变体的酶活性部分。在一些实施方案中,酶是b4galt1同工型2(seq id no:2),或seq id no:2的直系同源
物、突变体或变体的酶活性部分。在一些实施方案中,酶是b4galt1同工型3(seq id no:3),或seq id no:3的直系同源物、突变体或变体的酶活性部分。在一些实施方案中,酶是b4galt1同工型4(seq id no:4),或seq id no:4的直系同源物、突变体或变体的酶活性部分。
[0109]
在一些实施方案中,b4galt1的酶活性部分不包含细胞质结构域,例如seq id no:5。在一些实施方案中,b4galt1的酶活性部分不包含跨膜结构域,例如seq id no:6。在一些实施方案中,b4galt1的酶活性部分不包含细胞质结构域,例如seq id no:5,或跨膜结构域,例如seq id no:6。
[0110]
在一些实施方案中,b4galt1的酶活性部分包含内腔结构域的全部或一部分,例如seq id no:7或其直系同源物、突变体或变体。
[0111]
在一些实施方案中,b4galt1的酶活性部分包含seq id no:1的氨基酸109-398或其直系同源物、突变体或变体。在一些实施方案中,b4galt1的酶活性部分由seq id no:1或seq id no:1的直系同源物、突变体或变体组成。
[0112]
b4galt1的合适的功能部分可以包含与seq id no:8具有至少80%(85%、90%、95%、98%或100%)同一性的氨基酸序列或由该氨基酸序列组成。
[0113]
seq id no:8
[0114]
gpasnltsvpvphttalslpacpeespllvgpmliefnmpvdlelvakqnpnvkmggryaprdcvsphkvaiiipfrnrqehlkywlyylhpvlqrqqldygiyvinqagdtifnrakllnvgfqealkdydytcfvfsdvdlipmndhnayrcfsqprhisvamdkfgfslpyvqyfggvsalskqqfltingfpnnywgwggedddifnrlvfrgmsisrpnavvgrcrmirhsrdkknepnpqrfdriahtketmlsdglnsltyqvldvqryplytqitvdigtps
[0115]
st6gal1(例如人st6gal1)以及其直系同源物、突变体和变体包括st6gal1(例如人st6gal1)以及其直系同源物、突变体和变体的酶活性部分,连同包含它们的融合蛋白和多肽适合用于本文所述的方法。st6gal1,β-半乳糖苷α-2,6-唾液酸转移酶1将唾液酸从cmp-唾液酸转移到糖蛋白(诸如去唾液酸胎球蛋白和脱唾液酸-a1-酸性糖蛋白)上的galβ1
→
4glcnac结构。st6gal1也称为st6n或siat1。编码st6gal1的两种同工型的四种替代转录物(ncbi基因id 6480)在表1中有所描述。
[0116]
表1.人st6gal1同工型
[0117][0118]
》np_001340845.1(np_003023.1,np_775323.1)st6gal1[生物体=智人][基因id=6480][同工型=a](seq id no:9)
[0119]
mihtnlkkkfsccvlvfllfavicvwkekkkgsyydsfklqtkefqvlkslgklamgsdsqsvsssstqdphrgrqtlgslrglakakpeasfqvwnkdsssknliprlqkiwknylsmnkykvsykgpgpgikfsaealrchlrdhvnvsmvevtdfpfntsewegylpkesirtkagpwgrcavvssagslkssqlgreiddhdavlrfngaptanfqqdvgtkttirlmnsqlvttekrflkdslynegilivwdpsvyhsdipkwyqnpdynffnnyktyrklhpnqpfyilkpqmpwelwdilqeispeeiqpnppssgmlgiiimmtlcdqvdiyeflpskrktdvcyyyqkffdsactmgayhpllyekn
lvkhlnqgtdediyllgkatlpgfrtihc
[0120]
》np_775324.1st6gal1[生物体=智人][基因id=6480][同工型=b](seq id no:10)
[0121]
mnsqlvttekrflkdslynegilivwdpsvyhsdipkwyqnpdynffnnyktyrklhpnqpfyilkpqmpwelwdilqeispeeiqpnppssgmlgiiimmtlcdqvdiyeflpskrktdvcyyyqkffdsactmgayhpllyeknlvkhlnqgtdediyllgkatlpgfrtihc
[0122]
表2.st6gal1同工型a(seq id no:28)的拓扑结构
[0123][0124][0125]
表3.st6gal1同工型a(seq id no:28)的结合位点
[0126][0127]
表4.st6gal1同工型a(seq id no:28)的翻译后氨基酸修饰
[0128][0129]
st6gal1的可溶形式通过蛋白水解加工源自膜形式。
[0130]
在一些实施方案中,对应于st6gal1同工型a(seq id no:9)的氨基酸142、149、161、184、189、212、233、335、353、354、364、365、369、370、376或406的st6gal1氨基酸中的一个或多个氨基酸与seq id no:9相比是保守的。
[0131]
本文还提供了例如st6gal1的酶活性部分。在一些实施方案中,酶是stg6gal1同工型a(seq id no:9),或seq id no:9的直系同源物、突变体或变体的酶活性部分。在一些实施方案中,酶是stg6gal1同工型b(seq id no:10),或seq id no:10的直系同源物、突变体或变体的酶活性部分。
[0132]
在一些实施方案中,st6gal1的酶活性部分不包含细胞质结构域,例如seq id no:11。在一些实施方案中,st6gal1的酶活性部分不包含跨膜结构域,例如seq id no:12。在一
些实施方案中,st6gal1的酶活性部分不包含细胞质结构域,例如seq id no:11,或跨膜结构域,例如seq id no:12。
[0133]
在一些实施方案中,st6gal1的酶活性部分包含内腔结构域的全部或一部分,例如seq id no:13或其直系同源物、突变体或变体。
[0134]
在一些实施方案中,st6gal1的酶活性部分包含seq id no:9的氨基酸87-406(seq id no:14)或其直系同源物、突变体或变体。在一些实施方案中,st6gal1的酶活性部分由seq id no:4或seq id no:4的直系同源物、突变体或变体组成。
[0135]
st6gal1的合适的功能部分可以包含与seq id no:14具有至少80%(85%、90%、95%、98%或100%)同一性的氨基酸序列或由该氨基酸序列组成。
[0136]
seq id no:14
[0137]
akpeasfqvwnkdsssknliprlqkiwknylsmnkykvsykgpgpgikfsaealrchlrdhvnvsmvevtdfpfntsewegylpkesirtkagpwgrcavvssagslkssqlgreiddhdavlrfngaptanfqqdvgtkttirlmnsqlvttekrflkdslynegilivwdpsvyhsdipkwyqnpdynffnnyktyrklhpnqpfyilkpqmpwelwdilqeispeeiqpnppssgmlgiiimmtlcdqvdiyeflpskrktdvcyyyqkffdsactmgayhpllyeknlvkhlnqgtdediyllgkatlpgfrtihc
[0138]
在一些实施方案中,st6gal1包含以下或由以下组成:seq id no:14、seq id no:14的氨基酸4至320的部分或seq id no:14的氨基酸5至320的部分。
[0139]
也适用于本文所述的方法中的是与seq id no:15具有至少80%(85%、90%、95%、98%或100%)同一性的氨基酸序列。
[0140]
seq id no:15
[0141]
gssplldmlehhhhhhhhmakpeasfqvwnkdsssknliprlqkiwknylsmnkykvsykgpgpgikfsaealrchlrdhvnvsmvevtdfpfntsewegylpkesirtkagpwgrcavvssagslkssqlgreiddhdavlrfngaptanfqqdvgtkttirlmnsqlvttekrflkdslynegilivwdpsvyhsdipkwyqnpdynffnnyktyrklhpnqpfyilkpqmpwelwdilqeispeeiqpnppssgmlgiiimmtlcdqvdiyeflpskrktdvcyyyqkffdsactmgayhpllyeknlvkhlnqgtdediyllgkatlpgfrtihc
[0142]
变体
[0143]
在一些实施方案中,本文所述的酶与示例性序列(例如,如本文所提供)的氨基酸序列具有至少80%,例如至少85%、90%、95%、98%或100%同一性,例如,在被置换的示例性序列的至多1%、2%、5%、10%、15%或20%残基处具有差异,例如具有保守性突变,例如包括本文所述的突变或除本文所述的突变以外。在优选的实施方案中,变体保留亲本的期望活性,例如β-半乳糖苷α-2,6-唾液酸转移酶活性或β-1,4-半乳糖基转移酶活性。
[0144]
为了确定两个核酸序列的同一性百分比,以最佳比较目的对序列进行比对(例如,为了最佳比对可以在第一和第二氨基酸或核酸序列中的一个或两个中引入空位并且出于比较目的可以忽略非同源序列)。用于比较目的的参考序列的长度是参考序列的长度的至少80%,并且在一些实施方案中为至少90%或100%。然后比较相应氨基酸位置或核苷酸位置处的核苷酸。当第一序列中的位置被与第二序列中的相应位置相同的核苷酸占据时,则分子在该位置处是相同的(如本文所用,核酸“同一性”相当于核酸“同源性”)。两个序列之间的百分比同一性是序列所共有的相同位置数目的函数,考虑到空位的数目和每个空位的长度,需要引入这些参数用于两个序列的最佳比对。
[0145]
受试者多肽或核酸序列(即查询序列)与第二多肽或核酸序列(即目标序列)之间的同一性百分比以本领域技术范围内的各种方式确定,例如,使用公开可用的计算机软件,诸如smith waterman alignment(smith,t.f.和m.s.waterman(1981)《分子生物学杂志》(j mol biol)147:195-7);“bestfit”(smith和waterman,《应用数学进展》(advances in applied mathematics),482-489(1981)),如并入到genematcher plus
tm
中,schwarz和dayhof(1979)蛋白质序列与结构图谱(atlas of protein sequence and structure),dayhof,m.o.编辑,第353-358页;blast程序(局部序列比对检索基本工具(basic local alignment search tool);(altschul,s.f.,w.gish等人(1990)《分子生物学杂志》(j mol biol)215:403-10)、blast-2、blast-p、blast-n、blast-x、wu-blast-2、align、align-2、clustal或megalign(dnastar)软件。另外,本领域技术人员可以确定用于测量比对的适当参数,包括在待比较的序列的长度上实现最大比对所需的任何算法。一般而言,对于靶蛋白或核酸,比较的长度可以是任何长度,至多并且包括目标的全长(例如,5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或100%)。出于本公开的目的,同一性百分比是相对于查询序列的全长。
[0146]
出于本公开的目的,序列的比较和两个序列之间的同一性百分比的确定可以使用blossum 62评分矩阵来实现,其空位罚分为12,空位延伸罚分为4且移码空位罚分为5。
[0147]
保守性取代通常包括以下组内的取代:甘氨酸、丙氨酸;缬氨酸、异亮氨酸、亮氨酸;天冬氨酸、谷氨酸、天冬酰胺、谷氨酰胺;丝氨酸、苏氨酸;赖氨酸、精氨酸;和苯丙氨酸、酪氨酸。
[0148]
b4galt固定
[0149]
在一些实施方案中,如本文所述的包含酶或其部分的蛋白质固定在表面,例如固体载体上。
[0150]
用于蛋白质固定的方法,包括共价和非共价方法两者,是本领域已知和描述的。
[0151]
共价方法,诸如酶促方法(例如,转肽酶a)、酶自我标记(例如,snap-tag、halotag和clip-tag),化学方法(例如,肟连接、cu(i)催化的叠氮-炔环加成(cu(i)-catalyzed axide-alkyne cycoloaddition,cuaac)反应、应变促进的叠氮-炔环加成(strain-promoted azide-alkyne cycloaddition,spaac)反应、应变促进的炔烃-硝酮环加成(strain-promoted alkyne-nitrone cycloaddition,spanc)反应和逆电子需求的狄尔斯-阿尔德反应(inverse electron-demand diels-alder reaction,iedda)反应。参见例如,meldal和schoffelen,“recent advances in covalent,site-specific protein immobilization”,f1000research 216,5(f1000 faculty rev):2303。
[0152]
在一些实施方案中,蛋白质通过非共价方法固定(亲和力介导的移动性),诸如使用蛋白a或g用于抗体的结合、肽标签如聚组氨酸、蛋白标签,如麦芽糖结合蛋白和谷胱甘肽-s-转移酶、dna定向固定或生物素链霉亲和素相互作用对。参见例如,steen等人,“protein engineering for directed immobilization”,bioconjug chem.2013;24(11):1761
–
77;liu等人,“oriented immobilization of proteins on solid supports for use in biosensors and biochips:a review”,microchim acta 2016;183:1
–
19;sapsford等人,“functionalizing nanoparticles with biological molecules:developing chemistries that facilitate nanotechnology”,chem rev.2013;113(3):
1904
–
2074;等人,“affinity interactions as a tool for protein immobilization”,in:magdeldin s,编辑,affinity chromatography:intech,2012;29-46;trilling等人,“antibody orientation on biosensor surfaces:a minireview”,analyst 2013;138(6):1619
–
27;和meyer等人,“advances in dna-directed immobilization”,curr opin chem biol,2014;18:8
–
15。
[0153]
多肽
[0154]
因此,本文还提供了多肽,该多肽包含:i)b4galt酶(例如,β-1,4-半乳糖基转移酶(b4galt),例如人b4galt,例如,人b4galt1,或β-1,4-半乳糖基转移酶(b4galt)的直系同源物、突变体或变体,例如人b4galt,例如人b4galt1,包括β-1,4-半乳糖基转移酶(b4galt)的酶活性部分,例如人b4galt,例如人b4galt1,以及β-1,4-半乳糖基转移酶(b4galt)的酶活性部分的直系同源物、突变体和变体,例如人b4galt,例如人b4galt1);和ii)至少一个亲和标签。
[0155]
在一些实施方案中,至少一个标签位于n端、c端处或者位于n端和c末端两者处。
[0156]
在一些实施方案中,亲和标签选自由以下组成的组:聚组氨酸、几丁质结合蛋白(cbp)(例如,krrwkknfiavsaanrfkkisssgal,seq id no:16)、谷胱甘肽s-转移酶(gst)(例如,mspilgywkikglvqptrllleyleekyeehlyerdegdkwrnkkfelglefpnlpyyidgdvkltqsmaiiryiadkhnmlggcpkeraeismlegavldirygvsriayskdfetlkvdflsklpemlkmfedrlchktylngdhvthpdfmlydaldvvlymdpmcldafpklvcfkkrieaipqidkylksskyiawplqgwqatfgggdhppksd,seq id no:17)、麦芽糖结合蛋白(mbp)(例如mspilgywkikglvqptrllleyleekyeehlyerdegdkwrnkkfelglefpnlpyyidgdvkltqsmaiiryiadkhnmlggcpkeraeismlegavldirygvsriayskdfetlkvdflsklpemlkmfedrlchktylngdhvthpdfmlydaldvvlymdpmcldafpklvcfkkrieaipqidkylksskyiawplqgwqatfgggdhppksd,seq id no:18)、血细胞凝集素(ha)(例如,ypydvpdya,seq id no:19)、myc(例如,eqkliseedl,seq id no:20)、链霉亲和素结合肽(sbp)(例如,mdekttgwrgghvveglageleqlrarlehhpqgqrep,seq id no:21)、钙调蛋白标签(例如,madqlteeqiaefkeafslfdkdgdgtittkelgtvmrslgqnpteaelqdminevdadgngtidfpefltmmarkmkdtdseeeireafrvfdkdgngyisaaelrhvmtnlgekltdeevdemireadidgdgqvnyeefvqmmtakgsmgwdltvkmlagnefqvslsssmsvselkaqitqkigvhafqqrlavhpsgvalqdrvplasqglgpgstvllvvdkcdeplnilvrnnkgrsstyevrltqtvahlkqqvsglegvqddlfwltfegkpledqlplgeyglkplstvfmnlrlrgg,seq id no:22)、spot标签(例如,pdrvravshwss,seq id no:23),链霉亲和素标签(例如,no:23),链霉亲和素标签(例如,例如,trp-ser-his-pro-gln-phe-glu-lys(seq id no:24)、flag-tag(例如,dykddddk(seq id no:25)生物素以及其变体和所有前述的组合。
[0157]
在一些实施方案中,亲和标签是聚组氨酸标签。在一些实施方案中,聚组氨酸标签选自由以下组成的组:hhhh(seq id no:26)、hhhhh(seq id no:27)、hhhhhh(seq id no:28)、hhhhhhh(seq id no:29)、hhhhhhhh(seq id no:30)、hhhhhhhhh(seq id no:31)和hhhhhhhhhh(seq id no:32)。在一些实施方案中,至少一个标签包含3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个组氨酸。
[0158]
在一些实施方案中,亲和标签位于朝向酶的n端侧的位置。在一些实施方案中,亲和标签位于朝向酶的c端侧的位置。
[0159]
附加的标签是本领域已知的,并且可以用于将β4galt1固定到固体载体(例如树脂、柱、阵列等)的目的。在一些实施方案中,这些附加的标签可以与连接到固体载体的已知结合剂配对,使得标记的β4galt1与固体载体结合。
[0160]
在一些实施方案中,多肽还包括酶与亲和标签之间的裂解序列或间隔序列(例如,位于朝向酶的c端侧并朝向亲和标签的n端侧的位置)。在一些实施方案中,间隔序列的长度为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个氨基酸。在一些实施方案中,间隔序列的长度为至少3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个氨基酸。在一些实施方案中,裂解或间隔序列的长度为至少3个氨基酸。
[0161]
在一些实施方案中,间隔序列包含prd(seq id no:33)或由其组成。在一些实施方案中,间隔序列包含pgg(seq id no:34)。
[0162]
因此,适合用于本文所述方法的带有c端间隔基序列的合适的b4galt可以包含与seq id no:35或seq id no:36具有至少80%(85%、90%、95%、98%或100%)同一性的氨基酸序列。
[0163]
seq id no:35
[0164]
gpasnltsvpvphttalslpacpeespllvgpmliefnmpvdlelvakqnpnvkmggryaprdcvsphkvaiiipfrnrqehlkywlyylhpvlqrqqldygiyvinqagdtifnrakllnvgfqealkdydytcfvfsdvdlipmndhnayrcfsqprhisvamdkfgfslpyvqyfggvsalskqqfltingfpnnywgwggedddifnrlvfrgmsisrpnavvgrcrmirhsrdkknepnpqrfdriahtketmlsdglnsltyqvldvqryplytqitvdigtpsprd
[0165]
seq id no:36
[0166]
gpasnltsvpvphttalslpacpeespllvgpmliefnmpvdlelvakqnpnvkmggryaprdcvsphkvaiiipfrnrqehlkywlyylhpvlqrqqldygiyvinqagdtifnrakllnvgfqealkdydytcfvfsdvdlipmndhnayrcfsqprhisvamdkfgfslpyvqyfggvsalskqqfltingfpnnywgwggedddifnrlvfrgmsisrpnavvgrcrmirhsrdkknepnpqrfdriahtketmlsdglnsltyqvldvqryplytqitvdigtpspgg
[0167]
his标记的人β-1,4-半乳糖基转移酶1(b4galt)适合用于本文所述的方法。合适的b4galt可以包含与seq id no:37或seq id no:38(其示意图如图4所示)具有至少80%(85%、90%、95%、98%或100%)同一性的氨基酸序列。
[0168]
seq id no:37
[0169]
mgpasnltsvpvphttalslpacpeespllvgpmliefnmpvdlelvakqnpnvkmggryaprdcvsphkvaiiipfrnrqehlkywlyylhpvlqrqqldygiyvinqagdtifnrakllnvgfqealkdydytcfvfsdvdlipmndhnayrcfsqprhisvamdkfgfslpyvqyfggvsalskqqfltingfpnnywgwggedddifnrlvfrgmsisrpnavvgrcrmirhsrdkknepnpqrfdriahtketmlsdglnsltyqvldvqryplytqitvdigtpspgghhhhhhhh
[0170]
seq id no:38
[0171]
mgpasnltsvpvphttalslpacpeespllvgpmliefnmpvdlelvakqnpnvkmggryaprdcvsphkvaiiipfrnrqehlkywlyylhpvlqrqqldygiyvinqagdtifnrakllnvgfqealkdydytcfvfsdvdlipmndhnayrcfsqprhisvamdkfgfslpyvqyfggvsalskqqfltingfpnnywgwggedddifnrlvfrgmsisrpnavvgrcrmirhsrdkknepnpqrfdriahtketmlsdglnsltyqvldvqryplytqitvdigtpsprdhhhhhhh
[0172]
图4示出了seq id no:38的一部分的视觉标测图。这两种二硫化物在标测图中标记为n-聚糖。亲和标签是c端处的his-tag。
[0173]
生物素标记的人β-1,4-半乳糖基转移酶1(b4galt)适合用于本文所述的方法。合适的b4galt可以包含与seq id no:39具有至少80%(85%、90%、95%、98%或100%)同一性的氨基酸序列。在一些实施方案中,生物素标签是生物素的变体。
[0174]
seq id no:39
[0175]
mgpasnltsvpvphttalslpacpeespllvgpmliefnmpvdlelvakqnpnvkmggryaprdcvsphkvaiiipfrnrqehlkywlyylhpvlqrqqldygiyvinqagdtifnrakllnvgfqealkdydytcfvfsdvdlipmndhnayrcfsqprhisvamdkfgfslpyvqyfggvsalskqqfltingfpnnywgwggedddifnrlvfrgmsisrpnavvgrcrmirhsrdkknepnpqrfdriahtketmlsdglnsltyqvldvqryplytqitvdigtpspgg-生物素
[0176]
载体
[0177]
在一些实施方案中,载体例如固体载体(例如多孔固体载体)是树脂、柱、阵列、微阵列、固相。
[0178]
在一些实施方案中,载体材料可以包括膜、珠粒、凝胶、盒、柱、芯片、载玻片、板、阵列、微阵列或整料。在一些实施方案中,载体材料可以包括亲水性化合物、疏水性化合物、疏油性化合物、亲油性化合物或它们的任何组合。在一些实施方案中,载体材料可以包含聚合物或共聚物。
[0179]
合适的载体材料的示例包括但不限于聚醚砜、聚酰胺(例如琼脂糖、纤维素、多糖)、聚四氟乙烯、聚砜、聚酯、聚偏二氟乙烯、聚丙烯、碳氟化合物(例如聚(四氟乙烯-共-全氟(烷基乙烯基醚))、聚碳酸酯、聚乙烯、玻璃、聚碳酸酯、聚丙烯酸酯、聚丙烯酰胺、聚(噁唑酮)、聚苯乙烯、陶瓷、尼龙和金属。
[0180]
在一些实施方案中,载体包含金属(例如金属螯合物)、镍(例如,ni2+)、钴(例如,co2+)、几丁质、麦芽糖、gsh、抗体或纳米抗体、flag结合抗体或纳米抗体、ha结合抗体或纳米抗体、myc结合抗体或纳米抗体、ne结合抗体或纳米抗体、链霉亲和素、生物素、钙调蛋白、spot结合抗体或纳米抗体、其变体以及它们的组合。
[0181]
在一些实施方案中,载体包含结合亲和标签的配体,例如,包含b4galt的多肽的亲和标签,例如,如本文所述的聚组氨酸标签。在一些实施方案中,载体包含选自由以下组成的组的配体:镍(例如,ni-nta或ni-ida)、钴以及它们的组合。
[0182]
在一些实施方案中,载体是珠粒,例如磁珠。在一些实施方案中,载体是磁性琼脂糖珠。在一些实施方案中,磁性琼脂糖珠是磁性琼脂糖凝胶珠。在一些实施方案中,载体是树脂。在一些实施方案中,载体是琼脂糖树脂。在一些实施方案中,琼脂糖树脂是琼脂糖凝胶树脂。
[0183]
在一些实施方案中,磁性琼脂糖珠或琼脂糖树脂包含约1%至约10%w/v的琼脂糖凝胶。在一些实施方案中,磁性琼脂糖珠或琼脂糖树脂包含约1%w/v至约9%w/v、约1%w/v至约8%w/v、约1%w/v至约7%w/v、约1%w/v至约6%w/v、约1%w/v至约5%w/v、约1%w/v至约4%w/v、约1%w/v至约3%w/v、约1%w/v至约2%w/v、约2%w/v至约10%w/v、约2%w/v至约9%w/v、约2%w/v至约8%w/v、约2%w/v至约7%w/v、约2%w/v至约6%w/v、约2%w/v至约5%w/v、约2%w/v至约4%w/v、约2%w/v至约3%w/v、约3%w/v至约10%w/v、约3%w/v
至约9%w/v、约3%w/v至约8%w/v、约3%w/v至约7%w/v、约3%w/v至约6%w/v、约3%w/v至约5%w/v、约3%w/v至约4%w/v、约4%w/v至约10%w/v、约4%w/v至约9%w/v、约4%w/v至约8%w/v、约4%w/v至约7%w/v、约4%w/v至约6%w/v、约4%w/v至约5%w/v、约5%w/v至约10%w/v、约5%w/v至约9%w/v、约5%w/v至约8%w/v、约5%w/v至约7%w/v、至约6%w/v、约6%w/v至约10%w/v、约6%w/v至约9%w/v、约6%w/v至约8%w/v、约6%w/v至约7%w/v、约7%w/v至约10%w/v、约7%w/v至约9%w/v、约7%w/v至约8%w/v、约8%w/v至约10%w/v、约8%w/v至约9%w/v或约9%w/v至约10%w/v的琼脂糖凝胶。
[0184]
在一些实施方案中,载体的孔径范围为约20nm至约130nm。在一些实施方案中,载体的孔径范围为约20nm至约120nm、约20nm至约110nm、约20nm至约100nm、约20nm至约90nm、约20nm至约80nm、约20nm至约70nm、约20nm至约60nm、约20nm至约50nm、约20nm至约40nm、约20nm至约30nm、约30nm至约130nm、约30nm至约120nm、约30nm至约110nm、约30nm至约100nm、约30nm至约90nm、约30nm至约80nm、约30nm至约70nm、约30nm至约60nm、约30nm至约50nm、约30nm至约40nm、约40nm至约130nm、约40nm至约120nm、约40nm至约110nm、约40nm至约100nm、约40nm至约90nm、约40nm至约80nm、约40nm至约70nm、约40nm至约60nm、约40nm至约50nm、约50nm至约130nm、约50nm至约120nm、约50nm至约110nm、约50nm至约100nm、约50nm至约90nm、约50nm至约80nm、约50nm至约70nm、约50nm至约60nm、约60nm至约130nm、约60nm至约120nm、约60nm至约110nm、约60nm至约100nm、约60nm至约90nm、约60nm至约80nm、约60nm至约70nm、约70nm至约130nm、约70nm至约120nm、约70nm至约110nm、约70nm至约100nm、约70nm至约90nm、约70nm至约80nm、约80nm至约130nm、约80nm至约120nm、约80nm至约110nm、约80nm至约100nm、约80nm至约90nm、约90nm至约130nm、约90nm至约120nm、约90nm至约110nm、约90nm至约100nm、约100nm至约130nm、约100nm至约120nm、约100nm至约110nm、约110nm至约130nm、约110nm至约120nm、或约120nm至约130nm。
[0185]
在一些实施方案中,载体(例如珠粒或树脂,例如磁珠或磁性树脂)的尺寸(例如直径)为约10μm至约350μm。在一些实施方案中,载体(例如珠粒,例如磁珠)的尺寸(例如直径)为约10μm至约170μm、约10μm至约160μm、约10μm至约150μm、约10μm至约140μm、约10μm至约130μm、约10μm至约120μm、约10μm至约110μm、约10μm至约100μm、约10μm至约90μm、约10μm至约80μm、约10μm至约70μm、约10μm至约60μm、约10μm至约50μm、约10μm至约40μm、约10μm至约30μm、约10μm至约20μm、约20μm至约170μm、约20μm至约160μm、约20μm至约150μm、约20μm至约140μm、约20μm至约130μm、约20μm至约120μm、约20μm至约110μm、约20μm至约100μm、约20μm至约90μm、约20μm至约80μm、约20μm至约70μm、约20μm至约60μm、约20μm至约50μm、约20μm至约40μm、约20μm至约30μm、约30μm至约170μm、约30μm至约160μm、约30μm至约150μm、约30μm至约140μm、约30μm至约130μm、约30μm至约120μm、约30μm至约110μm、约30μm至约100μm、约30μm至约90μm、约30μm至约80μm、约30μm至约70μm、约30μm至约60μm、约30μm至约50μm、约30μm至约40μm、约40μm至约170μm、约40μm至约160μm、约40μm至约150μm、约40μm至约140μm、约40μm至约130μm、约40μm至约120μm、约40μm至约110μm、约40μm至约100μm、约40μm至约90μm、约40μm至约80μm、约40μm至约70μm、约40μm至约60μm、约40μm至约50μm、约50μm至约170μm、约50μm至约160μm、约50μm至约150μm、约50μm至约140μm、约50μm至约130μm、约50μm至约120μm、约50μm至约110μm、约50μm至约100μm、约50μm至约90μm、约50μm至约80μm、约50μm至约70μm、约50μm至约60μm、约60μm至约170μm、约60μm至约160μm、约60μm至约150μm、约60μm至约
140μm、约60μm至约130μm、约60μm至约120μm、约60μm至约110μm、约60μm至约100μm、约60μm至约90μm、约60μm至约80μm、约60μm至约70μm、约70μm至约170μm、约70μm至约160μm、约70μm至约150μm、约70μm至约140μm、约70μm至约130μm、约70μm至约120μm、约70μm至约110μm、约70μm至约100μm、约70μm至约90μm、约70μm至约80μm、约80μm至约170μm、约80μm至约160μm、约80μm至约150μm、约80μm至约140μm、约80μm至约130μm、约80μm至约120μm、约80μm至约110μm、约80μm至约100μm、约80μm至约90μm、约90μm至约170μm、约90μm至约160μm、约90μm至约150μm、约90μm至约140μm、约90μm至约130μm、约90μm至约120μm、约90μm至约110μm、约90μm至约100μm、约100μm至约170μm、约100μm至约160μm、约100μm至约150μm、约100μm至约140μm、约100μm至约130μm、约100μm至约120μm、约100μm至约110μm、约110μm至约170μm、约110μm至约160μm、约110μm至约150μm、约110μm至约140μm、约110μm至约130μm、约110μm至约120μm、约120μm至约170μm、约120μm至约160μm、约120μm至约150μm、约120μm至约140μm、约120μm至约130μm、约130μm至约170μm、约130μm至约160μm、约130μm至约150μm、约130μm至约140μm、约140μm至约170μm、约140μm至约160μm、约140μm至约150μm、约150μm至约170μm、约150μm至约160μm、或约160μm至约170μm。在一些实施方案中,载体的直径为约10μm至约40μm。在一些实施方案中,载体的直径为约10μm。
[0186]
用固定化b4-galt进行高唾液酸化的方法
[0187]
在一些实施方案中,本文特别描述了制备高唾液酸化(hsigg)的方法,该方法包括:(a)提供igg抗体的混合物,(b)将igg抗体的混合物在包含与固体载体结合的β1,4-半乳糖基转移酶i(β4galt1,也称为b4galt)的反应混合物中温育,以产生半乳糖基化igg抗体;(c)将半乳糖基化igg抗体在包含st6gal1(也称为st6)和cmp-nana的反应混合物中温育,从而形成hsigg制剂。
[0188]
本文描述了合适的β4galt1(例如人b4galt,例如人b4galt1)以及其直系同源物、突变体和变体,包括β-1,4-半乳糖基转移酶(b4galt)(例如人b4galt,例如人b4galt1)以及其直系同源物、突变体和变体的酶活性部分,连同包含它们的融合蛋白和多肽。
[0189]
本文描述了合适的st6gal1(例如人st6gal1)以及其直系同源物、突变体和变体包括st6gal1(例如人st6gal1)以及其直系同源物、突变体和变体的酶活性部分,连同包含它们的融合蛋白和多肽。
[0190]
在一些实施方案中,β4galt1通过至少一个亲和标签与固体载体结合。本文描述了合适的亲和标签和固体载体。
[0191]
在一些实施方案中,在步骤(b)之前将与固体载体(例如树脂、柱、阵列等)结合的β1,4-半乳糖基转移酶i(β4galt1)与半乳糖基化igg抗体分离。
[0192]
在一些实施方案中,在唾液酸化反应期间添加gmp-nana 1、2、3或更多次。
[0193]
在一些实施方案中,igg抗体包含从至少1000个供体中分离的igg抗体。在一些实施方案中,igg抗体的至少70%w/w是igg 1抗体。在一些实施方案中,供体受试者的至少90%已经暴露于病毒。在一些实施方案中,hsigg制剂中igg抗体上的支链聚糖的约60%、65%、70%、75%、80%或85%在α1,3分支和α1,6分支两者上具有唾液酸。在一些实施方案中,hsigg制剂中igg抗体的fab结构域上的支链聚糖的至少40%、50%、60%、65%、70%、75%、80%或85%在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸;并且hsigg制剂中igg抗体的fc结构域上的支链聚糖的至少60%、65%、70%、75%、80%
或85%在α1,3臂和α1,6臂两者上具有通过neuac-α2,6-gal末端键连接的唾液酸。
[0194]
实施例
[0195]
实施例1:高唾液酸化igg制剂
[0196]
可以如下制备其中总支链聚糖的超过60%是二唾液酸化的igg。图7中示出了示例性反应。
[0197]
简言之,使igg抗体的混合物暴露于使用β1,4半乳糖基转移酶1(b4-galt或β4galt1)和α2,6-唾液酸转移酶(st6-gal1)的顺序酶促反应。不需要在添加st6-gal1之前从反应中去除b4-galt,并且在酶促反应之间不需要部分或完全纯化产物。然而,从hsigg产物中去除酶的多个纯化步骤通常在唾液酸化之后进行。
[0198]
半乳糖基转移酶选择性地将半乳糖残基添加到预先存在的天冬酰胺连接的聚糖。所得的半乳糖基化聚糖用作唾液酸转移酶的底物,其选择性地添加唾液酸残基以封端连接到其上的天冬酰胺连接的聚糖结构。因此,总唾液酸化反应采用两种糖核苷酸(尿苷5
′‑
二磷酸半乳糖(udpgal)和胞苷-5
′‑
单磷酸-n-乙酰神经氨酸(cmp-nana))。定期补充后者以相对于单唾液酸化产物增加二唾液酸化产物。该反应包括辅因子氯化锰。
[0199]
以ivig开始的此类反应和反应产物的igg-fc聚糖图谱的代表性示例示于图5中。在图5中,左图是用以将igg转化为hsigg的酶促唾液酸化反应的示意图;右图是起始ivig和hsigg的igg fc聚糖图谱。在该研究中,经由糖肽质谱分析得出不同的igg亚类的聚糖图谱。用于定量不同igg亚类的糖肽的肽序列是:igg1=eeqynstyr(seq id no:40)、igg2/3eeqfnstfr(seq id no:41)、igg3/4eeqynstfr(seq id no:42)和eeqfnstyr(seq id no:43)。
[0200]
聚糖数据按igg亚类示出。来自igg3和igg4亚类的聚糖不能单独定量。如所示,对于ivig,所有未唾液酸化聚糖的总和大于80%,并且所有唾液酸化聚糖的总和小于20%。对于反应产物,所有未唾液酸化聚糖的总和小于20%,并且所有唾液酸化聚糖的总和大于80%。糖图谱中列出的不同聚糖的命名使用n连接的聚糖的oxford符号。
[0201]
实施例2:具有固定化b4-galt的高唾液酸化igg制剂
[0202]
可以如下制备其中总支链聚糖的超过60%是二唾液酸化的igg。
[0203]
简言之,使igg抗体的混合物暴露于使用his标记的β1,4半乳糖基转移酶1(b4-galt)和α2,6-唾液酸转移酶(st6-gal1)的顺序酶促反应。b4-galt固定在镍琼脂糖凝胶树脂上。在st6-gal1酶促反应之前,不需要对产物进行部分或完全纯化。
[0204]
his-β4galt1与镍琼脂糖凝胶树脂的偶联是通过β4galt1的c端的8x聚组氨酸标签与螯合的镍分子相互作用而发生的。固定作用在适合酶稳定性的水性溶液中进行优化,并显示在37℃下稳定超过21天。这种稳定性意味着在这段时间内酶(以及因此镍)的浸出最少,并且可以从一批固定化酶中产生多批产物。ivig的半乳糖基化所需的固定化酶的量通过执行蛋白质和酶活性测定并对比活性定量来确定,该比活性为可溶性酶的50%至80%。ivig的半乳糖基化在37℃下在ph 7.4的具有udp-gal的mops缓冲液中在72小时内发生。使用管旋转器进行恒定混合。过滤掉固定化酶,并通过质谱方法表征和定量半乳糖基化程度。发现半乳糖基化程度与可溶性酶的水平相当,并且对于igg1、2、3和4,几乎完全是g2f。3个分离反应的igg1结果显示在图6中,其是显示半乳糖基化后n-糖肽的相对丰度的条形图。游离/可溶性酶(1x)在每组中的柱2中,并且固定b4-galt的三个不同实验在每组中的柱3、4和
5中。起始免疫球蛋白在每组中的柱1中。
[0205]
因此,与可溶性酶相比,半乳糖基化反应中使用的酶少了约50%-80%,从而产生了相似或更合适的聚糖结构。
[0206]
实施例2:b4-galt的固定
[0207]
b4-galt的酶活性部分(seq id no:38,图4)使用本文所述的多种技术固定并如图8至图9所示进行分析。
[0208]
负载镍珠的吸附实现了至多50%的酶活性
[0209]
如图10a至图10d所示,b4-galt的聚组氨酸标签用作酶固定(图10a)到磁珠或多孔珠粒(图10b)的附着点。b4-galt固定在10μm磁珠上实现了游离酶活性的约52%,而b4-galt固定在多孔(120nm-180nm)的平均尺寸为130μm的多孔珠上实现了游离酶活性的约20%(图10c);n=3。图10d示出了在37℃下随时间推移的稳定性。
[0210]
如图11a至图11d,固定化酶能够半乳糖基化ivigs。图11a示出了各种聚糖结构。图11b示出了ivig典型的丰富聚糖结构。图11c示出了用磁珠固定的b4-galt进行半乳糖基化后igg1糖肽的相对丰度。图11d示出了用磁珠固定的b4-galt进行半乳糖基化后igg2/g3 n-糖肽的相对丰度。1x=与游离酶反应相同数量的单元。
[0211]
胺偶联实现了至多17%的酶活性
[0212]
如图12a至图12c所示,4-galt经由胺偶联化学反应(图12a)固定到磁珠或多孔珠(图12b)上。b4-galt固定在10μmnhs磁珠上实现了游离酶活性的约17%,而b4-galt固定在多孔(120nm-180nm)的尺寸为150μm至300μm的胺珠上实现了游离酶活性的约2
–
3%(图10c);n=3。图10d示出了在37℃下随时间推移的稳定性。
[0213]
环氧偶联减少了99%酶活性
[0214]
如图13a至图13c所示,4-galt通过多点环氧化学反应(图12a)固定至immobead(ib)或purolite(p)多孔珠,其中孔隙率分别为2nm-23nm和120nm-180nm,并且尺寸分别为150μm-500μm和150μm-300μm(图12b)。固定化酶的活性小于约0.1%(图12c)。
[0215]
其他实施方案
[0216]
应当理解,虽然已结合本发明的具体实施方式描述了本发明,但是前述描述旨在说明而非限制由随附权利要求书所限定的本发明的范围。其他方面、优点和修改均在以下权利要求书的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1