铜氧化物纳米片自支撑电极、其制备方法及其催化分解水的方法与流程
本发明属于催化剂技术领域,具体涉及一种铜氧化物纳米片自支撑电极、其制备方法及其在超低电位下催化分解水的方法。
背景技术:
近年来,由于化石能源的逐渐开采所带来的资源枯竭和环境保护等问题日益严重,因此开发可再生清洁能源受到了人们的密切关注。氢气作为一种清洁能源,由于其能量密度高,运输储存方便且产物不会造成环境污染,成为了公认的化石能源的良好替代品。
目前公认的电解水制氢所使用的较好催化剂如pt在负电位-0.1~-0.2vvs.rhe下进行;公认的较好的释氧电催化剂如ru或ruo2催化分解水释氧的电位值在+1.53v左右,因此释氧过程的必须使用大电位成为电解水的控制步骤。这也是目前电解水耗能大的导致工业上分解水制氢和制氧技术发展的瓶颈。
所以,开拓廉价的非贵金属、储量丰富的非贵金属作电催化剂,降低电催化分解水的电压,具有重要的经济价值和现实意义。
铜是人类最早使用的金属之一,在地壳和海洋中含量较为丰富,具有导热性和导电性高和耐腐蚀等优点。在催化剂领域,含铜催化剂表现出催化活性较高优点,但目前所报道的铜基催化剂普遍存在制备过程复杂,产生废气、废水、固体废物、噪声等污染物,对环境有一定的影响,并且所制备的催化存在稳定性差、易烧结等问题。
因此,需要开发制备过程简单、环保、催化效率更高、在更低的电位下具有催化分解水性能的催化释氧和制氢的自支撑电极,以满足工业应用的需求。
技术实现要素:
针对现有技术中的不足与难题,本发明旨在提供一种以非贵金属为原材料制成的铜氧化物纳米片自支撑电极作为催化作用的工作电极,该电极可在极低的电位下(0.00~+0.21v)催化分解水释氧,在电位为(+0.85~+1.25v)下催化分解水制氢,在起始电位低于-0.40v或起始电位为+1.75v开始催化分解水同时释放氢气和氧气。
第一方面,本发明提供一种铜氧化物纳米片自支撑电极,所述自支撑电极以铜丝为基底,铜氧化物纳米片均匀包裹在铜丝表面,其中铜氧化物为氧化亚铜和氧化铜混合物。
本发明的铜氧化物纳米片自支撑电极在0.00~+0.21v条件下产生氧气同时氧化铜转化成氧化亚铜;在+0.85~+1.25v条件下产生氢气,同时将氧化亚铜转化成氧化铜。
第二方面,本发明提供一种铜氧化物纳米片自支撑电极的制备方法,该方法包括以下步骤:
(1)将铜丝置于氧气饱和的强碱性溶液中浸泡0.5小时以上,待表面形成黑色的铜氧化物层停止反应;
(2)将经强碱性溶液浸泡后的铜丝置于高压加热容器内,充入氧气后进行加热反应,再冷却取出。
优选地,所述强碱性溶液为0.1~3.0mol/lnaoh或koh强碱性溶液。
优选地,所述高压加热容器为高压反应釜或高压管式炉,加热反应温度为180℃~220℃,反应时间12~24小时,反应压力为2~3mpa。
第三方面,本发明还提供一种铜氧化物纳米片自支撑电极在超低电位下催化分解水的方法,以第一方面所述的铜氧化物纳米片自支撑电极为工作电极,氯化银电极为参比电极,碳棒为辅助电极,组成三电极体系,其中自支撑电极中铜氧化物纳米片为催化剂;碱性溶液为电解质,在超低电位下催化分解水释放氢气或/和氧气。
优选地,所述铜氧化物纳米片自支撑电极应用于碱性条件下,在电位为0.00~+0.21v下催化分解水释放氧气,同时工作电极(一)中cuo转化成cu2o,黑色铜丝逐渐变成砖红色;对电极碳棒(+)上产生氧气。
优选地,所述铜氧化物纳米片自支撑电极应用于碱性条件下,在电位为+0.85~+1.25v下催化分解水制氢,同时工作电极(+)中cu2o转化成cuo,砖红色铜丝逐渐变成黑色;对电极碳棒(一)上产生氢气。
优选地,所述铜氧化物纳米片自支撑电极应用于碱性条件下,在起始电位低于-0.40v或起始电位为+1.75v开始催化分解水同时释放氢气和氧气。
与现有技术相比,本发明有益效果包括:
(1)本发明利用简单的碱性溶液中浸泡、氧气氛围中高压下将铜氧化物纳米片均匀负载在铜丝载体上,为分解水制氢催化剂依赖贵金属和释氧电位过大的这二难题提供了新的解决手段。
(2)本发明方法直接在铜丝表面生长铜氧化物,无需像传统的方法首先制备催化剂粉末,然后使用粘合剂涂覆在金属表面,操作简单,无需使用粘合剂,催化活性面积大,具有良好的催化活性。
(3)本发明制备的铜氧化物纳米片自支撑电极在碱性条件中,在极低的电位下电解水释氧和制氢的反应中具有良好的催化效率,同时催化剂在循环实验中具有优异的稳定性能。
(4)本发明利用两个电位下氧化铜和氧化亚铜的相互转化,反复制备氧气和氢气,避免传统的铜氧化物电极在某一个电位下催化制氢或氧不稳定性的缺陷,该电极的具有良好的稳定性。
(5)本发明制备的铜氧化物纳米片自支撑电极催化效果好、效率高,在连续循环制备氢气或/和氧气13h后催化电极仍具有较好的催化性能。
附图说明
图1为本发明铜氧化物纳米片自支撑电极电化学扫描图。
图2为本发明铜氧化物纳米片自支撑电极表面微观形貌和能谱分析图。
图3为本发明铜氧化物纳米片自支撑电极表面成分表征图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明作进一步的详细说明。
一种铜氧化物纳米片自支撑电极的制备方法,该方法包括以下步骤:
(1)将铜丝经过强碱性(饱和o2)溶液0.1~3.0mol/lnaoh或koh溶液浸泡0.5-72小时,待铜丝表面均匀覆盖一层黑色的铜氧化物层后取出后利用乙醇和超纯水清洗后晾干,备用;
(2)将上述强碱性溶液中浸泡后铜丝置于聚四氟乙烯内胆的高压反应釜中,反应釜内充满氧气,加热温度180℃,高压气固反应12小时后,再冷却取出,使得铜丝表面均匀获得黑色铜氧化物纳米片,形成一种自支撑电极。
本发明反应中发生反应的铜源直接来自于固体铜丝表面,属于固、液、气三相反应,反应条件均一,结合高压反应条件,因此易于形成均匀致密的纳米结构。
通过上述步骤所制得的铜氧化物纳米自支撑电极,其以铜丝为基底,表面均匀覆盖铜氧化物纳米片,作为电催化分解水的工作催化电极,其中铜氧化物为氧化亚铜和氧化铜混合物。
如图2所示,对上述制备方法形成的自支撑电极进行形貌分析结果显示,经高压反应釜反应后的铜丝覆盖了一层0.7um厚的物质,场发射扫描结果显示纳米颗粒大小比较均一,宽度为5~50nm,能谱分析结果显示铜丝表面氧和铜元素共存,因此将本发明通过化学反应所得的产物铜氧化物纳米片命名为cuxoynfs,其与基底铜丝一起构成工作电极,标记为cuxoynfs@cw。
利用上述铜氧化物纳米片自支撑电极电催化分解水,具体方法为:
以铜氧化物纳米片自支撑电极为工作电极,以氯化银电极为参比电极,以碳棒为对电极,组成三电极体系,其中自支撑电极中铜氧化物纳米片为催化剂;以1.0mol/lnaoh溶液为电解质,在电位为0.00~+0.21v下可催化分解水释放氧气,在电位为+0.85~+1.25v下可催化分解水制氢,在电位低于-0.50v或电位高于+1.70v(电位值对应电流密度为10ma·cm-2)催化分解水同时释放氢气和氧气。
下表1是本发明在不同电位范围内电催化水产氧和氢气的具体反应机理。
表1电化学产氧和氢气的机理
备注1.所有电位值都是相对于可逆标准氢(rhe)电极。
2.对电极为石墨碳棒。
3.*表示电流密度为10ma·cm-2对应的电位。
4._表示电极上无反应。
各阶段产生气体种类利用气相色谱技术进行分析。利用扫描电子显微技术(sem)、场发射扫描电子显微电技术(fesem)、x射线粉末衍射分析(xrd)、x射线光电子能谱(xps)、拉曼光谱(ramamshift)分析技术对所制备样品及电化学过程中的中间产物进行分析。
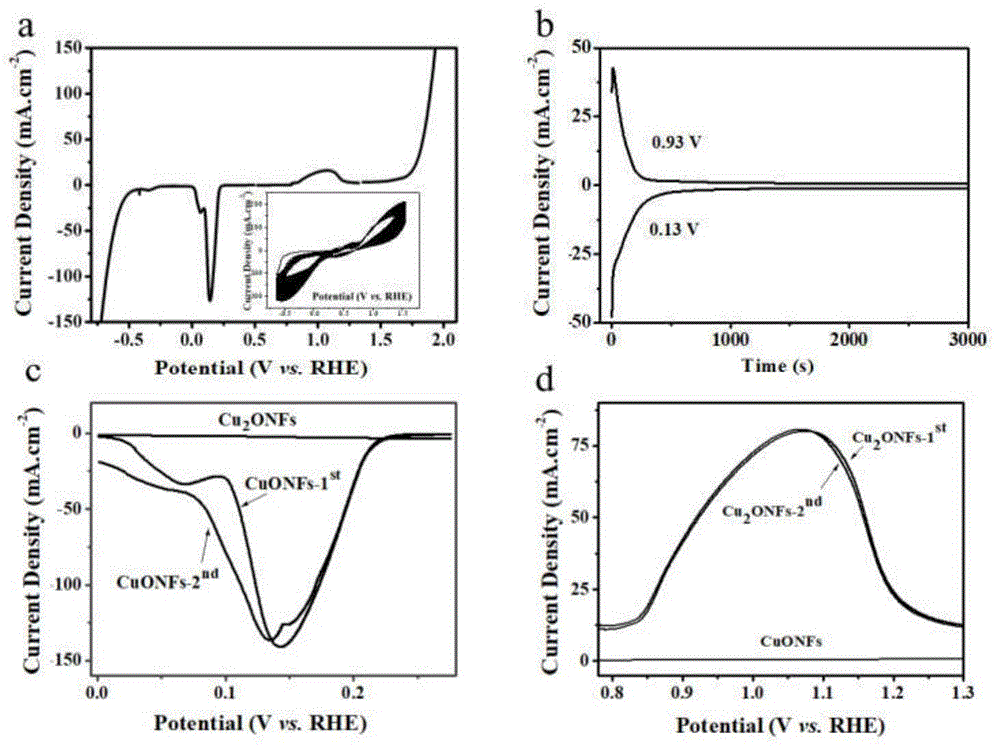
对本发明所述的自支撑电极性能进行说明,其中图1显示的是利用线性扫描伏安技术(lsv)、循环伏安技术(cv)、恒电位极化技术(it)对所发明的电极进行电化学性能和催化性质研究。
图1a为线性扫描伏安lsv图,从图1a可以看出在0.00~+0.21v和+0.85~+1.25v范围有明显的电化学电流峰,图1a中内插图为该电极在碱性溶液中持续13小时的循环伏安图,从该图可以看出连续制备气体13小时后,该电极仍具有一定的催化活性;将该电极置于+0.93v条件下恒电位极化反应至电流密度减小至1*10-3ma·cm-2(图1b),此时电极表面呈现黑色,然后利用lsv技术该黑色中间产物的性能,结果如图1c中cuonfs-1st曲线所示,然后将该电极置于+0.13v电位下进行恒电位极化至1*10-3ma·cm-2(图1b),此时电极表面已由黑色转变成砖红色。利用lsv分析技术检测砖红色电极电化学性能,结果如图1c中cu2onfs和图1d中cu2onfs-1st曲线所示;再将电位换至+0.93v条件下恒电位极化后进行扫描伏安分析,结果如图1c中cuonfs-2nd和图1d中cuonfs曲线。再将电极置于+0.13v电位下恒电位极化后进行lsv分析得到图1d中cu2onfs-2nd曲线。分别将曲线cuonfs-1st、cuonfs-2nd和cu2onfs-1st、cu2onfs-2nd进行比较,发现恒电位极化前后电流密度比较接近,说明利用恒电位极化方法可以将cuonfs和cu2onfs的催化制备氧气和氢气的能力进行恢复,即在这两个电位下可以反复催化释氧和制氢,该电极的具有良好的稳定性。
其中,图2显示的是利用扫描电子显微技术和场发射扫描电子显微技术和能谱技术研究电极表面的形貌和成分,图2a为低倍率的铜丝(cw)sem;图2b为低倍率的cuxoynfs@cw的sem图;图2c为cuxoynfs@cw场发射的sem(fesem)图;图2d为图2c的能谱(eds)图;图2e、2e-o、2e-cu、图2f、2f-o、2f-cu分别为+0.93v和+0.13v恒电位极化后所获中间产物的fesem图和相应元素分析图。
从图2a可以看出,cw表面比较光滑,无覆盖物;从图2b可以看出cuxoynfs@cw表面覆盖了一层比较均匀的材料;图2c可看出铜丝表面的材料呈纳米片状,覆盖的厚度比较均匀,为0.7um;能谱图显示cw表面生长材料含铜和氧元素。从图2e、2f可以看出,恒电位下所得中间产物前者呈玉米须状,后者呈片状,与图2b中高压反应所获产物比较,电解所获中间产物结构更加疏松;恒电位下所得中间产物的o和cu分布图比较可以发现,+0.93v条件下产物o含量比较多,与cu分布比较接近,说明产物可能为cuo;+0.13v条件下产物o含量比较少,说明产物可能为cu2o。
其中,图3显示的是利用x射线粉末衍射分析(xrd)、x射线光电子能谱(xps)、拉曼光谱(ramamshift)分析技术对样品进行表征。
图3a为xrd表征图,与标准卡片jcpdfno.04-0836相比,cuxoynfs@cw曲线中三个衍射峰2θ为43.43°,50.50°和74.21°分别对应铜基底的cu(111),(200),and(220)面,35.45°and38.58°对应cuo(002)andcuo(111),36.31°出现一非常微弱的衍射峰对应cu2o,说明cuxoynfs@cw表面有cuo、cu2o共存,而cw上2θ为35.45°、38.58°和36.31°处无衍射峰出现;图3b为样品的ramamshift表征图,cw基底上无明显的波峰出现,+0.93v恒电位极化产物cuonfs@cw对应的波谱中285,333和620cm-1出现三个散射峰,分别对应cuoag,bg(1),bg(2)的特征峰,而在高压反应釜所获产物cuxoynfs@cw的拉曼波谱图中285cm-1移动到297cm-1,623cm-1移动到633cm-1,这是cuo中存在少量的cu2o所致,+0.13v恒电位极化产物cu2onfs@cw的拉曼波谱图在215and650cm-1处出现散射峰,说明有cu2o存在;图3c和3d为样品的cu2p和o1s的xps精细谱,图3c中cuxoynfs@cw和cuonfs@cw曲线上出现结合能934.26和954.23ev的衍射峰,对应cu2p3/2和cu2p1/2,且都存在明显的shake-up峰,这是cuo特有的现象,这种材料的在934.26ev左右的衍射峰比较宽,说明成分比较复杂,有cu、cuo和cu2o共存;而cu2onfs@cw曲线图中出现932.64ev和952.34ev,对应cu2o的cu2p3/2的cu2p1/2,在937-950ev无明显的震激峰,说明无cu2+存在;图3d中cuonfs@cw和cu2onfs@cw曲线中o1s峰分别出现在531.05、530.15ev,cuo中o的电子云密度比cu2o中的o低,所以cuo中o的结合能更高。
以上所述仅表达了本发明的优选实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形、改进及替代,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!