一种框架核酸的电化学制备方法及其应用
1.本发明涉及纳米材料技术领域,具体涉及一种框架核酸的电化学制备方法及其应用。
背景技术:
2.dna纳米技术利用具有精确结构dna双螺旋和严格的watson-click碱基互补配对原则实现精确的二维和三维的静态或动态dna纳米结构,在医学诊断和分子机器等领域具有广阔的应用前景。其中,dna纳米结构的构建主要是利用dna单链间的碱基互补原则,利用不同长度及序列的dna单链间的结合能差异实现dna纳米结构最稳定构型的获得。然而,在dna单链中,由于一些非特异性的相互作用,往往会产生一些二级或三级结构(在动力学陷阱中),因此dna折纸组装往往需要借助加热或者其他手段打开 dna可能存在的二级或三级结构,继而利用dna间的碱基互补原则,实现dna链的可控折叠、杂交与组装。
3.当前,实现dna纳米结构的可控组装手段主要包含了热变性技术和非电离辐射 (微波和太赫兹)技术等。其中,热变性技术是一种最为常见和成熟用于打开dna自身或者不同dna间非特异性相互作用的手段。通常在90℃条件下,dna经历热变性的过程,二级结构(在动力学陷阱中)被打开,dna单链恢复为初始松散状态,随后在降温过程中发生dna复性,互补配对的dna形成有序的双螺旋结构。其中,商用的聚合酶链反应(polymerase chain reaction,pcr)核酸扩增仪仪器可以实现对反应体系温度的精确控制,因此,被广泛用于dna纳米结构的组装。但商用的pcr成本昂贵且可携带性差,因此限制了其在资源有限的情况下使用。此外,近年来有报道称,微波和太赫兹(thz) 体系中的非电离辐射可以在没有任何序列修改的情况下实现dna纳米结构的组装/解组装。然而,该体系并不适用于微型dna纳米结构合成体系,且成本高昂。总的来说,目前可用于打开dna中非特异性相互作用继而实现dna纳米结构的可控组装的技术是有限的。
4.最新研究表明,dna双螺旋结构中的氢键对于溶液ph非常敏感,在低ph条件下氢键被破坏,dna双链被打开,而在碱性条件下dna双链再次杂交。基于此,一系列基于ph调控的dna分子机器及聚合酶链式反应的工作被相继报道(y.zhang,q.li,l. guo,q.huang,j.shi,y.yang,d.liu and c.fan,ion-mediated polymerase chain reactionsperformed with an electronically driven microfluidic device.angew.chem.,int.ed.engl., 2016,55,12450-12454.)。因此,通过调控溶液体系的ph为组装dna纳米结构提供了新思路。而实现溶液体系的ph调控是一个实验室常规操作,但是微型的dna纳米结构合成体系给ph调控提出了新的要求和挑战。如常见的“体积滴定”方法在调控ph过程中会引入外源性物质,并且改变体系的总体积,因此并不适用于微型的dna纳米结构合成。而电化学方法具有灵敏度高、响应迅速、易于控制的特点,通过电化学方法电解水产生质子,实现对体系的ph的调控,对体系的体积影响微小,且不会产生任何无关累积废物,因此,非常适合用来对微体系的ph值进行调控。2008年,日本的hiroaki suzuki 课题组报道了一种非经典三电极电化学体系。利用氧化铱电极对ph敏感特性和银/氯化银电极的不可极化性质,
实现了对微型体系ph的精准快速调节和稳定。(k.morimoto,m. toya,j.fukuda and h.suzuki,automatic electrochemical micro-ph-stat for biomicrosystems. anal.chem.,2008,80,905-914)该工作为通过电化学方法精准快读速调控溶液ph继而实现dna纳米结构的可控合成提供了新契机。
技术实现要素:
5.本发明的目的是提供一种框架核酸的电化学制备方法及其应用,从而解决现有热变性技术制备框架核酸过程中使用的精确控制体系温度的仪器设备存在的设备昂贵和设备体积大不易携带等问题。
6.为了解决上述技术问题,本发明采用以下技术方案:
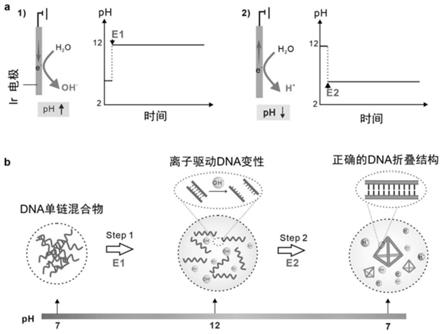
7.根据本发明的第一方面,提供一种框架核酸的电化学制备方法,所述电化学制备方法包括:电化学装置的构建:所述电化学装置通过pdms层与玻璃片层粘贴而成,其包括:通过盐桥连接的反应区和控制区,所述反应区中以银/氯化银为工作电极,所述控制区中以氧化铱为参比电极、铱为对电极;框架核酸的自组装:通过电化学策略构建形貌、生物化学性质可设计的框架核酸,提供构建所述框架核酸所需的dna单链,将 dna单链的混合液加入所述反应区中,通过向所述工作电极施加一定的电位使所述反应区内发生水的氧化反应,溶液ph降低,发生dna变性;通过向所述工作电极施加另一电位使所述反应区内发生水的还原反应,溶液ph升高,发生dna复性,最终实现框架核酸的电化学自组装。
8.所述框架核酸是由多条dna短链通过变性和复性形成的三维立体dna纳米结构。应当理解的是,短链的数量根据设计的框架核酸大小而定。
9.较优选地,所述框架核酸的形状是四面体,但是应该理解的是,其他形状的框架核酸如立方体、八面体、三棱柱、三角双锥等框架核酸同样可以用在本发明中。
10.所述框架核酸的自组装还包括:通过对dna单链的设计在所述框架核酸的结构上实现官能团的修饰。
11.较优选地,所述的功能框架核酸修饰的官能团是巯基,但是应该理解的是,其他化学基团和功能分子修饰的框架核酸如二茂铁、胺基、羧基、dbco、苯、cy3、cy5、 cy7、胆固醇、商业化荧光分子等修饰的框架核酸同样可以用在本发明中。
12.较优选地,所述巯基修饰的框架核酸中巯基与框核酸的计量比是3:1。
13.所述官能团在框架核酸上的修饰位点包括:框架核酸的顶点、框架核酸的内部空腔、或框架核酸的边框。
14.在所述框架核酸的电化学自组装过程中,捕获探针的方式包括:碱基互补配对作用、生物素和亲和素间的高亲和作用、抗原和抗体之间的相互作用、核酸适配体和特定靶标间的特异识别作用。
15.制备所述框架核酸的反应体系包括:nacl反应体系或mgcl2反应体系,其中,所述框架核酸在nacl反应体系中0.6m nacl条件下的产率最高,在mgcl2反应体系中60 mm mgcl2条件下的产率最高。
16.所述框架核酸的自组装还包括:通过将官能团修饰的框架核酸修饰在金电极界面,从而构建一种基于框架核酸的生物传感器。
17.根据本发明的一个优选方案,制备的一种dna生物传感器中巯基修饰在框架核酸
的顶点,其目的是借助au-s键将框架核酸致密的修饰在金电极表面,但是应该理解的是,其他修饰位点的框架核酸如框架核酸内部空腔、框架核酸的边框等框架核酸同样可以用在本发明中。
18.根据本发明所提供的方法,电化学体系中框架核酸的组装原理是:参比电极的电位与溶液ph具有良好的线性关系。通过向工作电极施加一定的电位使反应区发生水的氧化反应,溶液ph降低,dna在酸性体系中氢键作用被破坏,发生dna变性;而通过向工作电极施加另一电位使反应区发生水的还原反应,溶液ph升高,在碱性体系中dna发生复性,最终实现框架核酸的自组装。
19.应当理解的是,本发明中探针是通过双链杂交作用将靶标分子捕获,具体的来说,在dna四面体的框架核酸的顶点延伸出一定数量碱基,延伸出来的部分为dna单链,这部分单链可以通过碱基互补配对的方式将靶标分子捕获。应当理解的是,除了碱基互补配对作用,所述的捕获探针的方式包含生物素和亲和素间的高亲和作用,抗原和抗体之间的相互作用、核酸适配体和特定靶标间的特异识别作用等。重点是需要探针与靶标之间具有高亲和的特异识别作用。本发明所检测的靶标分子为dna,其他靶标分子或离子,如mirna、mrna、蛋白质、葡萄糖、肌氨酸和金属离子等也能用于该体系。
20.根据本发明提供的方法,实现了恒温、快速的框架核酸的组装。
21.根据本发明提供的方法,所述框架核酸的组装是由电位调控电解池中的溶液ph所实现的。
22.应当理解的是,由于不同框架核酸需要的驱动能量不一样,也就是说需要不同浓度的h
+
或者oh-实现变性和复性,因此,不同的框架核酸需要的电位是不一样的。根据不同的待构建框架核酸,具体如何设定电位,可根据具体实际情况实验获得。
23.根据本发明的一个优选方案,本发明的实施例3通过采用多个梯度的电位变化,可进一步提高四面体制备的产率。但是,应当理解的是,仅仅从一个电位变化为另一电位也可成功制备四面体,区别仅在于产率的高低。本发明并不仅限于实施例3这样一种形式的电位变化。
24.根据本发明的第二方面,提供一种框架核酸的电化学制备方法在医学诊断和分子机器领域的应用。
25.正如本发明的背景技术部分所述,现有热变性技术制备框架核酸过程中使用的精确控制体系温度的仪器设备存在的设备昂贵和设备体积大不易携带等问题,为了克服这些问题,本发明通过在电化学体系中对溶液ph的快速和精准调控,实现了对dna的变性和复性过程的调控,同时保留dna的分子信息和结构信息,本发明提供的方法突破了传统的思维模式,是一种相对现有技术更具创造性的技术手段。
26.实验结果表明,本发明提供的是一种简单快速有效的,利用控制工作电极电位可快速精准调控溶液ph的特点,可以得到一系列尺寸及特定官能团修饰的框架核酸的方法。本发明制备的框架核酸结构具有分散性良好,框架结构完整,有效调控生物传感界面的优点。本发明使用的试剂药品以及仪器设备廉价便携,易于标准化、商业化。因此,本发明为实现以电化学手段构建框架核酸、突破传统热变性技术缺陷提供了一种新的思路和技术支撑。
附图说明
27.图1示出了本发明的工作原理,其中,a示出了电化学方法调控溶液ph的示意图, b示出了ph控制框架核酸形成的示意图;
28.图2是制备氧化铱电极的电化学性能表征结果,其中,a是循环伏安图,b是电极稳定性能表征结果;
29.图3是制备的氧化铱电极的电化学性能表征及dna双链的tm值与ph之间的关系分析实验结果,其中a是电化学制备框架核酸的装置示意图,b是氧化铱的电位与ph之间的线性关系实验结果,c是氧化铱电极的电位调控速度表征,d是不同长度双链在不同 ph条件下的tm值的实验结果;
30.图4是ph调控dna双链的变性和复性状态的实验结果展示,其中,a是荧光法验证ph为11和7两种条件下dna双链的变性和复性状态示意图,b是ph为7和11条件下体系的荧光光谱,c是ph为7和11条件下体系的荧光强度分析结果;
31.图5是实施例3中制备框架核酸的具体实验参数,a是电化学方法的实验参数,b 是热变性方法的实验参数;
32.图6是不同种类和浓度的盐离子中框架核酸的凝胶电泳表征和产率分析实验结果,其中,a是不同na
+
浓度体系中框架核酸的凝胶电泳表征,b是不同na
+
浓度体系中框架核酸的产率分析实验结果,c是不同mg
2+
浓度体系中框架核酸的凝胶电泳表征,d是不同mg
2+
浓度体系中框架核酸的产率分析实验结果;
33.图7是在含有mg
2+
体系中分别使用电化学方法和热变性方法制备的三种尺寸框架核酸的凝胶电泳表征和产率分析分析结果,其中,a是框架核酸的凝胶电泳表征,b是框架核酸的产率分析分析结果;
34.图8是在含有na
+
体系中分别使用电化学方法和热变性方法制备的三种尺寸框架核酸的凝胶电泳表征和产率分析分析结果,其中,a是框架核酸的凝胶电泳表征,b是框架核酸的产率分析分析结果;
35.图9是分别使用电化学方法和热变性方法制备的三种尺寸框架核酸的afm表征;
36.图10是电化学方法制备的三种尺寸框架核酸的afm表征及尺寸分析结果,其中, c是三种尺寸框架核酸的afm表征,d是三种尺寸框架核酸的尺寸分析结果;
37.图11是电化学方法制备的巯基修饰的框架核酸的凝胶电泳表征及afm表征,其中,a是巯基修饰的框架核酸的凝胶电泳表征,b是巯基修饰的框架核酸的afm表征;
38.图12是框架核酸生物传感器的实验原理及性能表征,其中,a是框架核酸传感器的原理示意图,b是不同dna结构修饰的传感器的时间-电流实验结果,c是不同dna结构修饰的传感器的电流强度分析结果;
39.图13是不同dna结构修饰的传感器的循环伏安曲线。
具体实施方式
40.以下结合具体实施例,对本发明做进一步说明。应理解,以下实施例仅用于说明本发明而非用于限制本发明的范围。
41.根据本发明,提供一种框架核酸的电化学制备方法。本发明选择了不同尺寸的 dna四面体为例,然后在室温条件下通过调控工作电极上的电位实现对电解池中的溶液 ph
进行调节。具体地,当施加一定的电位时,反应区发生水的还原反应,产生大量的 oh-,反应区ph升高,单链dna发生变性;当施加一定另一电位时,反应区发生水的氧化反应,产生大量的h
+
,反应区ph降低,互补配对的dna单链杂交成双链,进行框架核酸的组装(如图1所示)。接着,将构建巯基修饰的dna四面体框架核酸,借助au-s 作用组装在金电极表面,调控核酸探针与靶标分子的杂交热力学,进而提高了生物传感器的总体性能。
42.其中,dna购自生工生物(上海);氯化钾,磷酸氢二钠,铱丝等试剂购于国药集团试剂有限公司。铂电极,银/氯化银电极购于武汉高仕睿联科技有限公司。britton
‑ꢀ
robinson缓冲液(0.01m h3po
4-h3bo
3-ch3cooh,0.1m kcl,用盐酸和氢氧化钠调控特定ph,以下简称br buffer)购于青岛捷世康生物科技有限公司。
43.dna序列如下表1所示。
44.表1
45.实施例1电化学装置的构建
46.在本实施例,构建一种电化学装置,包括以下步骤:
47.氧化铱电极的制备:以铱丝为工作电极,银/氯化银电极为参比电极,铂电极为对电极,0.7m na2hpo4溶液为电解液,采用辰华chi1040c,按照表2所示参数进行循环伏安氧化。将经循环伏安氧化处理的氧化铱电极浸泡在水中,水合老化24h。
48.表2 初始电位(v)-0.5最高电位(v)0.8最低电位(v)-0.5最终电位(v)0扫速(v/s)0.1扫描圈数300静息时间(v)0灵敏度(a/v)10-4
49.电极的性能测试过程:将ph分别为1.7、2.7、3.7、4.5、5.5、6.7、7.7、8.7、 9.5、10.4和11.6的britton-robinson(br)缓冲溶液依次加入到反应区,以银/氯化银为工作电极,氧化铱电极为参比电极,测量氧化铱电极与银/氯化银电极间的电位差,获取电位差与溶液ph值的相关曲线。标定好电位差与体系ph之间的对应关系后,搭建以氧化铱为参比电极,以银/氯化银为工作电极,铱电极为对电极,依据氧化铱电极与溶液ph 值间的相关曲线的数据,循环施加-190mv和178mv,考察电化学方法对溶液ph的快速和可逆调控能力。
50.pdms的制备:称取质量比为10:1的pdms和固化剂于干净的烧杯中,用玻璃棒将其搅拌均匀后,放置于真空干燥器中抽真空15min将混合物中的气泡抽出。然后将 pdms和固化剂的混合物倒至于水平玻璃槽中,放置在水平加热台上在80℃条件下固化 1小时就可以得到pdms薄膜。
51.电化学装置的构建:以银/氯化银为工作电极、氧化铱电极为参比电极、铱为对电极。预先用打孔器在pdms膜上打距离约为1.5cm的两个孔,然后将该pdms贴到载玻片表面,组装成电解槽。在控制区域加200μl 0.1m kcl,在反应区域加20μl待制备成纳米结构的单链混合液,以0.5%琼脂糖作为盐桥(如图3中的a所示)。
52.结果:循环伏安曲线显示在0.1v和0.5v(vs.ag/agcl)左右分别出现了一对氧化铱
的特征峰,证明我们成功制备了氧化铱电极(如图2中的a所示)。而且开路电位方法测定结果表明,氧化铱电极的电位与所处溶液ph之间具有良好的线性关系,相关系数r2为0.999,斜率为77mv ph-1
(如图3中的b所示)。当工作电位从-190mv(对应的 ph=12)更改为178mv(对应的ph=12)时,观察到明显的氧化电流,并且在20s内达到稳定状态(如图3中的c所示),说明电化学方法可以实现对溶液ph的快速调控。此外,该电化学调控系统可实现对溶液ph的数次可逆调控(如图2中的b所示)。
53.实施例2溶液ph对dna变性和复性过程的调控
54.不同ph条件下dna双链tm值的测量过程:将所需要的单链dna采用紫外-可见吸收光谱仪进行定量,将所有dna单链浓度定量至100μm的浓度。将链长分别为13 bp、20bp、26bp、37bp和47bp的互补配对的两条单链等比例地混合加入含有1
×ꢀ
sybr-green的不同ph的br缓冲溶液中,配成单链终浓度均为1μm的样品。将配好的样品放入rt-pcr仪中,95℃加热10min,然后骤降至25℃,再缓慢升温至95℃,实时采集整个变温过程中各组样品的荧光信号。
55.dna双链在不同ph体系中变性和复性过程的验证过程:采用紫外-可见吸收光谱仪将分别修饰有alexa488和bhq1的两条单链dna(f1-alexa488和f2-bhq1)均定量至50μm。然后将两条单链dna等量混合分别加入ph为7和11的br缓冲溶液中,单链dna的终浓度为100nm。荧光测试条件为:激发波长为488nm,发射波长498-650 nm,激发和发射狭缝均为5nm。
56.结果:dna熔解温度结果显示,随着双链dna的长度增大,tm值逐渐增大。并且对于同样长度的dna链而言,其tm随着溶液ph值的增大而减小(如图3中的d所示)。从而证明在碱性体系中,双螺旋结构的能量变弱,更利于解旋行为的发生。
57.在ph=7的br缓冲溶液中,f1-alexa488和f2-bhq1杂交成双链结构,两端的荧光基团和淬灭基团靠近,alexa488的荧光被淬灭,而在ph=11的碱性环境中,f1
‑ꢀ
alexa488和f2-bhq1形成的双链结构打开,两端的荧光基团和淬灭基团远离,alexa488 的荧光恢复,综上,溶液ph可实现对dna双链的杂交和解旋状态的调控(如图4所示)。
58.实施例3不同尺寸dna四面体框架核酸的制备
59.筛选电化学方法制备框架核酸的盐浓度的实验过程:为了筛选dna四面体制备的最佳mg
2+
浓度,将形成dna四面体纳米结构的四条单链dna以1μm的终浓度等比例地分别混合在tm buffer、10mm mgcl2、20mm mgcl2、40mm mgcl2和60mm mgcl2中,放入pcr仪中95℃加热10min,然后迅速降温至4℃并维持10min以上。为了筛选dna四面体制备的最佳na
+
浓度,将形成dna四面体纳米结构的四条单链dna以1 μm的终浓度等比例地分别混合在tm buffer、0.2m nacl、0.3m nacl、0.4m nacl、0.5 m nacl和0.6m nacl中,放入pcr仪中95℃加热10min,然后迅速降温至4℃并维持 10min以上。
60.框架核酸的电化学制备过程:将所需要的单链dna采用紫外-可见吸收光谱仪进行定量,将所有dna单链浓度定量至100μm。将制备20bp,26bp,和37bp的dna四面体的四条或者八条单链dna等量混合加入0.5m nacl或60mm mgcl2中,每条单链 dna的终浓度为1μm。取20μl加入反应区中,工作电位依次设置为178mv、104 mv、31mv、-43mv、-117mv和-190mv,每个电位条件均保持1min,制得电化学框架核酸(e-tdns)(如图5中的a所示)。
61.框架核酸的热变性制备过程:将所需要的单链dna采用紫外-可见吸收光谱仪进行
定量,将所有dna单链浓度定量至100μm。将制备dna四面体的四条或者八条单链 dna等量混合,加入反应区中,反应区的电解液为1
×
tm缓冲液(20mm tris,50mmmgcl2,ph 8.0)中,每条单链dna的终浓度为1μm,所得混合物加热至95℃保持10 min,随后在5min内迅速冷却至4℃并维持10min以上,制得热变性框架核酸(t
‑ꢀ
tdns)(如图5中的b所示)。
62.凝胶电泳表征:使用8%聚丙烯酰胺电泳凝胶电泳进行表征,在120v条件下运行2 h。
63.原子力显微镜表征:用0.5%(v/v)aptes溶液处理新撕开的云母1min,用大量超纯水冲洗去除云母表面未吸附的aptes,用洗耳球吹干云母表面备用。取10μl 1nm 样品滴至云母表面,吸附5min。在原子力显微镜下扫描成像,成像探针为scanasyst
‑ꢀ
fluid+,成像模式为peakforce qnm in fluid。
64.结果:凝胶电泳结果显示,在nacl反应体系中0.4~0.6m条件下产率相差不大, 0.6m nacl条件下框架核酸的产率最高,而在mgcl2反应体系中60mm mgcl2条件下框架核酸的产率最高,但为了配液方便,在后续的框架核酸组装实验中选择的反应体系为 0.5m nacl或60mm mgcl2溶液(图6)。
65.此外,凝胶电泳表征显示在nacl体系和mgcl2系统中电化学方法可以成功制备20 bp,26bp,和37bp的dna正四面体(图7和图8)。且原子力显微镜表征显示,与传统的热变性方法相比,电化学方法制备的dna四面体同样具有良好的分散性和结构完整性(图9),并且原子力图像尺寸分析显示20bp,26bp,和37bp的dna四面体的横向尺寸为8.6nm,11.7nm和17.5nm(图10)。
66.实施例4巯基修饰的框架核酸的制备
67.巯基修饰的框架核酸的制备:将所需要的单链dna采用紫外-可见吸收光谱仪进行定量,将所有dna单链浓度定量至100μm。将制备dna四面体的四条单链dna等量混合在含有3mm tcep的1
×
tm缓冲液(20mm tris,50mm mgcl2,ph 8.0)中,终浓度为1μm,进行变性合成框架核酸。变性过程参考实施例3。
68.凝胶电泳表征:使用8%聚丙烯酰胺电泳凝胶电泳进行表征,在120v条件下运行2 h。
69.原子力显微镜表征:用0.5%(v/v)aptes溶液处理新撕开的云母1min,用大量超纯水冲洗去除云母表面未吸附的aptes,用洗耳球吹干云母表面备用。取10μl 1nm 样品滴至云母表面,吸附5min。在原子力显微镜下扫描成像,成像探针为scanasyst
‑ꢀ
fluid+,成像模式为peakforce qnm in fluid。
70.结果:聚丙烯酰胺电泳表明电化学制备的框架核酸泳道在目标条带具有清晰的条带,修饰有巯基的dna四面体框架核酸制备成功(如图11中的a所示)。
71.原子力显微镜表征显示,电化学制备的巯基修饰的框架核酸具有良好的单分散性及结构完整性,这表明本发明提供的电化学方法能够用于制备含有巯基修饰的框架核酸 (如图11中的b所示)。
72.实施例5基于框架核酸探针的dna生物传感器的制备
73.四面体dna纳米探针在金电极表面的修饰:参考实施例4所述方法,分别采用电化学方法和热变性方法制备三个顶点修饰有巯基的框架核酸。分别取6μl制备的框架核酸滴加至金电极表面,放入湿盒中常温过夜组装。同样取6μl巯基修饰的单链dna滴加至金电极
表面,室温过夜组装。然后,用2mm的mch封闭1h,目的是减小dna在表面的非特异性吸附,有助于dna探针保持直立状态。
74.靶标dna的检测:将终浓度为10nm t-probe和终浓度为100nm的信号探针r
‑ꢀ
biotin在10mm pb杂交液里混合,在80℃加热5分钟,室温冷却20分钟。然后将组装好的电极浸泡到上述混合溶液中,37℃反应2个小时;再用0.01m pbs冲洗电极,n2吹干。随后加入3μl的avidin-hrp(0.5u/ml),室温标记15min。然后0.01m pbs冲洗,用于电化学测量。
75.电化学测量:所有的电化学测试都是通过辰华chi660e电化学工作站进行信号读出。三电极体系包括金电极作为工作电极、铂丝电极作为对电极、ag/agcl电极作为参比电极。循环伏安法的扫描速度为100mv/s,扫描范围从-0.25v到0.4v。另外,计时电流法电位设为100mv,取100s的电化学还原电流为输出电信号(hrp催化反应的平衡态)。
76.结果:与ssdna传感器相比,e-tdns和t-tdns传感器在-0.3v和0v之间的还原电流均显著增加(图13),e-tdns和t-tdns修饰的电极表面有更多的tmb氧化物得到电子被还原。时间-电流(i-t)曲线显示,在恒定还原电压(-0.1v)下,tdns修饰的金电极实验组还原电流显著增加(如图12中的b所示)。这些结果表明,e-tdns和 t-tdns修饰的金电极界面的dna杂交效率较高。单链dna组的信号仅比空白组高约2 倍,而e-tdns和t-tdns实验组的信号均比空白组高186倍以上。这些结果显示,刚性三维框架结构可以精确调节探针间距离,从而提高电化学界面杂交效率。且e-tdns和 t-tdns两组间的电流信号值无明显差异(大约2%),证明了电化学方法与传统的热变性方法制备的框架核酸结构一致(如图12中的c所示)。
77.以上所述的,均为本发明的较佳实施例,并非用以限定本发明的范围,本发明的上述实施例还可以做出各种变化。即凡是依据本发明申请的权利要求书记说明书内容所作的简单、等效变化,皆落入本法明专利的权利要求保护范围。本发明未详尽的均为常规技术内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1