一种应用于毛细管凝胶电泳分析蛋白的内标指示物的制作方法
本发明涉及蛋白质分析、毛细管凝胶电泳法(CGE-SDS),特别涉及一种应用于毛细管凝胶电泳分析蛋白的内标指示物以及采用该内标指示物测定蛋白样品的测定方法。
背景技术:
贝克曼库尔特公司(其母公司为AB SCIEX公司)的内标物(Internal Standard)10kDa Marker在CGE-SDS(毛细管凝胶电泳法)分析方法中主要用作一种迁移标记物,用于计算其他未知蛋白相对于该蛋白的位置,从而对未知蛋白进行预估。但是在对已知蛋白样品的分析(如QC试验)中,由于蛋白样品的分子量已知,该10kD marker的主要作用在于根据其出峰时间判断试验条件是否可接受。而对于QC样品来说,加入内标物的稳定性及批次间的一致性是QC分析方法中一个非常重要的因素,直接影响最终结果的准确性。
另一方面,由于蛋白质样品在发酵、纯化、灌装、存放等一系列过程中,物理和化学的因素会对蛋白质样品产生影响,从而导致蛋白质链的断裂而形成各种片段,这些片段从几百Da到几十kDa不等。对于单克隆抗体,其产生的部分碎片段在CGE-SDS中的出峰位置与10kD Marker(内标物)的出峰位置接近,从而直接导致10kD Marker对上述片段信号的覆盖,进而影响蛋白质样品的纯度计算,同时也会带来对风险杂质的误判。
因此,对内标指示物的选择必须满足下面几个条件:第一,该内标指示物必须不能和蛋白质产生化学或物理反应而改变待测样品的物化性质;第二,由于CGE-SDS方法是一种紫外吸收法,所以为了能在谱图上检测到该内标指示物,其必须在280nm或214nm处有紫外吸收;第三,由于CGE-SDS在采用蛋白样品制备样品缓冲液(sample buffer)及毛细管内的分离胶(Gel)中含有大量的SDS(十二烷基硫酸钠),且SDS必不可少,所以该内标指示物必须同时不能和SDS有相互作用;第四,该内标指示物必须在分离电场的作用下能够与带负电荷的蛋白质往相同的方向运动;第五,该内标指示 物必须稳定,在70℃的水浴条件下不引入新的片段;第六,该内标指示物在电场的作用下,其本身的出峰时间必须不能在蛋白质样品的出峰时间范围内。
由于当前所使用的通用内标物为贝克曼库尔特/AB SCIEX公司的10KD内标物,该内标物为人工合成多肽,不仅存在批次间的差异性,而且容易覆盖待分析样品片段的信号,致使影响待测样品的纯度计算,也同时带来了对风险杂质的误判。
因此,需要开发一种能同时满足上述几个条件的内标指示物,且该内标指示物稳定性好,在批次间具有一致性、不易覆盖分析样品片段的信号、并能准确计算蛋白质样品的纯度,同时也避免了对风险杂质的误判。
技术实现要素:
本发明的目的在于提供一种应用于毛细管凝胶电泳分析蛋白的内标指示物以及采用该内标指示物测定蛋白样品的测定方法,以解决现有技术中所存在的问题或不足。本发明的应用于毛细管凝胶电泳分析蛋白的内标指示物能彻底解决内标指示物批次间差异及影响待测蛋白样品纯度分析的准确性问题,同时不会引入新的杂质,稳定性好,且不易覆盖所分析的蛋白样品的样品片段信号、并能准确计算蛋白质样品的纯度,同时也避免了对风险杂质的误判。采用该内标指示物测定蛋白样品的测定方法可很好的实现上述蛋白样品的纯度测定,并获得上述优异的技术效果。
为了实现上述目的,本发明采用如下的技术方案:
一种采用毛细管凝胶电泳法测定蛋白样品纯度的方法,为采用苯甲酸作为内标指示物,并采用还原法毛细管凝胶电泳法测定蛋白样品纯度的方法。
本发明所述的蛋白优选为抗VEGF单克隆抗体。
进一步的,所述蛋白样品的浓度范围为0.3-2.0mg/ml,苯甲酸没有特定的测定范围,只要求出峰清晰可见即可。
优选的,所述蛋白样品的浓度为1.0mg/ml,内标指示物苯甲酸的浓度为3mg/ml。
所述采用毛细管凝胶电泳法测定蛋白样品纯度的方法,包括如下具体步骤:
(1)配置待测蛋白样品:蛋白样品-缓冲液-内标指示物溶液;
(2)将含有蛋白样品-缓冲液-内标指示物溶液的离心管,置于70℃水浴10min,然后振荡混匀,采用3000rpm的转速离心60s,取上清液90μL至PCR管中,最后将具有上清液的PCR管装入毛细管电泳仪的进样瓶中,盖上进样瓶瓶盖,备用分析;
(3)采用毛细管凝胶电泳法进样分析,获得吸光度-时间图谱,通过积分面积计算 获得所述蛋白样品的纯度;其中毛细管凝胶电泳法进样时,先依次采用0.1M的氢氧化钠冲洗毛细管电泳仪中的凝胶分离柱10min,0.1M的盐酸冲洗1min,超纯水冲洗1min,再采用电动进样待测蛋白样品;其进样条件为:电动进样电压5kV×20s,分离电压为15kV×30min,紫外波长214nm检测,分离柱柱温25℃。
进一步的,所述蛋白样品-缓冲液-内标指示物溶液的配置,包括如下步骤:
(a)0.3%(质量-体积百分比,单位g/ml)苯甲酸溶液的配置及存放:称取苯甲酸30.000±0.050mg,加水定容至10mL,于80℃水浴10min,混匀后,室温保存6个月。
(b)上样缓冲液的配置及存放:分别称取Tris 1.211±0.010g和SDS 1.000±0.010g,加水80mL溶解,混匀获得中间缓冲液;冷却后用浓HCl(HCl质量浓度为36.5%)调节所述中间缓冲液的pH至9.0±0.2,最后加水定容至100mL,混匀后室温保存。
(c)β-巯基乙醇与上样缓冲液的混合液配置:量取β-巯基乙醇0.5mL与所述上样缓冲液5.5ml,混匀后获得所述β-巯基乙醇与上样缓冲液的混合液。
(d)蛋白样品的稀释:将蛋白样品用水稀释至2.5mg/mL,获得稀释的蛋白样品。
(e)蛋白样品-缓冲液的配置:取40μL稀释的蛋白样品和60μLβ-巯基乙醇与上样缓冲液的混合液,混合均匀备用。
(f)蛋白样品-缓冲液-内标指示物溶液的配置:在100μL蛋白样品-缓冲液中加入2μL所述0.3%的苯甲酸溶液,制得所述蛋白样品-缓冲液-内标指示物溶液,该蛋白样品-缓冲液-内标指示物体系用于毛细管凝胶电泳分析,尤指用于还原法毛细管凝胶电泳分析。
上述蛋白样品-缓冲液-内标指示物溶液中蛋白样品的浓度为1.0mg/ml,内标指示物苯甲酸的浓度为3mg/ml。
与现有技术相比,本发明具有如下有益效果:
本发明的应用于毛细管凝胶电泳分析蛋白的内标指示物以及采用该内标指示物测定蛋白样品的测定方法,能够彻底解决内标指示物批次间差异及影响待测样品纯度分析的准确性问题,同时不会引入新的杂质,稳定性好,且该内标指示物不易覆盖所分析的蛋白样品的样品片段信号、并能准确计算蛋白质样品的纯度,同时也避免了对风险杂质的误判。
采用该内标指示物苯甲酸测定蛋白样品的测定方法可很好的实现上述蛋白样品的纯度测定,并同时获得上述优异的技术效果。
附图说明
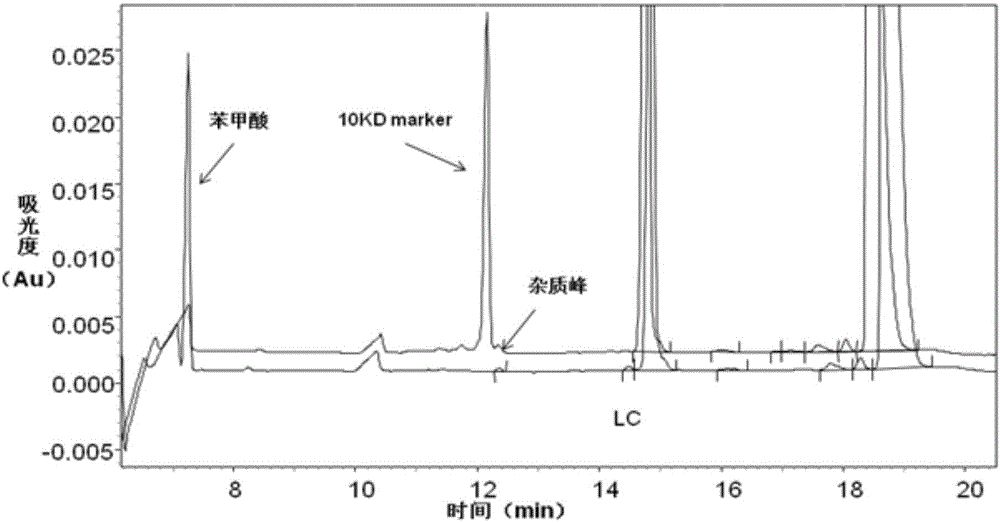
图1为10kD Marker内标物对各样品分析的影响图谱,其中纵坐标为吸光度(Au)。
图2为苯甲酸与10kD Marker2种内标物的差异性图谱。
图3为不同批次间10kD Marker的差异性图谱。
图4为使用内标指示物苯甲酸的多针比较图谱。
具体实施方式
下面将结合具体实施例进一步详细说明本发明,应理解,这些实施例只用于解释说明本发明,而不是用来限制本发明的保护范围。
实施例
1.1主要仪器:Beckman公司的PA800PLUS毛细管电泳仪。
1.2实验材料:具体实施例所使用的试验材料名称、货号以及生产厂家如表1所示。本发明实施例中如下的各蛋白样品是指抗VEGF单克隆抗体。
表1
注:上述NA代表无货号(因为是使用时根据需要自行配置)或无备注;上述0.1M中的M代表mol/L。
1.3缓冲液、蛋白样品溶液及所需溶液的配制
(1)0.1M浓度的氢氧化钠:称取NaOH 4.00±0.01g,加水定容至1000mL,混匀 后室温保存。
(2)0.1M浓度的盐酸:量取浓盐酸(HCl质量浓度为36.5%)9mL,加入水定容至1000mL,混匀后,室温保存。
(3)0.3%(质量-体积百分比,单位g/ml)苯甲酸溶液的配置及存放:称取苯甲酸30.000±0.050mg,加水定容至10mL,于80℃水浴10min,混匀后,室温保存6个月。
(4)上样缓冲液:分别称取Tris 1.211±0.010g和SDS 1.000±0.010g,加水80mL溶解,混匀获得中间缓冲液;冷却后用浓HCl(HCl质量浓度为36.5%)调节所述中间缓冲液的pH至9.0±0.2,最后加水定容至100mL,混匀后室温保存。
(5)β-巯基乙醇与上样缓冲液的混合液:量取β-巯基乙醇0.5mL与所述上样缓冲液5.5ml于离心管中,混匀后获得所述β-巯基乙醇与上样缓冲液的混合液。
(6)蛋白样品的稀释:将蛋白样品于离心管中,用水稀释至2.5mg/mL,获得稀释的蛋白样品。
(7)蛋白样品-缓冲液的配置:取40μL稀释的蛋白样品和60μLβ-巯基乙醇与上样缓冲液的混合液,置于离心管中,混合均匀备用。
(8)蛋白样品-缓冲液-内标指示物溶液的配置:在装有100μL蛋白样品-缓冲液的离心管中加入2μL所述0.3%的苯甲酸溶液,制得所述蛋白样品-缓冲液-内标指示物体系,该蛋白样品-缓冲液-内标指示物体系用于毛细管凝胶电泳分析,尤指用于还原法毛细管凝胶电泳分析。
(9)制剂Buffer的组成:5.8g/L的一水合磷酸二氢钠,1.2g/L的无水磷酸氢二钠,60g/L的海藻糖和0.4g/L的吐温20,该制剂Buffer的pH=6.2。
(10)制剂Buffer样品的稀释:取10μL制剂Buffer样品于离心管中,加88μL水,混匀备用,获得稀释的制剂Buffer样品。
本发明具体实施例中的蛋白样品优选为抗VEGF单克隆抗体。
上述蛋白样品-缓冲液-内标指示物溶液中蛋白样品的浓度为1.0mg/ml,内标指示物苯甲酸的浓度为3mg/ml。
1.4蛋白样品的预处理方法:
将上述1.3中(8)蛋白样品-缓冲液-内标指示物溶液的离心管,置于70℃水浴10min,然后振荡混匀,采用3000rpm的转速离心60s,取上清液90μL至PCR管中,最后将具有上清液的PCR管装入PA800PLUS毛细管电泳仪的进样瓶中,盖上进样瓶瓶盖,备 用分析。
1.5毛细管凝胶电泳分析方法所需条件:
依次采用0.1M的氢氧化钠冲洗PA800PLUS毛细管电泳仪中的凝胶分离柱10min,0.1M的盐酸冲洗1min,超纯水冲洗1min,再采用电动进样待测样品,其进样条件:电动进样电压5kV×20s,分离电压为15kV×30min,紫外波长214nm检测,分离柱柱温25℃。
2.分析与结果
2.1.10KD marker对待测蛋白样品的影响
采用与上述1.4中蛋白样品预处理一致的方法处理2个待测样品,其处理方法如下:
第一个待测样品:将上述1.3中(7)蛋白样品-缓冲液的离心管中加入2μL10KD marker,置于70℃水浴10min,然后振荡混匀,采用3000rpm的转速离心60s,取上清液90μL至PCR管中,最后将具有上清液的PCR管装入PA800PLUS毛细管电泳仪的进样瓶中,盖上进样瓶瓶盖,获得加10KD marker的待测蛋白样品,备用分析。
第二个待测样品:将上述1.3中(7)蛋白样品-缓冲液的离心管置于70℃水浴10min,然后振荡混匀,采用3000rpm的转速离心60s,取上清液90μL至PCR管中,最后将具有上清液的PCR管装入PA800PLUS毛细管电泳仪的进样瓶中,盖上进样瓶瓶盖,获得不加10KD marker的待测蛋白样品,备用分析。
不含蛋白的制剂Buffer样品:取40μL上述1.3中(10)稀释的制剂Buffer样品于离心管中,加60μLβ-巯基乙醇与上样缓冲液的混合液,再加入2μL10KD marker,置于70℃水浴10min,然后振荡混匀,采用3000rpm的转速离心60s,取上清液90μL至PCR管中,最后将具有上清液的PCR管装入PA800PLUS毛细管电泳仪的进样瓶中,盖上进样瓶瓶盖,获得不含蛋白的制剂Buffer样品,备用分析。
采用还原法毛细管凝胶电泳并采用1.5中同样的进样条件分别对加10KD marker的待测蛋白样品、不加10KD marker的待测蛋白样品以及不含蛋白的制剂Buffer样品进行进样分析,所获得的图谱如图1所示。
图1中,峰A代表10KD marker内标物峰,峰B代表与10KD marker峰连在一起或重叠在一起的杂质峰,代表LC代表蛋白的轻链,HC代表蛋白的重链,NGHC代表无糖重链,Add marker谱图代表加10KD marker的待测蛋白样品谱图,Without marker谱图代表不加10KD marker的待测蛋白样品谱图,Buffer谱图代表不含蛋白的制剂Buffer 样品谱图。
从图1中可以看出,10kD Marker在还原法毛细管凝胶电泳分析时,其出峰位置会影响与其分子量近似的样品出峰,严重影响积分计算所测蛋白样品的纯度的准确性。
图1中,不含蛋白的制剂Buffer样品中,可清晰的看到10KD marker内标物峰,在12.1min左右位置。不加10KD marker的待测蛋白样品中,可清晰的看到各杂质峰的出峰位置。而加10KD marker的待测蛋白样品中,10KD marker作为内标物也是一种蛋白,其出峰时间在12.1min左右,随着时间变化,其出峰时间会有一定的迁移,因此其出峰位置很容易与待测蛋白样品的杂质峰重合,直接影响积分计算所测蛋白样品的纯度的准确性,图1中明显可看出杂质峰B与10KD marker内标物峰A部分重合,因此无法准确获得所测蛋白样品的纯度,说明10KD marker并不适合作为本发明所测蛋白样品的内标物。
2.2内标指示物苯甲酸对待测蛋白样品的影响
采用与上述1.4中蛋白样品预处理一致的方法处理2个待测蛋白样品,其处理方法如下:
(1):将上述1.3中(7)蛋白样品-缓冲液的离心管中加入2μL10KD marker,置于70℃水浴10min,然后振荡混匀,采用3000rpm的转速离心60s,取上清液90μL至PCR管中,最后将具有上清液的PCR管装入PA800PLUS毛细管电泳仪的进样瓶中,盖上进样瓶瓶盖,获得加10KD marker的待测蛋白样品,备用分析。
(2):将上述1.3中(8)蛋白样品-缓冲液-内标指示物溶液的离心管置于70℃水浴10min,然后振荡混匀,采用3000rpm的转速离心60s,取上清液90μL至PCR管中,最后将具有上清液的PCR管装入PA800PLUS毛细管电泳仪的进样瓶中,盖上进样瓶瓶盖,获得加内标指示物苯甲酸的待测蛋白样品,备用分析。
采用还原法毛细管凝胶电泳并采用1.5中同样的进样条件分别对加10KD marker的待测蛋白样品、加内标指示物苯甲酸的待测蛋白样品进行进样分析,所获得的图谱如图2所示。
从图2中可知,内标指示物苯甲酸相对于10KD marker内标物来说分子量较小,其出峰时间在7.1min左右,而10KD marker出峰时间在12.1min左右,10KD marker出峰时间与样品杂质峰出峰位置相近,严重干扰杂质峰的积分结果,说明10KD marker并不适合作为本发明所测蛋白样品的内标物,而采用内标指示物苯甲酸则不会影响杂质峰 的积分结果,即不会影响杂质峰的计算,进而可以准确获得所测蛋白样品的纯度,是准确测定蛋白样品纯度的最佳内标指示物。
2.3.不同批次间10kD Marker的差异性
采用与上述1.4中蛋白样品预处理一致的方法处理不含蛋白的制剂Buffer样品,其处理方法如下:
取3份40μL上述1.3中(10)稀释的制剂Buffer样品于离心管中,分别加60μLβ-巯基乙醇与上样缓冲液的混合液,再分别加入3批不同批次的2μL10KD marker,置于70℃水浴10min,然后振荡混匀,采用3000rpm的转速离心60s,分别取上清液90μL至PCR管中,最后分别将具有上清液的PCR管装入PA800PLUS毛细管电泳仪的进样瓶中,盖上进样瓶瓶盖,获得3份加入不同批次10KD marker的待测样品,备用分析。
采用还原法毛细管凝胶电泳并采用1.5中同样的进样条件分别对所获得的3份加入不同批次的10KD marker的待测样品进行进样分析,所获得的图谱如图3所示。
从图3中可以看出,所使用的3批10kD Marker在相同的制剂buffer样品中引入了新的杂质,出现不同的杂质吸收峰,说明10kD Marker在不同批次间存在差异性,不同批次间的10kD Marker的稳定性差。
2.4内标指示物苯甲酸的稳定性
采用与上述1.4中蛋白样品预处理一致的方法处理如下待测蛋白样品,其处理方法如下:
将上述1.3中(8)蛋白样品-缓冲液-内标指示物溶液的离心管置于70℃水浴10min,然后振荡混匀,采用3000rpm的转速离心60s,取上清液90μL至PCR管中,最后将具有上清液的PCR管装入PA800PLUS毛细管电泳仪的进样瓶中,盖上进样瓶瓶盖,获得加内标指示物苯甲酸的待测蛋白样品,备用分析。
采用还原法毛细管凝胶电泳并采用1.5中同样的进样条件分别对加内标指示物苯甲酸的待测蛋白样品在3周内进样6针并分析获得图谱,如图4所示。
从图4中可知(图4中自上而下依次为第1针到第6针待测蛋白进样分析图谱),第1针到第6针待测蛋白进样图谱中,内标指示物苯甲酸出峰时间分别为7.136min,7.165min,7.168min,7.141min,7.088min,7.123min,其RSD结果为0.41%;分别积分获得蛋白样品的纯度分别为99.0%,99.1%,99.2%,99.1%,98.9%,98.9%,其RSD 结果为0.12%(如表2所示,各蛋白样品间的RSD在可接受范围内)。
由上可知,使用苯甲酸作为内标指示物不会引入新的杂质,不会产生新的杂质峰,因此不会对蛋白样品纯度的计算造成干扰,且显示出内标指示物苯甲酸的稳定性非常好。
表2
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!