一种庆大霉素C1a的检测方法与流程
本发明涉及一种庆大霉素C1a的检测方法。
背景技术:
现有庆大霉素C1a的HPLC柱前衍生化检测方法,一般为美国药典USP35-nf30版中对庆大霉素硫酸盐的检测方法。例如,准确量取10mL样品到容量瓶中,加入5mL异丙醇和4mLOPA衍生化试剂混匀,再用异丙醇定容至25mL,充分混匀后密闭,60℃水浴15min后置于冰水中终止反应,12000rmp离心5分钟后即可进行HPLC检测。其中,所使用的OPA衍生化试剂配方:邻苯二甲醛1g(0.0074mol),溶于5ml甲醇中,加入巯基乙酸2ml(0.0288mol),最后加0.4mol/L硼酸(45%氢氧化钠调pH值10.4)95ml混匀,再用45%氢氧化钠调pH 10.4,放冰箱避光保存。这一方法在工业生产中适用范围有限,线性范围窄,导致庆大霉素C1a浓度的检测结果准确性非常差。而实际生产过程中,浓度较高且纯度较低的庆大霉素C1a样品是人们经常要检测的对象,因此,发展一种准确性较高、线性范围广的庆大霉素C1a样品的衍生化试剂,是本领域亟待解决的问题。
技术实现要素:
本发明要解决的技术问题是为了克服现有技术中庆大霉素C1a在检测浓度时,线性范围窄、适用范围有限等缺陷,而提供了一种庆大霉素C1a的检测方法。本发明的庆大霉素C1a的检测方法操作简单,在检测生产样品中庆大霉素C1a浓度时准确性较高、线性范围广。
本发明提供了一种庆大霉素C1a的检测方法,其包括如下步骤:将含有庆大霉素C1a的待测样品和衍生化试剂混合均匀并进行衍生化反应,然后进行液相色谱或液相色谱-质谱联用方法检测,即可;
其中,所述衍生化试剂包含溶剂、邻苯二甲醛、巯基乙酸及缓冲溶液这几种组分;所述衍生化试剂中邻苯二甲醛与巯基乙酸的摩尔比为1:3.8~1:0.5;所述衍生化试剂的pH=10~11;
如果单次检测结果中所用衍生化试剂中邻苯二甲醛的摩尔量与所述待测样品中所测得的庆大霉素C1a的摩尔量的比值大于等于3.59,即为检测结果;如果单次检测结果中所用衍生化试剂中邻苯二甲醛的摩尔量与所述待测样品中所测得的庆大霉素C1a的摩尔量的比值小于3.59时,需提高单次检测中所述邻苯二甲醛与所述待测样品中庆大霉素C1a的实际摩尔比,进行重新检测,直至单次检测结果中“所用衍生化试剂中邻苯二甲醛的摩尔量与所述待测样品中所测得的庆大霉素C1a的摩尔量的比值”大于等于3.59为止;
所述含有庆大霉素C1a的待测样品为发酵产物中含有庆大霉素C1a的发酵液经过纯化预处理后所形成的待测样品。
较佳地,所述衍生化试剂中邻苯二甲醛与巯基乙酸的摩尔比为1:3.24~1:0.5,更佳地为1:1.2~1:0.8。
所述提高单次检测中所述邻苯二甲醛与所述待测样品中庆大霉素C1a的实际摩尔比的方法,较佳地为,在所述衍生化试剂各组分浓度、所述待测样品各组分浓度均不变的条件下提高检测体系中所述衍生化试剂与所述待测样品的质量比;或者为,在所述衍生化试剂与所述待测样品的质量比不变的条件下,对所述待测样品进行稀释和/或对所述衍生化试剂进行浓缩。
所述含有庆大霉素C1a的发酵液可为本领域各种常规代谢庆大霉素C1a的微生物培养发酵所得。较佳地,所述代谢庆大霉素C1a的微生物为绛红小单孢菌(Micromonmspora purpurea)。所述的绛红小单孢菌较佳地购自中国工业微生物菌种保藏管理中心(CICC)保藏的菌株编号为CICC11015的绛红小单孢菌。上述绛红小单孢菌均可在上述保藏中心购买得到。
较佳地,所述发酵液为放罐发酵液。
较佳地,所述纯化预处理为:将所述发酵液进行酸化处理使庆大霉素C1a释放出来,并固液分离后,滤液即为所述含有庆大霉素C1a的待测样品。
较佳地,所述纯化预处理还可包括如下步骤:在所述固液分离后,将所述滤液用阳离子交换树脂进行吸附,然后用碱水洗脱,洗脱液即为所述含有庆大霉素C1a的待测样品。较佳地,所述阳离子交换树脂为HZ-732阳离子交换树脂。
较佳地,所述酸化处理为将所述发酵液用硫酸水溶液调pH至1.5~2.5(更佳地为1.5~2.0)。较佳地,所述酸化处理的过程还进行静置。较佳地,所述静置的时间为1~4小时。较佳地,所述硫酸水溶液中硫酸浓度为4~18M,例如9M。较佳地,所述固液分离为采用过板框进行固液分离或离心分离。较佳地,所述碱水为1mol/L~5mol/LNaOH水溶液。较佳地,所述酸水为0.2mol/L~2mol/L硫酸水溶液。
较佳地,所述衍生化试剂是其各组分均匀混合后所形成的溶液。
较佳地,所述衍生化试剂中邻苯二甲醛与所述衍生化试剂的质量体积比为0.01g/mL~0.08g/mL;更佳地为0.012g/mL~0.04g/mL。
所述溶剂可为本领域各种常规溶剂,较佳地为醇类溶剂、酯类溶剂和醚类溶剂中的一种或多种。较佳地,所述醇类溶剂为甲醇、乙醇和丙醇中的一种或多种。
所述溶剂的用量可为本领域常规用量,较佳地,所述溶剂与所述邻苯二甲醛的体积质量比为1mL/g~10mL/g;更佳地为1.25mL/g~5mL/g。
所述缓冲溶液可为本领域各种常规缓冲溶液,较佳地为硼酸水溶液、硼砂水溶液和磷酸盐水溶液中的一种或多种。较佳地,所述硼酸水溶液中硼酸的摩尔浓度为0.2mol/L~0.5mol/L;更佳地为0.4mol/L~0.45mol/L。较佳地,所述硼酸水溶液的pH为10~11;更佳地为10.4~11.0。较佳地,所述硼酸水溶液的pH是通过质量分数为40%~50%(更佳地为45%)或饱和的氢氧化钠的水溶液和/或质量分数为40%~50%或饱和的氢氧化钾(更佳地为45%)的水溶液进行调节。
较佳地,所述衍生化试剂的pH是通过质量分数为40%~50%(更佳地为45%)或饱和的氢氧化钠的水溶液和/或质量分数为40%~50%或饱和的氢氧 化钾(更佳地为45%)的水溶液进行调节。
所述缓冲溶液的用量可为本领域各种常规用量,较佳地,所述溶剂与所述缓冲溶液的体积比为1:12~1:20;更佳地为1:19~1:13。
较佳地,所述衍生化反应在进行前,还将反应体系与异丙醇混合均匀。较佳地,所述异丙醇与所述反应体系的体积比为1:1~1:2。较佳地,所述衍生化反应是在密闭条件下进行。较佳地,所述衍生化反应的温度为40~60℃;更佳地为60~65℃。较佳地,所述衍生化反应的时间为10~20min;更佳地为15~17min。较佳地,所述衍生化反应在结束后,还包括后处理的操作。较佳地,所述后处理的操作为:采用将反应体系置于-10~0℃来终止反应,离心取上清液。较佳地,所述离心的转速为12000rmp~14000rmp。较佳地,所述离心的时间为5~10min。
较佳地,所述液相色谱或液相色谱-质谱联用方法检测中,所用色谱柱为C18色谱柱。所述C18色谱柱较佳地为纳微(Nano-Micro)公司的型号为Unisil 5-120C18的C18色谱柱。较佳地,所述C18色谱柱的填料粒径为5μm。较佳地,所述C18色谱柱的长度为250mm。较佳地,所述C18色谱柱的直径为4.6mm。较佳地,所述液相色谱或液相色谱-质谱联用方法检测中,所用流动相为体积比为4:1:15的庚烷磺酸钠水溶液、冰醋酸和甲醇的混合液;所述庚烷磺酸钠水溶液中庚烷磺酸钠的质量浓度为5g/L~10g/L。较佳地,所述液相色谱或液相色谱-质谱联用方法检测中,流动相的用量为1L~1.5L。较佳地,所述液相色谱或液相色谱-质谱联用方法检测中,流动相的流速为1.0mL/min~1.2mL/min。较佳地,所述液相色谱或液相色谱-质谱联用方法检测中,进样量为5~20μL。较佳地,所述液相色谱或液相色谱-质谱联用方法检测中,柱温为20~45℃。较佳地,所述液相色谱或液相色谱-质谱联用方法检测中,液相色谱检测波长为330nm~335nm。
较佳地,所述液相色谱-质谱联用方法检测中,采用电喷雾离子化电离源。较佳地,所述电喷雾离子化电离源的喷雾电压为4000~5000V。较佳地,所述液相色谱-质谱联用方法检测中,干燥器温度为300~350℃。较佳地,所 述液相色谱-质谱联用方法检测中,采用正离子扫描模式。
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:本发明的庆大霉素C1a的检测方法在检测庆大霉素C1a浓度时操作简单准确性较高、线性范围广。
附图说明
图1为参考实施例3中所得的曲线结果
图2为对比实施例1中所得的曲线结果
图3为实施例2中所得的曲线结果
图4为实施例3中所得的曲线结果
图5为实施例5中所得的曲线结果
图6为实施例6中所得的曲线结果
图7为实施例8中所得的曲线结果
图8为实施例9中所得的曲线结果
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
以下实施例中所用仪器:Agilent 1200型液相色谱仪,包括G1322A型在线脱气机,G1311A型自动进样器(美国安捷伦);DK-8D型电热恒温水槽,上海精密实验设备有限公司。
以下实施例中所用试剂:甲醇、硫酸、硼酸、异丙醇、氢氧化钠、邻苯二甲醛(OPA)均为分析纯,巯基乙酸、庚烷磺酸钠为色谱纯。
参考实施例1
标准品:精密称取庆大霉素C1a标准品,溶解在蒸馏水中制成浓度为18mg/ml的溶液,4℃冰箱保存,临用时进行稀释。
样品:放罐发酵液(对绛红色小单孢菌Micromonmspora purpurea进行发酵的发酵罐发酵)用4mol/L~18mol/IL硫酸酸化1小时后过板框进行固液分离,滤液经HZ-732离子交换树脂吸附后,1mol/L~5mol/LNaOH水溶液洗脱,洗脱液为待测样品,该样品中庆大霉素C1a的含量为2~15mg/mL,HPLC纯度为40%~60%左右。
1、衍生化试剂配制方法①:
邻苯二甲醛1g(0.0074mol),溶于5ml甲醇中,加入巯基乙酸2ml(0.0288mol),最后加0.4mol/L硼酸(45%氢氧化钠调pH值10.4)95ml混匀,再用45%氢氧化钠调pH 10.4,放冰箱避光保存。
这里衍生化试剂配制方法①可参考美国药典USP35-nf30版3326页左栏第3~5段中对庆大霉素硫酸盐的检测方法。
2、衍生化试剂配制方法②:
邻苯二甲醛4g(0.0296mol),溶于5ml甲醇中,加入巯基乙酸2ml(0.0288mol),最后加0.4mol/L硼酸(45%氢氧化钠调pH值10.4)95ml混匀,再用45%氢氧化钠调pH 10.4,放冰箱避光保存。
3、衍生化试剂配制方法③:
邻苯二甲醛1.2g(0.00888mol),溶于5ml甲醇中,加入巯基乙酸2ml(0.0288mol),最后加0.4mol/L硼酸(45%氢氧化钠调pH值10.4)95ml混匀,再用45%氢氧化钠调pH 10.4,放冰箱避光保存。
4、衍生化试剂配制方法④:
邻苯二甲醛4g(0.0296mol),溶于5ml甲醇中,加入巯基乙酸1ml(0.0144mol),最后加0.4mol/L硼酸(45%氢氧化钠调pH值10.4)95ml混匀,再用45%氢氧化钠调pH 10.4,放冰箱避光保存。
5、衍生化反应步骤:
准确量取10mL样品到容量瓶中,加入5mL异丙醇和4mL衍生化试剂 混匀,再用异丙醇定容至25mL,充分混匀后密闭,60℃水浴15min后置于冰水中终止反应,12000rmp离心5分钟后即可进行HPLC检测。
6、HPLC检测方法:
色谱条件:色谱柱Nano-Micro公司的型号为Unisil 5-120C18的色谱柱(5μm,4.6×250mm);流动相:庚烷磺酸钠水溶液(5g/L,200ml)-冰醋酸(50ml)-甲醇(750ml);流速1.2ml/min;柱温40℃;进样量20μl;检测波长330nm。庆大霉素C1a出峰时间约为9~11min。
这里HPLC检测方法可参考美国药典USP35-nf30版3326页左栏第3~5段中对庆大霉素硫酸盐的检测方法。
参考实施例2(精密度试验)
将参考实施例1中浓度为18mg/ml的标准品溶液用蒸馏水稀释成浓度为1.155mg/ml的标准品溶液;然后按照参考实施例1中衍生化试剂配制方法①配制衍生化试剂,并按照参考实施例1中衍生化反应步骤、HPLC检测方法进行衍生化及检测。重复进样5次,计算RSD,结果见表1。
表1
从表1可见,按照参考实施例1中的衍生化试剂的配制方法①、衍生化反应步骤、HPLC检测方法进行衍生化及检测,精密度较高。
参考实施例3(标准品曲线绘制)
精密吸取庆大霉素C1a标准品溶液,分别稀释成不同浓度的溶液,按照参考实施例1中的衍生化试剂的配制方法①、衍生化反应步骤、HPLC检测方法进行衍生化及检测。以结果中庆大霉素C1a峰面积为纵坐标(Y),庆大霉素C1a浓度为横坐标(X),进行线性回归,得回归方程:y=0.6672x+13.146R2=0.9997。该结果表明,采用该方法对庆大霉素C1a进行HPLC检测,在 庆大霉素C1a浓度为0.1~18mg/mL范围内呈良好的线性关系,线性回归结果如图1所示。
对比实施例1
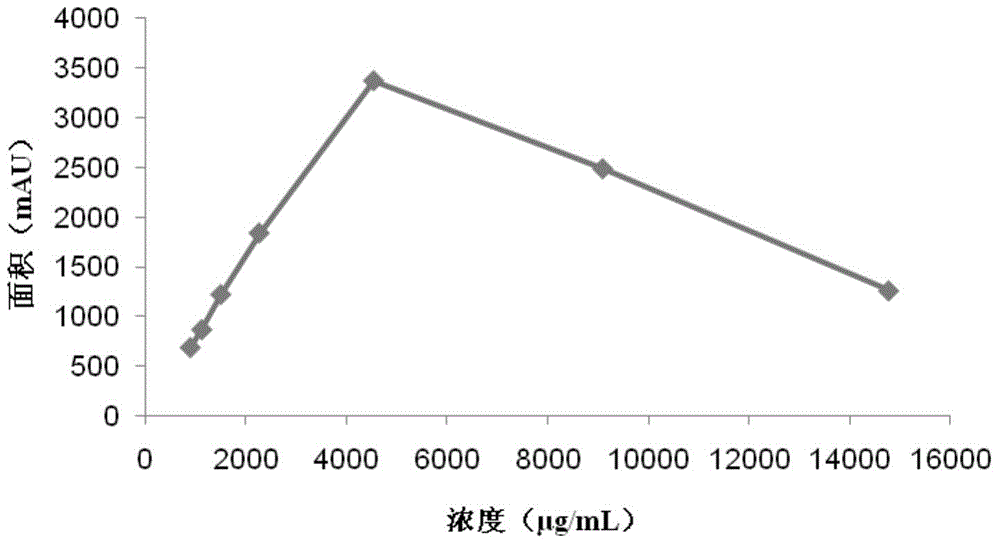
精密吸取参考实施例1中待测样品溶液,分别稀释成不同浓度的溶液,按照参考实施例1中的衍生化试剂的配制方法①、衍生化反应步骤、HPLC检测方法进行衍生化及检测。以结果中庆大霉素C1a峰面积为纵坐标(Y),庆大霉素C1a浓度为横坐标(X),进行线性回归,线性回归结果如图2所示。从图2可见,采用该方法对庆大霉素C1a样品2进行HPLC检测,在庆大霉素C1a浓度为大于2mg/mL时,线性关系较差。
其中,X轴上浓度值小于等于2mg/mL时,其浓度数值为按照参考实施例3中标准品曲线上其峰面积所对应的浓度数值;而X轴上浓度数值大于2mg/mL时,以其相对于浓度为2mg/mL的进样液的浓缩倍数来计算其浓度值。
实施例1(精密度试验)
将参考实施例1中浓度为18mg/ml的标准品溶液用蒸馏水稀释成浓度为1.155mg/ml的标准品溶液;然后按照参考实施例1中衍生化试剂配制方法②配制衍生化试剂,并按照参考实施例1中衍生化反应步骤、HPLC检测方法进行衍生化及检测。重复进样5次,计算RSD,结果见表2。
表2
从表2可见,按照参考实施例1中的衍生化试剂的配制方法②、衍生化反应步骤、HPLC检测方法进行衍生化及检测,精密度较高。
实施例2(标准品曲线绘制)
精密吸取庆大霉素C1a标准品溶液,分别稀释成不同浓度的溶液,按照 参考实施例1中的衍生化试剂的配制方法②、衍生化反应步骤、HPLC检测方法进行衍生化及检测。以结果中庆大霉素C1a峰面积为纵坐标(Y),庆大霉素C1a浓度为横坐标(X),进行线性回归,得回归方程:y=0.6669x+23.493,R2=0.9997。该结果表明,采用该方法对庆大霉素C1a进行HPLC检测,在庆大霉素C1a浓度为0.1~18mg/mL范围内呈良好的线性关系,线性回归结果如图3所示。
实施例3
将待测样品按照参考实施例1中的衍生化试剂的配制方法②、衍生化反应步骤、HPLC检测方法进行衍生化及检测,峰面积为Y轴,浓度为X轴,进行线性回归,结果见图4。
其中,X轴上浓度值小于等于14.6mg/mL时,其浓度数值为按照实施例2中标准品曲线上其峰面积所对应的浓度数值;而X轴上浓度数值大于14.6mg/mL时,以其相对于浓度为14.6mg/mL的进样液的浓缩倍数来计算其浓度值。
所得回归方程:y=0.5732x+187.06,R2=0.9994。该结果表明,采用本发明的衍生化试剂对纯度较低的样品衍生化后进行检测时,在样品浓度0.1~15mg/mL范围内仍能呈良好的线性关系(见图4)。
实施例4(精密度试验)
将参考实施例1中浓度为18mg/ml的标准品溶液用蒸馏水稀释成浓度为1.155mg/ml的标准品溶液;然后按照参考实施例1中衍生化试剂配制方法③配制衍生化试剂,并按照参考实施例1中衍生化反应步骤、HPLC检测方法进行衍生化及检测。重复进样5次,计算RSD,结果见表3。
表3
从表3可见,按照参考实施例1中的衍生化试剂的配制方法③、衍生化反应步骤、HPLC检测方法进行衍生化及检测,精密度较高。
实施例5(标准品曲线绘制)
精密吸取庆大霉素C1a标准品溶液,分别稀释成不同浓度的溶液,按照参考实施例1中的衍生化试剂的配制方法③、衍生化反应步骤、HPLC检测方法进行衍生化及检测。以结果中庆大霉素C1a峰面积为纵坐标(Y),庆大霉素C1a浓度为横坐标(X),进行线性回归,得回归方程:y=0.666x+20.017,R2=0.9998。该结果表明,采用该方法对庆大霉素C1a进行HPLC检测,在庆大霉素C1a浓度为0.1~18mg/mL范围内呈良好的线性关系,线性回归结果如图5所示。
实施例6
将待测样品按照参考实施例1中的衍生化试剂的配制方法③、衍生化反应步骤、HPLC检测方法进行衍生化及检测,峰面积为Y轴,浓度为X轴,进行线性回归,结果见图6。
其中,X轴上浓度值小于等于14.6mg/mL时,其浓度数值为按照参考实施例5中标准品曲线上其峰面积所对应的浓度数值;而X轴上浓度数值大于14.6mg/mL时,以其相对于浓度为14.6mg/mL的进样液的浓缩倍数来计算其浓度值。
所得回归方程:y=0.5779x+190.39,R2=0.9991。该结果表明,采用本发明的衍生化试剂对纯度较低的样品衍生化后进行检测时,在样品浓度0.1~15mg/mL范围内仍能呈良好的线性关系(见图6)。
实施例7(精密度试验)
将参考实施例1中浓度为18mg/ml的标准品溶液用蒸馏水稀释成浓度为1.155mg/ml的标准品溶液;然后按照参考实施例1中衍生化试剂配制方法④配制衍生化试剂,并按照参考实施例1中衍生化反应步骤、HPLC检测方法进行衍生化及检测。重复进样5次,计算RSD,结果见表4。
表4
从表4可见,按照参考实施例1中的衍生化试剂的配制方法④、衍生化反应步骤、HPLC检测方法进行衍生化及检测,精密度较高。
实施例8(标准品曲线绘制)
精密吸取庆大霉素C1a标准品溶液,分别稀释成不同浓度的溶液,按照参考实施例1中的衍生化试剂的配制方法④、衍生化反应步骤、HPLC检测方法进行衍生化及检测。以结果中庆大霉素C1a峰面积为纵坐标(Y),庆大霉素C1a浓度为横坐标(X),进行线性回归,得回归方程:y=0.6639x+28.235,R2=0.9997。该结果表明,采用该方法对庆大霉素C1a进行HPLC检测,在庆大霉素C1a浓度为0.1~18mg/mL范围内呈良好的线性关系,线性回归结果如图7所示。
实施例9
将待测样品按照参考实施例1中的衍生化试剂的配制方法④、衍生化反应步骤、HPLC检测方法进行衍生化及检测,峰面积为Y轴,浓度为X轴,进行线性回归,结果见图8。
其中,X轴上浓度值小于等于14.6mg/mL时,其浓度数值为按照参考实施例8中标准品曲线上其峰面积所对应的浓度数值;而X轴上浓度数值大于14.6mg/mL时,以其相对于浓度为14.6mg/mL的进样液的浓缩倍数来计算其浓度值。
所得回归方程:y=0.5758x+181.81,R2=0.9993。该结果表明,采用本发明的衍生化试剂对纯度较低的样品衍生化后进行检测时,在样品浓度0.1~15mg/mL范围内仍能呈良好的线性关系(见图8)。
- 还没有人留言评论。精彩留言会获得点赞!