标靶分子的检测方法及其中所用的试剂盒与流程
本发明涉及标靶分子的检测方法及其中所用的试剂盒。更具体而言,涉及基于载体上的该标靶分子与抗体的抗原抗体反应来检测标靶分子的方法。
背景技术:
:以各种疾病的早期诊断为目的,希望有用于高灵敏度地检测低浓度地存在于生物体样品中的疾病标记(生物标记)的生物传感技术。例如,在从体积1mm3的肿瘤中所含的100万个癌细胞的各个细胞向5l的血中分泌出100分子的生物标记的情况下,生物标记的血中浓度为30am左右。希望有能够检测此种非常低浓度的标靶分子的技术。非专利文献1中,记载有使用单分子的酶联免疫吸附测定(elisa)检测蛋白质的方法。该方法中,利用由蛋白特异性抗体覆盖的微细的球珠来捕捉微量的蛋白质,对球珠与蛋白质的复合体进行荧光标记。将包含该复合体的球珠利用离心力导入反应室,计数捕捉到蛋白质的球珠的个数,由此定量地测定蛋白质。专利文献1中,作为“单分子数字式计数器件”,公开有能够超高密度地形成微小的液滴的微阵列器件。通过在微小体积的液滴中进行elisa,可以将来自于标靶分子的信号二值化而进行测定(数字式elisa法)。具体而言,首先,使标靶分子、对捕捉抗体进行了表面修饰的球珠、以及检测抗体反应,在球珠表面上形成“捕捉抗体-标靶分子-检测抗体”的复合体。在标靶分子的浓度低的情况下,各个球珠会是仅结合有1个复合体、或完全没有结合复合体的某一种。然后,向微阵列器件中形成的多个微小液滴中分别各封入1个球珠。此后,计数发出来自于检测抗体的信号的液滴的个数而作为标靶分子的个数。由此,就可以将来自于标靶分子的信号二值化为0或1,高灵敏度并且高精度地进行标靶分子的检测及定量。与本发明相关,在专利文献2中,公开过如下的方法,即,在酶免疫检查法中,使用限制性酶作为与目的物质反应的抗体的标记,利用复合体的限制性酶切割具有限制性酶的切割碱基序列的dna链,分析测定该被切割了的dna链片段,由此检测目的物质。现有技术文献专利文献专利文献1:国际公开第2012/121310号专利文献2:日本特开平7-270418号公报非专利文献非专利文献1:davidmrissinetal.,naturebiotechnology:doi:10.1038/nbt.1641技术实现要素:发明所要解决的问题在如上所述地利用基于elisa的单分子数字式计数来测定标靶分子的情况下,一旦产生来自于非特异性地吸附在球珠上的检测抗体的噪音,就无法准确地将来自于标靶分子的信号二值化,定量性降低。因而,本发明的主要目的在于,提供一种技术,用于排除因检测抗体的非特异性吸附而产生的噪音,高灵敏度并且高精度地检测来自于标靶分子的信号。用于解决问题的方法为了解决上述的问题,本发明提供以下的[1]~[8]。[1]一种标靶分子的检测方法,该检测方法包括:复合体形成步骤,使标靶分子、载体和第二抗体反应,在所述载体上形成由所述第一抗体、所述标靶分子和所述第二抗体构成的复合体,其中,所述载体被修饰有与所述标靶分子特异性结合的第一抗体,所述第二抗体是与所述标靶分子特异性结合的、被标记有具有底物切割活性的酶的两个以上的抗体,且所述酶的底物特异性彼此不同;检测步骤,使底物与所述复合体反应,检测从所述荧光物质中发出的荧光,其中,所述底物是具有所述酶的切割位点的、在该切割位点的一端侧结合有荧光物质、在另一端侧结合有猝灭剂的两个以上的底物,且所述荧光物质的荧光波长彼此不同。[2]根据[1]所述的检测方法,其中,包括分析步骤,将荧光波长不同的两个以上的荧光的检测信号作为所述标靶分子的检测信号进行处理。[3]根据[1]或[2]的检测方法,其中,在所述复合体形成步骤与所述检测步骤之间,包括封入步骤,向形成于基板上的液滴中分别各封入一个所述载体。[4]根据[1]~[3]中任一项所述的检测方法,其中,所述载体为微球。[5]根据[1]~[4]中任一项所述的检测方法,其中,所述第一抗体和所述第二抗体结合于所述标靶分子的不同的表位。[6]根据[1]~[5]中任一项所述的检测方法,其为数字式elisa法。[7]一种标靶分子的检测方法,该检测方法包括:复合体形成步骤,使标靶分子、载体和第二抗体反应,在所述载体上形成由所述第一抗体、所述标靶分子和所述第二抗体构成的复合体,其中,所述载体被修饰有与所述标靶分子特异性结合的第一抗体,所述第二抗体是与所述标靶分子特异性结合、且被进行了彼此不同的标记的两个以上的抗体;检测步骤,检测来自于所述标记的信号;以及分析步骤,将来自于不同的两个以上的所述标记的所述信号作为所述标靶分子的检测信号进行处理。[8]一种酶联免疫吸附测定(elisa)试剂盒,其包含载体、第二抗体、和底物而成,所述载体被修饰有与标靶分子特异性结合的第一抗体,所述第二抗体是与所述标靶分子特异性结合的、被标记有具有底物切割活性的酶的两个以上的抗体,且所述酶的底物特异性彼此不同,所述底物是具有所述酶的切割位点的、在该切割位点的一端侧结合有荧光物质、在另一端侧结合有猝灭剂的两个以上的底物,且所述荧光物质的荧光波长彼此不同。发明效果根据本发明,可以提供一种技术,其在对标靶分子基于载体上的该标靶分子与抗体的抗原抗体反应进行检测的方法中,用于排除因检测抗体向载体上的非特异性吸附而产生的噪音,高灵敏度并且高精度地检测来自于标靶分子的信号。附图说明图1是用于说明复合体形成步骤中形成的复合体的图。图2是用于说明封入步骤中封入微小液滴中的微球的图。图3是用于说明检测步骤中的复合体与探针的反应的图。图4是用于说明复合体形成步骤中形成的复合体的图。具体实施方式以下,在参照附图的同时,对用于实施本发明的合适的方式进行说明。而且,以下说明的实施方式表示本发明的代表性的实施方式的一例,并非由此来狭义地解释本发明的范围。本发明的标靶分子的检测方法包括以下的步骤。此处,以将本发明的标靶分子的检测方法应用于基于elisa的单分子数字式计数(数字式elisa法)的实施方式为例,对各步骤进行说明。(1)复合体形成步骤,使标靶分子、载体和第二抗体反应,在所述载体上形成由所述第一抗体、所述标靶分子和所述第二抗体构成的复合体,其中,所述载体被修饰有与所述标靶分子特异性结合的第一抗体,所述第二抗体是与所述标靶分子特异性结合的、被标记有具有底物切割活性的酶的两个以上的抗体,其所述酶的底物特异性彼此不同。(2)封入步骤,向形成于基板上的液滴中分别各封入一个所述载体。(3)检测步骤,使底物与所述复合体反应,检测从所述荧光物质中发出的荧光,所述底物是具有所述酶的切割位点的、在该切割位点的一端侧结合有荧光物质、在另一端侧结合有猝灭剂的两个以上的底物,且所述荧光物质的荧光波长彼此不同。(4)分析步骤,将荧光波长不同的两个以上的荧光的检测信号作为所述标靶分子的检测信号进行处理。在本发明的检测方法中,设为检测对象的标靶分子只要是利用抗原-抗体反应与抗体结合的物质即可,特别是可以设为细菌及真菌等微生物、病毒、蛋白、核酸、糖以及它们的复合物等生物体分子。另外,设为检测对象的标靶分子并不仅限于1种,也可以同时检测2种以上的标靶分子。例如,通过使用针对蛋白a的第一抗体及第二抗体、针对蛋白b的第一抗体和第二抗体这四种抗体,可以区别蛋白a和蛋白b这两种标靶分子地同时检测。1.复合体形成步骤复合体形成步骤中,使标靶分子、修饰有与所述标靶分子特异性结合的第一抗体的载体、与所述标靶分子特异性结合且被标记有具有底物切割活性的酶的第二抗体反应,在所述载体上形成由所述第一抗体、所述标靶分子和所述第二抗体构成的复合体。作为第二抗体,可以使用被标记有底物特异性彼此不同的酶的两个以上的抗体。“具有底物切割活性的酶”只要是可以实现由底物的切割造成的荧光物质与猝灭剂的解离(详情后述)的酶,就没有特别限定。作为“具有底物切割活性的酶”,例如可以使用ec编号(酶编号、enzymecommissionnumber)中属于分类为ec2的转移酶、分类为ec3的水解酶及分类为ec4的裂解酶的酶。作为具体的酶及其底物(以及底物中的切割位点)的组合例如可以列举如下。[表1]酶底物(底物中的切割位点)酯酶酯键或由酯键衍生的键葡葡糖苷酶糖苷键或由糖苷键衍生的键磷酸酶磷酸酯键或由磷酸酯键衍生的键dnaasedna或其衍生物rnaaserna或其衍生物蛋白酶肽键或由肽键衍生的键图1中表示出复合体形成步骤中形成的复合体。本步骤中,首先,准备修饰有与标靶分子1特异性结合的第一抗体3的载体2、与标靶分子1特异性结合且被标记有酶51、52的第二抗体41、42。本发明中,所谓“抗体特异性结合”,意味着可以与抗原(此处是标靶分子1)结合、然而与其他物质不结合或结合弱。另外,所谓“结合弱”,意味着与针对抗原的结合亲和性相比,对其他物质的结合亲和性足以区分开来地低。抗体的结合亲和性(affinity)例如可以利用surfaceplasmonresonance(spr)法等公知的方法测定。第一抗体3是为了将标靶分子1捕捉到载体2上而发挥作用。第二抗体41、42是为了使捕捉到载体2上的标靶分子1能够在光学上检测出而发挥作用。第一抗体3和第二抗体41、42优选结合于标靶分子1的不同表位。换言之,第一抗体3的表位、第二抗体41的表位及第二抗体42的表位优选全都不同。以下,也将第一抗体3称作“捕捉抗体3”,将第二抗体称作“检测抗体41、42”。作为载体2,广泛使用微球。以下,也将“载体2”称作“微球2”。本发明中,“微球”被与“粒子”同义地使用,是该
技术领域:
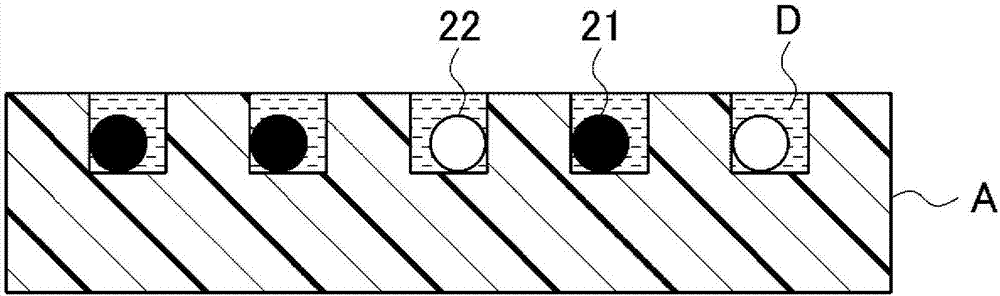
中惯用的技术术语。微球的形状没有特别限定,然而通常设为球形。微球的材料也没有特别限定,可以是玻璃、硅胶、聚苯乙烯、聚丙烯、膜及磁性体等。作为具体的材料,可以举出纤维素、纤维素衍生物、丙烯酸类树脂、玻璃、硅胶、聚苯乙烯、明胶、聚乙烯基吡咯烷酮、乙烯基与丙烯酰胺的共聚物、与二乙烯基苯等交联了的聚苯乙烯、聚丙烯酰胺、胶乳凝胶、聚苯乙烯葡聚糖、橡胶、硅、塑料、硝基纤维素、纤维素、天然海绵、硅胶、玻璃、金属塑料、纤维素、交联葡聚糖(sephadex(商标))及琼脂糖凝胶(sepharose(商标))等。球珠也可以是多孔性。球珠的平均粒径优选为5μm以下,例如可以设为1μm~4μm左右。而且,平均粒径例如可以使用电子显微镜观察或动态光散射法测定。捕捉抗体3对微球2的修饰是通过借助连接分子使捕捉抗体3与位于微球2的表面的修饰基结合而进行。例如,借助具有n-羟基琥珀酰亚胺(n―hydroxysuccinimide)等的交联剂使捕捉抗体3与位于氨基修饰球珠的表面的氨基共价结合。对检测抗体41、42加以标记的酶51、52被设为底物特异性彼此不同的酶。此处,所谓“底物特异性”,意味着在由酶催化的底物的切割中该酶不催化该底物以外的物质的切割或者催化的程度足够弱。作为“底物特异性彼此不同的酶”,例如在作为酶51使用酯酶的情况下,作为酶52,使用不以酯键作为切割位点的酶,即葡糖苷酶、磷酸酶等。另外,在作为酶与底物的组合采用限制性酶和核酸链的情况下,作为底物特异性彼此不同的酶51、52,使用识别序列(切割位点)彼此不同的酶。作为限制性酶,例如可以举出acci、alui、apai、bamhi、bglii、bsshii、bsteii、clai、ddei、drai、ecori、ecorv、haeiii、hincii、hindiii、hpai、hpaii、kpni、mlui、nari、ncoi、ndei、nhei、noti、psti、pvui、pvuii、rsai、saci、sali、scai、smai、spei、sphi、sspi、stui、xbai、xhoi等。作为酶51、52,可以将它们中的底物特异性不同的2个酶任意组合使用。以下,主要说明作为酶51、52使用限制性酶的例子,也将酶51、52称作“限制性酶51、52”。限制性酶51、52对检测抗体41、42的标记可以通过使用交联剂(crosslinker试剂)在检测抗体41、42与限制性酶51、52之间形成交联结构而进行。然后,本步骤中,使标靶分子1、修饰有捕捉抗体3的微球2、和标记有限制性酶51、52的检测抗体41、42反应。通过反应,在微球2上形成由捕捉抗体3和标靶分子1和检测抗体41、42构成的复合体(参照图1a)。标靶分子1、微球2及检测抗体41、42的反应可以是以一个阶段来进行,也可以是以两个阶段来进行。即,可以使标靶分子1、微球2及检测抗体41、42同时反应,也可以在使标靶分子1与微球2反应后,为了除去没有与捕捉抗体3结合的标靶分子1而清洗微球2,然后使微球2与检测抗体41、42反应。标靶分子1、微球2及检测抗体41、42的反应只要通过在适当的溶液中使它们接触而进行即可,可以在与以往公知的酶联免疫吸附测定相同的条件下进行。在标靶分子1的浓度低的情况下,反应后的各个微球2将会是仅具有1个分子的复合体、或者完全不具有复合体的某种。在后述的检测步骤中,使本步骤中形成的在表面具有复合体的微球2与结合有荧光物质的底物接触,检测因对检测抗体41、42加以标记的限制性酶51、52切割该底物而产生的荧光。此时,若产生检测抗体41、42向微球2上的非特异性吸附,就会从在表面具有非特异性吸附的检测抗体41、42的微球2中也产生由底物的切割造成的荧光。此处,所谓“抗体非特异性吸附”,意味着抗体吸附在包含抗原的物质中的并非抗原的部分、或吸附在不包含抗原的物质上,是指不借助抗原-抗体反应地吸附在物质上。图1b、c表示复合体形成步骤中可能产生的、检测抗体41、42向微球2上的非特异性吸附。图1b中,表示检测抗体41及检测抗体42的任意一方非特异性吸附于微球2的表面的状态。另外,图1c中,表示检测抗体41及检测抗体42双方非特异性吸附于微球2的表面的状态。复合体形成步骤中,在图1a所示的作为目的的复合体形成以外,也可能产生如图1b、c所示的检测抗体41、42的非特异性吸附。产生图1c所示的检测抗体41及检测抗体42双方的非特异性吸附的频率与产生图1b所示的任意一方抗体的非特异性吸附的频率相比足够小,对标靶分子1的检测精度基本上不造成影响。例如,若假定在微球2的1%中产生检测抗体41的非特异性吸附,同样地在微球2的1%中产生检测抗体42的非特异性吸附,则产生检测抗体41及检测抗体42双方的非特异性吸附的频率只不过为0.01%。后述的分析步骤中,通过将荧光波长不同的两个以上的荧光的检测信号作为标靶分子1的检测信号(信号)进行处理,而排除因图1b所示的非特异性吸附而产生的荧光的检测信号所引起的噪音。2.封入步骤封入步骤中,向形成于基板上的液滴中封入微球2。本步骤是将本发明的标靶分子的检测方法应用于数字式elisa法时所进行的步骤,并非本发明的检测方法的必需的步骤。本步骤中,为了在分析步骤中将来自于标靶分子1的信号用0或1二值化,向仅可以收容1个微球2的微小体积的液滴中,各封入一个微球2。微小液滴的形成及微球2向微小液滴中的封入例如可以合适地使用专利文献1公开的单分子数字式计数器件。根据该单分子数字式计数器件,可以一边在基板上超高密度地形成微小的液滴、一边同时地向液滴中封入微球2。复合体形成步骤后的微球2可以在为了除去没有与标靶分子1结合的检测抗体41、42而进行清洗后,再次悬浮于适当的溶剂中,供本步骤使用。复合体形成步骤后的微球2是形成有复合体的微球(参照图1a)与没有形成复合体的微球的混合物。此外,在没有形成复合体的微球中,包含非特异性吸附有检测抗体41、42的微球(参照图1b、c)。图2中,表示出封入微小液滴中的微球2。在形成于基板a上的液滴d中分别各封入了一个微球2。在复合体形成步骤中的反应时,在标靶分子1的浓度低的情况下,各个微球2将会是仅具有1个分子的复合体、或完全不具有复合体的某一种。图中,将在表面形成有复合体的微球用符号21表示,将没有形成复合体的微球用符号22表示。微球21是图1a中所示的状态的球珠,在微球22中包含图1b或c中所示的状态的球珠。以下,将形成有复合体的微球2表述为“微球21”,将没有形成复合体的微球2表述为“微球22”。3.检测步骤检测步骤中,使具有限制性酶51、52的识别序列且在成为切割位点的该识别序列的一端侧结合有荧光物质、在另一端侧结合有猝灭剂的底物(以下也称作“探针”)、与复合体形成步骤中形成于微球2的表面的复合体反应,检测从荧光物质发出的荧光。图3中,表示出本步骤中的探针与复合体的反应。在反应时,使用结合有不同的荧光波长的荧光物质的2个以上的探针。具体而言,图中以符号61表示的探针包含对检测抗体41加以标记的限制性酶51的切割位点71,夹隔着切割位点71在一个区域结合有荧光物质81,在另一个区域结合有猝灭剂91。另外,图中以符号62表示的探针包含对检测抗体42加以标记的限制性酶52的切割位点72,夹隔着切割位点72在一个区域结合有荧光物质82,在另一个区域结合有猝灭剂92。限制性酶51、52由于底物特异性不同,因此切割位点71、72也被设为彼此不同的碱基序列。另外,作为探针71、72的荧光物质81、82,使用荧光波长彼此不同、可以在光学上区分检测的荧光物质。此处,在作为酶与底物的组合采用限制性酶与核酸链的组合以外的情况下,例如作为酶51使用酯酶、作为酶52使用葡糖苷酶的情况下,作为探针61,使用包含对检测抗体41加以标记的酯酶的切割位点71(酯键)、且夹隔着切割位点71在一个区域结合有荧光物质81、在另一个区域结合有猝灭剂91的探针。另外,作为探针62,使用包含对检测抗体42加以标记的葡糖苷酶的切割位点72(糖苷键)、且夹隔着切割位点72在一个区域结合有荧光物质82、在另一个区域结合有猝灭剂92的探针。猝灭剂91、92在位于能够在与荧光物质81、82之间进行能量移动的一定的距离内的状态下,阻止(猝灭)荧光物质81、82的发光。作为荧光物质81、82及猝灭剂91、92,可以使用实时定量pcr等核酸的光学检测技术中通用的荧光物质和猝灭剂。作为荧光物质与猝灭剂的组合,例如可以举出选自alexafluor(注册商标)488(invitrogen公司制)、atto488(atto-tecgmbh公司制)、alexafluor(注册商标)594(invitrogen公司制)及rox(carboxy-x-rhodamine)中的荧光物质与bhq(注册商标、blackholequencher)-1或bhq(注册商标)-2的组合等。另外,可以举出荧光素与dabcyl的组合等。将通用的荧光物质与猝灭剂的组合表示于以下的表中。[表2]反应是通过使探针61、62与封入微小液滴d的微球2接触而进行。具体而言,例如将复合体形成步骤后进行了清洗的微球2再次悬浮在包含探针61、62的溶液中,由此使它们接触。另外,优选根据限制性酶51、52的种类使用合适的组成的缓冲液来进行反应,优选在封入步骤中使用此种缓冲液形成微小液滴。而且,对各种限制性酶最佳化了的缓冲液被与限制性酶组合起来在市场上销售。在向微小液滴d中封入了微球21的情况下,利用对形成复合体的检测抗体41加以标记了的限制性酶51将探针61的切割位点71切割。一旦切割位点71被切割,探针61就被切割为片段61a和片段61b,荧光物质81从猝灭剂91解离而变为能够发光的状态。同样地,一旦利用对形成复合体的检测抗体42加以标记了的限制性酶52将探针62的切割位点72切割,荧光物质82也会从猝灭剂92解离而变为能够发光的状态。荧光的检测是通过使用荧光显微镜、图像传感器等检测来自于封入了微球2的各微小液滴的荧光而进行。另外,本步骤中,优选还检测是否在各微小液滴中收容有微球2。该检测例如可以通过在显微镜下观察微球2的有无来进行,也可以通过检测由微球2造成的散射光的方法、利用借助场效应晶体管(fet)的电位计测的方法等来进行。4.分析步骤分析步骤中,将荧光波长不同的两个以上的荧光的检测信号作为标靶分子1的检测信号进行处理,将发出标靶分子1的检测信号的微小液滴d的个数作为标靶分子的个数计数。在复合体形成步骤中的反应时,在标靶分子1的浓度低的情况下,封入各个微小液滴d中的微球2会是仅具有1个分子的复合体的微球21、或完全不具有复合体的微球22的某一种,因此可以将发出标靶分子1的检测信号的微小液滴d的个数视为标靶分子1的个数。另外,可以使用封入了微球21及微球22的微小液滴d的个数、和封入了微球21的微小液滴d的个数,算出微球2的总数当中捕捉到标靶分子1的个数的比例。由此,就可以将标靶分子的浓度定量化。如上所述,若在微小液滴d中封入有微球21,就可以检测出来自于荧光物质81的荧光、和来自于与该荧光波长不同的荧光物质92的荧光。若只是如图1b所示的检测抗体41或检测抗体42非特异性吸附于微球2的表面,则只能从没有形成复合体的微球22检测出来自于荧光物质81及荧光物质92的任意一个的荧光。因而,通过将荧光物质81及荧光物质92这两方的荧光的检测信号作为标靶分子1的检测信号进行处理,就可以大幅度降低由从没有形成复合体的微球22产生的荧光的检测信号引起的噪音。由此,可以高精度地进行标靶分子1的检测信号的二值化,从而能够提高标靶分子1的定量性。而且,在如图1c所示的检测抗体41及检测抗体42双方非特异性吸附于微球2的表面的情况下,也可能产生荧光物质81及荧光物质92这两方的荧光,然而如前说明所示,由于产生检测抗体41及检测抗体42这两方的非特异性吸附的频率足够小,因此该荧光对于标靶分子1的定量性基本上不造成影响。本实施方式中所用的、微球2和检测抗体41、42(参照图1)、以及探针71、72(参照图3)可以作为用于实施本发明的标靶分子的检测方法的试剂盒恰当地实施。即,本发明在一个方面也提供一种酶联免疫吸附测定(elisa)试剂盒,其包含:(i)载体,其被修饰有与标靶分子特异性结合的第一抗体;(ii)第二抗体,其为与所述标靶分子特异性结合、被标记有具有底物切割活性的酶的两个以上的抗体,且所述酶的底物特异性彼此不同;(iii)底物,其为具有所述酶的切割位点、在该切割位点的一端侧结合有荧光物质、在另一端侧结合有猝灭剂的两个以上的底物,且所述荧光物质的荧光波长彼此不同。在该试剂盒中,微球2可以是被预先修饰有捕捉抗体3(第一抗体)的微球,也可以是在使用时借助连接分子使抗体与位于球珠的表面的修饰基结合的微球。另外,检测抗体41、42(第二抗体)可以是被预先标记有酶的抗体,也可以是在使用时使用交联剂使酶与抗体结合的抗体。另外,本发明的试剂盒也可以还包含用于捕捉抗体3对微球2的修饰或酶对检测抗体41、42的标记的交联剂等试剂、在复合体形成步骤及检测步骤中所用的各种缓冲液、在封入步骤中使用的基板a(参照图2)等。上述说明中说明了如下的实施方式,即,使用2个检测抗体、2个与之对应的探针,将荧光波长不同的2个荧光的检测信号作为标靶分子的检测信号,由此来降低来自于检测抗体的非特异性吸附的噪音。在本发明的标靶分子的检测方法中,也可以使用3组以上的检测抗体及探针,在该情况下,只要将荧光波长不同的3个以上的荧光的检测信号作为标靶分子的检测信号即可。所用的检测抗体及探针的个数越多,就越可以提高对来自于检测抗体的非特异性吸附的噪音的降低效果。另外,上述说明中说明了如下的实施方式,即,作为第二抗体,使用标记有具有底物切割活性的酶的检测抗体,利用该酶切割探针中的切割位点,由此产生荧光。本发明的标靶分子的检测方法中,也可以作为第二抗体应用标记有以往在化学发色中所用的酶的检测抗体、或标记有荧光色素的检测抗体。即,本发明还作为其第二实施方式包含包括以下的步骤的标靶分子的检测方法。(a)复合体形成步骤,使标靶分子、修饰有与所述标靶分子特异性结合的第一抗体的载体、和与所述标靶分子特异性结合且被进行了彼此不同的标记的两个以上的第二抗体反应,在所述载体上形成由所述第一抗体、所述标靶分子和所述第二抗体构成的复合体。(b)检测步骤,检测来自于所述标记的信号。(c)分析步骤,将来自于不同的两个以上的所述标记的所述信号作为所述标靶分子的检测信号进行处理。此处,在步骤(c)中,在“来自于标记的信号”中,包含从该标记直接及间接产生的信号。具体而言,在将标记有荧光色素的检测抗体作为第二抗体应用的情况下,“来自于标记的信号”是指从该荧光色素产生的荧光(参照图4b)。另外,在将标记有化学发色中所用的酶的检测抗体作为第二抗体应用的情况下,“来自于标记的信号”是指借助该酶的被催化的化学发色(参照图4a)。步骤(a)除了作为第二抗体使用碱性磷酸酶、半乳糖苷酶等在以往化学发色中所用的酶、或标记有各种荧光物质的检测抗体以外,可以与上述的实施方式(第一实施方式)的步骤(1)相同地进行。另外,在作为数字式elisa法实施本实施方式的情况下,可以包含第一实施方式中作为步骤(2)说明的封入步骤。可以利用上述的公知方法来进行酶或荧光色素对检测抗体的标记。另外,标记有酶或荧光色素的抗体也可以利用各种市售的产品。步骤(b)中,检测出在载体的表面形成了复合体的检测抗体的来自于标记的信号。图4a中,表示出在作为检测抗体41、42使用了标记有碱性磷酸酶的抗体和标记有半乳糖苷酶的抗体时形成于微球2上的“捕捉抗体3-靶物质1-第二抗体41、42”的复合体。在使用标记有酶的检测抗体的情况下,信号的检测可以利用使用了该酶的底物的发色法来进行。例如,在标记有碱性磷酸酶的检测抗体的情况下,可以通过取代第一实施方式中所用的探针而使作为碱性磷酸酶的发色底物的bcip(5-bromo-4-chloro-3-indolyl-phosphate)或nbt(4-nitrobluetetrazoliumchloride)与复合体反应来进行。另外,在标记有半乳糖苷酶的检测抗体的情况下,作为发色底物使用x-gal(5-溴-4-氯-3-吲哚基-β-d-吡喃半乳糖苷)等。作为检测抗体使用标记有彼此不同的酶的两个以上的抗体,作为发色底物根据对各抗体加以标记了的酶使用两个以上的化合物。通过利用吸光度计测来测定各发色底物的发色,就可以检测出来自于各个酶的信号。另外,在使用标记有荧光物质的检测抗体的情况下,信号的检测是通过使用荧光显微镜或图像传感器检测从荧光物质中发出的荧光来进行。图4b中,表示出在作为检测抗体41、42使用标记有fitc的抗体和标记有texasred(注册商标)的抗体时形成于微球2上的“捕捉抗体3-靶物质1-第二抗体41、42”的复合体。通过作为检测抗体使用标记有荧光波长彼此不同的荧光物质的两个以上的抗体,对每个波长范围检测来自于荧光物质的荧光,就可以检测出来自于各个荧光物质的信号。步骤(c)中,将来自于不同的两个以上的标记(上述的例子中是碱性磷酸酶和半乳糖苷酶、或者fitc和texasred)的信号作为标靶分子的检测信号进行处理。如上所述,在因检测抗体只是非特异性吸附于载体的表面而没有形成复合体的情况下,只能检测出来自于两个以上的标记中的任意一个标记的信号(参照图1)。因而,通过将来自于不同的两个以上的标记的信号作为标靶分子的检测信号进行处理,可以大幅度降低因检测抗体在载体上的非特异性吸附而引起的噪音。由此,可以提高标靶分子的检测精度,进而可以提高其定量性。符号的说明1:标靶分子,2:微球(载体),3:捕捉抗体(第一抗体),41、42:检测抗体(第二抗体),51、52:限制性酶,61、62:探针,71、72:切割位点,81、82:荧光物质,91、92:猝灭剂。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1