基于微流控芯片的通用凝血测定的制作方法
相关申请的交叉引用
本申请要求2014年9月9日提交的美国临时申请号62/048,183的权益和优先权,该申请通过引用以其全部内容结合在此。
本发明涉及一种基于微流控芯片的即时通用凝血测定装置和读取器,该装置和读取器可以用于测量正常健康患者、凝血障碍患者、抗凝血患者和抗凝血剂逆转患者的整体凝血状态。
背景技术:
凝血(coagulation或clotting)是血液从液态变成凝胶的过程。该过程可能引起止血,即从受损的血管停止失血,然后修复。凝血机制涉及到血小板的活化、粘附和聚集,伴随纤维蛋白原到纤维蛋白的转化,纤维蛋白沉积并成熟为稳健的网络。凝血障碍是可以导致出血或阻塞性凝血(血栓症)的疾病状态。
血管受伤损坏作为血管的内衬的内皮之后,凝血很快开始。将血液暴露于内皮下面的空间引发两类过程:血小板变化、以及内皮下组织因子暴露于血浆因子vii,最终引起纤维蛋白形成。血小板在伤口部位立即形成血栓;这被称为初期止血。二期止血同时发生:因子vii以外的额外的凝血因子(coagulationfactor或clottingfactor)以复杂级联产生响应从而形成纤维蛋白链,这些纤维蛋白链强化血小板血栓。
二期止血的凝血级联具有两条引起纤维蛋白形成的途径。它们是接触激活途径(又称为内源途径)、以及组织因子途径(又称为外源途径)。先前认为,凝血级联由连结到共同途径的两条同样重要的途径组成。现在已知,凝血开始的主要途径是组织因子途径。这些途径是一系列反应,其中丝氨酸蛋白酶及其糖蛋白辅因子的酶原(无活性酶前体)被激活成活性组分,这些活性组分然后催化级联中的下一个反应,最终产生交联纤维蛋白。凝血因子通常由罗马数字表示,并且附带小写字母“a”以表示活性形式。
凝血因子通常是通过使下游蛋白裂解而起作用的丝氨酸蛋白酶。存在一些例外情况。例如,fviii和fv是糖蛋白,并且因子xiii是转谷氨酰胺酶。凝血因子作为无活性酶原循环。凝血级联经典地被分为三条途径。组织因子途径和接触激活途径两者都激活因子x、凝血酶和纤维蛋白的“最终共同途径”。
组织因子途径(外源)
组织因子途径的主要作用是产生“凝血酶爆发”,这是一种过程,通过该过程,凝血级联在其反馈激活作用方面最重要的组成部分—凝血酶非常迅速地释放。fviia以比任何其他激活的凝血因子更大的量循环。该过程包括以下步骤:
在血管损坏之后,fvii离开循环并与在组织因子携带细胞(基质成纤维细胞和白细胞)上表达的组织因子(tf)接触,从而形成活化复合物(tf-fviia)。
tf-fviia激活fix和fx。
fvii本身由凝血酶、fxia、fxii和fxa激活。
fx通过tf-fviia的激活(形成fxa)几乎立即被组织因子途径抑制剂(tfpi)抑制。
fxa及其辅助因子fva形成凝血酶原酶复合物,该复合物将凝血酶原激活成凝血酶。
凝血酶然后激活凝血级联的其他组分,包括fv和fviii(其激活fxi,fxi进而激活fix),并且激活和释放fviii不与vwf结合。
fviiia是fixa的辅助因子,并且一起形成激活fx的“tenase”复合物;并且因此循环继续进行。(“tenase”是“十(ten)”和后缀“-ase”(用于酶)的缩写。)
接触激活途径(内源)
接触激活途径开始于以由高分子量激肽原(hmwk)、前激肽释放酶和fxii(哈格曼因子)形成胶原蛋白上的主要复合物。前激肽释放酶被转化为激肽释放酶,并且fxii变成fxiia。fxiia将fxi转化成fxia。因子xia激活fix,fix与其辅助因子fviiia形成tenase复合物,该复合物将fx激活成fxa。接触激活途径在起始凝块形成中的次要作用可以通过患有fxii、hmwk和前激肽释放酶的严重缺陷的患者没有出血障碍这一事实来说明。相反,接触激活系统看上去更多地参与炎症。
凝血测定
若干种技术被用于凝血测试,包括基于凝块的测试、显色测定或颜色测定、直接化学测量和elisa。在这些技术中,最常使用基于凝块的测定和显色测定。而凝血测定提供凝血功能的整体评定,显色测试被设计用于测量特异性定因子的水平或功能。
基于凝块的测定常用于评估疑似患有出血异常的患者并用于监测抗凝治疗。这些测试中大多数使用枸橼酸化钠血浆(citratedplasma),该血浆的制备需要数十分钟,并且在医院环境中通常需要几个小时到几天才能收到结果。大多数凝血测定的终点是纤维蛋白凝块形成。
凝血酶原时间(pt)通过将含有组织因子(其可以是起源于重组体或来源于脑、肺或胎盘的提取物)和钙的凝血活酶试剂添加到血浆中并测量凝血时间来进行。pt根据试剂和凝血计而不同,但通常范围在10秒与14秒之间。pt根据因子vii、x和v、凝血酶原或纤维蛋白原以及针对这些因子的抗体不足而延长。本测试在患有纤维蛋白原向纤维蛋白反应抑制剂(包括高剂量的肝素和纤维蛋白降解产物的存在)的患者中也是异常的。通常,pt试剂含有过量的磷脂,使得与阴离子磷脂反应的非特异性抑制剂(即,狼疮抗凝剂)不延长凝血时间。pt最常用于监测华法林治疗。pt测量在多个装置或中心之间是不可比较的,并且大多数华法林诊所形成其自己的正常患者范围,这是不可转换的,并且对所用特定测定中存在的确切试剂具有高度特异性。
通过首先将表面活性剂(例如,高岭土、硅藻土,鞣花酸或二氧化硅)和稀释后的磷脂(例如,脑磷脂)添加到枸橼酸化血浆中来进行活化部分凝血活酶时间(aptt)测定。也可以通过使用类似的化学活化剂在全血中即时测量aptt。因为组织因子不存在,所以将本测定中的磷脂称为部分凝血活酶。在孵育以允许最佳地激活接触因子(因子xii、因子xi、前激肽释放酶和高分子量激肽原)之后,添加钙,并测量凝血时间。aptt测量在多个装置或医院之间是不可比较的,并且大多数临床实验室形成其自己的正常患者范围,这是不可转换的,并且对所用特定测定中存在的确切试剂具有高度特异性。
尽管凝血时间根据所用的试剂和凝血计而不同,但aptt通常范围在22秒至40秒之间。aptt可能根据接触因子、因子ix、viii、x或v、凝血酶原、或纤维蛋白原不足而延长。特异性因子抑制剂、以及非特异性抑制剂也可延长aptt。纤维蛋白降解产物和抗凝剂(例如,肝素、直接凝血酶抑制剂或华法林)也延长aptt,尽管aptt对于华法林的敏感性要低于pt。
通过向血浆中添加过量凝血酶来进行凝血酶凝血时间(tct)测量。在低纤维蛋白原水平或血纤维蛋白原异常的患者和纤维蛋白降解产物水平升高的患者中,tct延长。这些异常常见于弥散性血管内凝血。肝素和直接凝血酶抑制剂也延长tct。
活化凝血时间(act)是用于监测大剂量肝素治疗或用比伐卢定治疗的即时全血凝血测试。在这些设置中所需的肝素或比伐卢定的剂量超出了可用aptt测量的范围。通常,将全血收集到含有凝血活化剂(例如,硅藻土、高岭土或玻璃颗粒)和磁力搅拌棒的管或筒中,并且然后测量血液凝结所花费的时间。act的参考值范围在70秒与180秒之间。抗凝血的期望范围取决于适应症和使用的测试方法。act与其他凝血测试无关联。
对于蛇静脉酶(ecarin)凝血时间(ect),使用来自鳞蝰蛇的毒液将凝血酶原转化为间体凝血酶(meizothrombin),这是一种对直接凝血酶抑制剂的抑制敏感的凝血酶原中间体。ect不能用于检测紊乱的凝血状态,而仅对治疗药物监测有用。这种测定对肝素不敏感,因为位阻阻止肝素-抗凝血酶复合物抑制间体凝血酶。因为ecarin也激活华法林治疗患者的血浆中发现的非羧化凝血酶原,所以甚至可以通过伴随的华法林治疗来测定直接凝血酶抑制剂的水平。尽管ect已被用于临床前研究,但测试尚未标准化,并不广泛可用。
抗因子xa测定用于测量肝素和低分子量肝素(lmwh)的水平。这些是使用其上连接有发色团的因子xa底物进行的显色测定。因子xa使显色底物裂解,从而释放可以用分光光度计检测的有色化合物,并与存在的因子xa量成正比。当将已知量的因子xa添加到含有肝素(或lmwh)的血浆中时,肝素通过抗凝血酶增强因子xa抑制,使得较少因子xa可用于使底物裂解。通过将此结果与用已知量的肝素产生的标准曲线相关联,我们可以计算血浆中的肝素浓度。使用抗xa测定需要了解患者正在服用哪种抗凝剂以便使用适当的校准器,并且不能用于监测抗-iia抗凝治疗。
临床应用中的抗凝药物包括华法林、肝素(普通肝素和lmwh)和直接凝血酶抑制剂(比伐卢定、水蛭素和阿加曲班)。
华法林对静脉血栓栓塞的一级和二级预防有效;对预防具有心房纤维性颤动或人工心脏瓣膜的患者的心因性栓塞事件有效;对预防具有急性心肌梗塞的患者的中风、复发性梗塞或心血管死亡有效;并且对高危人群的急性心肌梗塞的一级预防有效。因为对华法林的抗凝血反应的可变性,该可变性反映了代谢遗传变异以及环境因素(诸如药物、饮食和伴随疾病),所以需要进行定期凝血监测和剂量调整,以将国际标准化比率(inr)维持在治疗范围内。肝素是激活抗凝血酶并促进其使凝血酶和因子xa失去活性的能力的间接抗凝血剂。为了催化凝血酶的抑制作用,肝素通过高亲和力五糖序列与抗凝血酶结合并且与凝血酶结合。相反,为了促进因子xa的抑制作用,肝素只需要通过其五糖序列与抗凝血酶结合。含有少于18个糖单位的肝素分子太短,而不能与凝血酶和抗凝血酶结合,并且因此不能催化凝血酶的抑制作用。然而,这些较短的肝素片段可以催化因子xa的抑制作用,条件是它们含有五糖序列。因为与内皮细胞、单核细胞和血浆蛋白可变的非特异性结合,所以对肝素的抗凝反应是不可预测的。因为这种可变的抗凝反应,所以当以大于预防剂量给予肝素时,常规进行凝血监测。aptt是最常用于监测肝素的测试。不幸的是,aptt试剂对肝素的反应性不同,并且aptt治疗范围根据试剂和用于测试的凝血计的灵敏度而不同。已证明了aptt比pt更难标准化,并且通常引用的、为对照值的1.5至2.5倍的治疗范围经常导致系统性给予亚治疗肝素剂量。支持aptt治疗范围预测功效和安全性(相对于出血)的概念的证据在某种程度上微不足道。大约25%的患者需要大于35000u/d的肝素剂量以获得治疗性aptt,并且被称为对肝素有抗性。这些患者中大多数在用抗xa测定测量时具有治疗性肝素水平,并且2次测试之间的差异是由于高浓度促凝剂(诸如纤维蛋白原和因子viii)引起的,这缩短了aptt。尽管aptt反应与治疗范围内的肝素水平线性相关,但aptt在肝素剂量较高时变得不能测量。因此,将对整体抗凝的敏感度较低的测试(诸如act)用于监测接受经皮冠状动脉介入治疗或主动脉冠状动脉分流手术的患者的抗凝水平。
lmwh通过化学或酶促解聚作用源自普通肝素。lmwh已逐渐取代肝素用于大多数适应症。lmwh通常当用于预防目的而给予时以固定剂量给药,或者当用于治疗给予时,以体重调整剂量给药。通过抗因子xa水平监测lmwh的缺陷包括可商购的抗-xa显色测定之间的差的可比性、各种lmwh制剂中抗-xa与抗iia的比率差异以及血液取样定时相对于剂量给药的重要性。尽管使用高剂量的lmwh可能延长aptt,但这种测定不用于监测。迄今尚无临床可用的即时测定可用于监测数百万被给予lmwh的患者。
直接凝血酶抑制剂直接与凝血酶结合并阻断凝血酶与其底物的相互作用。三种肠胃外直接凝血酶抑制剂在北美已被许可用于有限的适应症。水蛭素和阿加曲班被批准用于治疗患有肝素诱发的血小板减少症的患者,而比伐卢定在接受经皮冠状动脉介入治疗(pci)的患者中被许可作为肝素的替代品。水蛭素和阿加曲班需要常规监测。tct对于用于此目的的少量水蛭素和阿加曲班太敏感。尽管act已用于监测介入性设置中所需的较高剂量的直接凝血酶抑制剂,但它在高浓度下不能提供最佳的线性反应。推荐aptt用于治疗监测;然而,每种直接凝血酶抑制剂具有其自己的剂量反应,并且测试对药物水平的灵敏度在aptt试剂之间不同。当用aptt监测水蛭素治疗时,调整剂量以维持aptt为对照的1.5倍至2.5倍,而对于阿加曲班,目标aptt为对照的1.5倍至3倍(但不超过100秒)。在需要较高剂量的直接凝血酶抑制剂的患者中,在心肺转流手术中,aptt似乎不那么有用,因为这种测试在增加药物浓度时变得反应性降低。ect似乎对低浓度和高浓度直接凝血酶抑制剂都有用,并且比aptt更少受到干扰物质的影响。然而,如上所述,它不是常规可用的。inr对不同药物浓度的反应性根据测定试剂和直接凝血酶抑制剂的类型而不同。这一特征使肝素诱发的血小板减少症患者从阿加曲班转变为维生素k拮抗剂变得复杂。
从上述内容可以看出,凝血和凝血抑制是一个复杂的过程。如果使用错误的凝血测定确定,则抗凝血剂的类型会产生误导和危险的结果。当抗凝血患者到达急诊室,没有关于他所用药物以及正在治疗的病症的信息时,这将产生潜在的灾难性情况。有时不可能等待进一步诊断以确定引起长时间出血的抗凝血剂或障碍。凝血、尤其是即时(“poc”)测试对快速、准确和通用测试的需要是众所周知的;然而,选项极其有限。
因此,本发明的目的是提供一种快速、准确和通用的凝血测试。
本发明的另外一个目的是提供即时凝血测试。
本发明的又另外一个目的是提供准确、可再现、易于操作、并且需要非常少量的样品的测试。
技术实现要素:
已经开发了一种用于测量分析物(特别是全血或全血衍生物)的物理特性的基于微流控芯片的测定装置。这些技术能够特别应用于测量全血或血液衍生物的凝血时间、确定抗凝药物对凝血(clotting或coagulation)动力学的影响、以及评估抗凝血剂逆转剂的效果。此外,这些技术能够用于优化抗凝药物和/或其逆转剂的剂量。该测定独立于抗凝血剂的存在,因为通过将该装置中的血液样品暴露于玻璃(或其他带负电的材料,诸如氧化硅)表面下来激活凝血,这激活内源途径,并且可以通过在活化材料表面上施加剪切流而进一步加速。没有化学活化剂并且高度受控且可重现的微环境产生即时通用凝血测定。
样品在微流控系统中进行处理。引入测试室的样品的体积在纳升、微升或毫升范围(最优选地1-10微升)内。将样品直接从血液样本或个体(诸如从手指针刺)引到入收集孔中。在一个实施例中,在通过注射器收集到无添加剂红顶管(red-toppedtube)或毛细管中之后,将样品(诸如血液或血浆)收集并转移到加热的微型装置中。通过血液或血浆暴露于装置内的玻璃表面下和样品暴露于用于分析凝血的装置下来开始进行样品的凝血,优选地一式两份。然后通过毛细管作用或使用泵将血液样品从收集孔抽吸到测试室中,该泵引起转向并且将血液样品暴露于活化材料表面下,同时将几何控制量的血液样品递送到测试室中。微流控系统与集成电极、加热器结构或传感器或致动器的其他部分被设计为一次性的。将微流控系统插入分析型可重复使用的壳体(在此称为“读取器”)中,该壳体是分析仪器的一部分,其连接微流控系统并提供用于测量凝血并将测量时间和特征传输至外部读取器、监视器或记录器的流体接口、电气接口、光接口和热接口。
通过粘度、光透射、电阻抗和/或压力的变化评估凝血。在优选实施例中,通过测量通过集成电极的血液阻抗和/或通过分别使用红外(ir)led和光电二极管测量光透射来检测凝血。集成的热电阻加热器/冷却器结构,诸如固态热泵或珀耳帖冷却器,将血液样品保持在限定的温度,最优选地约37℃(体温),并确保测量的可重复性和可比性。随着纤维蛋白原转化为纤维蛋白,ir吸收度增加,直到其以可测量的方式达到峰值。全血凝血时间的测定是在或大约在ir吸收度峰值下进行的。在完成测量之后,将包含血液样品的微流控芯片从读取器中取出并丢弃。
可以通过测量电阻抗来监测凝血的发展。纤维蛋白的形成增大电阻抗,直到其以可测量的方式达到峰值。在电阻抗峰值或约为峰值时,测定全血凝血时间。可以通过单独或同时测量的ir吸收度和电阻抗来测量全血凝血时间,作为比较的基础。电阻抗和ir吸收度曲线基本上一致,并通过独立的测量模式提供确认。
通过应用微技术制造并且加工和键合由硅、玻璃或其他合适材料制成的晶圆来制造微流控系统。还可以通过替代手段、例如通过应用软光刻技术或通过产生可以单独使用的读取器部分(例如由塑料或不同的合适的、基本上不透ir的材料制成)、或与微图案化芯片组合形成微流控系统来制造微流控系统。微流控系统通常由进入端口、出口和一个或多个通过通道连接的室组成,这些通道的长度范围从几十微米到几十毫米,并且高度和深度在几十微米到几百微米范围内。
附图说明
图1是凝血级联的示意图。
图2a是其中将血液吸移到一个室中并且然后将芯片插入封装中的微流控装置的一个实施例的横截面视图。
图2b是可以通过室侧引入血液的微流控装置的实施例的横截面视图;“吸取器”伸出读取器,类似于血糖测量。
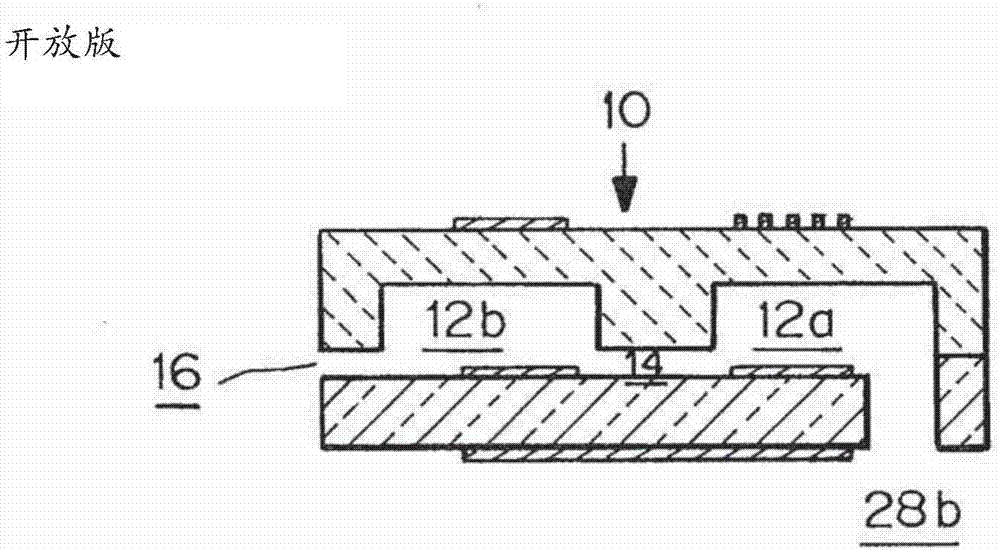
图3a是两个样品室装置的开放版的视图。
图3b是两个样品室装置的封闭后的视图。
图4a-4h是室的视图,示出了室、连接通道、电接触焊盘和热敏电阻。
图5是从封闭版读取器的底部的顶部观看的透视图。
图6是封闭版读取器的底部侧面的截面视图。
图7是封闭版读取器的顶部的透视截面图,示出了已就位的样品测定装置。
图8是从封闭版读取器的顶部的顶部观看的透视图。
图9a是从开放版读取器的底部的顶部观看的透视截面图。
图9b是从开放版读取器的底部部分的侧面观看的透视截面图。
图10a是从开放版读取器的顶部的侧面和底部观看的透视截面图。
图10b是从开放版读取器的顶部的侧面和顶部观看的透视截面图。
图11是系统的示意图,示出了包含单次使用的一次性测定室、读取器以及到计算机处理器和监视器的连接的箱子。
图12a-12f分别是无抗凝血剂的对照、每毫升血液300ng依杜沙班(edoxaban)抗凝血剂、和每毫升血液300ng依杜沙班与ciraparantag(per977;一种抗凝血剂逆转剂)的随时间推移(以分钟为单位)的阻抗(图12a、12c、12e)与红外透射(图12b、12d、12f)的曲线图。
具体实施方式
i.定义
微流控
微流控是一种从工程学、物理学、化学、生物化学、微米/纳米技术和生物技术中得到的高度跨学科的领域。范围从毫微微升到毫升的小体积液体通常在微流控系统中处理。用于制造微流控系统的方法通常允许传感器和/或致动器的集成,使得可以在微流控系统内有效地输送、操纵和分析液体。微流控系统与其环境之间的接口使得能够实现用于输送、操纵和分析的外部机构。
微米/纳米技术
微米/纳米技术通常用于制造微系统,包括微流控系统。微米/纳米技术通常能够产生尺寸在微米或纳米范围内的结构。这些技术可以基于最初开发用于集成电子电路的制造的硅晶圆加工技术。
毛细管作用
将液体样品装载到微流控系统中的便捷方式是通过毛细管作用。样品收集端口用样品润湿,并且通过毛细管力将样品有效地吸入微流控系统的狭窄的亲水通道和室。
抗凝血剂
抗凝血剂是一种干扰血液凝固能力的物质。作为治疗药物给药,抗凝血剂可以例如帮助减少或预防潜在的危及健康和/或生命的栓塞或血栓症的发生。
抗凝血剂逆转剂
抗凝血剂逆转剂可以作为治疗药物来给药,以便部分地或全部逆转抗凝血剂的效果。恢复血液凝固的能力可以是挽救生命的,例如,服用抗凝血剂并且正在经历严重伤害的患者可以用用于恢复血液凝固能力和防止过度失血的逆转试剂来治疗。
“开放”和“封闭”装置
“开放”装置具有从内室到外部的通道,允许血液直接进入室中。“封闭”装置没有外部通道,并且在与外部密封(与传感器、电极、led、和在室内评定凝血时利用的其他元件相关联的小孔除外)之前被填充。微流控系统的“开放版”被设计成使得芯片可以首先插入其封装中,被加热,但仍然可以是可进入的(开放)。样品可以通过润湿侧端口被装载到系统中,其中芯片已经搁置在其封装中。将通过毛细管力将样品吸入芯片中。
微流控系统的“封闭版”在其被放入其封装之后将是无法进入的。在将芯片通过背面侧端口的润湿或移液到其中来放入其封装中之前,必须将样品装载到系统中。
ii.装置
微流控芯片及其读取器的实施例在图2-10中示出,其中该系统包括图11反映的两个部分。如图2a和图2b所指示的,通过如下制造微流控芯片10:硅晶圆的各向异性湿法蚀刻和后续热氧化、
可以通过替代手段,使用任何适合于产生微流控结构的方法和任何适合于激活血液凝固级联的带负电荷的材料来制造微流控芯片。
可以修改室12a和12b以及连接这些室的通道14的截面尺寸和几何形状,并且可以改变室的数量。表面与体积的比率将总体影响凝固时间。在室装置密封之前,或通过允许从微室的外部进入的侧通道16,直接进入这些室(“封闭”,图2b)。
如图3a和图3b所示,芯片被设计成使得能够:
-通过背面电阻或电加热器结构进行加热(在室12a和12b的下侧)
-通过顶侧(外部)热敏电阻器18进行用于加热控制的温度测量
-通过气压测量进行凝血检测
-通过经嵌入电极20a和接触垫20b测量整个血液样本的阻抗进行凝血检测
-通过光学测量进行凝血检测
如图4a-4h所示,将电阻结构22沉积到硅晶圆24的背面(以形成电阻加热结构32,图4g、图4h),沉积到硅晶圆的正面26上(以分别在每个室的底板处形成用于阻抗测量的电极20a、20b和热敏电阻器18),并且沉积到
图2b、图3b中的装置(称为‘封闭装置’)具有通过硅部分30蚀刻的两个进入端口28a,28b。在将装置10插入密封封装之前,可以将样品吸移到端口28a、28b之一中。图2a、图3b中的装置具有通过硅部分蚀刻的一个进入端口28b和一个旁侧进入端口16,其实现为蚀刻到
组合式加热器/冷却器控制系统和热敏电阻器可以在‘芯片’的外部,并且可以集成到读取器结构中。如果放置芯片的空腔的壁比芯片质量明显更大,导热性高,并且形成几乎完全的环绕,则该空腔近似于‘黑体’,并且芯片必须与空腔达到热平衡。如果芯片与空腔接触或间隔紧密,则平衡时间常数可以非常短。这可以在发展过程中通过高温计测量来确立。这应降低系统的一次性部分的复杂性并且(有望)降低成本。
如图5-10所示的芯片封装或“读取器”为芯片提供电气、光学和流体接口。读取器由通过高精度3d打印、成型、机加工或其他制造工艺制造的底部(图5、图6、图9a、图9b)和顶部(图7、图8、图10a、图10b)部分组成。两个部分通过锁定配合到孔56中的金属定位销而连结并相互压靠。读取器可以包括用于显示、存储信息和通信能力的装置。
图5和图6示出了从两个不同角度看时的封闭装置芯片的底部读取器部分50。位于读取器内的凹陷54中的通道52a、52b将室2和1分别连接到芯片进入端口。在读取器的一侧,电磁阀(未示出)可以在通道端58处附接到读取器,以控制读取器通道与拧入读取器底部的带倒钩的管接头之间的连接。在相反侧,压力传感器(未示出)可以在孔60处附接到读取器上,以监测施加到读取器通道和芯片进入端口的压力。每个进入端口62a、62b由固定在孔70a、70b、70c和70d处的其自己的电磁阀/压力传感器来控制/监测。底部读取器部分展现了用于微流体芯片的凹陷54。小的竖直孔64a、64b固持弹簧销以在芯片底部接触加热器结构。在阅读器部分的中心处的孔66将irled芯片固持在金属壳读取器中,该读取器沿光路68延伸。
ir部件可以成型或集成为“chipstrate”形式。
尽管显示为单点光学测量,但可以使用多点光学测量。
图7和图8示出了从两个不同角度看时的封闭装置芯片的顶部读取器部分80。中心处的大(例如5mm)孔82将ir光电二极管芯片(未示出)固持在通过孔86引导光的金属壳读取器中。三个小(例如,小于一毫米)的竖直孔84固持三个弹簧销(未示出)以接触三个用于阻抗测量的电极(两腔室一个共用接地电极和每个室中一个对电极),使得阻抗测量可以在两个室里进行。另外两个竖直孔88固持弹簧销以接触芯片顶部的热敏电阻器。这些装置的其他实施例是已知的并且容易可供用于相同的功能。irled和光电二极管被放置成使得它们询问一个室的1mm直径的中心区域。
芯片读取器本身附接到项目箱100的盖子上,该项目箱包含执行自动化测量所需的电子电路、阀门和泵,如图11所示。将项目箱100连接到pc102,其中测量由labview程序和处理器110控制,并且结果显示在监视器104上。
图9a和图9b示出了从两个不同角度看时的开放装置芯片的底部读取器部分120。定位销孔122用于固定装置。读取器内的通道124将室2和1分别连接到芯片进入端口。在读取器的一侧,电磁阀(未示出)可以在通道端处附接到读取器,以控制读取器通道与拧入读取器底部的带倒钩的管接头之间的连接。在相反侧,压力传感器(未示出)可以在孔126a、126b处附接到读取器上,以监测施加到读取器通道和芯片进入端口的压力。每个进入端口由固定在孔处的其自己的电磁阀/压力传感器来控制/监测。底部读取器部分展现了用于微流体芯片的凹陷128。在阅读器部分的中心处的孔130将irled芯片固持在金属壳读取器中。
图10a和图10b示出了从两个不同角度看时开放装置芯片的顶部读取器部分140。中心处的大(例如5mm)孔142将ir光电二极管芯片(未示出)固持在通过孔144引导光的金属壳读取器中。三个小(例如,小于一毫米)的竖直孔146固持三个弹簧销(未示出)以接触三个用于阻抗测量的电极(两腔室一个共用接地电极和每个室中一个对电极),使得阻抗测量可以在两个室里进行。另外两个竖直孔148固持弹簧销以接触芯片顶部的热敏电阻器。irled和光电二极管被放置成使得它们询问一个室的1mm直径的中心区域。
尽管关于使用一条光束对两个室询问进行了描述,但可以使用单独的光束来询问两个室。仅用于说明目的,示出一条光束。
如图11所示,芯片读取器如上所述使用螺孔150附接到项目箱的盖板。
a.用于激活血液凝固的表面
微流控系统被制造成使得引入的血液或血浆样品与玻璃表面、微流控芯片的顶部部分和/或微流控芯片的底部部分的表面(由诸如
微流控系统被制造成使得引入的血液或血浆样品与玻璃表面(或其他带负电荷的表面)接触,该玻璃表面用于在不使用额外的化学或生物试剂的情况下激活凝血级联。通过使用分别用于制造微流控系统的玻璃晶圆和氧化硅晶圆来生成玻璃表面。可替代地,可以通过使用集成在形成微流控系统的读取器部分中的玻璃芯片,通过将玻璃沉积到微流控系统的内表面上(例如,通过使用旋涂玻璃产品)或通过将微小物体与微流控系统内的玻璃表面(例如,玻璃微珠)集成来实现玻璃表面。此外,可以通过硅表面的氧化来引入玻璃表面。
b.沉积的金属薄膜的电气特征
沉积的金属薄膜可以由铬粘附层(大约20nm厚)和金顶层(对于用于阻抗测量的内部电极大约为50nm厚,对于热敏电阻器大约为100nm厚,对于加热器结构大约为150nm厚)形成。使用塑料读取器中的弹簧加载式弹簧销实现与微流控控芯片上的所有薄膜电极的电接触。连接到金属膜测试结构的任一端的两个销(其中长度大约2mm并且宽度大约1mm)之间的典型电阻在销接触加热器结构的金属膜时为1.8欧姆,接触热敏电阻器的金属膜时为2.7欧姆,接触用于阻抗测量的内部电极的金属膜时为22欧姆。内部电极销之间的显着更高的电阻可能是由于较薄的金层和在大约300℃的阳极键合过程中可能的接触退化引起的。阳极键合之后,沉积加热器结构和热敏电阻器。
为了测量沉积的金属薄膜的电阻温度系数,使用展现电阻器/热敏电阻器结构的芯片代替用于阻抗测量的开路电极。将芯片插入其读取器中并在炉内加热。在不同温度下测量加热器、热敏电阻器和内部电极电阻器的电阻,并计算电阻温度系数α:
-加热器薄膜:α=0.0016k-1
-热敏电阻器薄膜:α=0.00115k-1
-内部电极薄膜:α=0.000108k-1。
c.用于样品定位的内部电极
除了阻抗测量以外,集成电极也可以用于检测微流控系统中分析物(诸如纤维蛋白)的存在与否和/或跟踪例如由于外部施加的气压脉冲引起的分析物移动。一旦将分析物添加到微流控系统中,就可以使用这样的检测和跟踪来开始分析程序,以将分析物定位在微流控系统内的具体位置,并且分别在限定位置之间来反复地来回地移动该分析物。
尽管关于两个室和两个电极进行了举例说明,但可以使用多个电极来确认多个室的填充(在凝血测量部位或在测量凝血的室之前的一个点,诸如更接近进口处)。
可以施加全血或血浆沿玻璃表面的反复移动,以增加血液的活化,加速血液凝固和/或减少测量时间。
d.过滤器结构的集成
机械过滤器结构可以集成到微流体芯片中,使得只有血浆到达分析室。过滤器可以实现为微柱阵列或者实现为被蚀刻到硅或玻璃中的微通道。以此方式,可以就地生产血浆(不使用抗凝血剂,诸如枸橼酸钠或edta),并以与全血相同的方式非常快速地测试,在分析中没有红细胞干扰。微柱阵列可以按偏移图案安排以抑制红细胞转运,同时将“堵塞”可用通道截面的过多部分的概率降到最低。
e.凝血检测手段
可以应用各种方式来确定血液凝固时间。
粘度
血液的粘度可以用作为表征凝血时间的测度。可以应用两个一般原则来产生粘度的直接或间接测度。可以通过具有已知几何形状的通道移动样品。可以通过以光学方式或通过成像或多光束“检查点”或由多电极阻抗传感器以电方式跟踪通过“长”通道的穿透速率来测量粘度。可以间接地测量粘度,例如通过测量样品在具体时间间隔期间在通道内行进的距离、在具体时间间隔期间被移位的样品体积或在具体时间间隔期间驱动力的变化(例如,如果样品被加压体积的捕获空气移动、气压的变化可以用作为样品体积位移的间接测度)。可替代地,物体可以通过血液样品移动,例如通过静电力或磁力被驱动。跟踪物体移动可以产生样品粘度的间接测度。
分析物的粘度可以通过微流控系统内的分析物通过加压的截留空气体积的移动来检测。空气可以例如通过连接到微流控系统的电动气泵进行加压。通过关闭连接到微流控系统的电磁阀,可以截留加压空气。在芯片的一个进入端口处的截留空气的压力降低指示分析物移动。了解微流控系统的几何形状和施加的压力的大小允许计算分析物粘度和检测粘度变化(例如,由于在血液情况下凝血而引起的粘度增大)。
经粘度监测进行的凝块检测涉及到测量连接到读取器上的流体端口的片上进口和出口上的压差(使用o形环密封件形成空气/流体密封)。
分析物的粘度可以通过微流控系统内的分析物通过加压的截留空气体积的移动来检测。空气可以例如通过连接到微流控系统的电动气泵进行加压。通过关闭连接到微流控系统的电磁阀,可以截留加压空气。在芯片的一个进入端口处的截留空气的压力降低指示分析物移动。了解微流控系统的几何形状和施加的压力的大小允许计算分析物粘度和检测粘度变化(例如,由于在血液情况下凝血而引起的粘度增大)。
阻抗
样品的凝固可能与其电阻抗或在施加电流或电压时复电阻有关。电阻抗由样品的欧姆电阻以及电容分量产生。例如,电阻抗可以例如通过直接集成在微流控芯片中或集成在读取器中的电极来测量,该读取器与其他部分一起形成微流控系统。电极可以部分地与样品直接接触或者仅通过薄的绝缘体(厚度范围从纳米到数百微米)与样品分离。
电极和导线可以形成为沉积到形成微流控系统的衬底上的图案化金属薄膜。电极和导线还可以通过插入并夹在读取器部分之间的图案化金属片或膜的集成来实现。如果使用半导体晶圆来制造微流控芯片,则半导体材料本身可以包含通过扩散法、注入法、蚀刻法、微加工或类似于集成电路或其他微装置生产中使用的技术的适当技术的任何组合制造的集成电极。集成电极可以用于直接测量分析物的电气特性(例如,电阻、电容、阻抗)。也可以使用合适的电子电路将分析物变化(和电气特性的相关变化)转化为可测量的电压、电流、频率或其他合适的参数。也可以在构建期间通过3d打印插入多个部分,或直接集成多个部分。例如,电阻器加热元件将由半导体衬底中的掺杂通道(例如,通过离子束注入)制造。
经阻抗监测进行的凝块检测通过将芯片插入读取器中来完成,从而在读取器中的金垫(连接到芯片上电极)和弹簧销之间形成接触,例如通过lcr仪表、或任何其他适当的测量系统从该读取器中读取电信号。
为了通过测量阻抗来检测凝血,将样品装载到芯片中,将芯片插入其读取器中,并且经由开尔文线夹将连接到内部阻抗电极的弹簧销连接到quadtech1920lcr仪表。以15秒的间隔记录血液样品的复阻抗的大小和相位。在100hz、1khz、10khz和100khz处的测量示出了大小或相位或两者的特征峰或平台期。峰或平台期表示凝血时间的测度。
参照图3a-3b,对于阻抗测量,外部lcr仪表在室12a的每一侧的两个电极20b、20a之间施加交流电压(20mvrms),并测量电极之间的电流。然后计算阻抗的大小和相位并计算凝血。
光学特性
样品的光学特性可能与凝血事件有关。可以使用波长在500nm至10,000nm(优选地1,300nm)范围内的光来通过微流控与芯片读取器照亮样品。以下参数可以用于跟踪凝血:透射光、反射光和散射光。如果使用相干光源,则可以使用偏振作为附加参数。
通过将芯片插入读取器中并测量横穿芯片的厚度(通过玻璃、流体填充室和下面的硅)的红外透射来进行经ir透射的凝块检测。这是通过在芯片和正下方对齐的光电二极管检测器上方放置ir源(led)来完成的。
对于光凝块检测,如上所述,将irled和光电二极管插入其读取器部分中。将血液样品吸移到芯片中,并且将芯片放入读取器中。在1,300nm的ir光下持续照亮样品。以通常100ms的时间间隔记录由光电二极管的光电流引起的1m欧姆电阻器上的电压降。通常测得电压为几伏。样品的凝固引起透射光和光电流随时间推移而变化。透射光曲线的特征峰指示凝血时间的测度。
连续照明测量作为一个简单的说明来呈现。可以使用更复杂的测量技术。例如,如果在1khz的重复率下照亮ir发射器持续50%持续时间,并且使用同步检测器来处理光电检测器输出,接着是1秒积分周期,则以上实例中的信噪比可以提高多达三十倍。此外,有源信号处理将允许处理小得多的信号,从而准许光电检测器的相对较低的阻抗终止,降低本征噪声和抵消漂移。环境电噪声敏感度将大大降低。
声学特性
测量样品中或沿样品表面的声音传播可以用作为凝血的附加测度。外部超声换能器可以用于测量超声行进通过样品所花费的时间。此外,表面声波装置可以用于测量样品的声学特性并检测凝血。
iii.制作装置的方法
除了诸如光刻等标准工艺之外,可以应用诸如硅晶圆的阳极键合或氢氧化钾各向异性湿蚀刻等特殊技术来形成微系统。除了标准紫外光光刻技术,可以使用诸如直接激光写入微消融或侵蚀、电子束光刻或聚焦离子束铣削等技术来限定微米级或纳米级的结构。软光刻是制造微流控系统的相关方式,并且基于微结构或图案的产生,例如通过标准光刻技术,以及随后在成型/铸造工艺中使用这些图案。弹性体材料(诸如聚二甲基硅氧烷(pdms))通常用于通过软光刻产生微流控系统。通过软光刻产生的结构化膜可以彼此附接或者附接到任何其他结构化或非结构化衬底上以形成复杂的微流控系统。另外,可以单独使用其他技术,诸如钻孔、铣削、成型或3d打印,或者与其他微米/纳米技术组合使用以制造微系统。
iv.样品采集
采血
在大多数情况下,待测试的个体将出现在诊所或医院,可能对于使用抗凝血剂的治疗状态未知。可以通过使用注射器、刺血针、或者直接从含血管线获得血液。由于使用替代性凝血途径,其中使用玻璃型表面激活凝血,血液可以含有抗凝血剂,诸如华法林、肝素、低分子量肝素、因子iia抑制剂、因子xa抑制剂、和其他因子抑制或因子受损血液。
华法林和相关的含有4-羟基香豆素的分子通过抑制维生素k环氧化物还原酶来减少血液凝固,该环氧化物还原酶是一种在维生素k1参与几种血液凝固蛋白(主要是凝血酶原和因子vii)的羧化之后将氧化的维生素k1再循环至其还原形式的酶。华法林不会拮抗维生素k1的作用,而是拮抗维生素k1的再循环,消耗活性维生素k。因此,新鲜维生素k总能逆转药理作用。当给药时,这些药物不会立即抗凝血。相反,它们的效果开始需要在剩余的活性凝血因子已经有时间自然消失在代谢中前大约一天,并且单次剂量的华法林的作用持续时间为2至5天。当中断或给予维生素k1时华法林作用果的逆转需要相似的时间。
肝素是肝脏和其他组织中发生抑制血液凝固的化合物。含硫多糖,作为抗凝血剂用于治疗血栓症。低分子量肝素是一种更高度加工的产品,因为它不需要通过aptt凝血参数(其具有更加可预测的血浆水平)进行监测并且具有较少的副作用,所以是有用的。然而,在紧急出血情况下,监测lmwh的能力是显着的未满足的临床需求,因为针对lmwh抗凝血剂监测尚无临床上可接受的即时测定。
药物(诸如利伐沙班、阿哌沙班和依杜沙班)通过直接抑制因子xa起作用(与通过抗凝血酶活化起作用的肝素和磺达肝素不同)。
另一种类型的抗凝血剂是直接凝血酶抑制剂。目前这一类成员包括二价药水蛭素、来匹卢定和比伐卢定;和一价药物阿加曲班和达比加群。
样品可以作为血液或血浆进行测试。血浆可以通过过滤或离心来制备。此外,通过使用例如双深度芯片或通道内珠粒封装将玻璃珠引入通道中,可以增加一个或多个微流控通道的额外的玻璃表面积。
其他生物样品
该装置可以与通过暴露于玻璃下来激活的其他类型的样品一起使用。
v.使用方法
将样品收集并给予到该装置中。当样品放入该装置时,开始确定凝血的手段。将结果与未凝固样品(通常来自汇集的血浆或汇集的血液)的标准结果进行比较,或参考治疗开始时的凝血时间,如在个体被给予抗凝血剂、或用于中和抗凝血剂并恢复较正常的血液凝固的治疗剂的情况下。
参考以下非限制性实例来进一步理解本发明。
实例1.芯片上加热的示范
使用芯片来示范集成加热器(或集成加热器/冷却器)的效果;优选固态热泵或‘珀耳帖冷却器’)结构。将12v直流电压施加到微流控芯片的硅部分背面的加热器电阻器上。在施加加热器电压和在加热过程中,在每个室(在硅前表面上的内部热敏电阻器)内和每个室的顶部(
-外部热敏电阻器:δt=20.3k
-内部热敏电阻器:δt=23.8k。
实例2:血液凝固的测量
材料与方法
使用市售的采血装置从患者上获得血液。获得10μl血液并移液到微量离心管中。将盐水用作缓冲溶液。将血液样品在微量离心管中用以下试剂之一上下移液五次进行混合:
-1μl缓冲溶液(称为假对照),
-1μl含有浓度为300ng/ml的抗凝血剂依杜沙班的缓冲液,
-1μl含有浓度均为300ng/ml的抗凝血剂依杜沙班和抗凝血剂逆转剂per977的缓冲溶液。
依杜沙班是市售抗凝血剂。per977(ciraparantag)是一种被设计成用于逆转依杜沙班的效果的试验药物。混合后立即将2.5μl的每个血液样品移液到封闭的装置芯片中。将芯片插入其读取器中,并且在室温(大约27℃)下立即记录ir光和阻抗测量值。省略了血液样品的加热。
通过ir和粘度阻抗两者获得结果。
结果
从图12a-12f中明显的是,ir(图12b、图12d和图12f)和阻抗测量值(图12a、图12c和图12e)彼此密切关联。两个测量值显示在2分钟左右时的特征峰值的假对照,指示样品凝血时间。添加抗凝血剂依杜沙班将该峰值转移到大约4分钟。除了峰值,依杜沙班曲线显示出12分钟左右时的特征局部最小值。将抗凝血剂逆转剂per977添加到含有依杜沙班的血液样品中,将每条曲线中的峰值转移回到2分钟,并抑制在12分钟左右时出现局部最小值。这些测量值指示依杜沙班的凝血延缓效果,并通过额外给予per977逆转这种效果。
根据前述详细描述,装置、系统及其使用方法的修改和变化对于本领域技术人员而言将是明显的,并且旨在属于所附权利要求书的范围内。
- 还没有人留言评论。精彩留言会获得点赞!