用于膀胱癌非侵入式诊断的分子标志的制造方法与工艺
本发明涉及用于肿瘤诊断的分子标志,特别涉及用于膀胱癌非侵入式诊断的分子标志。
背景技术:
在全球范围内,每年有近90万人被诊断为膀胱癌,每年约有25万人死于膀胱癌[1]。在我国,膀胱癌是泌尿系统最常见的恶性肿瘤,膀胱癌可分为非肌层浸润性膀胱癌(Ta/T1期)和肌层浸润性膀胱癌(T2-T4期)。早期膀胱癌患者可行经尿道膀胱肿物电切术(TransurethralResectionofBladderTumorTURBT),而肌层浸润性膀胱癌患者需行全膀胱切除、尿流改道,手术后严重影响患者生活质量,而且手术之后5年生存率仅为23%-46%[2]。因此,膀胱癌的早发现、早诊断、早治疗是提高肿瘤治疗效果和提高患者生存质量的关键。膀胱镜检查是膀胱癌早发现、早诊断的“金标准”,但膀胱镜检查为有创性检查,并且可能导致泌尿系感染、出血、尿道损伤,并且临床应用受到外科医生经验水平及场地设备等制约,再者,膀胱光镜检查的费用也颇为昂贵,诸多因素造成了膀胱镜检查不利于膀胱癌的早期筛查。因此,寻求无创、便捷、准确的膀胱癌早期诊断和术后检测方法,是研究者不断努力的方向。通过检测尿液中的瘤标是目前早期膀胱癌无创性诊断的一种研究趋势。目前已经有数种获得美国食品药物管理局(FoodandDrugAdministration,FDA)批准能在临床上应用的尿液膀胱肿瘤标记物,包括核基质蛋白22(nuclearmatrixprotein22,NMP22)、膀胱肿瘤抗原(Bladdertumorantigen,BTA)、UroVysion、ImmunoCytTMCYFRA21-1、UBCtest[3,4]。其中NMP22及BTA检测的平均敏感度分别为67%(41%-100%)及68%(51%-100%)、平均特异度分别为79%(43%-95%)及75%(54%-93%),而其他几种瘤标的敏感度和特异度有待多地区和多中心的进一步研究。这些检测方法的临床应用,可以使得膀胱癌患者减少膀胱镜检查得频率,减少患者的痛苦及医疗费用,但仍然不能完全取代膀胱镜检查。因此,在尿液当中寻找新的检测瘤标是目前膀胱癌无创性诊断的研究热点方向之一,期望能发现诊断准确率更高的瘤标,或者通过新瘤标与某种常用瘤标的联合诊断来提高诊断准确度,从而逐步实现膀胱癌无创诊断的目标。AIB1(Amplifiedinbreastcancer1)首先在人类乳腺癌细胞株当中被发现的癌基因,并已经证实了其在前列腺癌、乳腺癌等恶性肿瘤细胞当中扩增与表达,AIB1是多种恶性肿瘤生长、增殖多必须的[5-7]。发明人的前期研究表明,AIB1在膀胱癌组织当中的基因及蛋白表达水平均较正常组织增高,AIB1高表达水平与患者生存时间呈负相关,同时发明人还阐明了AIB1通过AKT信号通路及充当E2F1协调激活因子的作用来促进膀胱肿瘤细胞的增殖,发明人通过利用纳米技术特异抑制ABI1的表达之后,能后明显抑制膀胱癌细胞株的体外生长与及其在免疫缺陷小鼠体内成瘤[8-10]。EIF5A2(Eukaryoticinitiationfactor5A2)基因首先在卵巢癌HT29细胞株中发现[11]。之后研究者相继在卵巢癌、胃癌、肝癌、肺癌及结肠癌等恶性肿瘤中发现EIF5A2基因的扩增及其编码的蛋白异常表达,并且与肿瘤的发生及复发密切相关[12-17]。发明人的前期研究表明,EIF5A2基因在膀胱癌组织当中扩增,其编码的蛋白异常表达,EIF5A2可以充当肿瘤复发及进展的预测因子。发明人发现EIF5A2是患者预后的独立预测因子。发明人之后的研究当中揭示了EIF5A2是通过STAT而促进TGF-B1表达,进而诱导肿瘤细胞的上皮间充质转化化来促进肿瘤细胞的侵袭[18-20]。
技术实现要素:
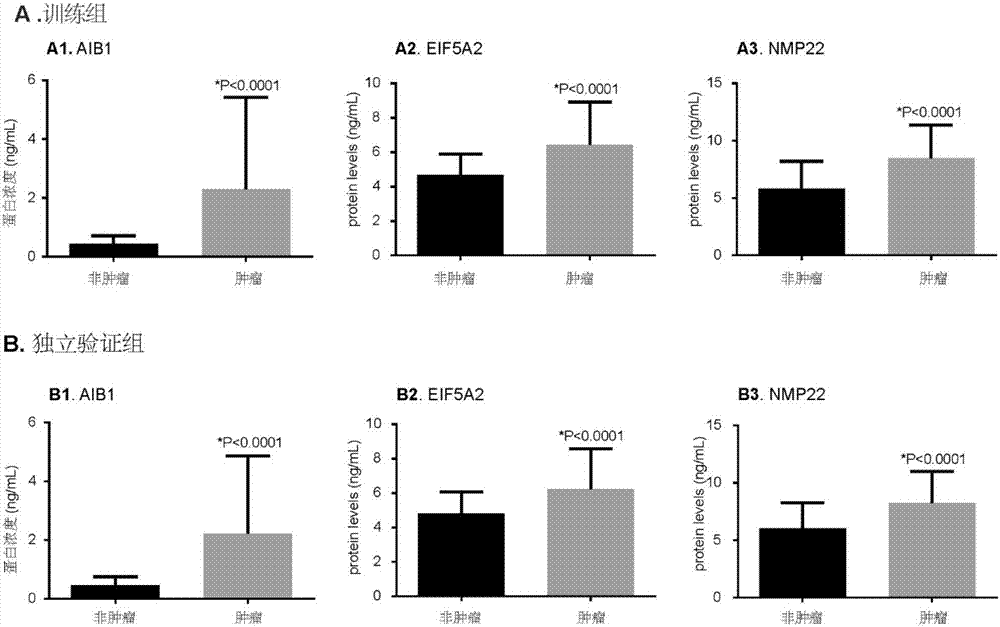
本发明的目的在于提供一种更为准确的用于膀胱癌诊断的非侵入式分子标志,以及基于该分子标志的诊断试剂盒。基于前期的研究基础,发明人通过检测膀胱患者及非膀胱癌人群中尿液当中的AIB1及EIF5A2的蛋白表达水平,发现AIB1及EIF5A2能够充当膀胱癌无创性诊断的新瘤标,联合AIB1、EIF5A2及NMP22更能提高膀胱癌的诊断准确度。发明人检测了不同组尿液样本中AIB1、EIF5A2和NMP22蛋白含量。训练组中,膀胱癌组尿液样本中AIB1(1.40vs.0.35ng/ml)、EIF5A2(5.83vs.4.56ng/ml)和NMP22(7.74vs.6.31ng/ml,三种蛋白的含量明显高于对照组(p值均小于0.0001)。其中,AIB1的受试者工作特征(receiveroperatingcharacteristicROC)曲线面积为0.846(95%可信区间[95%CI]0.775–0.917),通过ROC曲线,得出AIB1的诊断界限值为0.58ng/ml,AIB1对膀胱癌的诊断具有81%(95%CI:71%–89%)的敏感性及88%(95%CI:76%–96%)的特异性,阳性及阴性报告率分别为92%(95%CI:84%–97%)及73%(95%CI:60%–84%);EIF5A2的ROC曲线面积为0.761(95%CI0.675–0.846),通过ROC曲线,得出EIF5A2的诊断界限值为5.06ng/ml,EIF5A2对膀胱癌的诊断具有74%(95%CI:64%–83%)的敏感性及78%(95%CI:64%–89%)的特异性,阳性及阴性报告率分别为85%(95%CI:75%–92%)及64%(95%CI:51%–76%);NMP22的ROC曲线面积为0.794(95%CI0.712–0.876),通过ROC曲线,得出NMP22的诊断界限值为6.89ng/ml,NMP22对膀胱癌的诊断具有79%(95%CI:69%–87%)的敏感性及80%(95%CI:66%–90%)的特异性,阳性及阴性报告率分别为87%(95%CI:77%–94%)及69%(95%CI:56%–81%)。在210例独立验证组尿液样本中,发明人验证了AIB1、EIF5A2及NMP22具有类似的膀胱癌诊断准确度(表3)。采用单因素逻辑回归分析表明:尿液样本中AIB1、EIF5A2和NMP22含量的增加都与膀胱癌风险增加相关(p值均小于0.0001)。独立验证组中,该结论同样成立(p值均小于0.0001)。采用多因素逻辑回归分析表明:尿液样本中AIB1、EIF5A2和NMP22含量的增加都与膀胱癌风险增加相关(p值均小于0.0001)。独立验证组中,该结论同样成立(p值均小于0.0001)。发明人利用AIB1、EIF5A2和NMP22三种瘤标构建膀胱癌尿液诊断模型,在训练组中,模型的ROC曲线面积为0.919(95%CI:0.864–0.974),通过ROC曲线,诊断模型的界限概率分值是10.08,模型对膀胱癌的诊断具有92%(95%CI:84%–97%)的敏感性及92%(95%CI:81%–98%)的特异性,阳性及阴性报告率分别为95%(95%CI:88%–99%)及87%(95%CI:75%–95%)。独立验证组中,模型的ROC曲线面积为0.898(95%CI:0.849–0.947),模型对膀胱癌的诊断具有89%(95%CI:82%–94%)的敏感性及91%(95%CI:82%–96%)的特异性,阳性及阴性报告率分别为94%(95%CI:89%–98%)及82%(95%CI:72%–90%)。概率分值的分布显示模型具有更好的诊断准确性,优于单个诊断瘤标(p值均小于0.05)。采用单因素逻辑回归分析表明:模型中概率分值的增加与膀胱癌风险增加正相关(p值小于0.0001)。独立验证组中,该结论同样成立(p值小于0.0001)。采用多因素逻辑回归分析表明:模型中概率分值的增加与膀胱癌风险增加正相关(p值小于0.0001)。独立验证组中,该结论同样成立(p值小于0.0001)。发明人基于AIB1、EIF5A2和NMP22建立了膀胱癌的非侵入式诊断模型,极大地方便了膀胱癌的诊断。附图说明图1是训练组和独立验证组尿液样本中AIB1、EIF5A2和NMP22蛋白含量检测结果绘制的散点图;图2是训练组和独立验证组中AIB1、EIF5A2和NMP22在尿液样本中蛋白表达的浓度;图3是尿液AIB1、EIF5A2和NMP22用于膀胱癌诊断的特征表现情况;图4是含有AIB1、EIF5A2和NMP22的尿液膀胱癌诊断模型的表现情况。具体实施方式方法和材料样本和数据收集本研究是在获得当地伦理审查委员会批准后进行。所有纳入研究对象均签署知情同意书。总共收集了345位纳入研究对象的晨尿,尿液样本均值收集后30min内于-20℃保存直到分析。训练组中,85膀胱癌患者尿液样本为来自中山大学第一附属医院2013年11月25日至2014年10月28日期间所收集的样本。50位对照组对象由6名肾结石患者、5名良性膀胱肿物患者、7名良性前列腺增生症患者、7名血尿症患者、6名尿路感染患者和19名健康志愿者组成。5名良性膀胱肿物患者进行过经尿道膀胱肿物电切术,7名良性前列腺增生患者均进行过经尿路前列腺电切手术。独立验证组中,134份膀胱癌患者液样本均来自中山大学肿瘤中心2013年11月1日至2014年11月28日期间所收集的样本,对照组中76位对象由7名肾结石患者、8名良性膀胱肿物患者、10名良性前列腺增生症患者、9名血尿症患者、8名尿路感染患者和34名健康志愿者组成。良性膀胱损伤患者进行过经尿道膀胱肿物电切术,良性前列腺增生患者进行经尿路前列腺电切手术。肿瘤分级参照2004世界卫生组织(WHO)分级系统,肿瘤分期参照第六版肿瘤-淋巴结-转移[tumor-nodes-metastasis(TNM)]分期系统。所有纳入研究对象均确认无肾功能损害。对照组血尿患者均进行了膀胱镜检查确认无膀胱肿物。根据国际共识小组公开的膀胱组织标志,本研究为二期(验证)研究。报告数据参照根据诊断准确性报告规范(Standardsforreportingofdiagnosticaccuracy)。尿液样本的处理在治疗介入前,对每个对象收集约50ml清晨第一次中段尿液,收集后立即在4℃,1000g离心力下离心10分钟。吸取尿上清于-20℃冻存直至实验分析。试剂人属AIB1和NMP22(NUMA1:SEC332Hu)的ELISA试剂盒购自优尔生生命科学(中国武汉)。用于检测人尿液样本EIF5A2的酶联免疫吸附测定实验(enzyme-linkedimmunosorbentassayELISA)配对抗体(H00056648-AP11)和重组蛋白(H00056648-P01)购自Abnova公司(中国台湾台北)。二次链霉亲和素-过氧化物偶连抗鼠免疫球蛋白G抗体(ab6789)购自Abcam(Cambridge,MA,USA)。尿液样本AIB1和NMP22的检测使用ELISA试剂盒定量尿样中的AIB1和NMP22蛋白浓度,按试剂盒的使用说明重复测定3次。AIB1的检测敏感值为0.124ng/ml,NMP22的检测敏感值为0.063ng/ml。尿液样本EIF5A2的检测采用双抗体夹心酶联免疫吸附测定实验定量尿样中的EIF5A2。按配对抗体的使用说明重复测定3次。EIF5A2的检查敏感值为3ng/ml。统计分析组内分类变量差异使用卡方检验进行分析。使用非参数的Mann–WhitneyU检验比较组间的变量。重复测量数据的精度使用组内相关系数(intra-classcorrelationcoefficients)确定。美国国家肿瘤研究院推荐使用受试者工作特征(ROC)曲线评价某种瘤标是否适合于肿瘤诊断[21]。因此,发明人使用ROC曲线分析来选定一个由Youden指数确定的诊断界值[22]。对象值大于或等于界值被定义为阳性(患有肿瘤),对象值小于界值被定义为阴性(非肿瘤)。发明利用ROC曲线确定单个瘤标对膀胱癌诊断的敏感性、特异性、阳性报告率、阴性报告率。在训练组当中,发明人使用多二次回归分析以构建包含AIB1、EIF5A2和NMP22的模型,根据模型得出个体预测分值公式=(3.304×AIB1表达值)+(0.828×EIF5A2表达值)+(0.546×NMP22表达值),运用预测公式根据对象个体AIB1、EIF5A2和NMP22的表达水平计算每个对象的预测分值。发明人根据ROC曲线分析来选定一个由Youden指数确定的诊断界定预测分值,发明利用ROC曲线确定模型对膀胱癌诊断的敏感性、特异性、阳性报告率、阴性报告率。发明人采用同样的方法将该模型应用于独立验证组。发明人使用单因素和多因素二元逻辑回归分析计算比值比和95%置信区间。本研究中统计学意义设定为p<0.05,所有p值都是双边值。发明人使用SPSS12.0和第八版医学统计软件(MedCalcversion8.0)对数据进行分析。研究对象的特性表1体现了训练组和独立验证组的临床和病理学特性。训练组由85份膀胱癌患者的尿液样本(实验组)和50份对照尿液样本组成。实验组和对照之间的性别、年龄和吸烟习惯方面无统计学差异(p值均大于0.05)。实验组中,64.7%为非肌层浸润膀胱癌(non-muscleinvasiveBCa,NMIBC),43.5%为低级别膀胱癌(low-gradedisease)。独立验证组中由134份膀胱癌患者的尿液样本(实验组)和76份对照尿液样本组成,实验组和对照之间的性别、年龄和吸烟习惯方面无统计学差异(p值均大于0.05)。实验组中,64.7%的患者为非肌层浸润膀胱癌,41.8%为低级别膀胱癌。训练组和独立验证组的相对应组之间的患者在性别、年龄、吸烟习惯、肿瘤病理分期和肿瘤级别均无统计学差异(p值均大于0.05)。ELISA数据重复性的评估发明人验证ELISA蛋白测量结果的重复稳定性,重复测量了训练组和独立验证组尿液样本中AIB1、EIF5A2和NMP22的蛋白含量。根据所有样本的检测结果绘制散点图验证3次连续测量的重复性。在本研究中,所有的组内相关系数(ICC)都大于0.98,表明所有组中的测量结果都具有很好重复稳定性(图1)。基于此,发明人认为ELISA检测流程非常适用于尿液中AIB1、EIF5A2和NMP22蛋白水平的检测。实验组及对照组尿液样本中AIB1、EIF5A2和NMP22蛋白水平的表达图2显示了训练组和独立验证组中AIB1、EIF5A2和NMP22在尿液样本中蛋白表达的浓度。在训练组中,实验组和对照组中AIB1的中位浓度值分别为1.40ng/ml和0.35ng/ml;EIF5A2中位浓度值分别为5.83ng/ml和4.56ng/ml;NMP22的中位浓度值分别为7.74ng/ml和6.31ng/ml,实验组中三种蛋白的浓度均高于对照组,所有p值均小于0.0001,差异均具有统计学意义。在独立验证组中,实验组和对照组中AIB1的中位浓度值分别为1.31ng/ml和0.39ng/ml;EIF5A2的中位浓度值分别为5.74ng/ml和4.60ng/ml;NMP22的中位浓度值分别为7.78ng/ml和6.23ng/ml,实验组中三种蛋白的浓度均高于对照组,所有p值均小于0.0001,差异均具有统计学意义。如表2所示,在训练组中,肌层浸润性膀胱癌患者尿液中AIB1、EIF5A2和NMP22的蛋白浓度均比非肌层浸润性膀胱癌患者的浓度高,三组p值均小于0.05,差异均具有统计学意义。在独立验证组中得出同样的结果(表2)。将膀胱癌患者按性别、年龄、吸烟习惯分组时,在训练组或独立验证组中AIB1、EIF5A2和NMP22蛋白表达水平均无统计学差异(表2)。尿液AIB1、EIF5A2和NMP22用于膀胱癌诊断的特征表现通过训练组可得出AIB1、EIF5A2和NMP22的诊断界值分别为0.58ng/ml,5.06ng/ml,和6.89ng/ml。图3A为训练组中AIB1、EIF5A2和NMP22的ROC曲线。表3显示了尿液中三种生物标志的诊断准确水平。在训练组中,AIB1具有81%的敏感性和88%的特异性,ROC曲线下面积为0.846(95%可信度[95%CI]0.775–0.917);尿液EIF5A2具有74%的敏感度和78%的特异性,ROC曲线下面积为0.761(95%CI0.675–0.846)。尿液NMP22具有79%的敏感度和80%的特异性,ROC曲线下面积为0.794(95%CI0.712–0.876)。为验证这3个生物标志在不同的人群中具有相似的诊断表现,发明人在具有210例的独立组中对3个生物标记物进行了验证。将训练组中得出的3个生物标记物诊断界值分别用于独立验证组,发现它们均具有类似的诊断准确度(图3B,表3)。表3.训练组和独立验证组AIB1、EIF5A2、NMP22及模型的膀胱癌诊断准确度:CI=置信区间。将AIB1或EIF5A2的AUC与NMP22的进行对比,在训练组中它们的诊断准确度均无显著区别(p>0.05)。但是,在独立验证组中,AIB1的诊断准确度显著大于NMP22的诊断准确度。尿液AIB1、EIF5A2和NMP22蛋白水平用于膀胱癌诊断的逻辑回归分析训练组中,单因素逻辑回归分析提示尿液中AIB1、EIF5A2和NMP22含量的增加都与患膀胱癌的风险呈正相关(p值均小于0.0001,表4)。在独立验证组中得出同样的结论(p值均小于0.0001,表4)。多因素logistics回归分析排除了年龄、性别和吸烟习惯三种因素影响AIB1、EIF5A2和NMP22对膀胱癌诊断的准确度(p值均小于0.0001表4)。构建包含有AIB1、EIF5A2和NMP22的尿液膀胱癌诊断模型在训练组中,根据3个瘤标的蛋白水平得出膀胱癌诊断模型的概率分值是10.08。概率分值的分布图显示模型具有更好的诊断准确度(图4A),其具有92%的敏感性和92%的特异性,AUC为0.919(95%CI0.864–0.974),优于单个诊断标志(p值均小于0.05图3A)。在单因素logistic回归中,模型的概率分值与患膀胱癌的风险呈正相关(p<0.0001,表4)。多因素logistics回归分析排除了年龄、性别和吸烟习惯三种因素影响模型对膀胱癌诊断的准确度(p<0.0001,表4)。为验证模型在不同的人群中是否具有相似的诊断准确度,发明人将其应用于由来自其他医疗中心的134位患者和76对照对象。结果表明模型具有训练组的类似的诊断准确度(图4B)。图3B显示了模型的ROC曲线,其敏感性和特异性分别是89%和91%(表3)。模型的AUC为0.898(95%CI0.849–0.947),再次证明了其诊断准确度优于任何单个生物标志(p值均小于0.05,图3B)。在单因素logistic回归中,模型的概率分值与患膀胱癌的风险呈正相关(p<0.0001,表4)。多因素logistics回归分析排除了年龄、性别和吸烟习惯三种因素影响模型对膀胱癌诊断的准确度(p<0.0001,表4)。表4.训练组及独立验证组的逻辑回归分析:CI=置信区间。参考文献1.KlotzLandBrausiMA.WorldUrologicOncologyFederationBladderCancerPreventionProgram:Aglobalinitiative.UrolOncol-SeminOri.2015;33(1):25-29.2.JemalA,SiegelR,XuJandWardE.Cancerstatistics,2010.CA:acancerjournalforclinicians.2010;60(5):277-300.3.TilkiD,BurgerM,DalbagniG,GrossmanHB,HakenbergOW,PalouJ,ReichO,RoupretM,ShariatSFandZlottaAR.Urinemarkersfordetectionandsurveillanceofnon-muscle-invasivebladdercancer.Europeanurology.2011;60(3):484-492.4.BabjukM,SoukupV,PeslM,KostirovaM,DrncovaE,SmolovaH,SzakacsovaM,GetzenbergR,PavlikIandDvoracekJ.UrinarycytologyandquantitativeBTAandUBCtestsinsurveillanceofpatientswithpTapT1bladderurothelialcarcinoma.Urology.2008;71(4):718-722.5.GnanapragasamVJ,LeungHY,PulimoodAS,NealDEandRobsonCN.ExpressionofRAC3,asteroidhormonereceptorco-activatorinprostatecancer.Britishjournalofcancer.2001;85(12):1928-1936.6.TannerMM,GrenmanS,KoulA,JohannssonO,MeltzerP,PejovicT,BorgAandIsolaJJ.Frequentamplificationofchromosomalregion20q12-q13inovariancancer.Clinicalcancerresearch:anofficialjournaloftheAmericanAssociationforCancerResearch.2000;6(5):1833-1839.7.SakaguchiH,FujimotoJ,SunWSandTamayaT.Clinicalimplicationsofsteroidreceptorcoactivator(SRC)-3inuterineendometrialcancers.TheJournalofsteroidbiochemistryandmolecularbiology.2007;104(3-5):237-240.8.LuoJH,XieD,LiuMZ,ChenW,LiuYD,WuGQ,KungHF,ZengYXandGuanXY.ProteinexpressionandamplificationofAIB1inhumanurothelialcarcinomaofthebladderandoverexpressionofAIB1isanewindependentprognosticmarkerofpatientsurvival.InternationaljournalofcancerJournalinternationalducancer.2008;122(11):2554-2561.9.TongZT,WeiJH,ZhangJX,LiangCZ,LiaoB,LuJ,FanS,ChenZH,ZhangF,MaHH,QianWC,KongLL,FangY,ChenW,XieDandLuoJH.AIB1predictsbladdercanceroutcomeandpromotesbladdercancercellproliferationthroughAKTandE2F1.Britishjournalofcancer.2013;108(7):1470-1479.10.WeiJ,CheangT,TangB,XiaH,XingZ,ChenZ,FangY,ChenW,XuA,WangSandLuoJ.Theinhibitionofhumanbladdercancergrowthbycalciumcarbonate/CaIP6nanocompositeparticlesdeliveringAIB1siRNA.Biomaterials.2013;34(4):1246-1254.11.GuanXY,ShamJS,TangTC,FangY,HuoKKandYangJM.Isolationofanovelcandidateoncogenewithinafrequentlyamplifiedregionat3q26inovariancancer.Cancerresearch.2001;61(9):3806-3809.12.MarchetA,MocellinS,BellucoC,AmbrosiA,DeMarchiF,MammanoE,DigitoM,LeonA,D'ArrigoA,LiseMandNittiD.Geneexpressionprofileofprimarygastriccancer:towardsthepredictionoflymphnodestatus.Annalsofsurgicaloncology.2007;14(3):1058-1064.13.XieD,MaNF,PanZZ,WuHX,LiuYD,WuGQ,KungHFandGuanXY.OverexpressionofEIF-5A2isassociatedwithmetastasisofhumancolorectalcarcinoma.Humanpathology.2008;39(1):80-86.14.YangGF,XieD,LiuJH,LuoJH,LiLJ,HuaWF,WuHM,KungHF,ZengYXandGuanXY.ExpressionandamplificationofeIF-5A2inhumanepithelialovariantumorsandoverexpressionofEIF-5A2isanewindependentpredictorofoutcomeinpatientswithovariancarcinoma.Gynecologiconcology.2009;112(2):314-318.15.TangDJ,DongSS,MaNF,XieD,ChenL,FuL,LauSH,LiY,LiYandGuanXY.Overexpressionofeukaryoticinitiationfactor5A2enhancescellmotilityandpromotestumormetastasisinhepatocellularcarcinoma.Hepatology(Baltimore,Md).2010;51(4):1255-1263.16.HeLR,ZhaoHY,LiBK,LiuYH,LiuMZ,GuanXY,BianXW,ZengYXandXieD.OverexpressionofeIF5A-2isanadverseprognosticmarkerofsurvivalinstageInon-smallcelllungcancerpatients.InternationaljournalofcancerJournalinternationalducancer.2011;129(1):143-150.17.ZhuW,CaiMY,TongZT,DongSS,MaiSJ,LiaoYJ,BianXW,LinMC,KungHF,ZengYX,GuanXYandXieD.OverexpressionofEIF5A2promotescolorectalcarcinomacellaggressivenessbyupregulatingMTA1throughC-myctoinduceepithelial-mesenchymaltransition.Gut.2012;61(4):562-575.18.ChenW,LuoJH,HuaWF,ZhouFJ,LinMC,KungHF,ZengYX,GuanXYandXieD.OverexpressionofEIF-5A2isanindependentpredictorofoutcomeinpatientsofurothelialcarcinomaofthebladdertreatedwithradicalcystectomy.Cancerepidemiology,biomarkers&prevention:apublicationoftheAmericanAssociationforCancerResearch,cosponsoredbytheAmericanSocietyofPreventiveOncology.2009;18(2):400-408.19.WeiJH,CaoJZ,ZhangD,LiaoB,ZhongWM,LuJ,ZhaoHW,ZhangJX,TongZT,FanS,LiangCZ,LiaoYB,PangJ,WuRH,FangY,ChenZH,etal.EIF5A2predictsoutcomeinlocalisedinvasivebladdercancerandpromotesbladdercancercellaggressivenessinvitroandinvivo.Britishjournalofcancer.2014;110(7):1767-1777.20.LuoJH,HuaWF,RaoHL,LiaoYJ,KungHF,ZengYX,GuanXY,ChenWandXieD.OverexpressionofEIF-5A2predictstumorrecurrenceandprogressioninpTa/pT1urothelialcarcinomaofthebladder.Cancerscience.2009;100(5):896-902.21.PepeMS,EtzioniR,FengZ,PotterJD,ThompsonML,ThornquistM,WingetMandYasuiY.Phasesofbiomarkerdevelopmentforearlydetectionofcancer.JournaloftheNationalCancerInstitute.2001;93(14):1054-1061.22.FlussR,FaraggiDandReiserB.EstimationoftheYoudenIndexanditsassociatedcutoffpoint.BiometricaljournalBiometrischeZeitschrift.2005;47(4):458-472.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1