一种蛋白质双向电泳方法及其应用与流程
本发明属于生物技术领域,具体涉及一种蛋白质双向电泳方法及其应用。
背景技术:
芽孢杆菌产生的抗菌物质吸引了众多专家学者的注意力。芽孢杆菌抗菌物质通常分为两大类:一类是核糖体合成的抗生素,主要为羊毛硫类抗生素(lantibiotics),包括subtilin、subtilosin、ericin等;另一类为非核糖体合成的脂肽类抗生素(lipopeptides),主要包括芬荠素(fengycin)、表面活性素(surfactin)、伊枯草菌素家族(iturin、bacillomycin、mycosubtilin)、bacilysin等。抗菌脂肽对食品中的多种革兰氏阳性及阴性细菌均有较强的杀灭作用,能快速抑制微生物的生长,食用后易被体内蛋白酶水解消化且无毒副作用,在酸性条件下活性很强,具有良好的溶解性和稳定性,是极具发展前景的新型食品防腐剂。芬荠素由于具有高效的抗真菌活性,在食品防腐、食品保鲜等领域具有重要的应用前景,已引起广泛的关注。
通过蛋白质双向电泳的方法,对淀粉液化芽孢杆菌稳定期菌体细胞中全蛋白的分布进行分析,筛选出与芬荠素合成相关的调控因子,有助于从分子水平上为改造芬荠素生产菌株提供可靠的信息。
然而,现有的蛋白质双向电泳的方法,在进行稳定期菌体细胞中全蛋白的分布进行分析时,尤其是对于淀粉液化芽孢杆菌稳定期菌体细胞中全蛋白的分布进行分析,存在双向电泳图谱分辨率不高、重复性不好的问题。
技术实现要素:
本发明的目的是提供一种蛋白质双向电泳方法及其应用,解决了现有的蛋白质双向电泳的方法,在进行稳定期菌体细胞中全蛋白的分布进行分析时,尤其是对于淀粉液化芽孢杆菌稳定期菌体细胞中全蛋白的分布进行分析,存在双向电泳图谱分辨率不高、重复性不好的问题。
本发明提供了一种蛋白质双向电泳方法,包括:
步骤1,制备蛋白质样品;
步骤2,等电聚焦电泳,具体包括:
利用水化液对胶条进行水化,得到水化好的胶条,且水化好的胶条pH为4-7,其中每100mL水化液中含有以下组分:41-42.5g的尿素、15-16g的硫脲、2-2.2g的CHAPS、0.9-1.1g的DTT、2-2.2g的IPG Buffer、0.002-0.003g的溴酚兰,且水化液的溶剂为ddH2O;
将水化好的胶条与电泳设备接触,设置等电聚焦电泳运行条件,并进行蛋白质样品的上样,最后进行等电聚焦电泳,得到聚焦好的胶条,其中等电聚焦电泳的电压和时间采用如下设置:S1:50v,10h;S2:250v,3h;S3:500v,3h;S4:1000v,1h;S5:8000v,3h;S6:8000v,6-6.5h;
步骤3,将得到聚焦好的胶条进行平衡,然后进行SDS聚丙烯酰胺凝胶垂直电泳,得到含有蛋白质的电泳凝胶;
步骤4,采用银染染色的方法对含有蛋白质的电泳凝胶进行染色,最终获得双向电泳凝胶。
优选的,步骤1中,制备蛋白质样品具体按照以下步骤实施:
步骤a,收集稳定期的菌体细胞;
步骤b,取一定体积的裂解液,按0.1-0.2g/mL的浓度加入菌体细胞,并按1mg/mL的浓度加入复合蛋白酶抑制剂,将得到的混合液置于冰浴,冰浴的同时超声破碎细胞,直至混合液变澄清,超声完毕后,按10μL/mL的浓度加入核酸酶混合物,室温放置,最后离心并收集上清,得到全蛋白样品。
优选的,所述步骤b具体按照以下步骤实施:
取5mL裂解液,加入0.5-1.0g菌体细,并加入1mg复合蛋白酶抑制剂,将得到的混合液置于冰浴,冰浴的同时于80hz频率下超声破碎细胞,直至混合液变澄清;
超声完毕后,加入50μL核酸酶混合物,室温放置1h;
13000×g,4℃离心30min,收集上清,得到全蛋白质样品。
优选的,所述胶条为24cm的IPG胶条,且蛋白质样品的上样量为200μg。
优选的,所述等电聚焦电泳的电压设置时,S6:8000v,6h。
本发明还提供了一种蛋白质双向电泳方法,在检测淀粉液化芽孢杆菌稳定期菌体细胞中全蛋白分布的应用。
本发明提供的一种蛋白质双向电泳方法,在进行淀粉液化芽孢杆菌稳定期菌体细胞中全蛋白的分布进行分析时,双向电泳图谱分辨率高、重复性好。通过本发明的方法,对淀粉液化芽孢杆菌稳定期菌体细胞中全蛋白的分布进行分析,筛选出与芬荠素合成相关的调控因子,有助于从分子水平上为改造芬荠素生产菌株提供可靠的信息,具有较大的经济价值和社会意义。
附图说明
图1为淀粉液化芽孢杆菌CGMCC5569和淀粉液化芽孢杆菌FMB50的双向电泳图谱;
图2为差异表达蛋白的细胞定位的百分比分布示意图;
图3为利用qRT-PCR分析comA及spo0A的相对表达量的结果图;
图4为comA和spo0A调节芬荠素合成途径的假想示意图。
具体实施方式
下面结合附图和具体实施方式对本发明进行详细说明,但应当理解本发明的保护范围并不受具体实施方式的限制。
本发明提供了一种蛋白质双向电泳方法,在检测淀粉液化芽孢杆菌稳定期菌体细胞中全蛋白分布的应用时,具体按照以下步骤实施:
步骤1,制备蛋白质样品
步骤1.1,收集淀粉液化芽孢杆菌稳定期的菌体细胞
淀粉液化芽孢杆菌培养至稳定期,于6000×g,4℃离心5min,收集沉淀物,并迅速用预冷至4℃的20mmol/L的Tris-HCl洗涤沉淀物3次,获得菌体细胞,其中Tris-HCl的pH为6.8。
需要说明的是,淀粉液化芽孢杆菌培养36h左右即可达稳定期;用Tris-HCl每次洗涤沉淀物后,均于6000×g,4℃离心5min;获得的菌体细胞于液氮速冻,-70℃保存备用。
步骤1.2,提取淀粉液化芽孢杆菌稳定期的菌体细胞中的全蛋白,得到全蛋白质样品
取5mL裂解液,加入0.5-1.0g菌体细,并加入1mg复合蛋白酶抑制剂,将得到的混合液置于冰浴,冰浴的同时于80hz频率下超声破碎细胞,直至混合液变澄清;超声完毕后,加入50μL核酸酶混合物,室温放置1h;13000×g,4℃离心30min,收集上清,得到全蛋白质样品,可以将全蛋白质样品放入-70℃保存备用,也可以直接用于双向电泳。
在全蛋白质样品制备过程中加入1mg蛋白酶抑制剂及10μL核酸酶混合物,可以充分保证所提取全蛋白质的质量和数量。
需要说明的是,所述复合蛋白酶抑制剂为Roche公司的复合蛋白酶制剂,所述核酸酶混合物是GE Healthcare购买的核酸酶混合物。
需要说明的是,每100mL裂解液中包含以下组分:42.04g的尿素、15.2g的硫脲、4g的CHAPS(3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐)、1g的DTT(二巯基苏糖醇)、2g的IPG Buffer,裂解液的溶剂为ddH2O。其中裂解液配制时,先将尿素、硫脲、CHAPS、IPG Buffer混匀,使用前加入DTT。
需要说明的是,为了保证不同样品在等点聚焦电泳上样时,蛋白质的上样量一样,用2-D定量试剂盒(GE Healthcare)测定蛋白质浓度。以2mg/mL BSA作为标准溶液,采用分光光度计测定样本和标准液在480nm波长下的吸光率;根据标准溶液蛋白质含量的吸光率,标绘标准曲线;将样本与标准曲线比较,得到样本蛋白质浓度。
步骤2,等电聚焦电泳
利用水化液对24cm的IPG胶条进行水化,得到水化好的胶条,且水化好的胶条pH为4-7,其中每100mL水化液中含有以下组分:41-42.5g的尿素、15-16g的硫脲、2-2.2g的CHAPS、0.9-1.1g的DTT、2-2.2g的IPG Buffer、0.002-0.003g的溴酚兰,且水化液的溶剂为ddH2O;
需要说明的是,其中每100mL水化液中含有以下组分:41-42.5g的尿素、15-16g的硫脲、2-2.2g的CHAPS、0.9-1.1g的DTT、2-2.2g的IPG Buffer、0.002-0.003g的溴酚兰,且水化液的溶剂为ddH2O,均能实现本发明的技术方案,达到本发明的效果,由于其余步骤相同,此处仅以每100mL水化液中含有42.04g的尿素、15.2g的硫脲、2g的CHAPS、1g的DTT、2g的IPG Buffer、0.002g的溴酚兰为例说明本发明的技术方案。
将水化好的胶条与电泳设备接触,设置等电聚焦电泳运行条件,并进行蛋白质样品的上样,最后进行等电聚焦电泳,得到聚焦好的胶条,其中等电聚焦电泳的电压和时间采用如下设置:S1:50v,10h;S2:250v,3h;S3:500v,3h;S4:1000v,1h;S5:8000v,3h;S6:8000v,6h;
需要说明的是,S6:8000v,6-6.5h均能实现本发明的技术方案,达到本发明的效果,由于其余步骤相同,此处仅以S6:8000v,6h为例说明本发明的技术方案。
待24cm胶条等电聚焦达到80000vhr,时,等电聚焦电泳结束。
需要说明的是,水化液按以下步骤配制时,先将尿素、硫脲、CHAPS、IPG Buffer、溴酚兰和ddH2O混匀,-20℃保存备用,使用前加入DTT。
需要说明的是,S1为低电压水化步骤,S2为升压步骤。
需要说明的是,可以取不同长度或者取不同数量的胶条同时进行电泳,本实施例只是选取了其中较优长度的IPG胶条对本发明的方法进行解释说明。
步骤3,将得到聚焦好的胶条进行平衡,然后进行SDS聚丙烯酰胺凝胶垂直电泳,得到含有蛋白质的电泳凝胶,具体包括:
步骤3.1,DTT平衡:将聚焦好的胶条取出放入平衡管中,聚焦好的胶条的支持面贴试管内壁,加入含2%DTT的平衡缓冲液在摇床上缓慢摇动平衡15min,其中2%DTT指的是平衡缓冲液中DTT质量浓度(w/v)为2%,该步骤的平衡缓冲液采用的是本领域常规的平衡缓冲液。
步骤3.2,IAA(碘乙酰胺)平衡:将步骤3.1中平衡好的胶条取出放到SDS电泳缓冲液里轻轻沾几下,放到含2.5%IAA的平衡液里避光平衡15min,最后在SDS电泳缓冲液中稍微清洗一下,滤纸吸干多余水分,其中2.5%IAA指的是平衡缓冲液中IAA质量浓度(w/v)为2.5%。
需要说明的是,SDS电泳缓冲液中含有3.03%的Tris-base、14.4%的甘氨酸、1%的SDS,且SDS电泳缓冲液溶剂为ddH2O。
步骤3.3,SDS聚丙烯酰胺凝胶垂直电泳
步骤3.3.1,配制浓度为12.5%的均一的SDS聚丙烯酰胺分离凝胶。
每100mL的SDS聚丙烯酰胺分离凝胶中含有41.7mL的30%丙稀酰胺凝胶储存液、25mL的pH为8.8的1.5M Tris-HCl、1mL的10%(w/v)SDS、31.8mL的ddH2O和500μL的10%(w/v)APS;SDS聚丙烯酰胺分离凝胶配制时,先将丙稀酰胺凝胶储存液、Tris-HCl、SDS和ddH2O混合,磁力搅拌使之充分混匀,真空抽气30min,再加入APS。使用前每100mL的SDS聚丙烯酰胺分离凝胶中加入33μL的TEMED,混匀,然后开始灌胶,胶面覆盖少许饱和正丁醇,临用前SDS电泳缓冲液冲洗胶面三次,丙稀酰胺凝胶至少凝固达3h才可以使用。
步骤3.3.2,将已经平衡好的IPG胶条置于SDS聚丙烯酰胺分离凝胶顶端,排除气泡,使IPG胶条与凝胶表面紧密接触,操作中勿使胶条面与玻璃板接触,同时不要来回移动胶条,用低熔点琼脂糖封胶液封胶条,排尽胶条与凝胶面之间的气泡。
步骤3.3.3,上Marker:先将中低分子量蛋白Marker于95℃煮5min,吸取Marker滴于长宽约1mm的滤纸上,将滤纸置于胶条的碱性端,需要说明的是,中低分子量蛋白Marker的分子量范围是7.1-209KD。
步骤3.3.4,将10×SDS电泳缓冲液稀释为1×SDS电泳缓冲液后,加入电泳槽中,尽量避免产生过多气泡。待低熔点琼脂糖封胶液凝固后,将凝胶转移入垂直电泳槽,需要说明的是,10×SDS电泳缓冲液按常规方法配置,其中每100mL10×SDS电泳缓冲液中含有30.3g的Tris-base、144.2g的甘氨酸、10g的SDS,且10×SDS电泳缓冲液溶剂为ddH2O。
步骤3.3.5,接通电源,用Ettan-Dalt II垂直电泳仪进行电泳,温度控制在20℃,恒功率,24cm胶条参数设置为P1 2w/胶,1h;P2 5w/胶30min;P3 15w/胶10h。在溴酚兰前缘运行到凝胶底部边缘时,终止电泳,24cm胶条垂直电泳运行时间为7h。
步骤4,采用银染染色的方法对含有蛋白质的电泳凝胶进行染色,最终获得双向电泳凝胶
步骤4.1,取出步骤3.3.5电泳后的凝胶板,剥离凝胶。
步骤4.2,固定:凝胶置于固定液中固定3h或过夜,每500mL固定液的配制方法为:50mL冰醋酸、200mL无水乙醇、加去离子水定容至500mL。
步骤4.3,敏化:固定结束后换用敏化液,敏化30min,每500mL敏化液的配制方法为:150mL无水乙醇、1g硫代硫酸钠、34g无水醋酸钠,加去离子水溶解并定容至500mL。
步骤4.4,水洗:倒出敏化液,以去离子水洗3次,每次水洗时间为5min。
步骤4.5,银染:利用银染液银染20min,每500mL银染液的配制方法为:硝酸银1.25g,加入去离子水溶解并定容至500mL。
步骤4.6,水洗:倒出银染液后,以去离子水洗1次,水洗时间为2min。
步骤4.7,显色:加入显色液后仔细观察凝胶显色情况,直至蛋白质点完全显现为止,一般约需要5-10min左右,每500mL显色液的配制方法为:12.5g无水碳酸钠加去离子水溶解后定容至500mL,临用前每500mL显色液中加入200μL体积分数为37%的甲醛。
步骤4.8,终止:倒出显色液后,立即加入终止液,终止显色,每500mL终止液的配制方法为:7.3g EDTA-Na2加去离子水定容至500mL。
步骤4.9,保存:终止10min后以去离子水洗2次,获得双向电泳凝胶,每次水洗时间为10min。
为了研究淀粉液化芽孢杆菌CGMCC5569(该菌株的菌种保藏号为CGMCC5569)和芬荠素高产菌株淀粉液化芽孢杆菌FMB50(菌种保藏号为CGMCC6249)中的全蛋白分布情况,找出两个菌株之间的蛋白质分布差异,筛选出与芬荠素合成相关的调控因子,利用本发明的方法分别对淀粉液化芽孢杆菌CGMCC5569和FMB50中的全蛋白进行双向电泳,并对双向电泳凝胶进行图象采集及图谱分析,具体包括:
步骤A,染色后的双向电泳凝胶用ImageScanner TM扫描仪进行透射扫描,数字化图像文件运用Amersham Pharmacia公司的ImageMasterR 2D Elite(Version 2.00)软件分析。图象分析过程包括蛋白质点的检测、量化、背景扣除和点的匹配(Match)。蛋白质点自动检测后进行编辑,蛋白质点匹配前先从中选取一块凝胶图象作为参考胶(Reference gel),并建立一些匹配点(Seed matches),然后自动匹配其他蛋白质点,与参考胶不相匹配的点被加入到参考胶中。同一个样品的3张胶组成一个重复组(Replicate groups),差异表达蛋白质的表达强度用Student-t检验统计分析。选择重复性好且具有统计学意义,表达量相差两倍以上的点做质谱鉴定。
图1为淀粉液化芽孢杆菌CGMCC5569和淀粉液化芽孢杆菌FMB50的双向电泳图谱,其中图1A为淀粉液化芽孢杆菌CGMCC5569的双向电泳图谱,图1B为FMB50的双向电泳图谱。
由图1可知,用ImageMasterR 2D Elite(Version 2.00)软件对所得到的两株菌株全细胞可溶性蛋白的双向电泳图谱进行分析,发现有50个蛋白点的丰度值发生了变化。根据不同条件下双向电泳图谱的匹配情况,对凝胶图谱中重复性好,对丰度值发生2倍以上变化的50个蛋白质点进行了质谱鉴定,获得了50个完整的肽指纹图谱,进一步的Mascot数据库检索显示,其中蛋白点87和433,115和132,443和446,461和493,473和501,508和697为同一蛋白,共成功鉴定44个蛋白质。在淀粉液化芽孢杆菌FMB50中有37个蛋白表达上调,4个蛋白表达下调,5个蛋白只在淀粉液化芽孢杆菌CGMCC5569中出现,4个蛋白只在淀粉液化芽孢杆菌FMB50中出现。
步骤B,胶内酶解、质谱鉴定
步骤B1,蛋白质点酶切
步骤B1.1,酒精消毒所需用具。
步骤B1.2,去离子水洗胶3次,每次水洗时间为10min。
步骤B1.3,用直径1.5mm枪头从胶上取点,尽可能将目的点取完整。
步骤B1.4,取出的蛋白质点置于96孔板中,每孔加入去离子水50μL,超声波(超声功率20W,工作时间60s)处理3次,每次处理时间为10min。
步骤B1.5,3000rpm离心1min,吸干水分后,加入乙腈(ACN)50μL,涡旋5min。
步骤B1.6,3000rpm离心1min,吸干ACN,然后加入10mM DTT/25mM碳酸氢胺50μL,56℃水浴1h。
步骤B1.7,3000rpm离心1min,吸干,加入55mM IAA/25mM碳酸氢胺50μL,置于暗室45min。
步骤B1.8,3000rpm离心1min,吸干,加入体积分数为50%的ACN,逐级脱水,吸干后自然晾干5min,加入5ng/μL序列修饰后胰酶/25mM碳酸氢胺2μL,4℃放置30min。
步骤B1.9,加入25mM碳酸氢胺7.5μL,37℃放置12h。
步骤B1.10,加入0.35μL体积分数为2%的TFA终止。
步骤B2,质谱样品点样
步骤B2.1,点样前所用器械均用酒精消毒。
步骤B2.2,洗靶:体积分数为的50%甲醇超声10min,100%甲醇超声(5MHz,20w)10min,晾干。
步骤B2.3,点样前样品处理:在抽干的样品管中加入体积分数为0.5%的TFA溶解多肽混合物。
步骤B2.4,基质的配制:将α-氰基-β-羟基肉桂酸(HCCA)溶解在含有30%ACN/0.1%TFA中配成饱和溶液,充分振荡后高速离心。
步骤B2.5,点样:将样品和基质按1∶1等体积混合后吸取1μL点样于点样靶上,干燥晾干。
步骤B2.6,肽质量指纹图谱的检测:在延迟解吸和反射模式下进行谱图采集,激光波长337nm,加速电压设置19KV。每一个肽谱图大约是由200次轰击垒加而成,外标采用布鲁克公司肽混合物标准品,内标采用胰蛋白酶的自切峰,分别为m/z 842.50和m/z 2211.10。
步骤B2.7,洗靶:检测结束后,用体积分数为0.1%的TFA洗靶30-60s后吸弃。
步骤C,对步骤B得到的肽段质量指纹图谱进行数据库查询
肽质量指纹图谱是指蛋白质被特异性很高的蛋白水解酶水解后产生的肽片段混合物质量图谱。由于每一种蛋白质氨基酸序列不同,所以用蛋白水解酶水解后得到的肽片段混合物也不相同,其肽段混合物的质量数也具有特征性,称为肽质量指纹谱(PMF),可用于蛋白质的鉴定。通过将实验得到的肽质量指纹谱和数据库中理论的肽质量指纹谱加以比较后就可以鉴定蛋白质。
用Mascot搜索引擎(http://www.matrixscience.com//mascot/cgi/search_form.pl?FORMVER=2&SEARCH=PMF)进行数据库的检索。检索条件:蛋白质数据库选择NCBInr库,物种来源选择other firmicutes,酶选择Trypsin,允许不完全的酶解片段选择为1个,肽片段分子量最大允许误差为120ppm,离子选择为MH+,固定修饰为Carbamidomethyl(C),可变修饰为Oxidation(M)。
步骤D,对步骤C鉴定的蛋白质进行生物信息学分析
比较所鉴定蛋白质点在凝胶中的等电点、分子量值与实验得到的等电点、分子量,分析二者之间的符合情况及可能的翻译后修饰情况。利用蛋白质直系同源簇(COG,http://www.ncbi.nlm.nih.gov/COG/),对实验鉴定蛋白质进行功能分类。依据UniProKB(www.uniprot.org)数据库及相关的文献报道中淀粉液化芽孢杆菌蛋白质信息,得到蛋白质参与的生物学过程及分子功能。根据PSORTb Version 3.0.1软件(http://www.psort.org/psortb/index.html)对实验鉴定蛋白质进行细胞定位分析。
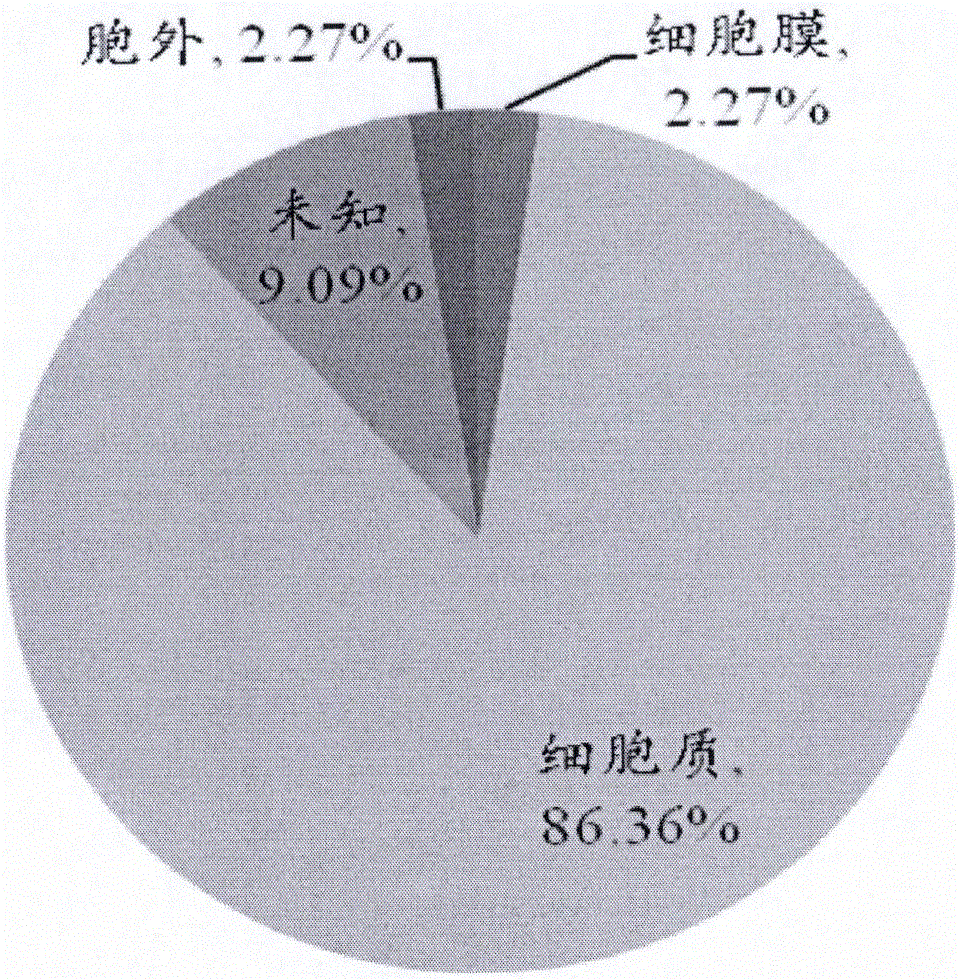
本发明的实施例共计鉴定成功44个蛋白质,用PSORTb Version 3.0.1软件(http://www.psort.org/psortb/index.html)对其进行细胞定位分析。其中有39个蛋白定位在细胞质,1个蛋白定位在胞外,1个蛋白定位在细胞膜,4个蛋白未知细胞定位。图2为差异表达蛋白的细胞定位的百分比分布示意图,说明分离的蛋白质主要是细胞质中的蛋白质,占分离到的总蛋白的86.36%。
利用qRT-PCR分析comA及spo0A的相对表达量(comA及spo0A为与芬荠素合成相关的基因),结果如图3所示,comA和spo0A在FMB50中mRNA的表达量分别为其在淀粉液化芽孢杆菌CGMCC5569中表达量的15.8倍和12.1倍。其在转录水平的表达与蛋白水平一致。根据实验结果推测,在解淀粉芽孢杆菌中,comA和spo0A调控因子通过激活芬荠素合成酶基因fen从而对芬荠素合成起正调控作用(参见图4)。
本发明建立的双向电泳体系,对2-DE方法进行改进,分别对淀粉液化芽孢杆菌蛋白质样品的制备、上样量、染色方法、胶条pH以及2-DE参数的选择等关键步骤进行优化。其优化后条件如下:染色方法选择银染;胶条pH值为4-7;24cm胶条上样量为200μg。
同时,采用含7M尿素和2M硫脲的水化液,结合低电压脱盐的等电聚焦可以获得高分辨率、重复性好的蛋白质2-DE图谱。银染后经软件分析,在单张2-DE图谱上可以检测1000以上蛋白点。
本发明利用比较蛋白质组学的方法分析淀粉液化芽孢杆菌CGMCC5569与淀粉液化芽孢杆菌FMB50的蛋白质表达差异。以上述实验为基础,研究了基因FMB50的可溶性全蛋白2-DE图谱的变化,并对差异表达的蛋白点进行质谱分析。2-DE图谱分析结果表明:在FMB50中,凝胶银染后经软件匹配,对其中丰度变化在2倍以上的50个差异蛋白点进行MALDI-TOF-MS分析,有44个蛋白点得到有效地鉴定。其中有ComA及Spo0A 2种调控因子与芬荠素合成相关。
本发明对所鉴定的蛋白质通过COG直系同源簇网站以及相关的文献报道对其功能进行了分类,发现这些蛋白质的功能涉及代谢、能量产生和转化、细胞分裂和染色体分配、翻译,核糖体结构和生物合成、DNA复制,重组和修复、细胞运动和分泌、翻译后修饰、一般功能预测等方面。其中明确定位的蛋白质有86.36%位于细胞质中。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- 还没有人留言评论。精彩留言会获得点赞!