植物亚细胞中总可溶性酚的分离提取方法与流程
本发明属于总可溶性酚的分离提取技术领域,涉及一种植物亚细胞中总可溶性酚的分离提取方法。
背景技术:
1980年,Weigel等人在《Plant Physiology》发表的一篇《Subcellular distribution and chemical form of cadmium in bean plants,1980,65(3):480-2》介绍了植物亚细胞的提取分离过程,分别测定了细胞壁、细胞器和细胞液中重金属含量;Ren等人在《Antimony uptake,translocation and speciation in rice plants exposed to antimonite and antimonate,2014,475C:83-89》一文中也描述了植物亚细胞的分离然及定量分析了各组分中重金属的含量。到目前为止,植物亚细胞的分离技术绝大多数都基于对重金属含量的测定。
文献记载,Folin-酚试剂是测定植物组织中总可溶性酚一种有效的方法。2005年Rodrigues等人在《Physiological&Molecular Plant Pathology》发表的《Silicon influences cytological and molecular events in compatible and incompatible rice-Magnaporthe grisea interactions,2005,66(4):144–159》介绍了一种新的测定总可溶性酚提取测定的方法。尽管对植物组织中总可溶性酚含量测定比较成熟,但这些方法都只停留在组织或者器官水平,没有进一步分离测定植物亚细胞中总可溶性酚含量的方法。
技术实现要素:
本发明提供一种植物亚细胞中总可溶性酚的分离提取方法,进而至少在一定程度上克服由于相关技术的限制和缺陷而导致的一个或者多个问题。
根据本发明的一个方面,提供一种植物亚细胞中总可溶性酚的分离提取方法,所述植物亚细胞中总可溶性酚的分离提取方法包括以下步骤:
步骤1,取新鲜水稻幼苗样品0.4g-0.6g在3mL-8mL的提取液中冰浴研磨成匀浆;
步骤2,将步骤1得到的匀浆倒入离心管中,在600r/min的条件下,4℃低温离心1min;将上清液a倒入一新的离心管中,沉淀物a在10000r/min的条件下,4℃低温离心10min;得到沉淀物b为细胞壁组分,上清液b留作备用;
步骤3,将上清液a和上清液b混合,得到上清液c,将上清液c在10000r/min的条件下,4℃低温离心30min,得到上清液d和沉淀物d;其中,上清液d为细胞液中的总可溶性酚,沉淀物d为细胞器组分;
步骤4,在沉淀物b和沉淀物d中分别加入3mL-8mL80%甲醇,在2000r/min-3000r/min的条件下,旋涡1min-2min,混匀;然后再在10000r/min的条件下,4℃低温离心5min,倒掉上清液分别得到沉淀物e和沉淀物f;
步骤5,在沉淀物e和沉淀物f中分别加入3mL-8mL80%甲醇,在2000r/min-3000r/min的条件下,旋涡1min-2min,混匀;然后在40KHZ的条件下,25℃超声处理25min-40min,再在100rmp-200rmp的条件下震荡10min-15min,最后在10000r/min的条件下,4℃低温离心15min,分别得到上清液g和上清液h,所述上清液g为细胞壁中的总可溶性酚,所述上清液h为细胞器中的总可溶性酚。
进一步的,步骤1中所述的提取液包括:0.25mM蔗糖、50mM Tris-HCl以及1mM二硫苏糖醇;所述提取液pH为7.5。
进一步的,在所述步骤4中,在沉淀物b和沉淀物d中分别加入5mL80%甲醇,在2000r/min-3000r/min的条件下,旋涡1min-2min,混匀。
本发明的一种植物亚细胞中总可溶性酚的分离提取方法,通过对新鲜水稻幼苗样品的一系列相关处理,最终得到总可溶性酚的样品,该方法是首次对植物组织进行亚细胞总可溶性酚分离提取,能稳定测量植物亚细胞总可溶性酚含量,取得了突出的进步。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1是地下部分亚细胞总可溶性酚含量。
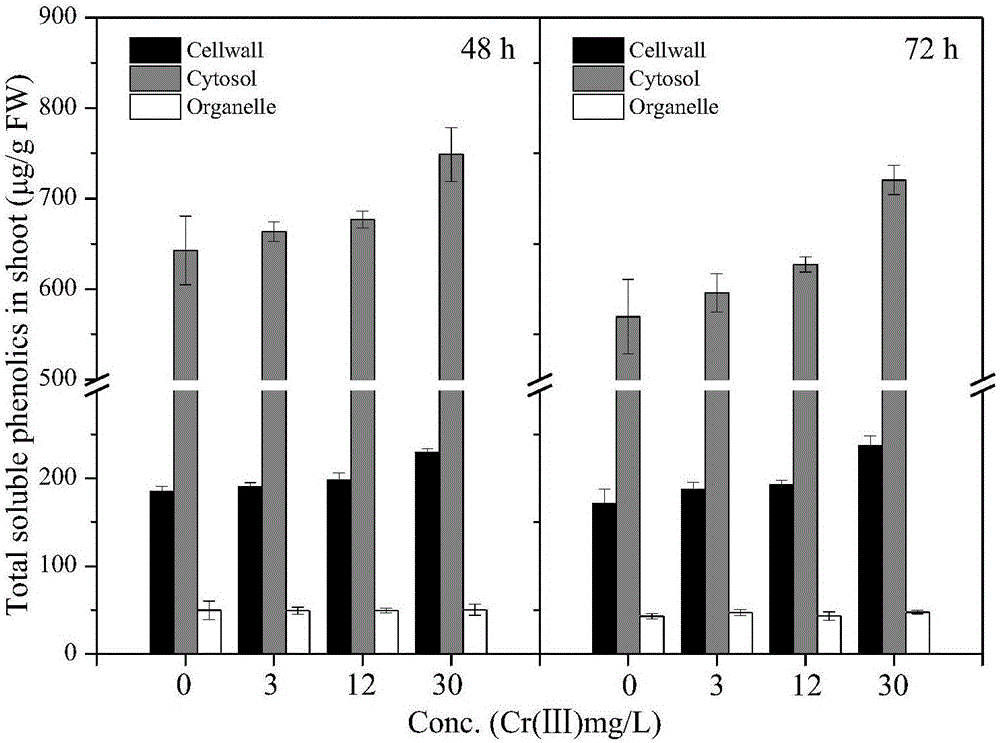
图2是地上部分亚细胞总可溶性酚含量。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1:
实验对象:湘早籼45号(湖南农业大学提供)
污染物质:九水硝酸铬(Cr(NO3)3·9H2O,Cr(III))(西陇化工股份有限公司)
培养条件:水稻种子浸泡24h后均匀摊撒在含有细沙的塑料杯中,放入光照培养箱,控制培养箱条件(温度25±0.5℃、湿度60±2%、光照强度7000lx),用改良霍格兰营养液浇灌。水稻培育14d后,挑选长势较好的水稻幼苗10株为一组,设置1组对照,3组实验组,每组4个平行样。用Cr(Ⅲ)进行处理,移植50mL三角瓶,用锡箔纸包好放入培养箱中,处理48h和72h。
实施例2:一种植物亚细胞中总可溶性酚的分离提取方法,包括以下步骤
步骤1,取新鲜水稻幼苗样品0.4g在3mL的0.25mM蔗糖、50mM Tris-HCl以及1mM二硫苏糖醇;所述提取液pH为7.5的提取液中冰浴研磨成匀浆;
步骤2,将步骤1得到的匀浆倒入离心管中,在600r/min的条件下,4℃低温离心1min;将上清液a倒入一新的离心管中,沉淀物a在10000r/min的条件下,4℃低温离心10min;得到沉淀物b为细胞壁组分,上清液b留作备用;
步骤3,将上清液a和上清液b混合,得到上清液c,将上清液c在10000r/min的条件下,4℃低温离心30min,得到上清液d和沉淀物d;其中,上清液d为细胞液中的总可溶性酚,沉淀物d为细胞器组分;
步骤4,在沉淀物b和沉淀物d中分别加入3mL80%甲醇,在2000r/min的条件下,旋涡1min,混匀;然后再在10000r/min的条件下,4℃低温离心5min,倒掉上清液分别得到沉淀物e和沉淀物f;
步骤5,在沉淀物e和沉淀物f中分别加入3mL80%甲醇,在2000r/min的条件下,旋涡1min,混匀;然后在40KHZ的条件下,25℃超声处理25min,再在100rmp的条件下震荡10min,最后在10000r/min的条件下,4℃低温离心15min,得到上清液g和上清液h,所述上清液g为细胞壁中的总可溶性酚,所述上清液h为细胞器中的总可溶性酚。
实施例3:一种植物亚细胞中总可溶性酚的分离提取方法,包括以下步骤
步骤1,取新鲜水稻幼苗样品0.5g在5mL的0.25mM蔗糖、50mM Tris-HCl以及1mM二硫苏糖醇;所述提取液pH为7.5的提取液中冰浴研磨成匀浆;
步骤2,将步骤1得到的匀浆倒入离心管中,在600r/min的条件下,4℃低温离心1min;将上清液a倒入一新的离心管中,沉淀物a在10000r/min的条件下,4℃低温离心10min;得到沉淀物b为细胞壁组分,上清液b留作备用;
步骤3,将上清液a和上清液b混合,得到上清液c,将上清液c在10000r/min的条件下,4℃低温离心30min,得到上清液d和沉淀物d;其中,上清液d为细胞液中的总可溶性酚,沉淀物d为细胞器组分;
步骤4,在沉淀物b和沉淀物d中分别加入5mL80%甲醇,在2500r/min的条件下,旋涡2min,混匀;然后再在10000r/min的条件下,4℃低温离心5min,倒掉上清液分别得到沉淀物e和沉淀物f;
步骤5,在沉淀物e和沉淀物f中分别加入5mL80%甲醇,在2500r/min的条件下,旋涡2min,混匀;然后在40KHZ的条件下,25℃超声处理35min,再在150rmp的条件下震荡12min,最后在10000r/min的条件下,4℃低温离心15min,得到上清液g和上清液h;所述上清液g为细胞壁中的总可溶性酚,所述上清液h为细胞器中的总可溶性酚。
实施例4,一种植物亚细胞中总可溶性酚的分离提取方法,包括以下步骤
步骤1,取新鲜水稻幼苗样品0.6g在8mL的0.25mM蔗糖、50mM Tris-HCl以及1mM二硫苏糖醇;所述提取液pH为7.5的提取液中冰浴研磨成匀浆;
步骤2,将步骤1得到的匀浆倒入离心管中,在600r/min的条件下,4℃低温离心1min;将上清液a倒入一新的离心管中,沉淀物a在10000r/min的条件下,4℃低温离心10min;得到沉淀物b为细胞壁组分,上清液b留作备用;
步骤3,将上清液a和上清液b混合,得到上清液c,将上清液c在10000r/min的条件下,4℃低温离心30min,得到上清液d和沉淀物d;其中,上清液d为细胞液中的总可溶性酚,沉淀物d为细胞器组分;
步骤4,在沉淀物b和沉淀物d中分别加入8mL80%甲醇,在3000r/min的条件下,旋涡2min,混匀;然后再在10000r/min的条件下,4℃低温离心5min,倒掉上清液分别得到沉淀物e和沉淀物f;
步骤5,在沉淀物e和沉淀物f中分别加入8mL80%甲醇,在3000r/min的条件下,旋涡2min,混匀;然后在40KHZ的条件下,25℃超声处理40min,再在200rmp的条件下震荡15min,最后在10000r/min的条件下,4℃低温离心15min,得到上清液g和上清液h;所述上清液g为细胞壁中的总可溶性酚,所述上清液h为细胞器中的总可溶性酚。
上述实施例2-实施例5中,选取0.25mM蔗糖、50mM Tris-HCI、1mM二硫苏糖醇;pH为7.5的提取液,其中,蔗糖是维持渗透压防止细胞器破裂,Tris-HCI是调节pH,二硫苏糖醇是一种很强还原剂保持细胞内物质稳定;该提取液的作用是尽量不破坏细胞器结构,保持细胞器成分的化学活性。
实施例6:亚细胞组分的分离
将研磨均匀的样品倒入10mL离心管中,在4℃条件下,以600g离心1min,用移液枪移出上清液倒入新离心管中,底部的沉淀物继续以10000g离心10min,离心后的沉淀物即为细胞壁组分;第二次离心的上清液与第一次离心的上清液混合后,以10000g离心30min,上清液即为细胞液组分,而沉淀物为细胞器组分。
实施例7:总可溶性酚测定
细胞液测定:取300μL上清液,加入300μL 1N Folin-酚试剂,摇匀,室温下静置5min,加400μL 1M Na2CO3,摇匀,静置10min,最后加入5mL超纯水,摇匀,室温(暗处)静置1h,在725nm处测OD值;
细胞壁和细胞器测定:取2mL上清液,加入300μL 1N Folin-酚试剂,摇匀,室温下静置5min,加400μL 1M Na2CO3,摇匀,静置10min,最后加入3.3mL超纯水,摇匀,室温(暗处)静置1h,在725nm处测OD值
实施例7:标准曲线
称取没食子酸标准品0.05g,超纯水定容至50mL,得1mg/mL储备液。吸取2.5mL用提取液定容至50mL得50μg/mL标准液1号,此标准液用于细胞液OD值校准;两外吸取2.5mL储备液用超纯水定容至50mL的50μg/mL标准液2号用于细胞壁和细胞器OD值校准。没食子酸标准曲线参考下表1所示。
表1没食子酸标准曲线
利用上述方法,测定水稻幼苗地上、地下部分48h和72h亚细胞总可溶性酚含量,分别参考图1和图2所示。
以上所述仅为本发明的较佳实施例而已,并非用于限定本发明的保护范围。凡在本发明的精神和原则之内所作的任何修改、等同替换、改进等,均包含在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!