快速且高敏感的细菌检测的制作方法
发明背景
发明领域
本发明涉及通过代谢监测的细菌检测,如细菌存活力和药物抗性,并且特别地,其涉及使用氧敏感性荧光材料的细菌检测和用于增强细菌和荧光材料共定位的方法。
背景技术:
使用微孔阵列和氧敏感性荧光膜的快速细菌检测技术描述于ayyashetal.,fastandinexpensivedetectionofbacterialviabilityanddrugresistancethroughmetabolicmonitoring,2014healthinnovationsandpoint-of-caretechnologiesconference(seattle,washingtonusa)october8-10,2014(“ayyashetal.2014”)。该技术中,包括细菌的孔内氧消耗导致荧光信号发射。该论文摘录呈现如下:
[我们介绍]创新的检测方法以通过小型化和并行化快速准确地诊断细菌感染。该方法用数种形状(正方形,圆形)、直径(100-1000μm)和深度(≤100μm)的孔加以证明。在概念证明的形成中,我们使用大肠杆菌的实验室菌株作为模型病原体。荧光氧传感器(三(2,2’-联吡啶)二氯化钌六水合物)(rtdp)的整合允许我们监视作为细菌代谢量度的溶解氧浓度。微孔内细菌的检测时间可以快至几个小时(4-5小时),其中浓度在102至108个细胞/ml之间变化。将合适的药物添加到肉汤中并通过荧光测量生长也探测药物抗性。本报告的用于孔微加工的方法是快速、经济、通用和简单的。(摘要)。
该方法中,将样品置于具有对感兴趣的特定细菌特异性的生长培养基的室中。该液体培养基为感兴趣的特定细菌的生长提供特定条件,同时防止其他污染物种生长。将在氧存在下淬灭的荧光团溶解在培养基中。由于细菌是需氧的,它们在代谢过程中消耗培养基中存在的氧,并消耗周围环境中的氧,产生荧光。可以通过将合适的药物添加到肉汤并通过荧光测量其生长或缺乏来探测药物抗性。(pp.22-23)。
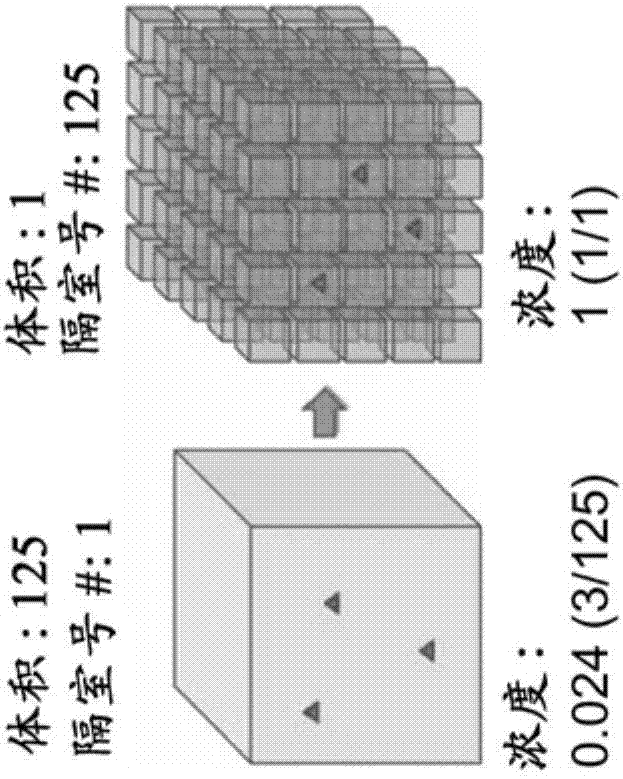
当在大体积下(1-10ml)完成该代谢监测时,它还花费长时间。然而如果将样品分割为数千个较小的体积,则一些孔将含有感兴趣的细菌,而其他孔将不含。分割过程会将细菌的局部浓度增加几个数量级。因此,存在于该小体积中的营养物质将被快速耗尽,并且可以更快地感测到该事件。这是我们对细菌的快速代谢监测后的工作原理。(p.23)。
实验设置和程序。在典型的实验中,将样品与含有生长培养基(luria-bertani(lb)培养基)和氧敏感性荧光团(三(2,2’-联吡啶)二氯化钌六水合物,(rtdp-0.1mg/ml)的溶液混合,并分配到微阵列上。简单的滑动过程将样品分配到亲水性微孔中,而疏水顶表面将样品从顶部清洁地除去(图1中的步骤4,5)。接下来,使用玻璃载玻片(使用表面活性剂变得疏水)将微阵列加盖并在荧光显微镜下成像以测量荧光团的强度。(p.23)。
ayyash等人2014的图1的一部分在本申请的图1中再现。本申请的图1a示意性地示出了ayyash等人2014描述的分割的示例,其增加细菌的局部浓度并且氧迅速耗尽。
发明概述
在ayyash等人2014描述的检测技术中,由于在细菌消耗氧的位置和荧光膜之间存在距离,因此氧消耗不会导致通过荧光膜的立即荧光信号发射。
本发明的实施方案提供了使用细菌和由氧淬灭的荧光材料的共定位的改善的、快速且高灵敏度的细菌检测方法。任选地,荧光材料对目标细菌具有亲和力。
本发明的一个目标在于改善细菌的周转时间(turnaroundtime)。其可实现以高灵敏度的快速检测。
本发明的附加特征和优点将在下面的描述中阐述,并且部分地将从描述中是明显的,或者可以通过本发明的实践来了解。本发明的目的和其他优点将通过书面说明书及其权利要求书以及附图中所特别指出的结构来实现和获得。
为了实现这些和/或其他目的,如体现并且广泛描述,本发明提供了用于检测活细菌的方法,其包括:提供由氧淬灭的荧光材料;在细菌培养室的区域中将所述荧光材料与所述细菌共定位;让所述细菌生长;并且检测由共定位的区域中的所述荧光材料发射的荧光信号。
荧光材料可以是荧光纳米颗粒或荧光膜,并且可以对细菌具有亲和力。可以使用离心、电泳、微流路径、磁场、3-d基质等实现共定位。
另一方面,本发明提供了可用于细菌检测的材料,所述材料包括由氧淬灭的荧光分子,并且还对目标细菌具有亲和力。
应当理解,上述一般描述和以下详细描述都是示例性和说明性的,并且旨在提供对所要求保护的本发明的进一步说明。
附图简述
图1和图1a示意性显示了使用微孔阵列和氧敏感性荧光膜的细菌检测方法。
图2示意性显示了根据本发明的实施方案的细菌检测原理。
图3a和图3b示意性显示了根据本发明实施方案的荧光纳米颗粒与细菌共定位的优点。
图4a至图4d示意性显示了用于实现或增强根据本发明实施方案的荧光纳米颗粒与细菌共定位的机制。
图5a至图5d示意性显示了用于实现或增强根据本发明实施方案的固定化的荧光纳米颗粒与目标细菌共定位的机制。
图6a示意性显示了具有金属核心的荧光纳米颗粒的结构。
图6b显示了通过使用具有金属核心的等离子体纳米颗粒的荧光信号增强。
图7a至7d示意性显示了可应用于图4a的实施方案的改进的离心装置。
发明详述
本发明的实施方案提供了细菌检测方法,其将细菌与包括由氧淬灭的荧光分子的荧光材料共定位。在一些实施方案中,所述荧光材料还对目标细菌或细胞具有亲和力。由于氧敏感性荧光材料和细菌间的距离接近,细菌的氧消耗立即导致来自荧光材料的荧光信号发射。因此,实现了快速且高敏感性的细菌检测。
图2示意性显示了根据本发明的实施方案的细菌检测原理。细菌检测方法使用包括由氧淬灭的荧光分子的荧光材料10。经由稍后更详细描述的共定位机制将荧光材料10与活细菌20共定位(步骤s1)。允许细菌20生长并消耗氧(步骤s2),这从相邻的荧光材料10中剥夺氧;结果,荧光材料发射荧光信号。检测来自共定位位置的荧光信号(步骤s3)。可以将ayyash等人2014中描述的用于检测荧光信号的设置用于步骤s3,或可以使用任何其他合适的设置。
在一些实施方案中,荧光材料是混合在含有目标细菌的样品中的荧光纳米颗粒。荧光纳米颗粒可以由核心形成,所述核心用由氧猝灭的荧光分子涂覆。在一些实施方案中,荧光纳米颗粒对目标细菌具有亲和力。将含有目标细菌和荧光材料的样品导入细菌培养室,如微孔或微流体装置。图3a和3b示意性显示了将荧光纳米颗粒与细菌共定位的优点。图3a示意性显示了微孔31,其中荧光膜11涂敷在其底部上(如ayyash等人2014所描述),和微孔中含有目标细菌20的样品。图3b显示了根据本发明的实施方案的围绕样品中细菌20的荧光纳米颗粒12。由于纳米颗粒12可以围绕细菌20,从纳米颗粒中氧剥夺的机会增加,并因此与使用荧光膜的情况相比,荧光信号增强(图3a)。
可以使用各种机制来增强荧光纳米颗粒12与目标细菌20的共定位,其中一些在下文参考图4a-4d描述。
第一种共定位方法使用离心(图4a)。将含有目标细菌20和荧光纳米颗粒12的样品置于细菌培养室32(如离心管)中并且在离心机中旋转(未示出)。结果,通过离心力将细菌20和荧光纳米颗粒12两者聚集在离心管的底部区域32a中,在那里它们彼此极其靠近(即共定位)。
第二种共定位方法在微流体装置33中使用电泳(图4b)。选择荧光纳米颗粒13以与目标细菌具有相似的电迁移率特性。将含有细菌20和纳米颗粒13的样品导入到微流体装置33中,在该处施加磁场。通过微流体装置的相同区域中的电场将细菌和纳米颗粒聚焦,在那里它们彼此极其靠近(即共定位)。
第三种共定位方法使用微流体装置,其中使用对细菌具有亲和力的捕捉材料3a(如抗体)修饰所述微流路径(图4c)。微流路径34可以是微流体装置的限定区段。本实施方案中的荧光纳米颗粒14也对细菌具有亲和力;例如,它们在其表面上可具有抗体。当含有目标细菌20和荧光纳米颗粒14的样品流过微流路径34时,细菌20被捕捉材料34a捕获在路径中。在细菌附近,荧光纳米颗粒14被微流路径34中的细菌20所捕获,使得荧光纳米颗粒与细菌彼此紧密接近(即共定位)。
第四种共定位方法使用还具有顺磁性的荧光纳米颗粒15(图4d)。本实施方案中的荧光纳米颗粒15还对细菌具有亲和力。将含有细菌20和荧光纳米颗粒15的样品置于细菌培养室35中,并且通过磁性纳米颗粒捕获细菌。通过磁性元件35a将磁场施加至细菌培养室35,并且通过磁力将磁性纳米颗粒15和细菌20聚集到细菌培养室的一端,使得磁性纳米颗粒和细菌彼此极其接近(即共定位)。
对于上文描述的第三种和第四种共定位方法(微流路径,图4c和磁力,图4d),需要荧光纳米颗粒对细菌具有亲和力。对于第一种和第二种共定位方法(离心,图4a,和电泳,图4b),荧光纳米颗粒和细菌间的亲和力不是需要的,但有助于提高共定位效果。使用对细菌具有亲和力的荧光纳米颗粒还稳定了荧光纳米颗粒和细菌的共定位。
上述共定位方法(图4a-图4d)可以彼此组合使用。
在一些其它实施方案中,氧敏感性荧光材料是细菌培养室或微流路径中固定化的荧光膜或其他材料,并且提供了机制以促进细菌和固定化荧光材料的共定位。以下参照图5a-图5d来描述一些示例。
第一种共定位方法使用离心(图5a)。将荧光膜16固定化在细菌培养室36(离心管)的底部区域中。将含有目标细菌20的样品置于离心管36中并且在离心机中旋转(未示出)。结果,通过离心力将细菌20聚集在离心管的底部区域中并且位于荧光膜16的极其接近处(即它们是共定位的)。
第二种共定位方法使用电泳(图5b)。将荧光膜17固定化在细菌培养室37的端壁上。将含有目标细菌20的样品置于细菌培养室37中并且施加电场,导致细菌朝着该端壁移动并聚集在那里,使得细菌位于荧光膜17的极其接近处(即它们是共定位的)。
第三种共定位方法使用微流体装置38,其中用荧光材料18修饰微流路径的侧表面(图5c)。微流路径的相同侧表面也用对细菌具有亲和力的材料38a(如抗体)修饰。当细菌20流过微流路径时,它们被抗体38a捕获于路径中,使得细菌位于荧光材料18的极其接近处(即它们是共定位的)。
第四种共定位方法使用在微流体装置的微流路径中具有3-d基质19的微流体装置39(图5(d))。3-d基质19由诸如羧基甲基葡聚糖等基础材料制成,所述基质用荧光材料涂层材料和对细菌具有亲和力的材料(如抗体)修饰。当细菌20流过基质19时,它们被抗体捕获在3-d基质中,使得细菌位于荧光材料18的极其接近处(即它们是共定位的)。
对于上文描述的第三种和第四种共定位方法,需要微流路径表面18和3-d基质19对细菌具有亲和力。对于第一种和第二种共定位方法(离心和电泳),对细菌具有亲和力的材料对于荧光膜16和17是不需要的,但有助于提高共定位效果。使用对细菌具有亲和力的荧光纳米颗粒还稳定了荧光纳米颗粒和细菌的共定位。
上文描述的共定位方法(图5a-图5d)可以彼此组合使用。
使用固定化的荧光材料的实施方案的另一个优点在于,由于将细菌聚集到固定有荧光材料的地方,因此不需要额外的荧光材料收集过程或机制。
所有上述共定位方法(图4a-图4d和图5a-图5d)实现了下述结果,即细菌和荧光纳米颗粒或固定化的荧光材料位于彼此的极其接近处,使得由细菌引起的氧剥夺对荧光材料的影响增强。荧光纳米颗粒或固定化的荧光材料中的荧光分子是那些由氧淬灭的分子。
在使用荧光纳米颗粒(图4a-图4d)和荧光膜(图5a-图5d)的实施方案中,可以使用金属增强荧光(mef)原理来进一步增强颗粒和膜的荧光信号。mef是指当荧光材料在金属附近时荧光信号的强度增加的现象。
在荧光纳米颗粒的情况下,图6a示意性显示了具有金属核心的荧光纳米颗粒40(称为等离子体纳米粒子)的结构。荧光纳米颗粒40由金属核心41、金属核心外部的间隔层42,和间隔层外部的荧光材料层43组成。用于金属核心41的金属可以是金、银或铝等。间隔层42可以由二氧化硅或其它合适的材料制成。荧光材料43是由氧淬灭的材料。优选地,使用(三(2,2’-联吡啶)二氯化钌六水合物)(rtdp,激发波长:460nm;发射波长:600nm)作为荧光材料,在这种情况下,银是mef的优选金属。如图6b所示,在500nm及以上的波长处,等离子体纳米颗粒的荧光信号可以是没有金属核心的纳米颗粒发射的荧光信号的30倍。等离子体纳米颗粒是已知的;它们已经描述于例如美国专利号8759110和d.brouardetal.,label-freebiosensingbasedonmultilayerfluorescentnanocompositesandacationicpolymerictransducer,acsnano,vol.5,no.3,1888-1896(2011)中。
在荧光膜或涂层材料的情况下(如图5a-图5d示出的实施方案中的那些)为了利用mef,膜可以由多层形成,所示层包括细菌培养室或3-d基质表面上的金属层、金属层上的间隔层、和间隔层上的荧光材料层。与上文对等离子体纳米颗粒提及的相同材料可用于这里的荧光膜的各种层。
图7a-图7d示意性显示了改进的离心设备,其可应用于图4a实施方案中以进一步增强细菌和荧光纳米颗粒的共定位。图7a显示了常规离心装置,其中离心管72相对于旋转轴71布置为锐角。图7a是侧视图,其中旋转轴在图纸的平面内。图7b-图7d以顶视图显示了替代离心装置的三个例子,其中旋转轴71与图纸平面垂直。在顶视图中,离心机容器72相对于旋转轴71在形状上是对称的。在图7b和图7d中,离心机容器72分别为管状或三角形,其分别具有两个或三个窄端,在那里可以将细菌和纳米颗粒浓缩成小体积。也可以使用其他具有窄端的合适形状。
在上述各种实施方案中,细菌培养室优选尽可能小以避免除荧光材料(荧光纳米颗粒或固定化的荧光材料)以外的材料捕获氧。
对于本领域技术人员显而易见的是,在不脱离本发明的精神或范围的情况下,可以在本发明的细菌检测方法和相关装置中进行各种修改和变化。因此,本发明旨在覆盖落入所附权利要求书及其等同方案的范围内的修改和变化。
- 还没有人留言评论。精彩留言会获得点赞!