一种用于高血压个体化用药基因ADRB1‑1165C>G检测的电化学传感器制备方法与流程
本发明涉及一种在临床上指导美托诺尔等高血压个体化用药的adrb11165c>g基因多态性检测的电化学传感器的制备方法及应用,尤其是基于金属有机框架包裹血红素的非标记型生物传感器,用于检测adrb11165c>g基因多态性,属于电化学检测领域。
背景技术:
在过去十年中,鉴定疾病特定基因的改变使得靶向治疗得到了迅猛发展。在高血压治疗中,通过使用美托洛尔及其类似药物靶向携带adrb1突变基因使其治疗效果得到了显著提高,具有更高功效和更少副作用的联合治疗的其它药物已处于临床试验中,因此,对患者常规地筛选是否携带有该基因的突变以确定他们是否可以受益于这种类型的治疗。adrb1是β1-肾上腺素能受体基因,已知其为高血压β受体阻滞剂的靶基因。adrb1体细胞突变,arg389gly(rs1801253,c.1165c>g)存在于68.6-80.5%的高血压中,arg389gly的高血压患者比携带纯合arg389arg的人群需要更大的剂量,因此,需要适用于该基因型检测的灵敏方法。
现有检测adrb1突变的方法依赖于dna测序和聚合酶链反应(pcr)等。dna测序昂贵的检测费用以及缓慢的检测周期(2-3周)使其不能作为临床常规检测手段。pcr容易受到来自生物样品复杂组分的干扰,同时需要样品的预处理和来自大体积样品的核酸纯化过程。因此,迫切需要一种更为准确并能够在血清或血液中直接检测adrb1突变的方法。近年来,电化学dna传感器这一万能的检测平台由于其灵敏度高,成本低廉,快速和检测样品量少等优势在生物标志物的检测方面得到了迅猛发展。
血红素是一种众所周知的天然金属卟啉化物,具有类似过氧化物酶样活性。然而,血红素作为催化剂常常面临催化活性低,在中性和碱性水性缓冲液中稳定性差等问题。为了突破这些瓶颈,发展作为血红素的支持基质以获得具有强催化活性和高稳定性的仿生催化剂是一种理想的方式。fe-mil-88nh2金属有机框架由于其高比表面积,可调孔径和暴露的活性位点,是一种新型的主体基质材料,可用于血红素的固载,发展具有高催化活性和长催化寿命的固态催化剂。一些研究者将血红素包裹在fe-mil-88nh2中构建电化学或化学发光传感器用于蛋白质的检测。
然而,到目前为止,fe-mil-88nh2金属有机框架包裹血红素构建电化学dna传感器很少有报道。
技术实现要素:
本发明的目的是提供一种用于高血压个体化用药基因adrb1-1165c>g检测的电化学传感器制备方法,用于通过使用pt/hemin@fe-mil-88nh2/cu2+作为信号扩增平台的超敏检测adrb1突变基因,铂纳米粒子、氯高铁血红素、cu2+的协同作用不仅能增加对h2o2的电催化活性,而且能提高捕获探针的有效固定,大大扩展了检测范围,同时验证了其临床实际应用的可行性。
为达到目的,本发明采用如下技术方案:
一种用于高血压个体化用药基因adrb1-1165c>g检测的电化学传感器制备方法,其特征是包括以下步骤:
(1)铂纳米粒子/血红素@金属有机框架/铜离子(pt/hemin@fe-mil-88nh2/cu2+)纳米复合材料的制备;
(2)使用pt/hemin@fe-mil-88nh2/cu2+作为纳米复合材料信号扩增平台,建立电化学dna生物传感器;
(3)应用步骤(2)得到的电化学dna生物传感器对基因adrb1-1165c>g进行检测。
本发明中,上述步骤(1)“铂纳米粒子/血红素@金属有机框架/铜离子(pt/hemin@fe-mil-88nh2/cu2+)纳米复合材料的制备;”,包括以下步骤:
(1.1)hemin@fe-mil-88nh2纳米复合材料的制备:
把0.187g的六水三氯化铁(fecl3•6h2o)、0.226g的血红素和0.126g的二氨基对苯二甲酸溶于15ml二甲基亚砜(dmf)中,混合溶液置于硅树脂中120℃油浴4h;然后加入3.45mmol抗坏血酸,加热15min;逐渐冷却至室温,离心,用二甲基亚砜、乙醇、去离子水依次清洗,离心后所得纳米材料沉淀物置于真空干燥箱中干燥过夜,得到金属有机框架包裹的血红素纳米复合材料hemin@fe-mil-88nh2/cu2+;
(1.2)pt/hemin@fe-mil-88nh2纳米复合材料的制备:
通过采用硼氢化钠还原的方法合成铂纳米粒子功能化的hemin@fe-mil-88nh2;首先,用1ml质量百分比浓度1%的氯铂酸(h2ptcl6)加入到1ml浓度为1mg/ml的hemin@fe-mil-88nh2溶液中,超声20min;然后把2ml浓度为0.1m的硼氢化钠(nabh4)溶液逐滴加入上述混合溶液中,400rpm搅拌30min;混合溶液离心,水洗三次,铂纳米粒子通过pt-n键连接结合于hemin@fe-mil-88nh2表面,得到pt/hemin@fe-mil-88nh2纳米复合材料;
(1.3)pt/hemin@fe-mil-88nh2/cu2+复合材料的制备:
首先,把1ml浓度为2mg/ml的pt/hemin@fe-mil-88nh2纳米复合材料溶液分散于10ml浓度为2mg/ml的硝酸铜(cu(no3)2)水溶液中,室温搅拌24h,使铜离子吸附于pt/hemin@fe-mil-88nh2纳米复合材料表面;所得杂合物离心,水洗3次以除去未结合的cu2+,得到pt/hemin@fe-mil-88nh2/cu2+纳米复合材料。
本发明中,上述步骤(2)“使用pt/hemin@fe-mil-88nh2/cu2+作为纳米复合材料信号扩增平台,建立电化学dna生物传感器”,其特征在于,括以下步骤:
(2.1)分别依次用0.3mm和0.05mm的氧化铝(al2o3)粉末将电极抛光成镜面,然后分别按超纯水、无水乙醇、超纯水的顺序超声电极各5min,室温干燥备用;
(2.2)将6ml浓度为2mg/ml的pt/hemin@fe-mil-88nh2/cu2+纳米复合材料溶液滴加在电极表面,室温干燥;
(2.3)将10ml浓度为1μm序列表中的seqidno:1所示dna片段捕获探针溶液滴加至电极表面,4℃孵育12h;
(2.4)用清洗缓冲液将孵育后的电极冲洗干净后,滴加6μl浓度为1.0mm己硫醇(ht)室温孵育30min,得到电化学dna生物传感器;其中,所述清洗缓冲液的组分组成:浓度为10mm的na2hpo4、浓度为2mm的kh2po4、浓度为37mm的nacl、浓度为2.7mm的kcl、其余是去离子水;ph为7.4。
本发明中,上述步骤(3)“应用电化学dna生物传感器对基因adrb1-1165c>g进行检测”,其特征在于包括以下步骤:
(3.1)用清洗缓冲液将孵育后的电极冲洗干净后将浓度依次从1fm、10fm、100fm、1pm、10pm的目标dna片段溶液(所述dna见序列表中的seqidno:2所示)滴加于同一批次构建的不同电极表面,37℃杂交2h;
(3.2)将孵育后的电极用清洗缓冲液冲洗干净后置于氮气中干燥;
(3.3)将电极置于7ml磷酸盐缓冲溶液中进行表征,待背景电流稳定之后,20μl,1.2moll-1的h2o2加入上述磷酸盐缓冲溶液中,在-0.7v电位下i–t曲线记录其电流值;其中,所述磷酸盐缓冲溶液的组分组成:浓度为0.1m的na2hpo4、浓度为0.1m的kh2po4、浓度为0.1m的kcl、其余是去离子水;
(3.4)根据所得峰电流与目标dna片段溶液(所述dna见序列表中的seqidno:2所示)浓度呈线性关系,绘制标准曲线。
有益效果:与现有技术相比,本发明突出的特点是:
(1)为了提高传感器的检测限,引入具有良好生物相容性的铂纳米粒子(ptnps)用于协同催化h2o2。由于铂/血红素@fe-mil-88nh2纳米复合材料大的表面积,高电导率和优异的吸附能力,其表面氨基官能化可用于cu2+吸附,可进一步促进过氧化氢的氧化还原。基于pt/hemin@fe-mil-88nh2/cu2+的协同效应,获得具有多重信号放大的;将铂纳米粒子,血红素,铜离子引入到电化学dna生物传感器的制备中,构建了具有多重级联催化信号放大性能的纳米复合材料用于传感界面修饰,不仅提高了生物分子的固载量,而且提高了电化学dna生物传感器的灵敏度和生物相容性;
(2)本方法对adrb1基因进行检测,不需要对样品核酸进行标记及pcr放大处理;
(3)本方法制备的电化学dna生物传感器可为临床根据不同病人基因型调整美托洛尔用药剂量;
(4)使用完全相同的纳米材料和修饰方法,利用捕获探针,信号探针与目标dna的特异性识别,只需通过改变探针的核酸序列即可实现多种疾病(如肿瘤)个体化用药基因的特异性,高灵敏检测,另外,此方法简便,快速,便于实现商品化,从而推进转化医学的发展。
附图说明
图1为本发明的电化学dna生物传感器的构建示意图。
图2为本发明的pt/hemin@fe-mil-88nh2纳米复合材料的场发射扫描电镜图、能量衍射光电子光谱图及x射线光电子能谱分析图。
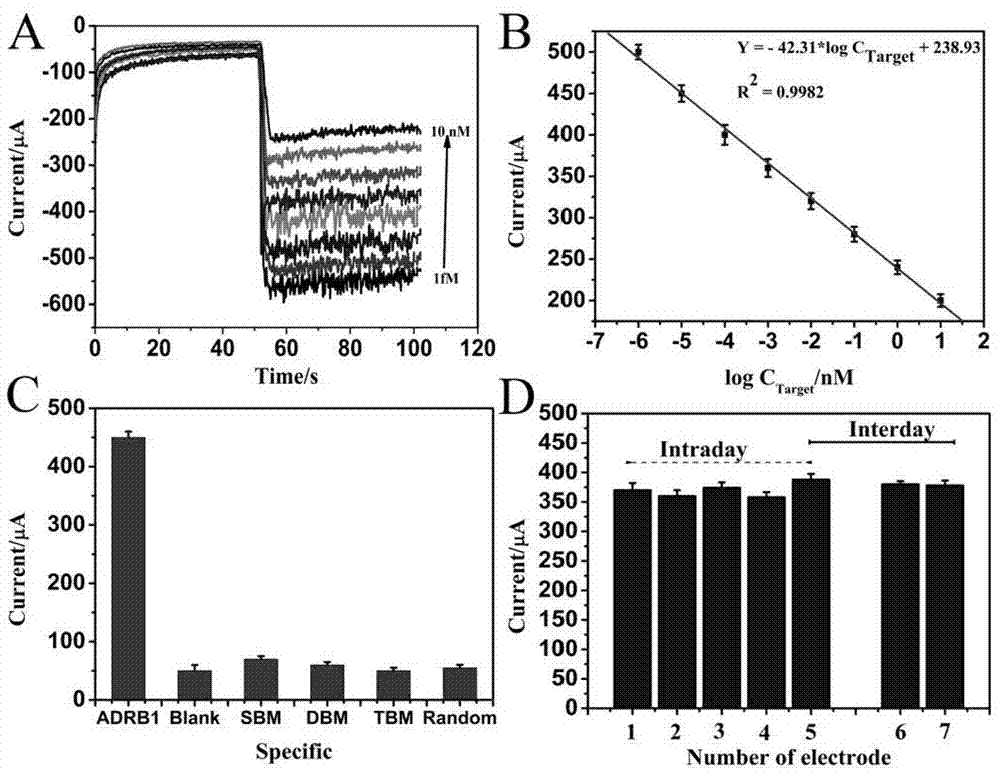
图3为本发明的电化学dna生物传感器在检测adrb1-1165c>g基因多态性时得到的i-t曲线与浓度的线性关系,以及传感器的特异性与重现性。
具体实施方式
下面结合具体实施例对本发明进行进一步阐述,应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
实施例1
结合图1所示,进一步描述本发明的实施方式如下:
步骤1.0.187g的六水三氯化铁(fecl3•6h2o)、0.226g的血红素和0.126g的二氨基对苯二甲酸溶于15ml二甲基亚砜(dmf)中,混合溶液置于硅树脂中120℃油浴4h;然后3.45mmol抗坏血酸加入上述溶液中,加热15min;逐渐冷却至室温,离心,dmf、乙醇、去离子水依次清洗,沉淀物置于真空干燥箱中干燥过夜,得到金属有机框架包裹的血红素(hemin@fe-mil-88nh2)纳米复合材料;
步骤2.在合成好1ml的hemin@fe-mil-88nh2(1mg/ml)溶液中加入1ml质量百分比浓度为1%的氯铂酸(h2ptcl6),剧烈超声20min;然后把2ml浓度为0.1m硼氢化钠(nabh4)溶液逐滴加入上述混合溶液中,400rpm搅拌30min;混合溶液离心,水洗三次,铂纳米粒子可通过pt-n键连接结合于hemin@fe-mil-88nh2表面,得到铂纳米粒子功能化的hemin@fe-mil-88nh2(pt/hemin@fe-mil-88nh2);
步骤3.将1ml,2mg/mlpt/hemin@fe-mil-88nh2分散于10ml,2mg/mlcu(no3)2水溶液中,室温搅拌24h,使铜离子吸附于pt/hemin@fe-mil-88nh2表面;所得杂合物离心,水洗多次,得到pt/hemin@fe-mil-88nh2/cu2+纳米复合材料;
从图2a、2bpt/hemin@fe-mil-88nh2的场发射扫描电镜图可见许多亮点样结构分布于hemin@fe-mil-88nh2表面,此为铂纳米粒子,表明铂纳米粒子已成功修饰于hemin@fe-mil-88nh2表面;图2c为pt/hemin@fe-mil-88nh2的能量衍射光电子光谱图,从图可见除了c、n、o、fe元素峰以外明显可见pt元素峰,同样表明铂纳米粒子已成功修饰成功于hemin@fe-mil-88nh2的表面;图2d、2e、2e为pt/hemin@fe-mil-88nh2的x射线光电子能谱分析图,从图可见pt4f、c1s、n1s、o1s和fe2p特征峰,进一步说明pt/hemin@fe-mil-88nh2已成功合成;
步骤4.分别用0.3mm和0.05mm的氧化铝(al2o3)粉末将电极抛光成镜面,然后分别按超纯水、无水乙醇、超纯水的顺序超声电极各5min,室温干燥备用;
步骤5.将6ml浓度为2mg/mlpt/hemin@fe-mil-88nh2/cu2+滴加在电极表面,室温干燥;
步骤6.将10ml浓度为1μm序列表中的seqidno:1所示dna片段捕获探针溶液滴加至电极表面,4℃孵育12h;
步骤7.用清洗缓冲液将孵育后的电极冲洗干净后滴加6μl浓度为1.0mm己硫醇(ht)室温孵育30min,得到电化学dna生物传感器;其中,所述清洗缓冲液的组分组成:浓度为10mm的na2hpo4、浓度为2mm的kh2po4、浓度为37mm的nacl、浓度为2.7mm的kcl、其余是去离子水;ph为7.4;
步骤8.将本发明上述传感器于4℃保存,间断检测传感器电流响应,储存28天后电流响应仍为初始电流的91.17%,表面传感器具有良好的稳定性;本发明取同一批次制备的dna生物传感器5支,在相同条件下对0.1、10、和1000fm的adrb1-1165c>g基因dna片段分别进行测定,每一浓度测定5次,结果响应电流的相对标准偏差少于4.11%;同时,取不同批次制备的dna生物传感器3支,在相同条件下对0.1、10、和1000fm的adrb1-1165c>g基因dna片段分别进行测定,每一浓度测定5次,结果响应电流的相对标准偏差少于4.33%,说明传感器批内及批间差异小,传感器重现性良好;
步骤9.用清洗缓冲液将孵育后的电极冲洗干净后将不同浓度(浓度依次为1fm、10fm、100fm、1pm、10pm)的目标dna片段溶液(所述dna片段见序列表中的seqidno:2所示)滴加于电极表面,37℃杂交2h;
步骤10将孵育后的电极用清洗缓冲液冲洗干净后置于氮气中干燥;
步骤11.将电极置于7ml磷酸盐缓冲溶液中进行表征,待背景电流稳定之后,加入20μl浓度为1.2mol/l的h2o2加入上述磷酸盐缓冲溶液中,在0.7v电位下i–t曲线记录其电流值;其中,所述磷酸盐缓冲溶液的组分组成:浓度为0.1m的na2hpo4、浓度为0.1m的kh2po4、浓度为0.1m的kcl、其余是去离子水;
步骤12.根据所得峰电流与adrb1-1165c>g基因的dna片段溶液(所述dna见序列表中的seqidno:2所示)浓度呈线性关系,绘制工作曲线;测定结果表明adrb1-1165c>g基因dna片段浓度在1fm-10nm范围内成线性关系,线性相关系数为0.998,检测限位0.33fm;
步骤13.将本发明上述传感器用于检测目标核酸序列(序列表中的seqidno:2所示)、错配碱基(序列表中的seqidno:3、4、5所示)及随机序列(序列表中的seqidno:6所示),结果错配碱基电流响应相对于目标核酸序列显得微不足道,说明传感器的特异性好,可以很好区分目标序列且可排除空白血浆基质干扰;
从图3a可见传感器的电流响应值随着待测目标基因浓度的增加而减小,且具有良好的线性相关性(图3b);从3c可见传感器对adrb1-1165c>g目标基因(adrb1)进行检测时,电流响应值远远大于单碱基错配(sbm)、双碱基错配(dbm)、三碱基错配(tbm)、随机序列(random)以及空白血浆(blank),说明传感器的选择性良好;从图3d可见,传感器批内(intraday)、批间(interday)差异很小,说明传感器的重现性佳,可以很好用于目标物质分析。
从图3可以看出,以传感器对空白血浆的测量电流响i0应值为基线,然后采用传感器对含有基因片段的待测血浆进行检测;若待测血浆中含有adrb1-1165c>g目标dna片段,则传感器的电流响应值i1会较空白血浆的电流响应值i0明显升高,且i0和i1两则电流响应值间会存在明显统计学差异;若待测血浆中不含有adrb1-1165c>g目标序列(此时可能是单碱基错配、双碱基错配、三碱基错配,随机序列或血浆中其他物质),则传感器的电流响应值i1会与空白血浆的电流响应值i0无明显变化,且i0和i1两则电流响应值间不存在统计学差异。电化学传感器测量结果直观如图3c所示,即adrb1-1165c>g患者比未突变人群需要更大的剂量。
以上所述仅是本发明的优选实施方式,应当指出的是,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提条件下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
本发明中,所述的浓度符号代表的含义如下:
m:mol/l(摩尔/升);
mm:mmol/l(毫摩尔/升);
μm:μmol/l(微摩尔/升);
nm:nmol/l(纳摩尔/升);
fm:fmol/l(飞摩尔/升);
pm:pmol/l(皮摩尔/升)。
序列表
<110>十堰市太和医院
<120>一种用于高血压个体化用药基因adrb1-1165c>g检测的电化学传感器制备方法
<160>6
<210>1
<211>12
<212>dna
<213>人工序列
<220>
<223>根据大小和极性而设计,以用作与生物素结合作为捕获探针
<400>1
gaagtggcagca12
<210>2
<211>30
<212>dna
<213>人工序列
<220>
<223>根据大小和极性而设计,以用作靶基因序列
<400>2
tgctgccacttcgtcaccaaccgggcctac30
<210>3
<211>30
<212>dna
<213>人工序列
<220>
<223>根据大小和极性而设计,以用作随机序列
<400>3
catccatcgtatgtcaccaaccgggcctac30
<210>4
<211>30
<212>dna
<213>人工序列
<220>
<223>根据大小和极性而设计,以用作与靶基因相对应的单碱基错配序列
<400>4
tgctgcgacttcgtcaccaaccgggcctac30
<210>5
<211>30
<212>dna
<213>人工序列
<220>
<223>根据大小和极性而设计,以用作与靶基因相对应的双碱基错配序列
<400>5
tcctgcgacttcgtcaccaaccgggcctac30
<210>6
<211>30
<212>dna
<213>人工序列
<220>
<223>根据大小和极性而设计,以用作与靶基因相对应的三碱基错配序列
<400>6
tcctgcgacttggtcaccaaccgggcctac30
- 还没有人留言评论。精彩留言会获得点赞!