一种测定复方氨基酸注射液中半胱氨酸含量的方法与流程
本发明涉及医药检测
技术领域:
,具体涉及一种测定复方氨基酸注射液中半胱氨酸含量的方法。
背景技术:
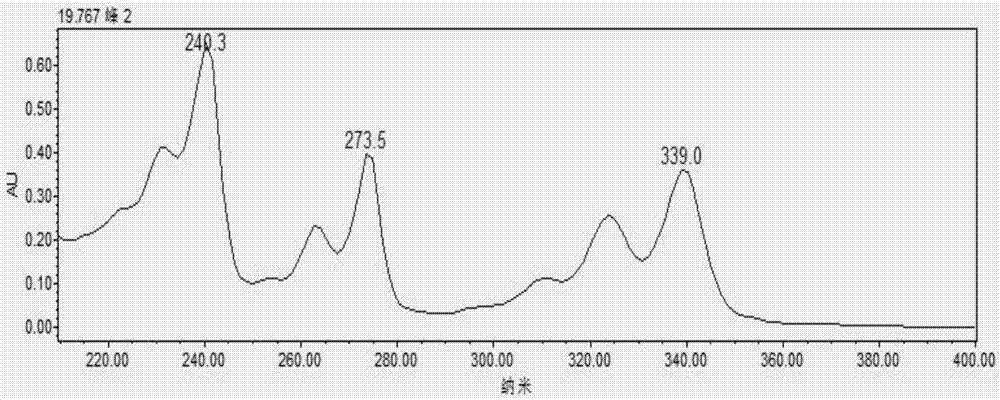
:目前国家已经批准的复方氨基酸注射液有十几个品种,如18aa、18aa-i、18aa-ii、18aa-iv、18aa-v等。合成蛋白质的20种氨基酸中,半胱氨酸最不稳定,极易被氧化成不溶于水的胱氨酸等物质。因此,在复方氨基酸注射液中,半胱氨酸的含量是否符合规定直接反映产品质量和工艺水平。现有技术中有报道采用比色法测定半胱氨酸的含量,具体是利用显色剂与半胱氨基酸在一定ph值条件下进行显色反应,并利用uv法进行检测;但是比色法的专属性较差,显色剂与其它氨基酸在相应ph值条件下也有不同程度的显色,干扰测定结果。现有技术中还有报道采用强氧化剂将半胱氨酸氧化成胱氨酸,然后采用茚三酮柱后衍生-氨基酸分析仪进行测定;但是该方法氧化半胱氨酸的条件剧烈、不易控制,且氨基酸分析仪的灵敏度较低,要求有较高浓度的半胱氨酸,不适用于复方氨基酸注射液中半胱氨酸含量的测定。近年来,高效液相色谱法广泛应用于氨基酸分析,但通常需要对氨基酸进行衍生以提高检测灵敏度。现有技术中有报道将碘乙酸-邻苯二甲醛、碘乙酸-pico·tag以及n-乙基顺丁烯二酰亚胺作为衍生剂对半胱氨酸进行衍生,但是存在衍生步骤多、其它氨基酸干扰的问题,不能准确测定复方氨基酸注射液中半胱氨酸的含量。技术实现要素:本发明的目的在于提供一种测定复方氨基酸注射液中半胱氨酸含量的方法,该方法专属性好、精密度好、回收率较高。本发明提供了一种测定复方氨基酸注射液中半胱氨酸含量的方法,包括以下步骤:(1)配制半胱氨酸水溶液,作为对照品溶液;将复方氨基酸注射液作为供试品溶液;采用n-(1-芘)马来酰亚胺对所述对照品溶液和供试品溶液中半胱氨酸进行衍生;(2)将所述步骤(1)得到的衍生后的对照品溶液和供试品溶液进行高效液相色谱分析,根据衍生后的对照品溶液和供试品溶液的液相色谱图,采用外标法得到复方氨基酸注射液中半胱氨酸的含量。优选的,所述步骤(1)中衍生时半胱氨酸与n-(1-芘)马来酰亚胺的摩尔比为1:(1~3)。优选的,所述步骤(1)中n-(1-芘)马来酰亚胺以n-(1-芘)马来酰亚胺乙腈溶液的形式使用。优选的,所述n-(1-芘)马来酰亚胺乙腈溶液的质量浓度为0.15~0.25mg/ml。优选的,所述步骤(1)中衍生的温度为15~25℃。优选的,所述步骤(1)中衍生的时间为15~25min。优选的,所述步骤(2)中高效液相色谱分析采用pda检测器。优选的,所述步骤(2)中高效液相色谱分析的检测波长为274nm。优选的,所述步骤(2)中高效液相色谱分析采用十八烷基硅烷键合硅胶色谱柱。优选的,所述步骤(2)中高效液相色谱分析的柱温为30~40℃。本发明提供了一种测定复方氨基酸注射液中半胱氨酸含量的方法,配制半胱氨酸水溶液,作为对照品溶液;将复方氨基酸注射液作为供试品溶液;采用n-(1-芘)马来酰亚胺对所述对照品溶液和供试品溶液中半胱氨酸进行衍生;将得到的衍生后的对照品溶液和供试品溶液进行高效液相色谱分析,根据衍生后的对照品溶液和供试品溶液的液相色谱图,采用外标法得到复方氨基酸注射液中半胱氨酸的含量。采用本发明提供的方法能够实现复方氨基酸注射液中半胱氨酸含量的准确测定,且专属性好、精密度好、回收率较高,能够通过半胱氨酸含量变化,间接反映复方氨基酸注射液中其它氨基酸降解情况,有效控制复方氨基酸注射液产品的质量。附图说明图1为半胱氨酸衍生物的紫外吸收光谱图;图2为n-(1-芘)马来酰亚胺的紫外吸收光谱图;图3为实施例1中阴性对照溶液的液相色谱图;图4为实施例1中供试品溶液的液相色谱图;图5为实施例2中阴性对照溶液的液相色谱图;图6为实施例2中供试品溶液的液相色谱图;图7为实施例3中阴性对照溶液的液相色谱图;图8为实施例3中供试品溶液的液相色谱图。具体实施方式本发明提供了一种测定复方氨基酸注射液中半胱氨酸含量的方法,包括以下步骤:(1)配制半胱氨酸水溶液,作为对照品溶液;将复方氨基酸注射液作为供试品溶液;采用n-(1-芘)马来酰亚胺对所述对照品溶液和供试品溶液中半胱氨酸进行衍生;(2)将所述步骤(1)得到的衍生后的对照品溶液和供试品溶液进行高效液相色谱分析,根据衍生后的对照品溶液和供试品溶液的液相色谱图,采用外标法得到复方氨基酸注射液中半胱氨酸的含量。本发明配制半胱氨酸水溶液,作为对照品溶液。本发明对于所述对照品溶液的浓度没有特殊的限定,采用本领域技术人员熟知的与供试品溶液中半胱氨酸相匹配的浓度即可。本发明对于配制所述对照品溶液溶液的方法没有特殊的限定,采用本领域技术人员熟知的配制溶液的技术方案即可。本发明将复方氨基酸注射液作为供试品溶液。本发明对于所述复方氨基酸注射液的种类没有特殊的限定,采用本领域技术人员熟知的含有半胱氨酸的复方氨基酸注射液即可,具体品种如18aa-v、18aa-ⅶ或18aa-ix。本发明采用n-(1-芘)马来酰亚胺对所述对照品溶液和供试品溶液中半胱氨酸进行衍生。n-(1-芘)马来酰亚胺结构稳定、不易降解,本发明采用n-(1-芘)马来酰亚胺为衍生剂,对半胱氨酸进行衍生后得到的半胱氨酸衍生物在紫外区有很强的吸收,可以屏蔽复方氨基酸注射液中其它氨基酸的干扰,实现复方氨基酸注射液中半胱氨酸含量的准确测定。在本发明中,所述n-(1-芘)马来酰亚胺与半胱氨酸的反应式如下:在本发明中,衍生时所述半胱氨酸与n-(1-芘)马来酰亚胺的摩尔比优选为1:(1~3),具体可为1:1、1:2或1:3。在本发明中,所述n-(1-芘)马来酰亚胺优选以n-(1-芘)马来酰亚胺乙腈溶液的形式使用。在本发明中,所述n-(1-芘)马来酰亚胺乙腈溶液的质量浓度优选为0.15~0.25mg/ml,更优选为0.18~0.22mg/ml,最优选为0.20mg/ml。在本发明中,n-(1-芘)马来酰亚胺对半胱氨酸进行衍生时反应体系的ph值优选为5.6~6.4。本发明在对所述半胱氨酸进行衍生时,优选根据所述复方氨基酸注射液的ph值以及所含总氨基酸浓度对所述复方氨基酸注射液进行稀释。这样一方面符合衍生时反应体系的ph值要求,另一方面在进行后续高效液相色谱分析时,不会导致色谱柱超载或对高效液相色谱设备产生不良影响。在本发明的实施例中,在对复方氨基酸注射液18aa-v、18aa-ⅶ或18aa-ix中半胱氨酸含量进行测定时,具体是将所述复方氨基酸注射液稀释5倍,然后与n-(1-芘)马来酰亚胺乙腈溶液混合,进行衍生反应。在本发明中,所述衍生的温度优选为15~25℃,更优选为18~22℃,最优选为20℃;所述衍生的时间优选为15~25min,更优选为18~22min,最优选为20min。完成所述衍生后,本发明将得到的衍生后的对照品溶液和供试品溶液进行高效液相色谱分析,根据衍生后的对照品溶液和供试品溶液的液相色谱图,采用外标法得到复方氨基酸注射液中半胱氨酸的含量。本发明对于所述高效液相色谱分析时采用的流动相以及洗脱方式没有特殊的限定,根据所测复方氨基酸注射液的种类,采用本领域技术人员熟知的流动相以及洗脱方式即可。具体的,在本发明中,以复方氨基酸注射液18aa-v为样品时,所述高效液相色谱分析优选采用以下梯度洗脱程序:时间(min)流动相a(%)流动相b(%)09010184060251090331090349010409010其中,流动相a为0.01mol/l的磷酸二氢钠溶液,所述流动相a的ph值为2.4~3.4;流动相b为乙腈。在本发明中,所述流动相a的ph值优选为2.4~3.4,更优选为2.8±0.1。本发明优选采用磷酸调节所述流动相a的ph值;所述磷酸的质量百分浓度优选为8~12%,更优选为10%。具体的,在本发明中,以复方氨基酸注射液18aa-ⅶ为样品时,所述高效液相色谱分析优选采用以下梯度洗脱程序:时间(min)流动相a(%)流动相b(%)0901084060181090241090259010其中,流动相a为0.015mol/l的醋酸钠溶液,所述流动相a的ph值为2.8±0.1;流动相b为乙腈。本发明优选采用磷酸调节所述流动相a的ph值;所述磷酸的质量百分浓度优选为8~12%,更优选为10%。具体的,在本发明中,以复方氨基酸注射液18aa-ix为样品时,所述高效液相色谱分析优选采用以下梯度洗脱程序:时间(min)流动相a(%)流动相b(%)0901084060181090241090259010309010其中,流动相a为0.01mol/l的磷酸二氢钠溶液,所述流动相a的ph值为2.8±0.1;流动相b为乙腈。本发明优选采用磷酸调节所述流动相a的ph值;所述磷酸的质量百分浓度优选为8~12%,更优选为10%。在本发明中,所述流动相的流速优选为0.8~1.2ml/min,更优选为1.0ml/min。在本发明中,所述高效液相色谱分析优选采用pda检测器。在本发明中,所述高效液相色谱分析的检测波长优选为274nm。本发明采用pda检测器对半胱氨酸衍生物和n-(1-芘)马来酰亚胺进行检测,得到半胱氨酸衍生物和n-(1-芘)马来酰亚胺的紫外吸收光谱图,见图1和图2。由图1和图2可知,半胱氨酸衍生物和n-(1-芘)马来酰亚胺的紫外吸收光谱相似,在波长为274nm处均有较大的吸收峰,且在该波长下大部分氨基酸不出峰,避免了其它氨基酸的干扰。在本发明中,所述高效液相色谱分析优选采用十八烷基硅烷键合硅胶色谱柱。在本发明中,所述高效液相色谱分析的柱温优选为30~40℃,更优选为33~37℃,最优选为35℃。在本发明中,所述高效液相色谱分析的进样量优选为10μl。经所述高效液相色谱分析得到衍生后的对照品溶液和供试品溶液的液相色谱图,本发明采用外标法得到复方氨基酸注射液中半胱氨酸的含量。在实际应用时,可以根据需要,通过半胱氨酸的含量折算出盐酸半胱氨酸的含量,实现复方氨基酸注射液中盐酸半胱氨酸含量的测定。下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例1测定复方氨基酸注射液18aa-v中盐酸半胱氨酸的含量(1)以湖北一半天制药有限公司制备的复方氨基酸18aa-v注射液为样品,测定复方氨基酸注射液18aa-v中盐酸半胱氨酸含量的方法,包括以下步骤:(11)精密称取半胱氨酸,与水混合,配制0.06mg/ml的半胱氨酸水溶液,作为对照品溶液;按照复方氨基酸注射液18aa-v的配方配制复方氨基酸注射液,用水稀释5倍,作为供试品溶液;将n-(1-芘)马来酰亚胺与乙腈混合,得到质量浓度为0.2mg/ml的n-(1-芘)马来酰亚胺乙腈溶液,作为衍生剂溶液;(12)分别将所述步骤(11)中0.5ml对照品溶液和0.5ml供试品溶液与1ml衍生剂溶液混合,20℃条件下衍生20min;(13)将所述步骤(12)得到的衍生后的对照品溶液和供试品溶液进行高效液相色谱分析,根据衍生后的对照品溶液和供试品溶液的液相色谱图,采用外标法得到衍生后的供试品溶液中半胱氨酸的含量,进而得到复方氨基酸注射液18aa-v中半胱氨酸的含量;通过半胱氨酸的含量折算出盐酸半胱氨酸的含量,得到复方氨基酸注射液18aa-v中盐酸半胱氨酸的含量;其中,所述高效液相色谱分析的条件具体如下:梯度洗脱程序:其中,流动相a为0.01mol/l的磷酸二氢钠溶液,所述流动相a的ph值为2.8±0.1;流动相b为乙腈;流动相的流速为1.0ml/min;采用pda检测器,检测波长为274nm;采用十八烷基硅烷键合硅胶色谱柱,柱温为35℃;进样量为10μl。(2)方法专属性试验按照复方氨基酸注射液18aa-v的配方,配制不含半胱氨酸的混合溶液,用水稀释5倍,作为阴性对照溶液;按照复方氨基酸注射液18aa-v的配方配制复方氨基酸注射液,用水稀释5倍,作为供试品溶液;将所述阴性对照溶液和供试品溶液按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,结果见图3和图4。图3为阴性对照溶液的液相色谱图,图中a为12.153min处杂峰,2为n-(1-芘)马来酰亚胺;图4为供试品溶液的液相色谱图,图中1为半胱氨酸衍生物,2为n-(1-芘)马来酰亚胺。由图3和图4可知,阴性对照溶液在半胱氨酸衍生物的保留时间处无色谱峰,且12.153min处杂峰对半胱氨酸测定无干扰;衍生后未反应的n-(1-芘)马来酰亚胺也不会干扰半胱氨酸的测定。通过pda检测器对供试品溶液中半胱氨酸衍生物的色谱峰纯度进行检测,结果见表1。由表1可知,半胱氨酸衍生物的色谱峰为单一纯色谱峰,方法专属性好。表1供试品溶液中半胱氨酸衍生物的色谱峰纯度检测结果(3)线性试验按照复方氨基酸注射液18aa-v的配方,配制不含半胱氨酸的混合溶液,用水稀释5倍,作为阴性对照溶液;精密称取半胱氨酸74.2mg,与500ml所述阴性对照溶液混合,得到半胱氨酸标准溶液;分别精密量取半胱氨酸标准溶液并加水稀释,得到质量浓度分别为10.2μg/ml、30.7μg/ml、61.4μg/ml、71.6μg/ml和102.3μg/ml的半胱氨酸标准溶液;将得到的不同稀释浓度的半胱氨酸标准溶液按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,以半胱氨酸衍生物的峰面积为纵坐标,半胱氨酸的浓度为横坐标,峰面积对浓度作线性方程,得到半胱氨酸的标准曲线;所述半胱氨酸的标准曲线方程、相关系数和线性范围具体见表2。由表2可知,半胱氨酸在10.2~102.3μg/ml范围内线性良好,相关系数r2为0.9995。表2半胱氨酸的标准曲线方程、相关系数和线性范围表2中,x为半胱氨酸的质量浓度,y对应半胱氨酸衍生物的液相色谱图峰面积。(4)加标回收率试验精密称取半胱氨酸,与水混合,配制0.060mg/ml的半胱氨酸水溶液,作为对照品溶液;按照复方氨基酸注射液18aa-v的配方配制复方氨基酸注射液,用水稀释5倍,作为供试品溶液;分别精密称取半胱氨酸,与所述供试品溶液混合,配制半胱氨酸质量浓度分别为0.048mg/ml、0.060mg/ml和0.072mg/ml的混合溶液(半胱氨酸浓度分别为测定浓度0.060mg/ml的80%、100%和120%)各三份,作为加标回收试验溶液;将所述对照品溶液和加标回收试验溶液按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,按外标法计算,并通过半胱氨酸的含量折算出盐酸半胱氨酸的含量,即得盐酸半胱氨酸的回收率,结果见表3。由表3可知,盐酸半胱氨酸的回收率在97.51%~101.78%之间,平均回收率为100.2%,rsd(%)为1.4(n=9),说明测定结果准确。表3加标回收率试验结果(5)重复性试验和中间精密度试验重复性试验以湖北一半天制药有限公司制备的产品批号为20150101的复方氨基酸注射液18aa-v为样品,用水将所述复方氨基酸注射液18aa-v稀释5倍,作为供试品溶液;精密称取半胱氨酸,与水混合,配制0.06mg/ml的半胱氨酸水溶液,作为对照品溶液;将所述供试品溶液和对照品溶液按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,按外标法计算,并通过半胱氨酸的含量折算出盐酸半胱氨酸的含量,连续实验6次,比较各次半胱氨酸衍生物的峰面积和盐酸半胱氨酸的标示含量,计算rsd(%),结果见表4。表4重复性试验结果重复性试验半胱氨酸衍生物峰面积盐酸半胱氨酸的标示含量(%)1322411090.162322312590.143316877388.624330823492.525326407891.286321625089.95rsd(%)1.461.46中间精密度试验试验员a和实验员b,在不同的试验时间,采用不同的仪器,进行如下中间精密度试验:以湖北一半天制药有限公司制备的产品批号为20150101的复方氨基酸注射液18aa-v为样品,用水将所述复方氨基酸注射液18aa-v稀释5倍,作为供试品溶液;精密称取半胱氨酸,与水混合,配制0.06mg/ml的半胱氨酸水溶液,作为对照品溶液;将所述供试品溶液和对照品溶液按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,按外标法计算,并通过半胱氨酸的含量折算出盐酸半胱氨酸的含量,连续实验6次,比较各次半胱氨酸衍生物的峰面积和盐酸半胱氨酸的标示含量,计算rsd(%),结果见表5。表5中间精密度试验结果中间精密度试验半胱氨酸衍生物峰面积盐酸半胱氨酸的标示含量(%)1329753790.172318986587.223323880788.564330846490.475320661987.686328661689.87rsd(%)1.541.54计算重复性试验和中间精密度试验中盐酸半胱氨酸12个标示含量数据的平均值为89.72%,rsd(%)为1.7%,说明本发明提供的方法具有良好的精密度。(6)稳定性试验以湖北一半天制药有限公司制备的产品批号为20150101的复方氨基酸注射液18aa-v为样品,室温(22℃)条件下,开启胶塞后分别于0h、1h、2h和4h取样,分别用水将所述复方氨基酸18aa-v注射液稀释5倍,按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,计算rsd(%),结果见表6,说明所述样品开封后在4h内稳定性良好。表6稳定性试验结果(7)样品测定以湖北一半天制药有限公司中试制备的复方氨基酸注射液18aa-v为样品(样品规格分别为100ml和500ml),用水将所述复方氨基酸注射液18aa-v稀释5倍,作为供试品溶液;精密称取半胱氨酸,与水混合,配制0.06mg/ml的半胱氨酸水溶液,作为对照品溶液;将所述供试品溶液和对照品溶液按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,按外标法计算,并通过半胱氨酸的含量折算出盐酸半胱氨酸的含量,结果见表7和表8。表7样品(规格100ml)测定结果表8样品(规格500ml)测定结果从实施例1中可以看出,采用本发明提供的方法能够实现复方氨基酸注射液18aa-v中半胱氨酸含量的准确测定,且专属性好、精密度好、回收率较高。本发明提供的方法能够有效控制复方氨基酸注射液18aa-v产品的质量,同时综合考虑大生产、储存及运输等因素,在盐酸半胱氨酸含量不低于标示含量的70%情况下,间接反映复方氨基酸注射液18aa-v中其它氨基酸无降解。实施例2测定复方氨基酸注射液18aa-ⅶ中半胱氨酸的含量(1)以湖北一半天制药有限公司制备的复方氨基酸18aa-ⅶ注射液为样品,测定复方氨基酸注射液18aa-ⅶ中半胱氨酸含量的方法,包括以下步骤:(11)精密称取半胱氨酸,与水混合,配制0.07mg/ml的半胱氨酸水溶液,作为对照品溶液;按照复方氨基酸注射液18aa-ⅶ的配方配制复方氨基酸注射液,用水稀释5倍,作为供试品溶液;将n-(1-芘)马来酰亚胺与乙腈混合,得到质量浓度为0.2mg/ml的n-(1-芘)马来酰亚胺乙腈溶液,作为衍生剂溶液;(12)分别将所述步骤(11)中0.5ml对照品溶液和0.5ml供试品溶液与1ml衍生剂溶液混合,20℃条件下衍生20min;(13)将所述步骤(12)得到的衍生后的对照品溶液和供试品溶液进行高效液相色谱分析,根据衍生后的对照品溶液和供试品溶液的液相色谱图,采用外标法得到衍生后的供试品溶液中半胱氨酸的含量,进而得到复方氨基酸注射液18aa-ⅶ中半胱氨酸的含量;其中,所述高效液相色谱分析的条件具体如下:梯度洗脱程序:时间(min)流动相a(%)流动相b(%)0901084060181090241090259010其中,流动相a为0.015mol/l的醋酸钠溶液,所述流动相a的ph值为2.8±0.1;流动相b为乙腈。流动相的流速为1.0ml/min;采用pda检测器,检测波长为274nm;采用十八烷基硅烷键合硅胶色谱柱,柱温为35℃;进样量为10μl。(2)方法专属性试验按照复方氨基酸注射液18aa-ⅶ的配方,配制不含半胱氨酸的混合溶液,用水稀释5倍,作为阴性对照溶液;按照复方氨基酸注射液18aa-ⅶ的配方配制复方氨基酸注射液,用水稀释5倍,作为供试品溶液;将所述阴性对照溶液和供试品溶液按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,结果见图5和图6。图5为阴性对照溶液的液相色谱图,图中2为n-(1-芘)马来酰亚胺;图6为供试品溶液的液相色谱图,图中1为半胱氨酸衍生物,2为n-(1-芘)马来酰亚胺。由图5和图6可知,阴性对照溶液在半胱氨酸衍生物的保留时间处无色谱峰;衍生后未反应的n-(1-芘)马来酰亚胺也不会干扰半胱氨酸的测定。通过pda检测器对供试品溶液中半胱氨酸衍生物的色谱峰纯度进行检测,结果见表9。由表9可知,半胱氨酸衍生物的色谱峰为单一纯色谱峰,方法专属性好。表9供试品溶液中半胱氨酸衍生物的色谱峰纯度检测结果(3)线性试验按照复方氨基酸注射液18aa-ⅶ的配方,配制不含半胱氨酸的混合溶液,用水稀释5倍,作为阴性对照溶液;精密称取半胱氨酸100.0mg,与100ml所述阴性对照溶液混合,得到半胱氨酸标准溶液;分别精密量取半胱氨酸标准溶液并加水稀释,得到质量浓度分别为10.0μg/ml、30.0μg/ml、50.0μg/ml、70.0μg/ml和90.0μg/ml的半胱氨酸标准溶液;将得到的不同稀释浓度的半胱氨酸标准溶液按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,以半胱氨酸衍生物的峰面积为纵坐标,半胱氨酸的浓度为横坐标,峰面积对浓度作线性方程,得到半胱氨酸的标准曲线;所述半胱氨酸的标准曲线方程、相关系数和线性范围具体见表10。由表10可知,半胱氨酸在10.0~90.0μg/ml范围内线性良好,相关系数r2为0.9997。表10半胱氨酸的标准曲线方程、相关系数和线性范围表10中,x为半胱氨酸的质量浓度,y对应半胱氨酸衍生物的液相色谱图峰面积。(4)加标回收率试验精密称取半胱氨酸,与水混合,配制0.070mg/ml的半胱氨酸水溶液,作为对照品溶液;按照复方氨基酸注射液18aa-ⅶ的配方配制复方氨基酸注射液,用水稀释5倍,作为供试品溶液;分别精密称取半胱氨酸,与所述供试品溶液混合,配制半胱氨酸质量浓度分别为0.056mg/ml、0.070mg/ml和0.084mg/ml的混合溶液(半胱氨酸浓度分别为测定浓度0.070mg/ml的80%、100%和120%)各三份,作为加标回收试验溶液;将所述对照品溶液和加标回收试验溶液按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,按外标法计算,即得半胱氨酸的回收率,结果见表11。由表11可知,半胱氨酸的回收率在99.10%~100.90%之间,平均回收率为100.08%,rsd(%)为0.63(n=9),说明测定结果准确。表11加标回收率试验结果(5)重复性试验和中间精密度试验重复性试验以湖北一半天制药有限公司制备的产品批号为20140601的复方氨基酸注射液18aa-vii为样品,用水将所述复方氨基酸注射液18aa-vii稀释5倍,作为供试品溶液;精密称取半胱氨酸,与水混合,配制0.07mg/ml的半胱氨酸水溶液,作为对照品溶液;将所述供试品溶液和对照品溶液按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,按外标法计算,连续实验6次,比较各次半胱氨酸衍生物的峰面积和半胱氨酸的标示含量,计算rsd(%),结果见表12。表12重复性试验结果重复性试验半胱氨酸衍生物峰面积半胱氨酸的标示含量(%)1354760990.52357826491.23363119292.64359146591.65354178090.36355105890.5rsd(%)0.970.97中间精密度试验试验员a和实验员b,在不同的试验时间,采用不同的仪器,进行如下中间精密度试验:以湖北一半天制药有限公司制备的产品批号为20140601的复方氨基酸注射液18aa-vii为样品,用水将所述复方氨基酸注射液18aa-vii稀释5倍,作为供试品溶液;精密称取半胱氨酸,与水混合,配制0.07mg/ml的半胱氨酸水溶液,作为对照品溶液;将所述供试品溶液和对照品溶液按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,按外标法计算,连续实验6次,比较各次半胱氨酸衍生物的峰面积和半胱氨酸的标示含量,计算rsd(%),结果见表13。表13中间精密度试验结果中间精密度试验半胱氨酸衍生物峰面积半胱氨酸的标示含量(%)1354153490.32354545690.43357683291.24347093988.55353761290.26355722290.7rsd(%)1.011.01计算重复性试验和中间精密度试验中半胱氨酸12个标示含量数据的平均值为90.67%,rsd(%)为1.08%,说明本发明提供的方法具有良好的精密度。(6)稳定性试验以湖北一半天制药有限公司制备的产品批号为20140601的复方氨基酸注射液18aa-vii为样品,室温(22℃)条件下,开启胶塞后分别于0h、1h、2h、3h、4h取样,分别用水将所述复方氨基酸18aa-vii注射液稀释5倍,按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,计算rsd(%),结果见表14,说明所述样品开封后在4h内稳定性良好。表14稳定性试验结果(7)样品测定以湖北一半天制药有限公司小试、中试制备的各三批复方氨基酸注射液18aa-vii为样品,用水将所述复方氨基酸注射液18aa-vii稀释5倍,作为供试品溶液;精密称取半胱氨酸,与水混合,配制0.07mg/ml的半胱氨酸水溶液,作为对照品溶液;将所述供试品溶液和对照品溶液按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,按外标法计算,得到半胱氨酸的标示含量,结果见表15。表15样品测定结果从实施例2中可以看出,采用本发明提供的方法能够实现复方氨基酸注射液18aa-vii中半胱氨酸含量的准确测定,且专属性好、精密度好、回收率较高。本发明提供的方法能够有效控制复方氨基酸注射液18aa-vii产品的质量,同时综合考虑大生产、储存及运输等因素,在半胱氨酸含量不低于标示含量的80%情况下,间接反映复方氨基酸注射液18aa-v中其它氨基酸无降解。实施例3测定复方氨基酸注射液18aa-ix中半胱氨酸的含量(1)以湖北一半天制药有限公司制备的复方氨基酸18aa-ix注射液为样品,测定复方氨基酸注射液18aa-ix中半胱氨酸含量的方法,包括以下步骤:(11)精密称取半胱氨酸,与水混合,配制0.05mg/ml的半胱氨酸水溶液,作为对照品溶液;按照复方氨基酸注射液18aa-ix的配方配制复方氨基酸注射液,用水稀释5倍,作为供试品溶液;将n-(1-芘)马来酰亚胺与乙腈混合,得到质量浓度为0.2mg/ml的n-(1-芘)马来酰亚胺乙腈溶液,作为衍生剂溶液;(12)分别将所述步骤(11)中0.5ml对照品溶液和0.5ml供试品溶液与1ml衍生剂溶液混合,20℃条件下衍生20min;(13)将所述步骤(12)得到的衍生后的对照品溶液和供试品溶液进行高效液相色谱分析,根据衍生后的对照品溶液和供试品溶液的液相色谱图,采用外标法得到衍生后的供试品溶液中半胱氨酸的含量,进而得到复方氨基酸注射液18aa-ix中半胱氨酸的含量;其中,所述高效液相色谱分析的条件具体如下:梯度洗脱程序:时间(min)流动相a(%)流动相b(%)0901084060181090241090259010309010其中,流动相a为0.01mol/l的磷酸二氢钠溶液,所述流动相a的ph值为2.8±0.1;流动相b为乙腈;流动相的流速为1.0ml/min;采用pda检测器,检测波长为274nm;采用十八烷基硅烷键合硅胶色谱柱,柱温为35℃;进样量为10μl。(2)方法专属性试验按照复方氨基酸注射液18aa-ix的配方,配制不含半胱氨酸的混合溶液,用水稀释5倍,作为阴性对照溶液;按照复方氨基酸注射液18aa-ix的配方配制复方氨基酸注射液,用水稀释5倍,作为供试品溶液;将所述阴性对照溶液和供试品溶液按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,结果见图7和图8。图7为阴性对照溶液的液相色谱图,图中2为n-(1-芘)马来酰亚胺;图8为供试品溶液的液相色谱图,图中1为半胱氨酸衍生物,2为n-(1-芘)马来酰亚胺。由图7和图8可知,阴性对照溶液在半胱氨酸衍生物的保留时间处无色谱峰;衍生后未反应的n-(1-芘)马来酰亚胺也不会干扰半胱氨酸的测定。通过pda检测器对供试品溶液中半胱氨酸衍生物的色谱峰纯度进行检测,结果见表16。由表16可知,半胱氨酸衍生物的色谱峰为单一纯色谱峰,方法专属性好。表16供试品溶液中半胱氨酸衍生物的色谱峰纯度检测结果(3)线性试验按照复方氨基酸注射液18aa-ix的配方,配制不含半胱氨酸的混合溶液,用水稀释5倍,作为阴性对照溶液;精密称取半胱氨酸97.6mg,与100ml所述阴性对照溶液混合,得到半胱氨酸标准溶液;分别精密量取半胱氨酸标准溶液并加水稀释,得到质量浓度分别为9.8μg/ml、19.7μg/ml、39.4μg/ml、59.0μg/ml和78.7μg/ml的半胱氨酸标准溶液;将得到的不同稀释浓度的半胱氨酸标准溶液按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,以半胱氨酸衍生物的峰面积为纵坐标,半胱氨酸的浓度为横坐标,峰面积对浓度作线性方程,得到半胱氨酸的标准曲线;所述半胱氨酸的标准曲线方程、相关系数和线性范围具体见表17。由表17可知,半胱氨酸在9.8~78.7μg/ml范围内线性良好,相关系数r2为0.9998。表17半胱氨酸的标准曲线方程、相关系数和线性范围表2中,x为半胱氨酸的质量浓度,y对应半胱氨酸衍生物的液相色谱图峰面积。(4)加标回收率试验精密称取半胱氨酸,与水混合,配制0.05mg/ml的半胱氨酸水溶液,作为对照品溶液;按照复方氨基酸注射液18aa-ix的配方配制复方氨基酸注射液,用水稀释5倍,作为供试品溶液;分别精密称取半胱氨酸,与所述供试品溶液混合,配制半胱氨酸质量浓度分别为0.04mg/ml、0.05mg/ml和0.06mg/ml的混合溶液(半胱氨酸浓度分别为测定浓度0.05mg/ml的80%、100%和120%)各三份,作为加标回收试验溶液;将所述对照品溶液和加标回收试验溶液按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,按外标法计算,即得半胱氨酸的回收率,结果见表18。由表18可知,半胱氨酸的回收率在97.76%~100.74%之间,平均回收率为99.28%,rsd(%)为1.06(n=9),说明测定结果准确。表18加标回收率试验结果(5)重复性试验和中间精密度试验重复性试验以湖北一半天制药有限公司制备的产品批号为20140601的复方氨基酸注射液18aa-ix为样品,用水将所述复方氨基酸注射液18aa-ix稀释5倍,作为供试品溶液;精密称取半胱氨酸,与水混合,配制0.05mg/ml的半胱氨酸水溶液,作为对照品溶液;将所述供试品溶液和对照品溶液按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,按外标法计算,连续实验6次,比较各次半胱氨酸衍生物的峰面积和半胱氨酸的标示含量,计算rsd(%),结果见表19。表19重复性试验结果中间精密度试验试验员a和实验员b,在不同的试验时间,采用不同的仪器,进行如下中间精密度试验:以湖北一半天制药有限公司制备的产品批号为20140601的复方氨基酸注射液18aa-ix为样品,用水将所述复方氨基酸注射液18aa-ix稀释5倍,作为供试品溶液;精密称取半胱氨酸,与水混合,配制0.05mg/ml的半胱氨酸水溶液,作为对照品溶液;将所述供试品溶液和对照品溶液按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,按外标法计算,连续实验6次,比较各次半胱氨酸衍生物的峰面积和半胱氨酸的标示含量,计算rsd(%),结果见表20。表20中间精密度试验结果中间精密度试验半胱氨酸衍生物峰面积半胱氨酸的标示含量(%)1201249087.242202509787.793214520293.004211113091.525211136891.536211310491.61rsd(%)2.592.59计算重复性试验和中间精密度试验中半胱氨酸12个标示含量数据的平均值为90.32%,rsd(%)为1.81%,说明本发明提供的方法具有良好的精密度。(6)稳定性试验以湖北一半天制药有限公司制备的产品批号为20140601的复方氨基酸注射液18aa-ix为样品,室温(22℃)条件下,开启胶塞后分别于0min、80min、160min、240min和320min取样,分别用水将所述复方氨基酸18aa-ix注射液稀释5倍,按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,计算rsd(%),结果见表21,说明所述样品开封后在5h内稳定性良好。表21稳定性试验结果(7)样品测定以湖北一半天制药有限公司小试、中试制备的各三批复方氨基酸注射液18aa-ix为样品,用水将所述复方氨基酸注射液18aa-ix稀释5倍,作为供试品溶液;精密称取半胱氨酸,与水混合,配制0.05mg/ml的半胱氨酸水溶液,作为对照品溶液;将所述供试品溶液和对照品溶液按照步骤(12)所述的方法衍生后,按照步骤(13)所述的方法进行高效液相色谱分析,按外标法计算,得到半胱氨酸的标示含量,结果见表22。表22样品测定结果从实施例3中可以看出,采用本发明提供的方法能够实现复方氨基酸注射液18aa-ix中半胱氨酸含量的准确测定,且专属性好、精密度好、回收率较高。本发明提供的方法能够有效控制复方氨基酸注射液18aa-ix产品的质量,同时综合考虑大生产、储存及运输等因素,在半胱氨酸含量不低于标示含量的80%情况下,间接反映复方氨基酸注射液18aa-ix中其它氨基酸无降解。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法-939的制作方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法-933的制作方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法-939的制作方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法-933的制作方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法-939的制作方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法-933的制作方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法