核酸适配体识别和功能化磁性微球分离预处理的卡那霉素快速检测试纸及其制备和应用的制作方法
本发明涉及一种基于核酸适配体识别和功能化磁性微球分离预处理的卡那霉素快速检测试纸及其制备和应用,属于环境、食品和医药分析领域。
背景技术:
抗生素(antibiotics)是由细菌、真菌或动植物代谢出的次级代谢产物,具有抗病原体的性质。由于氨基糖苷类抗生素对比其他类别的抗生素来讲成本相对较低、水溶效果较好、抗菌谱广,同时对常见的细菌性疾病具有良好的治疗效果,因此广泛应用。卡那霉素(kanamycin)是使用最为频繁的氨基糖苷类抗生素之一,卡那霉素是通过链霉菌(streptomyceskanamyceticus)发酵产生的,广泛用于细菌引起的感染治疗中。卡那霉素的作用机制是通过误读遗传密码并结合核糖体的30s亚基抑制翻译来扰乱细菌蛋白质的合成,进而抑制细菌的生长繁殖。卡那霉素作为二线抗生素以注射和胶囊的形式应用于兽医学,有效抑制革兰氏阴性菌和革兰氏阳性菌的生长。随着卡那霉素越来越频繁和过度的使用,导致其在动物来源的食品中逐步积累,对我们的健康是一种危害,可能引发耳毒症、尿毒症和神经毒症等。因此在全球范围内关于卡那霉素残留日益增加的问题成为严重的公共卫生威胁。
由于卡那霉素的残留存在诸多危害,为提高食品质量和安全性,发展实用简单快速的检测方法是十分必要的。现在已经报道了多种用于抗生素残留的检测方法,例如微生物检测法、仪器分析法、生化免疫检测法和电化学检测法等。这些检测方法的应用均存在一些缺点,并且不适合现场检测和放大生产,因此应尽快建立一种能够用于检测食品中卡那霉素残留的方便、快速、经济、准确性好、灵敏度高的检测方法,可以有效提高动物源性食品的安全性。
技术实现要素:
本发明的目的是克服上述不足,提供一种基于核酸适配体识别和功能化磁性微球分离预处理的卡那霉素快速检测试纸及其制备和应用,将胶体金标记层析试纸条技术、磁性微球的快速分离及核酸适配体的特异性等诸多技术的优势联合起来,制备一种用于简便、快速、成本低、灵敏度高的卡那霉素残留的检测试纸并应用于样品检测。
本发明的技术方案,一种基于核酸适配体识别和功能化磁性微球分离预处理的卡那霉素快速检测试纸,其组成包括样品垫、金标垫、硝酸纤维素膜、吸水垫、pvc底板、检测线和质控线;所述pvc底板上依次粘贴样品垫、金标垫、硝酸纤维素膜和吸水垫,其中样品垫搭接金标垫,硝酸纤维素膜直接设置于pvc底板上,硝酸纤维素膜一端搭接金标垫,硝酸纤维素膜另一端搭接吸水垫;所述硝酸纤维素膜上依次设有检测线和质控线。
所述样品垫、金标垫、硝酸纤维素膜、吸水垫各搭接部重叠段为2mm。
所述金标垫上滴加功能化金纳米粒子aunps-dna1,检测线上修饰捕获探针1capdna1,质控线上修饰捕获探针2capdna2,cdna迁移到检测线后能介导形成互补链三明治结构捕获aunps,多余的aunps则在质控线被捕获;卡那霉素浓度与检测线上捕获的aunps数量及显色深浅呈现相关性。
所述金标垫的制备过程为:制备金纳米粒子并分别通过au-s键的共价作用将dna1与金纳米颗粒偶联形成功能化的金纳米粒子aunps-dna1;
其中dna1序列为:5’-atagcacaaccgtc-(ch2)6-hs-3’
所述在硝酸纤维素膜上靠近金标垫的一端用预先孵育过的链霉亲和素和生物素修饰capdna1来制备检测线,在靠近吸水垫一端用链霉亲和素和生物素修饰capdna2来制备质控线;
其中capdna1及capdna2的序列分别为:
capdna1:5’-biotin-tgactgtaagccg-3’;
capdna2:5’-ggttgtgctattatga-biotin-3’。
所述基于核酸适配体识别和功能化磁性微球分离预处理的卡那霉素快速检测试纸的制备方法,步骤如下:
(1)功能化磁性微球的制备:首先设计一段与适配体apt部分互补的cdna,将cdna和apt分别在95℃金属浴3min,然后将cdna和apt充分混合,在37℃孵育1h,使apt-cdna和apt充分杂交;将磁性微球mbs用10mmol/l、ph7.4的pbs缓冲液清洗5次后与上述杂交dna混合,37℃震荡1h,形成功能化磁性微球mbs-apt-cdna,该功能化磁性微球用清洗液清洗3次除去未结合到磁性微球表面的apt-cdna,将预处理好的功能化磁性微球mbs-apt-cdna,4℃保存备用;
其中,apt及cdna的序列分别为:
apt:5’-biotin-tgggggttgaggctaagccga-3’,
cdna:5’-ttgtgctatcggcttac-3’;
(2)功能化金纳米粒子的制备:制备金纳米粒子之前所有的玻璃仪器均用王水浸泡30min,然后用蒸馏水洗净,超纯水浸泡12h,烘干备用;将100ml质量浓度0.01%的氯金酸加入250ml圆底烧瓶中,搅拌并加热至沸腾,在剧烈搅拌下快速加入3.5ml质量浓度1%的柠檬酸三钠,继续加热搅拌15min后溶液变成酒红色,停止加热,继续搅拌30min后静置,室温自然冷却,得到粒径13nm的金纳米粒子溶液,4℃保存备用;
将上述金纳米粒子溶液在沸水浴条件下继续加热并不断搅拌,使水分蒸发,直至烧瓶内的溶液体积到20ml后停止沸水浴,室温自然冷却,得到浓缩的金纳米粒子,4℃保存备用;
将15µl1mmol/l的三(2-羧乙基)膦tcep与30µl100µmol/l的dna1混合,进行巯基化反应,然后加入到1ml浓缩的金纳米粒子中,室温下搅拌1h;接着将30µl15mmol/l的三磷酸脱氧腺苷datp加入到上述溶液中,室温搅拌35min;震荡完成后加入20µl1mol/l的nacl溶液室温放置30min,4℃保存6h来增加结合的稳定性;4℃、8000r/min离心10min去除多余的试剂;重悬于1ml含0.5%tween-20、5%bsa、2%蔗糖、0.5%tritonx-100的20mmol/l的na3po4缓冲液中得到功能化金纳米粒子aunps-dna1,4℃避光保存备用;
其中,dna1的序列为:5’-atagcacaaccgtc-(ch2)6-sh-3’,与cdna和capdna2均部分互补;
(3)样品垫、金标垫预处理:将金标垫及样品垫裁剪成合适的大小后在ph8.2含1%nacl、0.5%tween-20、1%bsa、2%蔗糖、1%tritonx-100的0.1mol/ltris-hcl缓冲液中完全浸泡30min,然后放到37℃恒温干燥箱中烘干后,干燥条件保存、备用;
在处理好的金标垫上滴加功能化金纳米粒子aunps-dna1,37℃恒温干燥箱中烘干,干燥条件保存,备用;
(4)硝酸纤维素膜预处理:首先,将生物素化的capdna1及capdna2分别与链霉亲和素streptavidin结合;将10µl1mg/ml链霉亲和素分别与20µl10µmol/l生物素化的capdna1及capdna2混合均匀后在4℃的条件下结合2h,使链霉亲和素和生物素化的capdna1及capdna2充分偶联;
取1µl结合好的streptavidin-biotin-capdna1在靠近金标垫一端6mm处划检测线t线;取1µlstreptavidin-biotin-capdna2在靠近吸水垫一端6mm处划质控线c线;将划好t、c线的硝酸纤维素膜在37℃下烘干,4℃保存备用;
(5)试纸条的组装:试纸条的组成材料主要包括pvc底板、样品垫、金标垫、硝酸纤维素膜、吸水垫五部分,先将硝酸纤维素膜粘贴到pvc底板的对应位置上,轻压,使二者紧密结合,将处理过的样品垫、金标垫,分别粘贴在pvc底板的对应位置上,样品垫与金标垫,金标垫与硝酸纤维素膜各重叠2mm,最后将吸水垫与硝酸纤维素膜重叠2mm粘贴到pvc底板上,多余部分裁掉;各部分粘贴牢固并裁成规格为60mm×4mm的试纸条,干燥条件保存,备用。
所述基于核酸适配体和功能化磁性微球分离预处理的卡那霉素快速检测试纸的应用:将功能化磁性微球mbs-apt-cdna用10mmol/l、ph7.4的pbs缓冲液清洗3次后,重悬于结合缓冲液,向其中加入待测样品,震荡10min使磁性微球表面的apt与样品中所含的卡那霉素充分结合,将与其互补的cdna置换到溶液中;
所述结合缓冲液具体为含1mmol/ledta、50mmol/lnacl、0.05%tween-20的50mmol/l、ph7.5的tris-hcl缓冲液;
在磁力作用下吸附磁性微球,取含cdna的上清液作为试纸条检测液;将制备好的试纸条置于试纸条卡盒中,在加样孔滴加待检测的溶液;
当检测液中不存在卡那霉素时,t线不显色、c线显色;
当检测液中存在卡那霉素时,t、c线均显色;静置10min,待试纸条显色完全后,通过肉眼观察检测线颜色深浅可定性或半定量分析,或将试纸条置于胶体金定量仪中进行扫描检测,得到检测线和质控线的峰面积值,根据标准曲线定量测定出检测液中卡那霉素浓度。
本发明的有益效果:①该方法利用磁性微球良好的分离效果以及适配体的构象变化实现检测线光学强度的变化,进而实现对卡那霉素的检测;②试纸法检测卡那霉素简便快速,检测不受环境条件的限制,结果可视化,便于扩大并应用。检测过程只需20min即可获得实验结果,与常用检测卡那霉素的方法相比检测效率大幅提高、实际应用效果明显增强;③该检测方法可以通过观察颜色强度实现对卡那霉素的定性分析,也可以通过胶体金定量仪进行定量检测,对动物源性食品中卡那霉素残留检测具有重要意义。
附图说明
图1基于适配体和功能化磁性微球分离的卡那霉素检测试纸原理图。a、磁性微球预处理过程图;b、试纸条组成图;c、试纸检测阴性结果图;d、试纸检测阳性结果图;1、样品垫;2、金标垫;3、硝酸纤维素膜;4、吸水垫;5、pvc底板;6、检测线;7、质控线。
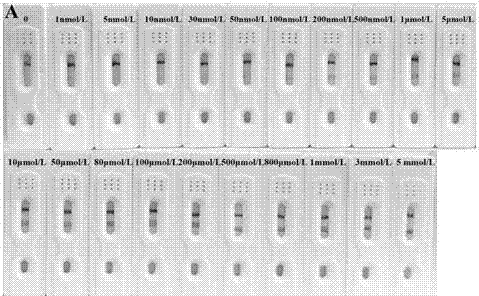
图2用试纸条检测不同浓度卡那霉素标准溶液的检测图。
图3在标准检测液中t线峰面积与卡那霉素浓度的标准曲线图。
图4该试纸条检测法的特异性验证图。
图5该试纸条检测法的稳定性验证图。
图6该试纸条的实际样品检测图。a、牛奶;b、蜂蜜;c、奶粉。
具体实施方式
实施例1基于核酸适配体和磁性微球分离预处理的卡那霉素快速检测试纸
包括磁性微球的预处理、金纳米粒子的制备及功能化、金标垫和样品垫的预处理、硝酸纤维素膜的预处理、试纸条的组装、检测试纸条显色情况;具体步骤为:
(1)功能化磁性微球的制备
首先设计一段与适配体apt部分互补的cdna,将cdna及apt分别在95℃金属浴3min,使cdna的互补部分打开,形成一条单链,便于下一步cdna和apt的互补杂交。将cdna和apt充分混合,在37℃恒温培养箱中孵育1h,使cdna和apt充分结合。由于磁性微球表面修饰有链霉亲和素,apt的5’端修饰有生物素,因此apt可以由链霉亲和素-生物素作用偶联到磁性微球表面。将磁性微球用10mmol/l、ph7.4的pbs缓冲液清洗5次后与上述apt-cdna混合液结合,在37℃下震荡1h,避免磁性微球沉降,形成mbs-apt-cdna。结合好的磁性微球用清洗液清洗3次除去未结合到磁性微球表面的apt-cdna。将预处理好的功能化磁性微球mbs-apt-cdna,4℃保存备用。
(2)金纳米粒子的制备及功能化
制备金纳米粒子之前所有的玻璃仪器均用王水浸泡30min,然后用蒸馏水洗净,超纯水浸泡12h,烘干备用;将100ml质量浓度0.01%的氯金酸加入250ml圆底烧瓶中,搅拌并加热至沸腾,在剧烈搅拌下快速加入3.5ml质量浓度1%的柠檬酸三钠,继续加热搅拌15min后溶液变成酒红色,停止加热,继续搅拌30min后静置,室温自然冷却,得到粒径13nm的金纳米粒子溶液,4℃保存备用;
将上述金纳米粒子溶液在沸水浴条件下继续加热并不断搅拌,使水分蒸发,直至烧瓶内的溶液为20ml后停止沸水浴,室温自然冷却,得到浓缩的金纳米粒子,4℃保存备用;
将15µl1mmol/l的三(2-羧乙基)膦tcep与30µl100µmol/l的dna1混合,进行巯基化反应,然后加入到1ml浓缩的金纳米粒子中,室温下搅拌1h;接着将30µl15mmol/l的三磷酸脱氧腺苷datp加入到上述溶液中,室温搅拌35min;震荡完成后加入20µl1mol/l的nacl溶液室温放置30min,4℃保存6h来增加结合的稳定性;4℃、8000r/min离心10min去除多余的试剂;重悬于1ml含0.5%tween-20、5%bsa、2%蔗糖、0.5%tritonx-100的20mmol/l的na3po4缓冲液中,4℃避光保存备用;
(3)样品垫、金标垫预处理
将金标垫及样品垫裁剪成合适的大小后在ph8.2含1%nacl、0.5%tween-20、1%bsa、2%蔗糖、1%tritonx-100的0.1mol/ltris-hcl缓冲液中完全浸泡30min,然后放到37℃恒温干燥箱中烘干后,干燥条件保存、备用;
在处理好的金标垫上滴加功能化金纳米粒子,即aunps-dna1,其中dna1与cdna和capdna2均部分互补,37℃恒温干燥箱中烘干,干燥条件保存,备用;
(4)硝酸纤维素膜预处理
首先,将生物素化的capdna1及capdna2与链霉亲和素结合。将10µl1mg/ml链霉亲和素分别与20µl10µmol/l生物素化的capdna1及capdna2混合均匀后在4℃的条件下结合2h,链霉亲和素和生物素之间的强结合力会使链霉亲和素和生物素化的capdna1及capdna2充分偶联。取1µl结合好的streptavidin-biotin-capdna1在靠近金标垫一端6mm处划检测线(t线)。取1µlstreptavidin-biotin-capdna2在靠近吸水垫一端6mm处划质控线(c线)。将划好t、c线的nc膜在37℃下烘干,干燥条件下4℃保存备用。
(5)试纸条的组装
胶体金层析试纸条的组成材料主要包括pvc底板、样品垫、金标垫、硝酸纤维素膜、吸水垫五部分,先将硝酸纤维素膜粘贴到pvc底板的对应位置上,轻压,使二者紧密结合,将处理过的样品垫、金标垫,分别粘贴在pvc底板的对应位置上,样品垫与金标垫,金标垫与硝酸纤维素膜各重叠2mm,最后将吸水垫与硝酸纤维素膜重叠2mm粘贴到pvc底板上,多余部分裁掉;然后各部分粘贴牢固,裁成规格为60mm×4mm的试纸条,干燥条件保存,备用。
实施例2用试纸条对卡那霉素标准溶液的测定
(1)磁性微球的预处理
首先设计一段与适配体apt部分互补的cdna,将cdna及apt分别在95℃金属浴3min,使cdna的互补部分打开,形成一条单链,便于下一步cdna和apt的互补杂交。将cdna和apt充分混合,在37℃恒温培养箱中孵育1h,使cdna和apt充分结合。由于磁性微球表面修饰有链霉亲和素,apt的5’端修饰有生物素,因此apt可以由链霉亲和素-生物素作用偶联到磁性微球表面。将磁性微球用10mmol/l、ph7.4的pbs缓冲液清洗5次后与上述apt-cdna混合液结合,在37℃下以震荡1h,避免磁性微球沉降,形成mbs-apt-cdna。结合好后的磁性微球用清洗液清洗3次除去未结合到磁性微球表面的apt-cdna。将预处理好的功能化磁性微球mbs-apt-cdna4℃保存备用。
(2)将按上述方法制备好的试纸条,用于定性或半定量的分析和用胶体金定量仪定量的检测卡那霉素。先按上述磁性微球的预处理步骤分别处理含0-5mmol/l的卡那霉素,然后用相同条件制备出的试纸条来检测置换下来的cdna,由于cdna的量与卡那霉素浓度成正比,因此确定cdna的浓度就可以确定卡那霉素的浓度。如图2所示,当检测液中不存在卡那霉素时,由于cdna没有被置换下来,检测线上的capdna1在没有cdna时不能捕获金纳米粒子,质控线上的capdna2可以捕获金纳米粒子,因此试纸条上只有质控线显色,检测线不显色。当卡那霉素的浓度逐渐增大时,c线的颜色基本没有变化,t线的颜色逐渐增强,当卡那霉素的浓度达到50nmol/l时,肉眼可以观察到检测线有轻微的显色,因此设定50nmol/l为该检测方法的可视化检测限。用胶体金定量仪检测试纸条检测线的峰面积,确定不同浓度的卡那霉素与检测线峰面积的关系,如图3所示,随着卡那霉素浓度的增大,检测线的峰面积逐渐增大,当卡那霉素的浓度在5-500nmol/l之间时,卡那霉素的浓度与检测线的峰面积之间存在线性关系,线性回归方程为:y=678.2684x+263.9928,r2=0.9917,x代表卡那霉素的浓度,y表示检测线的峰面积。根据线性关系计算出的理论检测限为4.958nmol/l(s/n=3)。这表示该试纸条检测具有较高的灵敏性。
实施例3试纸条检测法的特异性验证
将相同条件制备好的试纸条分别来检测浓度均为5mmol/l的链霉素(str)、氨苄青霉素(amp)、新霉素(neo)、庆大霉素(gen)、卡那霉素(kan)和水,检测后对比检测线的显色情况和峰面积大小来验证该试纸条检测的特异性,不同种类抗生素用于检测后的检测线峰面积图,如图4所示。在图4中可以看出在检测卡那霉素时检测线的峰面积明显高于其他几种抗生素,因此证明该检测方法对卡那霉素的检测有较高的特异性。
实施例4试纸条检测法的稳定性验证
为确定该试纸条的稳定性,将试纸条组装完成后置于4℃分别保存不同的天数后用于检测。本实验将试纸条分别储存0、3、7、15、30、60和90天后分别检测不同浓度的卡那霉素(0、30、100nmol/l、10、100、500μmol/l),不同保存时间试纸条的检测线的光学强度确定该检测方法的稳定性结果显示如图5所示。在图5中可以看出该检测方法在3个月的保存时间内检测相同浓度卡那霉素的峰面积变化微小,检测线的峰面积的减弱程度在3.60%-9.84%之间。表明该试纸条稳定性较好。
实施例5实际样品中卡那霉素残留的检测
为了验证该检测方法的实用性,分别检测了牛奶、蜂蜜及奶粉中的卡那霉素。首先向牛奶、蜂蜜及奶粉样品中添加卡那霉素至浓度分别为0、30nmol/l、50nmol/l、100nmol/l、200nmol/l、500nmol/l、1μmol/l、10μmol/l及100μmol/l,然后对它们进行预处理,向牛奶中逐滴滴加20%的三氯乙酸溶液,将牛奶的ph调节到4.6,然后45℃水浴10min以沉淀蛋白,10000r/min离心25min除去凝结的蛋白质和脂肪,得到经预处理后的牛奶样品。蜂蜜用磁性微球结合液稀释10倍即可。取2g奶粉加入磁性微球结合液5ml混匀。10000r/min离心20min除去脂肪层取上清液,然后将上清液用磁性微球结合液进行十倍稀释,得到经预处理后的奶粉样品。将预处理后的牛奶、蜂蜜及奶粉样品与mbs-apt-cdna充分混合,反应后用试纸条来检测溶液中被置换下来的cdna。用胶体金定量仪检测查看检测线的出峰情况。在图6中可以看出用试纸条检测牛奶、蜂蜜、奶粉中的卡那霉素的检测限分别为50nmol/l、50nmol/l及100nmol/l。不同的实际样品的检测限是不同的,检测牛奶和蜂蜜结果基本与标准品结果相一致,在检测奶粉时,检测限也在可接受的范围内。因此,这种试纸条检测在实际样品检测中有良好的应用前景。
实施例6试纸条检测法与hplc检测法的比较
高效液相色谱是抗生素检测的一种常用方法,在此利用hplc与试纸条检测技术进行比较后验证试纸条方法的准确性。分别用试纸条和hplc检测不同浓度的卡那霉素标准品,本发明中所用的hplc的检测器是岛津的蒸发光检测器,流动相是0.2%三氟乙酸-甲醇(95:5)溶液、流速1.0ml/min、柱温30℃、进样量20μl、漂移管温度80℃、检测时间10min。对比平均浓度、rsd值来确定该检测方法的准确性。如表1所示,从平均浓度的角度分析,建立的试纸条检测技术和hplc与检测时加入的卡那霉素标准品的浓度相近,表明这两种检测方法具有良好的准确性;从rsd值的角度分析,试纸条检测的rsd值在2.15%-4.96%之间,hplc的rsd在0.25%-0.59%,证明试纸条检测技术的准确性虽略逊于hplc,但表现依然良好,同时试纸条检测法在灵敏度和检测限方面均大大优于hplc检测法。
表1试纸条检测法和hplc法检测卡那霉素结果比较
序列表
<110>江南大学
<120>核酸适配体识别和功能化磁性微球分离预处理的卡那霉素快速检测试纸及其制备和应用
<130>201712031103
<141>2017-12-21
<160>5
<170>siposequencelisting1.0
<210>1
<211>14
<212>dna
<213>dna1序列(2ambystomalateralexambystomajeffersonianum)
<400>1
atagcacaaccgtc14
<210>2
<211>13
<212>dna
<213>capdna1(2ambystomalateralexambystomajeffersonianum)
<400>2
tgactgtaagccg13
<210>3
<211>16
<212>dna
<213>capdna2(2ambystomalateralexambystomajeffersonianum)
<400>3
ggttgtgctattatga16
<210>4
<211>21
<212>dna
<213>apt(2ambystomalateralexambystomajeffersonianum)
<400>4
tgggggttgaggctaagccga21
<210>5
<211>17
<212>dna
<213>cdna(2ambystomalateralexambystomajeffersonianum)
<400>5
ttgtgctatcggcttac17
- 还没有人留言评论。精彩留言会获得点赞!
- 一种舌癌细胞的核酸适配体及试剂盒的制造方法与工艺
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 胰岛素核酸适体INS5及其制备方法与制造工艺
- 一种高亲和力兴奋剂核酸适体EPO4及其制备方法与制造工艺
- 一种邻苯二甲酸酯类增塑剂单链DNA核酸适配体及其筛选与表征方法及电化学传感器与制造工艺
- 基于高特异性核酸适体荧光探针INS1胰岛素试剂盒及其检测方法与制造工艺
- 运用核酸适配体与溶菌酶特异性识别并形成G四链体进行荧光显现潜指纹的方法与制造工艺
- 基于快速识别核酸适体荧光探针INS2胰岛素试剂盒及其检测方法与制造工艺
- 一种用于检测沙门氏菌的增敏型核酸适配体试纸条及其制备方法
- 一组特异性结合结核分枝杆菌的核酸适配体及其应用