用于样品表征的介电感测的制作方法
本申请要求2016年1月15日提交的题为“传感器、装置、系统及其制造方法”的美国临时专利申请no.62/279467的权益,其全部内容通过引用并入本文。
本公开涉及用于确定样品的性质的介电感测。
背景技术
材料的复介电常数相对于频率的定量测量(例如,介电谱,也称为ds)可以是应用广泛的强大监测技术。例如,ds可用于石油工业中的石油化学分析、用于安全或防御目的的物质分析、农业中的土壤水分监测、酒精饮料生产过程中的发酵监测、食品质量/安全监测和制药业中的药物开发。ds还可以用作生物医学领域的分析工具,其作为一种无标记、非破坏性和实时的方法,用于在样品制备最小化的情况下研究射频(rf)/微波场与生物/生化样品的相互作用。利用ds研究了生物材料的关键分子特征(诸如人体血液、脊髓液、乳房组织和皮肤)以用于疾病检测和临床诊断。典型的ds系统往往很大且昂贵,使得它们在某些情况下成本过高。
技术实现要素:
本公开涉及传感器系统、制造传感器的方法和使用传感器的方法。
作为一个示例,一种流体监测装置,包括介电微传感器,该介电微传感器包括集成到微流体通道中的电容感测结构。该微流体通道包括流体输入部以接收被测样品(sut)的样品体积。发射器向微传感器的rf输入提供输入射频(rf)信号。接收器从微传感器接收输出rf信号。计算设备计算基于输出rf信号在时间间隔上变化的sut的介电常数值。计算设备可以基于在时间间隔的至少一部分上所计算的介电常数值来确定至少一个介电常数参数。
作为另一示例,一种系统包括传感器接口,该传感器接口包括:输出,被配置为电连接到感测装置的输入;以及输入,被配置为电连接到感测装置的输出。传感器接口包括:发射器,用于向输出提供输入射频(rf)信号;以及接收器,用于从输入接收输出rf信号,其中所述输出rf信号提供感测装置中的被测样品(sut)的介电常数的量度。计算设备计算基于输出rf信号在时间间隔上变化的sut的介电常数值。计算设备可以基于在时间间隔的至少一部分上所计算的介电常数值来确定至少一个介电常数参数。
作为另一示例,一种方法,包括向介电微传感器提供输入射频(rf)信号。该方法还包括响应于输入rf信号从介电微传感器接收输出rf信号。rf输出信号表示设置在介电微传感器中的被测样品(sut)的阻抗的量度。该方法还包括计算基于输出rf信号在测量时间间隔上变化的sut的介电常数值。该方法还包括分析在测量时间间隔的至少一部分上的sut的介电常数值,以确定sut的至少一个介电常数参数。
附图说明
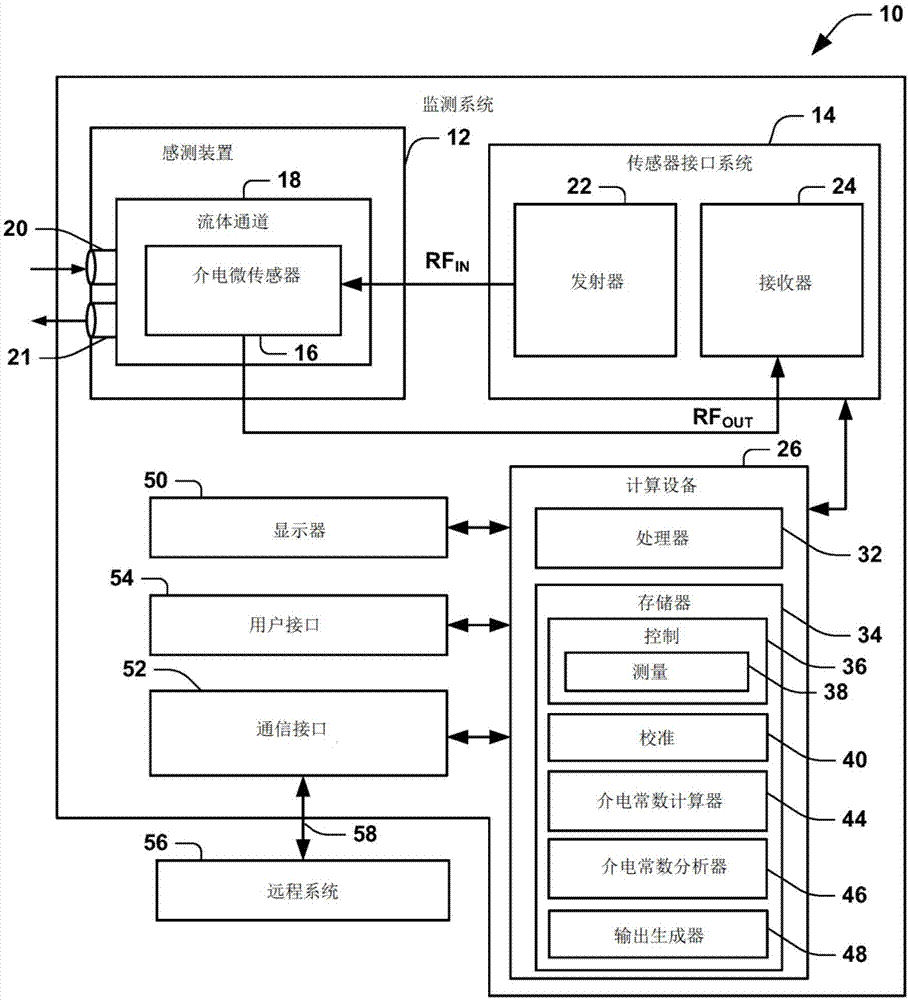
图1描绘了样品监测装置的示例。
图2描绘了介电微传感器的示例的俯视图。
图3描绘了沿着3-3线截取的图2的介电微传感器的示例。
图4是图2的示例传感器的组装图。
图5描绘了另一介电微传感器的示例。
图6描绘了作为时间函数的标准化介电常数的示例,其示出了介电常数参数的示例。
图7是多个不同样品的作为时间函数的介电常数的曲线图。
图8描绘了表现出不同凝结性质的多个样品的介电常数的示例。
图9描绘了作为时间函数的介电常数的另一个示例,示出了血液样品之间的比较。
图10描绘了作为时间函数的介电常数的示例,示出了多个样品的不同血小板功能性质。
图11a和11b示出了与旋转血栓弹力测定法相关的介电常数参数的示例。
图12描绘了便携式样品监测装置的示例。
图13是描绘用于确定被测样品的性质的方法介电常数的示例的流程图。
具体实施方式
本公开涉及用于确定样品的性质的介电感测。例如,介电微传感器、相关的接口电子器件和计算设备可以集成在便携式装置(例如,手持式或台式机)中。可以将微传感器放置在微流体通道内以测量通道中的被测样品(sut)(例如,液体(例如,溶液)或气体)的阻抗性质。测量的阻抗可用于计算在测量间隔的时间上的sut的相应介电常数值。分析基于时间的介电常数值以确定与sut的一个或多个性质相关的介电常数参数。对于给定sut的介电常数参数的示例包括到达峰值介电常数的时间、峰值介电常数值和平台介电常数值之间的差异、与时间间隔的一部分相关联的介电常数值的变化率(例如,斜率)、以及介电常数值的其他函数特征。在一些示例中,可以可拆卸地连接一次性介电微传感器,使得可以重复使用相同的监测装置来对许多不同的sut进行测量。
在使用血液作为sut的示例中,可以分析介电常数值以提供血液sut的抗凝血性质的指示。附加地或可替代地,可以分析介电常数值以提供血液sut的血小板功能的指示。因此可以评估这些和其他性质以确定治疗剂(诸如一种或多种药剂)的功效。作为一个示例,当治疗剂是抗凝血剂(例如,目标特异性(target-specific)口服抗凝血剂,诸如xa因子抑制剂或直接凝血酶抑制剂)时,可以使用本文公开的传感器、监测装置、系统和方法来确定当前剂量的功效以及促进用于实现希望的治疗结果的滴定。结果,本文公开的方法实现了快速、高通量、低成本的ds测量,其能够快速且全面地诊断血小板和凝血缺陷,其可以在护理点使用。
图1描绘了基于样品的介电常数测量来确定被测样品(sut)的性质的系统10的示例。系统10可以包括感测装置12和传感器接口系统14。传感器接口系统14可利用rf输入信号(rfin)来驱动介电传感器16。例如,介电传感器16是介电谱(ds)微传感器,包括驻留在流体通道18中的电路(例如,电极布置)以测量微传感器的阻抗。介电传感器16被配置为具有与其测量的阻抗相对应的介电常数,并且介电常数取决于放置在流体通道18中的sut。例如,可以通过一个或多个流体端口20提供流体sut(例如,来自流体源,诸如微量移液管)到流体通道18中。在一些示例中,流体sut可以仍然基本上在通道18内,或者在其他示例中,它可以在测量期间流过通道。流体通道18可以是微流体通道,其体积例如小于约10μl。
作为示例,介电传感器16可以包括以相对且间隔开的关系分布在通道18中的电极,以在间隔开的电极的相对表面之间提供电容感测区域。例如,悬浮电极可以相对于流体通道的给定表面固定,并与相对于通道的另一表面固定的一对感测电极为间隔开的相对关系。因此,该对感测电极对可以沿着流体通道18的给定表面基本上共面,该流体通道18的给定表面与悬浮电极的表面相对且平行。感测电极中的一个可以被配置为从传感器接口系统14接收作为激发信号的rf输入信号(rfin),并且其他感测电极可以向传感器接口系统提供相应的rf输出信号(rfout)。
传感器接口系统14包括发射器22和接收器24(例如,可以集成到收发器中)。发射器22可以被配置为以希望的激发频率提供rf输入信号。例如,激发频率可以在微波范围内。例如,发射器22可以提供扫过一定范围的频率的rf输入信号,例如从大约1khz到大约100ghz(例如,从大约1khz到大约100mhz)。频率范围可以是激发扫过的连续范围。在其他示例中,发射器22可以在多个不同的离散激发频率下提供rfin,其中可以根据sut和应用要求来设置激发频率。作为一个示例,为了监测血液sut,发射器22可以提供rfin以至少包括大约1mhz和大约100mhz的频率。可以响应于程序输入信号(例如,通过装置的用户接口54或从远程系统56发送)来设置激发频率,以此根据应用要求调整频率以最大化传感器的灵敏度。激发信号的频率范围可以在整个范围内连续或者提供在两个或更多个离散频带中,频率范围可以是用户可编程的(例如,响应于用户输入)。
接收器24被配置为基于来自在感测装置12中实现的介电传感器16的rf输出信号来提供表示测量的传感器传递特征的输出信号(out)。输出信号可以是模拟信号或被转换数字信号(例如,通过模数转换器)。接收器24可以包括被配置为处理rf输出信号的电路,例如通过放大(例如,可变增益)和滤波rf输出信号以确定rfout的复信号分量,其中可以根据激发信号rfin的频率或频率范围来配置滤波。rf输出信号可以是对应于通过介电传感器16的电压传输测量的复信号,其作为在输出节点处所见的复阻抗或导纳的函数而变化(例如,在本文的多个图中在rfout处示出)。也就是说,rfout可以与由通道18内的sut引起的介电常数的变化具有预定关系。
发射器22和接收器24可以在集成电路芯片(例如,片上系统)中实现,或者它们可以实现为被配置为执行本文公开的功能的单独部件。虽然发射器22和接收器24在图1中被示为共同驻留在接口系统14中(例如,在单个集成电路(ic)芯片中),但在其他示例中,发射器和接收器可以实现为独立的单独电路。
在图1的示例中,传感器系统10还包括计算设备26。计算设备26可以包括处理器(例如,具有一个或多个处理器核)32和存储器34。存储器34可以存储指令和数据,且处理器32可以访问存储器以基于存储的数据执行指令以执行本文公开的功能和方法。
例如,存储器34存储控制功能36,控制功能36在由处理器28执行时控制传感器接口系统14的操作。例如,ds控制32可以选择性地控制rf输出信号的频率范围(例如,频带),其中rf输出信号由发射器22施加到每个相应ds传感器16。控制36还包括可由处理器32执行的指令,以基于来自接收器的输出而执行测量功能38。
作为示例,测量功能36被配置为基于输出信号rfout中提供的幅度和相位来测量复阻抗。例如,测量功能38与传感器接口系统14协同操作以作为阻抗分析器操作。以这种方式,测量功能38测量复阻抗,其对应于基于设置在流体通道18内的sut的介电传感器16的电容并响应于输入激发信号rfin。如所提到的,发送器22可以在一个或多个离散频率或扫过一个或多个预定义的频带而提供rfin作为激发信号。因此,测量功能38基于来自传感器16的rf输出信号将阻抗(例如,电容)测量值和相关联的时间戳(例如,时间指数)作为基于时间的阻抗数据存储在存储器34中。附加信息(例如,元数据)也可以存储在阻抗数据中,以此来指定输入信号频率、温度和/或与sut相关的其他参数。
作为另一示例,在测试阶段的第一部分期间,控制36可以控制发射器22在第一频率范围(例如,低频范围)内提供rf输出信号。在感测过程的一个或多个后续或其他不同阶段期间,控制36可以控制发射器22为用于激发设置在流体通道18中的传感器和相关联的sut的一个或多个不同的频率范围而提供rf输入信号。例如,可以使用不同的频率来提取sut的不同性质。因此,接收器24可以接收并提供与感测过程的每个阶段关联的相应输出信号。控制36还可以控制接收器24以提供作为i模式中的dc输出电压和q模式中的另一dc输出电压的rf输出数据。虽然控制功能36和测量功能38已经被描述为计算设备26的一部分,但是在其他示例中,测量功能和控制功能可以分布在传感器接口系统14和计算设备之间,或者可以与计算设备分开实现(例如,作为传感器接口的一部分或作为单独的控制系统)。
计算设备26还可以包括数据处理方法和/或功能36、44和46,用于基于由对于给定测量间隔的测量功能38提供的输出数据来计算介电常数。因此,计算设备26还可以处理来自一个给定传感器(或来自多个传感器)的接收输入信号,并提供输出数据,其中输出数据包括阻抗测量以及介电常数数据和从测量中获得的其它信息,以用于表示复介电常数、对应于测量rf输出信号的原始数据以及从其得到的其他信息。
作为另一示例,计算设备26包括校准功能40,校准功能40被编程为确定给定传感器16的校准介电常数。例如,控制功能36可控制发射器以提供处于或包括预定激发频率(或频带)的rfin,其中已知两个或更多个大体上不同的sut在介电常数上差异很小或没有差异。因此,不同类型的样品可以根据样品利用不同的激发频率进行校准以及测试。对于血液sut的示例,校准输入频率可以是约100mhz。以这种方式,测量的阻抗(例如,电容)对应于水的电容,并且在校准频率下响应于rfin从rfout(例如,通过介电常数计算器44)得到的介电常数提供了传感器16的水介电常数的量度。也就是说,校准电容和介电常数表示传感器16的电容和介电常数,其中在通道18中的sut具有已知的介电常数值(例如,水在100mhz下具有大约80的已知介电常数)。阻抗的校准测量(例如,通过测量功能38)和校准介电常数的确定(例如,通过介电常数计算器44)可以作为正常感测过程的一部分实现,而sut在流体通道18内,如以上所描述的,只要以适当的校准频率提供激发即可。
作为另一示例,如果传感器装置12用于测量在100mhz下的血液的介电常数,则血液的介电常数接近水的介电常数(例如,
在1mhz下确定血液介电常数的示例中,可以使用以下过程。在将感测装置附接到系统10之后,可以将血液插入传感器中(例如,使用微量移液管)。如本文所公开的,在多个频率(例如,从1khz扫至100mhz,或在1mhz和100mhz处)下测量血液的导纳(即,ys,blood)。
在没有sut的情况下计算传感器的标称电容(即,气隙电容或c0),如以下:
其中εr,blood(@100mhz)取为
然后,介电常数计算器44计算在感兴趣的频率下的血液介电常数(即,εr,blood(@1mhz)),如以下:
其中,基于在校准频率(例如,100mhz)下测量的血液导纳来计算c0。
或者,校准测量可以作为每个sut的单独过程来执行,诸如在将任何sut放置在流体通道18中之前执行。校准功能42将校准介电常数值(例如,对应于气隙介电常数或电容)存储在存储器34中。在某些类型的感测中,诸如对于tpeak,可以省略校准功能40,这是因为给定类型材料的到达峰值时间不受校准或不校准传感器的介电常数的影响。
介电常数计算器44也由处理器32执行以确定sut的介电常数。这可以包括用于如上所述确定校准介电常数,以及更一般地在感测期间确定校准介电常数。因此,介电常数计算器44在相应的测量时间间隔上确定介电传感器16和sut的介电常数。该间隔的范围可以从控制40激活传感器接口14以提供rf输入信号的时间到控制42在感测完成时停用传感器接口14的后续时间。测量间隔可以是固定时间,或者可以基于监测测量的电容或确定的介电常数来控制和终止测量间隔。
作为示例,介电常数计算器44可以基于在一个或多个测量频率(例如,一个或多个频带)下测量的阻抗并且基于(例如,由校准功能42确定的)校准介电常数来确定sut的相对介电常数。例如,介电常数计算器44可以通过将测量的阻抗值(例如,电容)除以校准电容值(例如,气隙电容)来计算给定时间指数处和输入频率下的介电常数,以提供sut在给定的时间处的相对介电常数值。另外,在一些示例中,可以相对于第一测量点处的介电常数、峰值介电常数或另一个值来标准化测量间隔上的介电常数值。可以在限定测量时间间隔的时间指数范围内为多个测量数据点中的每一个来计算标准化的相对介电常数值。每个介电常数值可以作为介电常数数据存储在存储器34中以用于进一步处理和分析。如上文所提到的,在一些测量中(例如,峰值时间),可以省略校准,并且介电常数计算器44可以在没有校准介电常数的情况下确定sut的介电常数,并且在一些情况下没有进行标准化。
处理器32还可以执行介电常数分析器46,介电常数分析器46被编程为基于由介电常数计算器44计算的介电常数值来确定一个或多个介电常数参数。介电常数分析器46可以确定测量时间间隔的一个或多个不同部分(包括最长为整个间隔)的参数。作为一个示例,介电常数分析器46在测量时间间隔的一部分上分析存储的介电常数值以确定达到峰值介电常数值所花费的时间(tpeak)。例如,介电常数分析器46使用峰值检测器功能以确定峰值介电常数值,并且因此可以将达到峰值介电常数的时间间隔(例如,经过的时间)作为sut的tpeak存储在存储器中。该时间值tpeak可以是与进行相关阻抗测量时相关联的时间指数,或者可以被确定为开始时间和测量发生时之间的差值以提供tpeak。对于sut是血液sut的示例,tpeak值可以因此提供血液样品的抗凝血性质的指示。tpeak值可以存储在存储器34中。
作为另一个示例,介电常数分析器46可以被编程为分析存储的介电常数值以确定峰值介电常数值(tpeak)和平台介电常数值之间的差值。平台介电常数值可以表示随时间保持基本恒定的介电常数值,例如在测量时间间隔的尾端部分。如本文所用,术语“基本恒定”旨在表示从给定值随时间的足够小的变化率(例如,约+5%或更低)。介电常数分析器46可以例如通过确定在一段时间内介电常数值的时间导数保持小于预定值或为零来确定平台介电常数值。峰值介电常数和平台介电常数值之间的差值可用于提供与sut相关的附加性质的指示。对于血液sut的例子,峰值介电常数和平台介电常数值之间的差值可以提供血小板功能的指示。
在又一个示例中,介电常数分析器46可以在时间间隔的一部分上评估sut的介电常数值以确定介电常数值的变化率,诸如对应于表示介电常数值的弯曲部分的斜率。例如,介电常数分析器46可以确定测量间隔的开始和峰值介电值之间的上升沿斜率。介电常数分析器46还可以计算诸如在tpeak值和平台介电常数值之间的下降沿斜率。可以对峰介电值和平台介电值之间的尾部进行进一步分析,以提供与sut相关的其他性质的指示。
在一些示例中,输出生成器48可以利用计算的介电常数参数tpeak值来在装置10的对应显示器50上呈现相关信息。输出生成器可以将输出提供为包括在显示器50上的展示,诸如一个或多个介电常数参数的图形和/或文本表示。还可以基于一个或多个介电常数参数来提供音频输出。例如,输出发生器48可以显示峰值时间、tpeak、和/或表示测量间隔或其一部分上的介电常数值的曲线的图形输出。作为另一个示例,输出发生器48可以向显示器50提供峰值介电常数值和平台介电常数值之间的差值的指示,诸如可以计算介电常数差值或其缩放版本。输出发生器48还可以被编程为向显示器50提供介电常数曲线的斜率的指示,该斜率的指示与由介电常数分析器46确定的sut的其他相应性质相关联。
在一些情况下,显示器50还可以呈现比较结果,该比较结果是由介电常数分析器46基于将当前结果与已知标准或与相同患者或患者群体的一个或多个先前结果进行比较来确定的。例如,为了用作患者或医疗点装置,还可以生成一组指令并将其作为输出提供给显示器50。如果tpeak值超出预期参数,例如,输出生成器48还可以向显示器50发送警报以通知用户寻求医疗帮助和/或调整处方药物。附加地或可替代地,如果tpeak处的介电常数值与平台介电常数之间的差值在预期参数之外,则输出发生器48可以向显示器提供警报。还可以向显示器50提供相应的结果,包括原始数据和/或其他计算的介电常数信息和分析结果。
如上文提到的,装置包括用户接口54以与系统10交互。用户接口54可以包括触摸屏接口、小键盘、键盘、鼠标、语音接口和/或其组合。作为示例,用户可以使用用户接口54来确认在显示器上呈现的信息,诸如在给定sut的测量间隔之前、期间和之后。附加地或可替代地,用户可以利用用户接口54来输入关于用户的信息(例如,健康和/或人口统计信息)和/或环境条件。用户接口54可用于对装置10进行编程/配置,以用于诸如本文所公开的感测过程的一个或多个部分。例如,用户接口54可用于设置一个或多个频率范围,包括一个或多个频带,以在sut的测试期间用于激发信号。例如,响应于经由用户接口54输入的指令,计算设备26可以利用控制40来指示发射器22进行相应操作。指令可以存储在存储器34或发送器22的其他存储器(例如,程序寄存器)中,以控制在测试过程期间施加的激发信号的频率及其持续时间。附加地或可替代地,用户接口54还可用于控制呈现在显示器38中的信息以及用于执行其他后处理功能(例如,报告功能、记录用户对问题的响应等)和数据分析。
在一些示例中,计算设备26利用通信接口52经由通信链路58与远程系统56通信。通信链路58可以被实现为包括一个或多个物理连接(例如,导电连接或光纤)、一个或多个无线链路(例如,根据802.11x标准或其他短程无线通信来实现)或网络基础设施(其包括一个或多个物理和/或无线通信链路)。
远程系统56可以包括服务器、通用计算设备(例如,笔记本计算机、膝上型计算机、台式计算机、工作站、智能手机等)和/或它可以是被配置为经由链路58与一个或多个装置10交互的专用系统。例如,计算设备26利用通信接口52基于给定sut的测量结果向远程系统56发送介电常数相关信息。作为另一示例,远程系统56可以向装置发送程序指令以配置和/或更新其操作程序指令。在远程系统包括医疗护理提供者的后台系统的示例中,计算设备26可以使用链路58上的安全通信(例如,符合健康保险携带和责任法案(hippa)的通信)来发送原始测量数据的副本和/或由介电常数分析器46确定的结果。在这样的示例中,远程系统56可以与多个装置通信。
如上文所提到的,这种通信可以包括响应于分析器46确定一个或多个sut性质在预期参数之外而发出的警报。在其他示例中,远程系统可以执行这种分析并经由链路向装置返回警报。作为响应,警报可以在显示器上呈现给用户(例如,患者或护理提供者)。无论警报源自何处(例如,由装置或远程系统56生成),这种警报都可以触发相应的通知以发送给及警告一个或多个个人(例如,医疗护理专业人员)。相应的通知可以通过通信协议(诸如电子邮件、sms文本消息、寻呼机、电话呼叫等)传送给每个这样的接收者。
图2、图3和图4示出了三维介电微传感器60(例如,对应于感测装置12)的示例。微传感器60可以电耦合到传感器接口系统(例如,接口14),诸如通过电触点。其他类型的连接(例如,导电或无线)也可用于提供相对于ds感测装置60的双向通信。
在图2、图3和图4的示例中,接口系统(例如,发射器22)向微传感器60的输入78提供rf输入信号。微传感器60包括具有复导纳(例如,电容)的电路,其中复导纳作为流体通道70内的sut的介电常数的函数而变化,诸如本文所公开的。微传感器60包括输出80,输出80经由输出连接(例如,引脚或其他类型的电连接)向接口系统(例如,接口14)提供rf输出信号,其中rf输出信号基于输入频率和sut的介电常数作为时间的函数而变化。
在图2、图3和图4的示例中,微传感器60包括流体通道70,一定体积的sut(例如,液体或气体)可以经由端口72(例如,入口孔和出口孔)引入流体通道70中。为了清楚起见,以下讨论假定sut是流体,例如血液。当然,在其他示例中可以使用其他类型的sut。
微传感器60包括设置在流体通道70内的电容传感器74。例如,电容传感器74包括与流体通道70内的传感器电极78和80隔开并相对的悬浮电极76,以提供测定体积的感测区域(例如,对应于悬浮电极和相关传感器电极之间的重叠区域)。传感器74的电容基于电极76、78和80之间的材料(或材料不存在)的介电常数。电容传感器74中的传感器电极78和80可以彼此电隔离。rf输入信号耦合到输入传感器电极76以激发电容传感器74,并且耦合另一个传感器电极80以提供rfout。
如图3的横截面图所示,传感器74包括平面传感器电极,该平面传感器电极通过微流体通道70与悬浮电极分离,以形成具有标称气隙电容c0的电容感测区域,其由重叠电极区域和微流体通道高度限定。例如,在激发频率ω下,当通道加载具有εr=ε’r-jε"r的复合介电常数的sut时,电容感测区域导纳是ys=ωc0ε"r+jωc0ε’r。在图2-4的示例中,感测结构电连接到输出节点,以在当传感器由输入信号rf/微波信号(vrf)驱动以及流体通道70加载有具有δεr的sut时提供输出信号rfout,诸如vout∝vrfωc0(δε"r+jε’r)。
还如图3的横截面图(以及图4的组装图)所示,微传感器60可以制造成多个部件,这些部件被附接在一起以提供合成的传感器结构。如图4所示,例如,微传感器60包括顶部部分84和底部部分86,底部部分86通过中间通道层88与顶部部分间隔开。底部部分86包括在基底层表面上制造的悬浮电极76。电极78和80设置在其基底层的相应表面上。在该示例中,感测电极78和80各自从基底的相对侧边缘延伸超过微传感器60的中心纵向轴线,以终止于基底的中心部分附近的相应端部。中间部分88具有用于确定形成在其中的通道70的体积的厚度。顶部部分84可包括入口/出口72以提供用于进入由通道70限定的容积的流体连通。例如,部分88中的通道70和相关联的端口72可通过微机械加工(例如,激光微机械加工)或通过其他类型的机械加工或蚀刻技术来制造。在一些示例中,通道70的表面还可以涂覆有聚合物或其他材料(例如,电绝缘膜,诸如聚乙二醇)以帮助防止蛋白质吸附到与蛋白质溶液接触的表面上。例如,聚合物可以通过物理吸附或化学吸附进行施加。
作为另一个示例,图4示出了可用于产生图2的感测装置60和图5的传感器100的传感器制造和组装的示例。为了清楚起见,图4的讨论使用与图2和图3中相同的附图标记。
作为示例,顶部部分84和底部部分86的基底层可以使用聚甲基丙烯酸甲酯(pmma)制造。中间通道基底层88可以由双面粘合(dsa)材料的薄膜层形成,薄膜层厚度远小于含电极的基底层84和86。作为一个示例,每个层84和86可以厚约1.5mm,而层88厚约250μm。根据应用要求可以使用其他相对厚度。
悬浮电极76和传感器电极78和80中的每个可以通过在基底层86和88的相应的相对表面上的希望位置上(例如,与感测电极对齐并且在通道70内)沉积导电材料来形成。例如,悬浮电极106可以是通过使用荫罩和剥离工艺的溅射沉积而沉积在帽的内顶表面上的导电材料(例如,金、铜或铝)。作为示例,在基底的通道表面上蒸发
如图4所示,为了便于感测装置100的构造,层84、86和88中的每一个可包括多个对齐孔90。每个层可通过插入相应的对齐引脚92而连接在一起并保持在适当位置,对齐引脚92可以插入到孔90中。在一些示例中,阻挡材料的薄膜涂层可以沉积在层84、86和88的表面上以保护金属和塑料表面不与sut直接接触。在其他示例中,诸如对于血液sut,可以不使用涂层以帮助增加灵敏度。
在一些示例中,层84中的微流体入口/出口孔70可以配置成具有适配标准微量移液管尖端的直径。作为一个示例,微流体通道70具有小于约10μl(例如,约5-9μl)的总样品体积和在悬浮电极76上方的感测区域中小于约1μl(例如,约0.8μl或更小)的体积。可以根据应用要求来实现通道和感测区域的其他体积。可以通过使用插入基底层84和86之间的dsa膜层88将基底层84和86附接在一起以组装微传感器60。如上文所提到的,对齐孔90和引脚92可用于对齐微流体通道内的感测电极上方的悬浮电极。
如图4的示例中所示,可以通过基底层86的相对侧边缘中的接触开口94进行到感测电极78和80的电连接,基底层86可以电连接到传感器接口系统(例如,到接口14的发射器22和接收器24)。因此,例如,当微传感器60连接到监测装置时,来自(例如传感装置12的)连接器接口的相关电路的连接器(例如,引脚)可以延伸到开口94中以接触相应的电极78和80。
在图2-4的示例中,传感器60与其端子一起被示出,其端子可以电连接到印刷电路板(pcb)上的接口电子器件。在一些示例中,微传感器60和接口系统14之间的连接可以被配置为传感器接触垫和pcb输入/输出垫之间的即插即用型模块连接(例如,使用加载有弹簧的接触引脚来提供电连接)。该连接方法促进使用潜在危险或污染的解决方案进行ds测量,因为在对给定sut进行测量之后可以更换低成本传感器而不会污染整个仪器。也就是说,在一些示例中,微传感器60意图单次使用,其可以在每次使用之后被丢弃和更换,而接口系统14和相关电子器件可以一次又一次地重复使用。在其他示例中,给定传感器可以被反复地重复用于相同或不同sut的多个测量。
图5示出了可在系统10中使用的介电微传感器100(例如,对应于装置12)的另一示例。装置100包括三维平行板的电容感测结构102。电容感测结构102包括两个平面感测电极103和104,平面感测电极103和104间隔开并根据微流体通道108的高度与悬浮电极106分离,以形成设置在微流体通道内的3d电容感测区域。电容感测结构102设置在基底材料110内。感测装置100包括端口112(例如,入口孔和出口孔),可以通过端口112引入一定体积的流体(例如,液体或气体)。
感测装置100的横截面视图与图3的示例中所示的相同,并且可以参考图3及其讨论以理解如何构造不同部分并将其附接在一起得到传感装置。在图5的示例中,感测电极由平行电极形成,平行电极从对应的基底层的公共侧边缘延伸(而不是如图2的示例中的相对侧边缘)。其他配置可以用于感测装置12,诸如美国专利公开no.2015/0346131中公开的示例实施方式,其通过引用并入本文。
在系统10中应用感测装置100,可以将输入rf信号(例如,扫过一个或多个频带)(例如,通过发射器22)施加到输入电极103以激发感测电路。可以在另一个感测电极104处(例如,通过接收器24)测量得到的rf输出信号。可以对测量的信号进行滤波和放大(例如,通过接收器24的模拟和/或数字电路)并对其进行处理(例如,通过计算设备26执行的方法/功能),以计算驻留在通道108内的sut的介电常数。如本文所公开的,可以实施数据处理以在一个或多个预定频率或频带上精确地测量复相对介电常数的实部和/或虚部。
图6描绘了作为时间的函数的标准化介电常数的示例图150,其示出了可以基于测量时间间隔上的介电常数值对于给定的sut确定(例如,通过介电常数分析器46)的介电常数参数的示例。在所示的示例中,测量数据和介电常数值被标准化为在时间tpeak处(其在154处示出)发生的峰值介电常数值152。在示例图150中,示出了以下介电常数参数:到达峰值介电常数的时间(tpeak)(在154处)、初始斜率(s1)(在160处)、在tpeak之后介电常数下降的斜率(s2)(在162处),以及在tpeak之后的介电常数变化幅度(δεr,max),(在158处)。在其他示例中,其他介电常数参数可以通过分析介电常数值(例如,由介电常数分析器46执行)来确定,诸如与测量间隔的端部处的介电常数值的尾部相关联。因此,根据介电常数值150确定的介电常数参数的每个都可以基于ds测量来提供用于量化给定sut的性质的指示。对于血液sut的示例,一些性质可包括血液sut的细胞性质(例如,基于δεr,max158的血小板功能)和/或分子性质(例如,基于tpeak的凝血因子)。
图7描绘了针对多个不同血液sut的作为时间的函数的介电常数的曲线图165(在166处示出)。在图7的示例中,相应测量间隔的介电常数值曲线图示出本文公开的方法产生关于峰值时间(tpeak)参数的可再现结果(在168处示出)。在该示例中,曲线被标准化为介电常数在1mhz下获得的第一测量点。
图8描绘了表现不同凝结性质的多个不同血液sut的介电常数的示例曲线图170。在示例曲线图170中,介电常数值表示来自患有凝血病的患者的血液sut,其中不同的样品表现出达到峰值的不同时间(tpeak)。在该示例曲线图170中,介电常数被标准化为介电常数在1mhz下获得的第一测量点。
图7和图8示出根据本文公开的系统和方法的传感器装置及其用途能够捕获与止血过程相关的各种性质,包括血小板活化和粘附、凝血因子集合和凝血酶产生、以及纤维蛋白形成。作为比较,在图7和图8的曲线图中达到峰值的时间(tpeak)示出图7的正常血液sut相对于图8的凝血病sut之间的统计学显着差异。与常规筛选凝血测定相比,本文公开的方法被认为其表现出较传统的筛选凝固试验而言改善的敏感性,诸如包括活化的部分促凝血酶原激酶时间(aptt)和凝血酶原时间(pt)。
图9描绘了曲线图180,其示出了作为时间的函数的介电常数的另一个示例,示出了血液样品之间的比较。在图9中,曲线图被标准化为介电常数在1mhz下获得的第一测量点。图9的示例曲线图180示出,本文公开的感测装置和相关系统和方法可以提供目标特异性口服抗凝血剂(tsoac)功效的定量指示。例如,图9中的曲线图的介电常数值显示使用tsoac的患者对利伐沙班sut表现出延长的tpeak。图9中所示的误差条表示重复测量,并表示为平均值±平均值的标准误差(sem)。
图10描绘了另一个曲线图190,其示出了作为时间的函数的介电常数的示例,示出了多个样品的不同血小板功能性质。例如,用细胞松弛素d(cyd)处理的sut表现出峰值介电常数值和平台介电常数值(即δεr,max参数)之间的差值减小(在194、196和198处示出),其指示对血小板抑制的敏感性。图190中的误差条表示重复测量并且表示为平均值±sem。在图10的示例中,针对每个经cyd处理的sut示出的介电常数值被标准化为tpeak处的针对激发频率约为1mhz的介电常数(在192处示出)。
图11a和图11b示出了示例曲线图200和210,曲线图200和210示出了介电常数参数,其已经由本文公开的感测装置和相关系统和方法确定,并与旋转血栓弹力测定法(rotem)参数相关。图11a的曲线图200中所示的相关性信息来源于来自健康供体的全血样品,样品在各种浓度的凝血酶和抗凝血酶下混合以调节制备的样品的rotem凝固时间(ct)参数。抗凝血酶和凝血酶对凝血的最终共同途径(即,纤维蛋白生成/交联)分别具有抑制作用加速作用,分别延长和加速rotem测量中的凝固时间。在图11a中,根据本文公开的方法确定的tpeak参数显示出与rotemct参数的非常强的相关性。
对于图11b中的示例曲线图210,将全血样品与各种浓度的cyd混合以调节血小板活性,这转而影响rotem测量中的最大凝块硬度(mcf)参数。在图11b中,根据本文公开的方法,根据ds测量确定的δεr,max参数示出了与rotemmcf参数的强相关性。图11a和图11b中的误差条表示重复测量并且表示为平均值±sem。
本文公开的感测装置和监测系统对由凝血的细胞(即血小板)组分和分子(即凝血因子)组分引起的各种止血缺陷敏感,并且与临床相关的rotem诊断参数相比具有有前景的相关性敏感性。
作为另一示例,图12描绘了ds微系统300的另一示例,其可以实现为集成手持系统(例如,系统10)并可以利用即插即用传感器(例如,传感器16、60或100)。传感器系统300的部件可以由生物相容材料构成,诸如包括金、玻璃和pmma,通常用于生物微流体设备。
在图12的以下描述中,为了清楚起见,参考先前关于图1介绍的部件,使用类似的附图标记来指代系统300的部件。系统300可以包括感测装置12和相关联的接口电子器件14。在图14的示例中,感测装置12包括介电传感器16(例如,对应于示例传感器60或100)。因此,传感器16和接口电子器件14可以被配置为产生复输出,该复输出依赖于(例如,作为后者的数学函数变化)传感器16的微流体传感器通道中设置的sut的响应于激发信号的复介电常数。
作为示例,可以使用微量移液管(或其他设备)302将sut注入传感器16的微流体通道中。传感器接口电子器件14包括发射器电路22以向包含sut体积的给定传感器的输入提供激发信号(例如,在单个频率或一个或多个频带的频率范围下)。传感器16的输出耦合到接收器(例如,接收器24)的相应前端rf模块304(在fe处示出)。每个前端rf模块304被配置为对响应于激发信号接收的每个传输的信号进行预处理(例如,执行下变频、滤波和放大),并提供相应的if信号。来自前端rf模块304中给定的一个的if信号可以被选择性地提供到其他接收器电路306以进行进一步处理(诸如包括转换为信号的数字版本)以及被提供到计算模块26。计算模块26可以基于系统输出信号计算sut的介电常数,以提供作为介电常数数据存储在存储器34中的相应输出介电常数值。介电常数数据可包括在激发频率的总范围上计算的复介电常数值(例如,实和虚介电常数),包括提供到传感器16的不同子范围。介电常数数据还可包括原始信号测量和输入激发频率。计算模块26还可以分析介电常数数据以确定sut的介电常数参数(诸如本文所公开的),sut的介电常数参数可以用于提供sut的性质的指示。可以在显示器310上呈现sut的一个或多个介电常数参数和/或性质。系统300可以包括用户接口(ui)312,ui312提供人机接口以使用户能够与系统300交互,诸如查看结果、重置系统或执行其他人机交互。
计算模块26还可以向通信模块28提供介电常数数据及其分析。通信模块28可以将输出数据和原始测量数据发送到远程系统。例如,通信模块28可以将输出数据传输到后台系统(例如,服务器),后台系统可以被编程为分析数据并将结果和原始数据存储在数据库中。远程系统还可以将命令信息传送到系统300以编程一个或多个系统参数(例如,信号增益和/或频率范围)以控制其操作和/或向用户提供指令,诸如本文所公开的。图12的系统300可以包括壳体,壳体包含传感器接口电子器件14、计算模块26和通信模块28,以使得系统300可以提供便携式手持设备。系统300还可以包括电源314,诸如内部电池和/或连接到外部电源的电源接口。
虽然图12的示例系统是手持设备,但是在其他示例中,系统300可以实现为台式系统。在该示例中,系统300可以被配置为测量多个介电传感器16(其中的每个具有各自的sut)的介电常数。每个传感器可以包括或共享相应的接口,以向计算模块26提供相应的测量数据,用于计算每个相应sut的介电常数值。以这种方式,实验室或其他提供者可以同时监测多个样品。
图13是描绘用于测量介电常数并确定sut的性质的方法400的示例的流程图。方法开始于402,其将介电微传感器(例如,传感器16)附接到接口系统(例如,接口14)。例如,介电微传感器包括集成到微流体通道(例如,通道18)中的电容感测结构,该微流体通道包括流体输入部以接收sut的样品体积。因此,402处的附接可以将接口系统的发射器和接收器连接到介电微传感器的相应输入和输出。
在404处,将sut置于介电微传感器的微流体通道内。一旦sut在介电微传感器内,方法就前进到406并且将输入射频(rf)信号提供到介电微传感器。例如,接口系统的发射器(例如,发射器22)将rf输入信号提供到微传感器的输入。rf输入信号可以包括一个或多个频率,包括校准频率(其被用于(例如,通过介电常数计算器44)确定介电微传感器的校准介电常数,诸如对应于气隙的介电常数,如本文所公开的)。
在408处,响应于输入rf信号从介电微传感器接收输出rf信号。rf输出信号表示设置在介电微传感器中的sut的阻抗(例如,电容)的量度。输入和输出信号可以在测量时间间隔(例如,固定时间或取决于测量的时间)上在介电微传感器和接口系统之间传送。
在410处,基于输出rf信号在测量时间间隔上计算sut的介电常数值。如本文所公开的,介电常数可以计算为相对介电常数并且标准化为选择的介电常数值(例如,到达峰值的介电常数)。例如,校准介电常数也可以被应用于介电常数值(例如,将测量的介电常数值除以校准介电常数值)以提供sut的相对介电常数值。介电常数值可以存储在存储器(例如,存储器34)中。
在412处,在测量时间间隔的至少一部分上分析sut的介电常数值以确定sut的一个或多个介电常数参数。例如,在412处的分析包括确定达到峰值介电常数值的时间。例如,在sut包括血液样品的情况下,分析可以包括基于达到峰值介电常数值的时间来确定血液样品的抗凝血性质的指示。抗凝血性质的指示还可以表示抗凝治疗(诸如目标特异性口服抗凝血剂)的治疗效果。
附加地或可替代地,在412处的分析可以包括确定达到峰值的介电常数值和平台介电常数值之间的差值,诸如本文所公开的。例如,差值可用于确定血液样品的血小板功能的指示。可以分析介电常数值以确定可以指示sut的细胞和/或分子性质的其他参数,诸如本文所公开的。在测量时间间隔完成之后,方法进行到414并且可以从接口系统移除介电微传感器。可以附接另一个介电微传感器,并且重复方法400以分析另一个sut的性质。在一些示例中,方法400中使用的介电微传感器是一次性使用的设备,其可以被附接以感测sut的性质,并且在完成测试之后,根据适当的处理程序将其移除并处置。
因此,鉴于前述内容,本文公开的ds微系统可以提供低功率、低成本且便携的仪器,用于使用μl样品体积在宽频率范围下快速提取表征生物或其他样品溶液的分子和/或细胞性质的关键信息。所提出的传感器级测量技术可用于实现介电常数测量的高分辨率。
以上描述的是示例。当然,不可能描述结构、组件或方法的所有可想到的组合,但是本领域普通技术人员将认识到许多其他组合和置换是可能的。因此,本发明意图涵盖落入本申请范围(包括所附权利要求)内的所有这些改变、修改和变化。
在本公开或权利要求书记载“一个”、“一”、“第一”、或“另一个”元素或其等同物的情况下,应该将其解释为包括一个或多个这样的元素,既不要求也排除两个或更多这样的元素。如本文所用,术语“包括”意为包括但不限于。术语“基于”意为至少部分基于。
- 还没有人留言评论。精彩留言会获得点赞!