心肌肌钙蛋白的测定方法及测定试剂与流程
本发明涉及一种心肌肌钙蛋白的测定方法及测定试剂。
背景技术:
心肌肌钙蛋白参与心肌收缩的调节,以由心肌肌钙蛋白i、肌钙蛋白c、心肌肌钙蛋白t的3种亚单元构成的复合体的形态存在。心肌肌钙蛋白i和心肌肌钙蛋白t均在心脏中特异性地表达,心肌细胞受伤害时,被释放到血中,因此,在心肌梗塞的诊断、心脏疾病的监测中作为血中标记物被利用。
作为与心肌肌钙蛋白的测定关联的技术,报道了以下技术。
专利文献1中记载有:通过利用含有给定的阴离子型表面活性剂(具有1个磺酸基的烷基)的基质,可以将标准液中的心肌肌钙蛋白稳定化。专利文献2中记载有:在心肌肌钙蛋白的免疫学测定中,可以利用2价的阳离子。
现有技术文献
专利文献
专利文献1:国际公开第2006/116005号
专利文献2:日本专利第5864530号
技术实现要素:
发明所要解决的技术问题
血中的心肌肌钙蛋白作为心肌梗塞的诊断标记物被广泛利用,但在血中以由心肌肌钙蛋白i、肌钙蛋白c及心肌肌钙蛋白t构成的复合体形式存在,且与血中成分形成复合体。特别是心肌肌钙蛋白i容易由于其它成分等的状态而改变性状,如在肝素存在下与肝素显示相互作用,容易被血中蛋白酶分解等,在使用抗肌钙蛋白抗体的免疫测定中不显示稳定的值,因此,被看作不稳定的蛋白质。例如,将血清用作血液试样的情况的心肌肌钙蛋白i的测定值、及将血浆用作血液试样的情况的心肌肌钙蛋白i的测定值有时不一定显示相同的值。在医疗现场,含有各种抗凝固剂(例如肝素、edta、柠檬酸)的采血管被用于血浆的制备,但血浆中的心肌肌钙蛋白i的测定值有时根据用于血浆的制备的抗凝固剂的种类而显示不同的值。另外,在检测中使用不同抗体时,测定试剂间也可看到肌钙蛋白测定值的背离。因此,存在如下问题:在测定心肌肌钙蛋白i量的心肌梗塞的诊断中,在免疫测定法中难以规定心肌肌钙蛋白i的真值,因此,难以设定不受试样的种类或其它成分的影响的正常人的固定值。心肌肌钙蛋白t的测定仅使用单一的测定法,因此,如肌钙蛋白i那样的测定值背离的问题不严重,但如果报道了多种测定方法的情况下,有可能产生与心肌肌钙蛋白i同样的问题。
本发明的目的在于,提供一种心肌肌钙蛋白的测定方法及测定试剂,所述测定方法不论试样种类或有无其它成分均可更准确地测定试样中所含的心肌肌钙蛋白量。
用于解决问题的技术方案
本发明人等为了实现上述目的进行了深入研究,结果发现,在使用以免疫学方式测定生物体试样中的心肌肌钙蛋白i的方法时,通过在将所述生物体试样供于免疫反应之前设置前处理工序,不论生物体试样的种类或有无其它成分,均可得到再现性好的心肌肌钙蛋白测定值,从而完成了本发明,其中,所述前处理工序将含有表面活性剂及酸性化剂中的任一种或两者的前处理液进行混合。
本发明的构成如下所述。
(1)一种通过免疫分析测定从生物体中分离出的试样中的心肌肌钙蛋白的方法,其包含前处理工序,所述前处理工序将从生物体中分离出的试样和含有表面活性剂及酸性化剂中的任一种或两者的前处理液进行混合。
(2)根据(1)所述的方法,其中,所述前处理液还含有还原剂。
(3)根据(1)或(2)所述的方法,其中,所述前处理液含有表面活性剂,该表面活性剂为选自由阴离子型表面活性剂、阳离子型表面活性剂、两性表面活性剂、非离子型表面活性剂构成的组中的1种以上的表面活性剂。
(4)根据(3)所述的方法,其中,所述表面活性剂为阴离子型表面活性剂。
(5)根据(3)所述的方法,其中,所述前处理工序在加热条件下进行。
(6)根据(1)所述的方法,其中,所述前处理液含有酸性化剂,前处理工序中的酸性化剂的终浓度超过0.05n且为0.5n以下。
(7)根据(1)~(6)中任一项所述的方法,其中,所述心肌肌钙蛋白为心肌肌钙蛋白i。
(8)一种心肌肌钙蛋白的免疫分析用试剂,其具备含有表面活性剂及酸性化剂中的任一种或两者的前处理液。
发明效果
根据本发明,可以提供一种心肌肌钙蛋白的测定方法及测定试剂,其通过使心肌肌钙蛋白从其它成分游离并降低相互作用导致的影响,不论试样的种类或有无其它成分,均可更准确地测定试样中所含的心肌肌钙蛋白量。另外,根据本发明,可以提供一种心肌肌钙蛋白的测定方法及测定试剂,其通过使心肌肌钙蛋白的性状均匀化,能够以高灵敏度稳定地测定心肌肌钙蛋白。
附图说明
图1是表示利用市售测定试剂得到的血清中的心肌肌钙蛋白i测定值、和利用伴有酸性化前处理的本发明的测定方法得到的血清中的心肌肌钙蛋白i测定值的相关性的图。
图2是表示在伴有酸性化前处理的本发明的测定方法中显示高值的被检体的凝胶过滤色谱法的各级分对心肌肌钙蛋白i的检测给予的影响的图。
图3是表示伴有酸性化前处理的本发明的测定方法中的前处理液的酸浓度和测定值的关系的图。
具体实施方式
<心肌肌钙蛋白的测定方法>
用本发明的方法所测定的心肌肌钙蛋白可以为心肌肌钙蛋白i、肌钙蛋白c及心肌肌钙蛋白t中的任一种,优选为心肌肌钙蛋白i。心肌肌钙蛋白i(ctni)为构成参与心肌收缩的调节的心肌肌钙蛋白复合体的3种亚单元(肌钙蛋白i、c及t)之一。本发明中所测定的心肌肌钙蛋白为源自任意动物的心肌肌钙蛋白,优选为源自哺乳动物(例如人、猴子、黑猩猩等灵长类;马、大鼠、兔等啮齿类;狗、猫等宠物;猪、牛等家畜;马、绵羊等驯化动物)的心肌肌钙蛋白,更优选为源自灵长类的心肌肌钙蛋白,特别优选为源自人的心肌肌钙蛋白。关于源自人的心肌肌钙蛋白i的氨基酸序列,例如参照genbank:caa62301.1。当然,源自人的心肌肌钙蛋白i并不限定于由上述编号中所参照的氨基酸序列构成的心肌肌钙蛋白i,也可以为其变异体(例如天然地产生的变异体)。另外,本发明中所测定的心肌肌钙蛋白i可以在生物体试样中以游离型、与肌钙蛋白c和/或肌钙蛋白t的复合体的形态、及与自身抗体等其它分子的复合体的形态存在。关于源自人的肌钙蛋白c的氨基酸序列,例如参照genbank:aaa36772.1。关于源自人的心肌肌钙蛋白t的氨基酸序列,例如参照genbank:caa52818.1。
1.前处理工序
本发明的方法为通过使生物体试样和抗体反应、即免疫反应而测定存在于生物体试样中的心肌肌钙蛋白i的方法,其特征在于,包含在免疫反应(反应工序)之前将生物体试样和前处理液混合的前处理工序。通过前处理工序,可以使心肌肌钙蛋白i为游离状态,降低与其它蛋白质等成分的相互作用的影响。前处理液可以含有表面活性剂及酸性化剂中的任一种,也可以含有两者。优选前处理液含有表面活性剂或酸性化剂中的任一种。
在所述前处理工序中进行混合的生物体试样和前处理液的体积比优选设为1:10~10:1,特别优选设为1:5~5:1,进一步优选设为1:3~3:1。本发明中所使用的生物体试样只要是可能含有心肌肌钙蛋白i的试样,就没有特别限定,可举出例如:血清、血浆、全血、尿、便、口腔粘膜、咽粘膜、肠道粘膜及活检试样(例如肠道试样、肝脏试样)。优选生物体试样为血清或血浆。
作为所述前处理液中所含的表面活性剂,可以使用阴离子型表面活性剂、阳离子型表面活性剂、两性表面活性剂、非离子型表面活性剂中的任一种,特别优选阴离子型表面活性剂。作为阴离子型表面活性剂,可以优选使用十二烷基硫酸钠(sds)、n-月桂酰肌氨酸钠(nls)、十二烷基硫酸锂、十二烷基苯磺酸钠、脱氧胆酸等,特别可以优选使用sds、nls。作为阳离子表面活性剂,例如可以使用十六烷基三甲基氯化铵(c16tac)、十六烷基三甲基溴化铵(ctab)等。作为两性表面活性剂,例如可以使用chaps等。作为非离子型表面活性剂,例如可以使用tween20、tritonx-100等。表面活性剂的浓度需要为足以使心肌肌钙蛋白i从其它蛋白质等游离的浓度,作为与生物体试样混合成的混合液的前处理时的浓度,优选设为0.1~12.5%,特别优选设为0.25~10%,进一步优选设为0.5~7.5%。通过将表面活性剂浓度设为0.1~12.5%,发挥使心肌肌钙蛋白i充分地游离、且不易发生析出等效果。
作为所述前处理液中所含的酸性化剂,可以优选使用盐酸、硫酸、乙酸等。前处理液的酸的当量度以前处理时的浓度计优选设为超过0n且0.5n以下,特别优选设为0.03n以上且0.125n以下。在前处理中使用酸性化剂的情况下,优选以在与生物体试样的混合时不产生沉淀的方式添加阳离子型表面活性剂。作为阳离子表面活性剂,特别优选在同一分子中具有碳原子数10个以上的一条链烷基和叔胺或季铵盐的阳离子型表面活性剂。作为这种表面活性剂的实例,可举出:癸基三甲基氯化铵、十二烷基三甲基氯化铵、十四烷基三甲基氯化铵、十六烷基三甲基氯化铵(c16tac)、癸基三甲基溴化铵、十二烷基三甲基溴化铵、十四烷基三甲基溴化铵、十六烷基三甲基溴化铵(ctab)、氯化十二烷基吡啶鎓、氯化十四烷基吡啶鎓、氯化十六烷基吡啶鎓等。阳离子表面活性剂的添加量以与被检体混合时的浓度计优选0.01%以上且15%以下,进一步优选0.05%~10%。
在前处理液中,优选进一步使用还原剂。作为还原剂,2-(二乙基氨基)乙硫醇盐酸盐(deaet)、三(2-羧基乙基)膦盐酸盐(tcep)、二硫苏糖醇(dtt)、2-巯基乙醇、硫代甘油、亚硫酸钠、硼氢化物等现有的还原剂均可以使用,但可以以溶液中的稳定性的理由特别优选使用deaet、tcep。作为还原剂的浓度,以前处理时的浓度计优选设为0.1~200mm,特别优选设为0.5~100mm,进一步优选设为1.0~40.0mm。
前处理液中根据需要可以含有尿素、硫脲等其它蛋白变性剂。变性剂的浓度以处理时浓度计优选0.1m以上,进一步优选0.5m以上且低于4m。另外,在前处理液中,为了增强处理效果,可以添加单糖类、二糖类的任一种、或将它们组合而添加。进而,在前处理液中可以含有螯合剂。已知心肌肌钙蛋白i在钙离子等二价阳离子存在下容易与肌钙蛋白c等产生相互作用。通过使用螯合剂,可以避免钙离子等的影响,使心肌肌钙蛋白i容易游离。作为螯合剂,edta、柠檬酸、egta、植酸等均可以使用,但特别优选使用edta。
就前处理工序而言,优选将生物体试样和前处理液混合之后,进一步进行加热。特别是在前处理液中使用表面活性剂的情况下,为了提高其效果,优选进行加热。加热温度优选设为35~95℃,特别优选设为50~90℃,进一步优选设为70~85℃。另外,加热时间优选设为1分钟以上,特别优选设为3分钟以上,进一步优选设为5分钟以上。加热时间不存在特别的上限,通常为60分钟以下、特别为30分钟以下的加热时间即可。
前处理工序可以具备:在混合生物体试样和前处理液后,进一步添加中和液而进行混合的中和处理。特别是在前处理液中使用酸性化剂的情况下,对于在其后的反应工序(抗原抗体反应)之前将混合液的ph调整为适于反应的状态是有用的。作为中和液,可以优选使用氢氧化钠、氢氧化钾等碱化剂及含有n,n-二(羟乙基)甘氨酸(bicine)、tricine等ph缓冲剂的溶液。在中和液中,可以进一步含有sds、nls等表面活性剂。
2.反应工序
本发明的方法的上述前处理工序得到的生物体试样混合液接着被供于免疫分析的反应工序。在反应工序中,使生物体试样混合液与缓冲液混合,使混合液中的抗原与针对心肌肌钙蛋白的抗体进行反应。
作为所述缓冲液,可举出例如以mes缓冲液、磷酸缓冲液、柠檬酸缓冲液、tris缓冲液、碳酸缓冲液为基础的溶液,特别可以优选使用以磷酸缓冲液、柠檬酸缓冲液为基础的溶液。另外,为了使前处理的效果持续,缓冲液可以含有edta等螯合剂。在使用含有表面活性剂的溶液作为前处理液的情况下,例如优选使用:含有以与前处理后的混合液混合时的终浓度计为0.01~10%、特别为0.05~5.0%左右的bsa、聚乙烯基吡咯烷酮(pvp)、聚乙烯醇(pva)、葡聚糖硫酸钠等水溶性高分子的缓冲液。另外,在使用含有酸性化剂的溶液作为前处理液的情况下,优选使用含有碱剂、或可缓和前处理液的酸的影响的具有缓冲能力的缓冲液。前处理工序的混合液和缓冲液的混合优选以体积比计设为1:10~10:1,特别优选设为1:5~5:1,进一步优选设为1:3~3:1。
本发明的方法中所使用的针对心肌肌钙蛋白的抗体为将心肌肌钙蛋白的氨基酸序列的至少一部分作为表位来识别的抗体。作为针对心肌肌钙蛋白i的抗体所识别的表位,已知有以特异的表位为主的各种物质(例如filatovvletal.,biochem.mol.biol.int.1998,45(6):1179-1187;国际公开第2012/115221号)。因此,针对心肌肌钙蛋白i的抗体没有特别限定,可以为识别这种各种表位的抗体,但可以优选使用具有识别游离的心肌肌钙蛋白i的性质的抗体。特别优选对游离(单独)的心肌肌钙蛋白i的反应性比对形成了复合体的心肌肌钙蛋白的反应性高的抗体。作为这种抗体的表位,可举出例如与肌钙蛋白c的结合部位重复的区域(第43号~第65号的氨基酸残基)或其一部分区域。另外,可举出例如和与心肌肌钙蛋白t的结合部位重复的区域(第66号~第89号)或其一部分区域。这种表位区域在通常的被检体中存在于复合体的内部,因此,不易受到分解,可稳定地存在。需要说明的是,本说明书中的心肌肌钙蛋白i蛋白质的氨基酸编号以genbank:caa62301.1中记载的氨基酸序列(序列编号1)为基准。
针对心肌肌钙蛋白i的抗体可以为容易获得的市售抗体。在源自人的心肌肌钙蛋白i的氨基酸序列中,可举出例如由第20号~第60号的氨基酸残基构成的肽部分中所发现的表位(例如由第24~40号、或第41~49号的氨基酸残基构成的肽)、由第61号~第120号的氨基酸残基构成的肽部分中所发现的表位(例如由第86~90号的氨基酸残基构成的肽)、由第130号~第150号的氨基酸残基构成的肽部分中所发现的表位、及由第160号~第209号的氨基酸残基构成的肽部分中所发现的表位。优选针对心肌肌钙蛋白i的抗体为识别心肌肌钙蛋白i特异性表位(特别是人心肌肌钙蛋白i特异性表位)的抗体。
针对心肌肌钙蛋白的抗体可以为多克隆抗体或单克隆抗体中的任一种。针对心肌肌钙蛋白的抗体可以为免疫球蛋白(例如igg、igm、iga、igd、ige、igy)的任一种同种型。针对心肌肌钙蛋白的抗体另外可以为全长抗体。全长抗体是指包含分别含有可变区及恒定区的重链及轻链的抗体(例如含有2个fab部分及fc部分的抗体)。针对心肌肌钙蛋白的抗体另外可以为源自这种全长抗体的抗体片段。抗体片段为全长抗体的一部分,可举出例如恒定区缺失抗体(例如f(ab’)2、fab’、fab、fv)。针对心肌肌钙蛋白的抗体另外可以为单链抗体等改造抗体。
针对心肌肌钙蛋白的抗体可以使用以往公知的方法制作。例如,针对心肌肌钙蛋白的抗体可以将上述的表位用作抗原而制作。另外,市售有识别如上所述的表位的多种针对心肌肌钙蛋白的抗体,因此,也可以使用这种市售品。
针对心肌肌钙蛋白的抗体可以固定于固相。本说明书中,有时将固定于固相的抗体简称为固相化抗体。作为固相,可举出例如可收容或搭载液相的固相(例如板、薄膜、试管等支撑体及孔板、微流路、玻璃毛细管、纳米柱、独石柱等容器)、以及可悬浮或分散于液相中的固相(例如粒子等固相载体)。作为固相的材料,可举出例如玻璃、塑料、金属、及碳。作为固相的材料,另外可以使用非磁性材料、或磁性材料,从操作的简便性等观点出发,优选磁性材料。固相优选为固相载体,更优选为磁性固相载体,进一步更优选为磁性粒子。作为抗体的固相化方法,可以利用以往公知的方法。作为这种方法,可举出例如:物理性吸附法、共价键法、利用亲和性物质(例如生物素、链霉亲和素)的方法、及离子键法。在特定的实施方式中,针对心肌肌钙蛋白的抗体为固相化于固相的抗体,优选为固相化于磁性的固相的抗体,更优选为固相化于磁性粒子的抗体。
就反应工序而言,可以将前处理工序的混合液和缓冲液进行混合之后,与进行了固相化的抗体接触,另外,也可以在缓冲液中预先放入例如固相化于粒子的抗体而制成粒子液,使所述混合液和粒子液混合。就反应工序而言,例如可以如免疫凝集法或竞争法那样仅以一次反应工序实施,也可以设置二次反应工序。需要说明的是,设置二次反应工序的情况下,可以在一次反应工序和二次反应工序之间设置用于除去未反应成分的清洗工序。
针对心肌肌钙蛋白的抗体可以用标记物质进行标记化。本说明书中,有时将用标记物质进行了标记化的抗体简称为标记化抗体。作为标记物质,可举出例如:酶(例如过氧化物酶、碱性磷酸酶、荧光素酶、β半乳糖甙酶)、亲和性物质(例如链霉亲和素、生物素)、荧光物质或蛋白质(例如荧光素、异硫氰酸荧光素、若丹明、绿色荧光蛋白、红色荧光蛋白)、发光或吸光物质(例如荧光素、水母蛋白、吖啶鎓、钌)、放射性物质(例如3h、14c、32p、35s、125i)。另外,在本发明的方法中设置二次反应的情况下,用于二次反应的抗体也可以用这种标记物质进行标记化。
在特定的实施方式中,本发明的方法包含其它抗体作为用于二次反应的抗体,所述其它抗体针对心肌肌钙蛋白、且识别与针对心肌肌钙蛋白的抗体不同的表位。这种其它抗体所识别的表位的详细情况,与上述的关于针对心肌肌钙蛋白的抗体而详述的表位同样(其中,并用的情况下,表位的种类不同)。针对心肌肌钙蛋白的抗体所识别的表位与针对心肌肌钙蛋白的其它抗体所识别的表位的组合没有特别限定。例如,使用识别在由第20号~第60号的氨基酸残基构成的肽部分中所发现的特定的表位(例如由第24~40号、或第41~49号的氨基酸残基构成的肽)的抗体作为针对心肌肌钙蛋白i的抗体的情况下,作为针对心肌肌钙蛋白i的其它抗体,可以使用识别该特定的表位以外的表位、例如在由第20号~第60号的氨基酸残基构成的肽部分中所发现的其它表位(例如由第24~40号、或第41~49号的氨基酸残基构成的肽)、在由第61号~第120号的氨基酸残基构成的肽部分中所发现的表位(例如由第86~90号的氨基酸残基构成的肽)、在由第130号~第150号的氨基酸残基构成的肽部分中所发现的表位、或在由第160号~第209号的氨基酸残基构成的肽部分中所发现的表位的抗体。例如,在利用夹心法的情况下优选应用这种其它抗体。
3.检测工序
在一抗或二抗使用了标记的情况下,通过适于所使用的标记的方法、例如在使用酶标记的情况下添加酶的底物而检测。例如,将碱性磷酸酶(alp)用作标记抗体的情况下,可以设为将3-(2’-螺金刚烷)-4-甲氧基-4-(3’-磷酰氧基)苯基-1,2-二氧杂环丁烷·2钠盐(amppd)用作酶底物的化学发光酶免疫测定法(cleia)的体系。
本发明的方法为使用针对心肌肌钙蛋白的抗体的免疫分析。作为这种免疫分析,可举出例如直接竞争法、间接竞争法、及夹心法。另外,作为这种免疫分析,可举出:化学发光酶免疫测定法(cleia)、化学发光免疫分析(clia)、免疫比浊法(tia)、酶免疫测定法(eia)(例如直接竞争elisa、间接竞争elisa、及夹心elisa)、放射免疫分析(ria)、胶乳凝集反应法、荧光免疫分析(fia)、及免疫色谱法。这些免疫分析本身为公知的,没必要在此详细地叙述,分别简单地进行说明。
直接竞争法为如下方法:将针对待测定的靶抗原(本发明中为心肌肌钙蛋白i)的抗体固相化于固相(关于固相及固相化,如上所述),在用于防止非特异吸附的封闭处理(用血清白蛋白等蛋白质溶液处理固相)后,使该抗体、含有所述靶抗原的被检试样(本发明中为如上所述进行了前处理工序的生物体试样)和一定量的标记后的抗原(标记如上所述)反应,清洗后,对与固相结合的标记进行定量。被检试样中的抗原和标记抗原与抗体竞争地结合,因此,被检试样中的抗原量越多,与固相结合的标记的量越少。制作各种已知浓度的抗原标准液,分别固相化于固相并测定标记量(根据标记的性质而测定吸光度、发光强度、荧光强度等,以下相同),制作以抗原浓度为横轴、以标记量为纵轴的标准曲线。对未知的被检试样,测定标记量,通过将所测定的标记量代入标准曲线,可以测定未知的被检试样中的抗原量。直接竞争法本身在该领域中为公知的,例如记载于us20150166678a1。
在间接竞争法中,将靶抗原(本发明中,为心肌肌钙蛋白i)固相化于固相(关于固相及固相化,如上所述)。接着,在固相的封闭处理后,将含有靶抗原的被检试样(本发明中为如上述那样进行了前处理工序的生物体试样)和一定量的抗靶抗原抗体进行混合,使其与所述固相化抗原反应。清洗后,对与固相结合的所述抗靶抗原抗体进行定量。其可以通过使针对所述抗靶抗原抗体的标记的二抗(标记如上所述)反应、清洗后测定标记量而进行。制作各种已知浓度的抗原标准液,分别固相化于固相而测定标记量,制作标准曲线。对未知的被检试样,通过测定标记量并将所测定的标记量代入标准曲线,可以测定未知的被检试样中的抗原量。需要说明的是,也可以不使用标记二抗而使用标记的一抗。间接竞争法本身在该领域中为公知的,例如记载于上述的us20150166678a1。
夹心法为如下方法:将抗靶抗原抗体固相化于固相(关于固相及固相化,如上所述),在封闭处理后,使含有靶抗原的被检试样(本发明中为如上述那样进行了前处理工序的生物体试样)反应,清洗后,使针对靶抗原的标记的二抗(标记如上所述)反应,清洗后,对与固相结合的标记进行定量。制作各种已知浓度的抗原标准液,分别测定固相化于固相的标记量,制作标准曲线。对未知的被检试样,通过测定标记量并将所测定的标记量代入标准曲线,可以测定未知的被检试样中的抗原量。夹心法本身在该领域中为公知的,例如记载于us20150309016a1。
上述的各种免疫分析中,化学发光酶免疫分析法(cleia)、化学发光免疫分析(clia)、酶免疫分析法(eia)、放射免疫分析(ria)、荧光免疫分析(fia)为基于在进行上述的直接竞争法、间接竞争法、夹心法等时使用的标记种类而进行分类的免疫分析。化学发光酶免疫分析法(cleia)为使用酶(例如上述的碱性磷酸酶)作为标记、使用产生化学发光性化合物的底物(例如上述的amppd)作为底物的免疫分析。酶免疫分析法(eia)为使用酶(例如上述的过氧化物酶、碱性磷酸酶、荧光素酶、β半乳糖甙酶等)作为标记的免疫分析。作为各酶的底物,使用可通过吸光度测定等而定量的化合物。例如,在过氧化物酶的情况下,使用1,2-亚苯基二胺(opd)或3,3′5,5′-四甲基联苯胺(tmb)等,在碱性磷酸酶的情况下,使用对硝基苯基磷酸酯(pnpp)等,在β-半乳糖甙酶的情况下,使用mg:4-甲基伞形基半乳糖甙、ng:硝基苯基半乳糖甙等,在荧光素酶的情况下,使用荧光素等。放射免疫分析(ria)为使用放射性物质作为标记的方法,作为放射性物质,如上所述可举出3h、14c、32p、35s、125i等放射性元素。荧光免疫分析(fia)为使用荧光物质或荧光蛋白作为标记的方法,作为荧光物质或荧光蛋白,如上所述可举出荧光素、异硫氰酸荧光素、若丹明、绿色荧光蛋白、红色荧光蛋白等。使用这些标记的免疫分析本身在该领域中为公知的,例如记载于us8039223b或us20150309016a1。
免疫比浊法(tia)为利用了因通过待测定的靶抗原(本发明中,为心肌肌钙蛋白i)和针对该抗原的抗体的抗原抗体反应而生成的抗原抗体复合物而浊度增大的现象的免疫分析。在抗靶抗原抗体溶液中添加各种已知浓度的抗原,分别测定浊度,制作标准曲线。对未知的被检试样,同样地测定浊度,将所测定的浊度代入标准曲线,由此可以测定未知的被检试样中的抗原量。免疫比浊法本身为公知的,例如记载于us20140186238a1。胶乳凝集法与免疫比浊法类似,为使用表面固定有抗靶抗原抗体的胶乳粒子的悬浮液取代免疫比浊法中的抗体溶液的方法。免疫比浊法及胶乳凝集法本身在该领域中为公知的,例如记载于us820,398b。
免疫色谱法为在由滤纸、纤维素薄膜、玻璃纤维、无纺布等多孔性材料形成的基体(也称为基质或条板)上进行上述的夹心法或竞争法的方法。例如,利用夹心法的免疫色谱法的情况下,将固定化有抗靶抗原抗体的检测区域设置于上述基体上,将含有靶抗原的被检试样(本发明中为如上述那样进行了前处理工序的生物体试样)添加于基体,从上游侧使展开液流动而使靶抗原移动至检测区域,将其固定化在检测区域。将固定化的靶抗原用标记的二抗夹在中间,对被固定化在检测区域的标记进行检测,由此检测被检试样中的靶抗原。通过将含有标记二抗的标记区域形成于检测区域的更上游侧,靶抗原和标记二抗的结合体被固定化在检测区域。在标记为酶的情况下,含有酶的底物的底物区域也设置于检测区域的更上游侧。在竞争法的情况下,例如将靶抗原固定化在检测区域,可以使被检试样中的靶抗原和固定化在检测区域的靶抗原竞争。在检测区域的更上游侧设置标记抗体区域,使被检试样中的靶抗原和标记抗体反应,通过在检测区域固定化未反应的标记抗体并对标记进行检测或定量,可以检测或定量被检试样中的靶抗原。免疫色谱法本身在该领域中为公知的,例如记载于us6210898b。
<心肌肌钙蛋白i的测定试剂>
本发明的心肌肌钙蛋白的测定试剂为可实现上述的心肌肌钙蛋白的测定方法的测定试剂。本发明的测定试剂的特征在于,除通常的免疫分析中所使用的构成之外,包含含有表面活性剂及酸性化剂中的任一种或两者的前处理液作为构成成分。
本发明的试剂在相互隔离的形态或组合物的形态中含有各构成成分。具体而言,各构成成分可以以分别收容于不同的容器(例如管、板)的形态提供,也可以以一部分构成成分为组合物的形态(例如同一溶液中)提供。或者,本发明的试剂可以以器件的形态提供。具体而言,可以以构成成分全部收容于器件中的形态提供。或者,也可以是构成成分的一部分以收容于器件中的形态提供,剩余的部分以不收容于器件中的形态(例如收容于不同的容器的形态)提供。该情况下,没有收容于器件中的构成成分可以在测定靶物质时通过注入于器件中而被使用。
在优选的实施方式中,本发明的试剂可以具有与应采用的免疫分析的种类相应的构成。例如,采用夹心法的情况下,本发明的试剂可以含有:作为必须的构成成分的i)前处理液、ii)针对心肌肌钙蛋白i的抗体、iii)缓冲液、以及作为任意的构成成分的iv)针对心肌肌钙蛋白i的其它抗体、v)标记物质、vi)稀释液、及根据需要的vii)与标记物质反应的底物。ii)及iii)的构成成分可以包含在同一溶液中。iv)的构成成分也可以用v)标记物质进行标记化。优选针对心肌肌钙蛋白可以固相化于磁性粒子。
实施例
<实施例1sds前处理的效果确认试验(1)>
(1)抗心肌肌钙蛋白i(ctni)抗体板的制作
在聚苯乙烯制96孔微孔板(nunc社制)中分注包含含有抗ctni抗体19c7(hytest社制)2μg/ml的抗体稀释液(0.1m碳酸氢钠、ph9.6)100μl/孔,在4℃下进行一夜孵育。用pbs清洗3次微孔板,接着,分注封闭液(含有0.5%酪蛋白钠、2%蔗糖、0.05%proclin(注册商标)300的pbs)350μl/孔,在室温下进行2小时以上孵育。除去封闭液之后,将板进行干燥,作为抗ctni抗体板。
(2)被检体前处理
制备表1所示的前处理液1~3。以前处理液:血清被检体=1:2(体积比,以下同样)的方式对ctni浓度已知的2个血清被检体和空白(健康人血清)混合前处理液1~3,在1000rpm的振荡的条件下于80℃加热5分钟,作为已处理的被检体。同时,将pbs和各血清被检体以pbs:血清被检体=1:2的方式进行混合,作为未处理被检体(无加热)。血清被检体的ctni浓度预先使用西门子社centaur进行测定。
(3)被检体中的ctni测定
将已处理的被检体与缓冲液(24mm磷酸二氢钾、76mm磷酸氢二钾、1.0%bsa、1.0%pvp、0.05%酪蛋白钠、0.05%tween20(商品名)、0.05%氯化钠、0.10%proclin(注册商标)300)以已处理的被检体:缓冲液=1:2的方式进行混合,以100μl/孔添加于抗ctni抗体板(一次反应)。在振荡的条件下在室温下反应2小时后,用清洗液(0.05%tween20(商品名)/pbs)清洗5次。以100μl/孔分注含有生物素化抗ctni抗体16a11(hytest社)1μg/ml的缓冲液,在振荡的条件下在室温下反应1小时(二次反应)。用清洗液清洗5次之后,以100μ/孔分注将hrp标记链霉亲和素(roche社制)用缓冲液稀释了10000倍的标记抗体液,在振荡的条件下在室温下反应30分钟。用清洗液清洗5次之后,以100μl/孔分注opd底物液(wako社制),在室温下静置于暗处15分钟。以100μl/孔分注2n硫酸而使反应停止,测定各孔的490nm/630nm的吸光度。
(4)结果
将各前处理条件下的ctni测定结果示于表1。通过进行前处理,可知阳性被检体的信号强度(吸光度)上升。特别可知:在前处理液2、3的条件下进行前处理的情况下,与未处理的测定条件相比,信号强度、s/n比均提高。
[表1]
<实施例2sds前处理的效果确认试验(2)>
对ctni浓度已知的血清被检体7例,将前处理液设为表2中的前处理液4,除此之外,用与实施例1同样的方法进行测定。将测定结果示于表2。
[表2]
<实施例3sds前处理·测定体系的特异性确认>
对浓度已知的血清被检体4例,在一次反应体系中添加20μg/ml的抗ctni抗体19c7(hytest社),在二次反应体系中添加10μg/ml的未标记抗ctni抗体16a11,除此之外,进行与实施例2同样的试验(抑制试验)。将各条件下的测定结果及与实施例2的结果的比较示于表3。在抑制试验中,即使在全部的被检体中实施前处理,也确认施加超过95%的抑制,可以确认为具有特异性的测定体系。
[表3]
<实施例4酸性化前处理的效果确认·elisa>
(1)抗ctni抗体板的制作
在聚苯乙烯制96孔微孔板(nunc社制)中,以100μl/孔分注含有抗ctni抗体24f9(fujirebio社制、识别ctni的第37号~第60号的氨基酸残基)2μg/ml的抗体稀释液(0.1m碳酸氢钠、ph9.6),在4℃下进行一夜孵育。用pbs清洗3次微孔板,接着,以350μl/孔分注封闭液(含有0.5%酪蛋白钠、2%蔗糖、0.05%proclin(注册商标)300的pbs),在室温下进行2小时以上孵育。除去封闭液之后,将板干燥,作为抗ctni抗体板。
(2)ctni的测定
对ctni浓度已知的3个血清被检体和空白(健康人血清),将各70μl与前处理液5(0.83m尿素、0.14n盐酸、0.25%tritonx-100(商品名)、0.07%c18tab、0.17%c16aps、0.02%chaps、83.3mm咪唑、20mmdeaet)70μl进行混合,在37℃下加热5分钟而制备酸性化前处理样品。对相同被检体,另外将各70μl与70μl的pbs进行混合,同样地加热,将其作为未处理样品。血清被检体的ctni浓度预先使用西门子社centaur进行测定。
在抗ctni微孔板中分注缓冲液(0.6mbicine、2%蔗糖、10mmedta2na、2%bsa、proclin(注册商标)300、naoh(~ph9.2))25μl,接着添加样品(酸性化前处理、未处理)各75μl并进行混合。关于未处理被检体,使用ph7.0的缓冲液。在振荡的条件下于37℃孵育1小时,用清洗液(0.05%tween20(商品名)/pbs)清洗5次。以100μl/孔分注含有生物素化抗ctni抗体16a11(hytest社)1μg/ml的缓冲液,在振荡的条件下于37℃反应1小时(二次反应)。用清洗液清洗5次之后,以100μl/孔分注将hrp标记链霉亲和素(roche社制)用缓冲液稀释了10000倍的标记抗体液,在振荡的条件下在室温下反应30分钟。用清洗液清洗5次之后,以100μl/孔分注opd底物液(sigma社制),在室温下静置于暗处15分钟。以100μl/孔分注2n硫酸而使反应停止,测定各孔的490nm/630nm的吸光度。
将各样品的ctni测定结果示于表4。可知:通过进行酸性化前处理,阳性被检体的信号强度(吸光度)上升。
[表4]
<实施例5酸性化前处理的效果确认·cleia>
ctni测定试剂的制备
抗体结合粒子溶液(固相化抗体溶液):将在羧基化磁性粒子(fujirebio制)中结合有抗ctni抗体24f9的抗体结合磁性粒子以成为0.025%(w/v)的浓度的方式悬浮于缓冲液(36mm磷酸二氢钾、114mm磷酸氢二钾、2.5%bsa、0.05%酪蛋白钠、1.5%tritonx-100(商品名)、0.1m氯化钠、20mmedta2na、0.1%proclin(注册商标)300、ph7.0),制备抗体结合粒子溶液。
标记化抗体溶液:将利用碱性磷酸酶(高活性、糖降低的重组体、roche制)标记抗ctni抗体16a11(hytest社)而得到的标记化抗体用标记体稀释液(50mmmes、2.5%(w/v)bsa、100mmnacl、0.3mmzncl2、及1.0mmmgcl2、ph6.8)以成为0.5μg/ml的方式稀释,制备标记化抗体溶液。
将这些溶液填充于自动免疫测定装置lumipulsepresto(fujirebio社制)的专用试剂瓶,固定于给定的位置。
(2)被检体的酸性化前处理
对16个血清被检体,将各67μl与前处理液6(0.83m尿素、0.14n盐酸、0.25%tritonx-100(商品名)、0.07%c18tab、0.17%c16aps、0.02%chaps、83.3mm咪唑、20mmdeaet)134μl进行混合,在37℃下加热5分钟。其后,添加中和液(0.6mbicine、2%蔗糖、10mmedta2na、2%bsa、200mmnls、proclin(注册商标)300、1nnaoh(~ph9.2))101μl并进行混合,制备酸性化前处理样品。
(3)ctni量测定
使用自动免疫测定装置(lumipulsepresto、fujirebio社制),按照以下的步骤,测定酸性化前处理样品的ctni量。
在反应用小玻璃管中分注抗体结合粒子溶液50μl和酸性化前处理样品100μl,制备第1反应液。第1反应液在搅拌后在37℃下孵育8分钟,形成结合于磁性粒子的抗ctni抗体和样品中所含的ctni抗原的免疫复合体。
孵育后,将磁性粒子利用磁铁聚集于管壁,除去未与磁性粒子结合的物质。其后,重复清洗液(lumipulse(注册商标)清洗液、fujirebio社制)的注入及清洗液的除去并清洗磁性粒子。
清洗后,将标记化抗体溶液50μl及磁性粒子进行混合而制备第2反应液。第2反应液在37℃下孵育8分钟,形成由固相化于磁性粒子的抗ctni抗体-ctni抗原-标记抗体构成的免疫复合体。
孵育后,将磁性粒子再利用磁铁聚集于管壁而除去未与磁性粒子结合的物质。其后,重复清洗液的注入及清洗液的除去并清洗磁性粒子。
在磁性粒子中加入含有amppd(3-(2’-螺金刚烷)-4-甲氧基-4-(3’-磷酰氧基)苯基-1,2-二氧杂环丁烷·2钠盐)的底物液(lumipulse(注册商标)底物液、fujirebio社制)200μl,搅拌后,在37℃下孵育4分钟。底物液中所含的amppd通过与磁性粒子间接地结合的碱性磷酸酶的催化作用而分解,释放在波长477nm具有极大发光的光。发光强度反映与磁性粒子结合的ctni量,因此,可以通过测定波长477nm的发光强度(计数)而测定ctni量。
(4)与市售试剂的测定值的比较
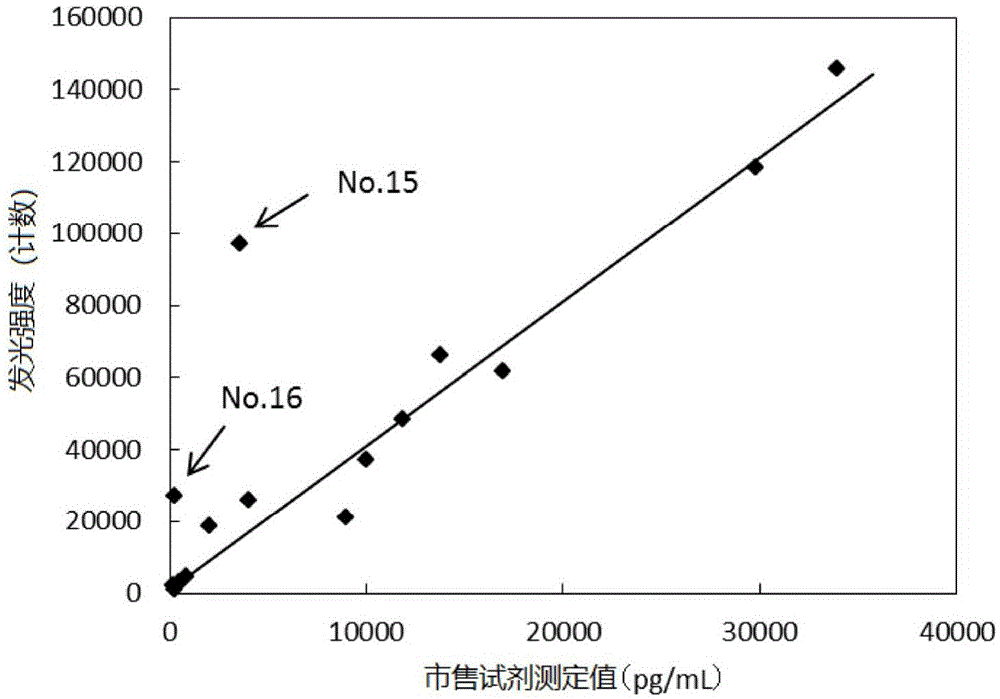
对用上述方法测定的16个血清被检体,另外使用市售试剂,按照添附文件的记载测定ctni。将各被检体的市售试剂的测定值和用上述的(1)~(3)所示的方法得到的测定值(计数)示于表5及图1。本发明的方法和市售试剂的ctni测定值在大部分被检体中显示良好的相关性,但有2个被检体(no.15、16)在用本发明的方法时测定值显著地升高。
[表5]
<实施例6背离被检体的利用凝胶过滤色谱法的解析>
(1)背离被检体的凝胶过滤色谱法
对实施例5中的、酸性化剂前处理样品的测定值在高值侧与市售试剂的相关曲线背离的被检体no.16,为了查明高值化的主要原因,进行使用凝胶过滤色谱法的解析。
将已经过滤的凝胶过滤缓冲液(50mmpb、0.05%tween20、0.08%chaps、300mmnacl、1mmedta、ph6.0)50μl和已经过滤的被检体150μl进行混合,进一步添加已经过滤的蛋白酶抑制剂14μl,制备凝胶过滤样品。将样品全部导入凝胶过滤柱中,在下述条件下进行分离。
(分离条件)
柱:superdex20010/30
分离缓冲液:50mmpb,0.05%tween20,0.08%chaps,300mmnacl,1mmedtaph6.0
流速:0.5ml/分钟
回收范围:6-23mltotal34fr.(0.5ml/级分)
(2)已知浓度tni溶液的回收试验
在回收的各级分100μl中添加1.125ng/ml天然肌钙蛋白i(tni)溶液80μl,制备回收率测定用样品。将固相化于磁性粒子的抗体从24f9变更为19c7,除此之外,用与实施例5同样的方法制备抗体结合粒子溶液、标记化抗体溶液,对各级分的回收率测定用样品,使用lumipulsepresto,在与实施例5同样的条件下进行ctni的测定。将各级分的测定结果(发光强度(计数))示于图2。未处理的被检体no.16显示在11.5ml附近的洗脱级分中存在显著地抑制天然tni和19c7抗体的反应的物质。洗脱体积、与抗人igg抗体的反应性等暗示:该抑制物质为人抗ctni抗体(自身抗体)。
在实施例5中作为比较用途而实施的使用市售试剂的ctni测定法是不包含被检体的前处理等工序的测定天然tni的体系,但在测定被检体no.16时有可能受上述的抑制物质的影响而成为比实际的ctni量低的值。另一方面推测:在本发明的方法中,通过被检体的前处理将ctni进行单独化,可以避免特异性地抑制与天然tni的反应的物质(推测为自身抗体)的影响,因此ctni测定值升高,从与市售试剂的相关曲线背离至高值侧。
<实施例7酸性化剂的最适浓度>
研究了用于酸性化前处理的酸性化剂的最适浓度。将盐酸浓度设为0.03、0.05、0.06、0.125、0.25、0.28、0.5n中的任一种,除此之外,用与实施例5同样的方法制备7种前处理剂。对应于各前处理剂的中和液以与前处理液混合后的ph成为7.5±0.2的方式调整ph,除此之外,用与实施例5同样的方法制备。
对天然tni、ctni浓度已知的血清被检体2件(no.17、18),以ctni浓度成为2250pg/ml的方式用pbs进行稀释。接着,使用上述7种前处理液及对应的中和液,用与实施例5同样的方法分别进行酸性化前处理。对各酸性化前处理样品,用与实施例5同样的方法,使用lumipulsepresto测定对应于ctni量的发光强度(计数)。取代上述的天然tni及被检体,用pbs也进行同样的处理及测定,作为空白。用各样品的计数值除以对应的空白的计数值而算出s/n比。
表6及图3中示出各酸处理条件下的s/n比。
[表6]
在本实施例中,酸性化前处理在酸浓度超过0n且0.5n以下的条件下发挥使s/n比上升的效果。特别确认:在酸浓度为0.03n~0.125n时,s/n比上升。
发明人等确认:与天然tni相比,本实施例中使用的抗ctni抗体24f9与单独的ctni较强地反应(没有示出数据)。另一方面,确认:市售的抗ctni抗体19c7也与单独的ctni进行反应,但与天然tni更强地反应(没有示出数据)。使用19c7那样的抗体的情况下,通过酸性化前处理,虽然可得到避免抑制物质的影响的效果,但是,有可能通过ctni的单体化而抹杀其效果。使用24f9那样的抗体的情况下,通过酸性化前处理,除避免抑制物质的影响的效果之外,ctni的单独化起到增强作用,因此推测:即使为低的酸浓度,也使测定值显著地上升。
序列表
<110>富士瑞必欧株式会社(fujirebio,inc.)
<120>心肌肌钙蛋白的测定方法及测定试剂
<130>pf598-pct
<160>1
<170>patentinversion3.5
<210>1
<211>210
<212>prt
<213>智人(homosapiens)
<400>1
metalaaspglyserseraspalaalaarggluproargproalapro
151015
alaproileargargargserserasntyrargalatyralathrglu
202530
prohisalalyslyslysserlysileseralaserarglysleugln
354045
leulysthrleuleuleuglnilealalysglngluleugluargglu
505560
alaglugluargargglyglulysglyargalaleuserthrargcys
65707580
glnproleugluleualaglyleuglyphealagluleuglnaspleu
859095
cysargglnleuhisalaargvalasplysvalaspglugluargtyr
100105110
aspileglualalysvalthrlysasnilethrgluilealaaspleu
115120125
thrglnlysilepheaspleuargglylysphelysargprothrleu
130135140
argargvalargileseralaaspalametmetglnalaleuleugly
145150155160
alaargalalysgluserleuaspleuargalahisleulysglnval
165170175
lyslysgluaspthrglulysgluasnarggluvalglyasptrparg
180185190
lysasnileaspalaleuserglymetgluglyarglyslyslysphe
195200205
gluser
210
- 还没有人留言评论。精彩留言会获得点赞!