脑转移瘤的尿液蛋白标志物及其用途的制作方法
本发明涉及临床医学,具体涉及人脑转移瘤相关的蛋白标志物。具体而言,本发明涉及利用大鼠脑内walker-256肿瘤细胞局部生长模型和质谱分析获得的人脑转移瘤早期诊断、与脑胶质瘤的鉴别诊断相关的蛋白标志物的用途。
背景技术:
生物标志物是指与生理或病理性过程相关的可监测的变化,其涵盖范围广泛,目前作为疾病早期诊断或预后的标志物应用最广,影响最大。疾病标志物在疾病的预防、诊断、治疗和预后中发挥重要作用,能够及早且灵敏的提示疾病的发生和进展情况。尿液是机体经由泌尿系统及尿路排出到体外的排泄物,富集机体的各种变化,其敏感,变化早,除70%的尿液蛋白来自肾脏和泌尿道分泌,还有30%的尿液蛋白来自血浆的滤过,因此,尿液可以反映泌尿系统和其他器官病变引起的变化(参见youheg.canurinebethegoldmineforbiomarkerdiscovery?scichinalifesci2013;43)。尿蛋白质组学是一种使用蛋白质组学技术来研究尿液中所有蛋白质的方法。在质谱技术飞速发展的推动下,尿液蛋白的鉴定深度和定量水平不断提高,极大地促进了尿蛋白质组学在疾病标志物发现和验证研究中的应用(zhao,m等人acomprehensiveanalysisandannotationofhumannormalurinaryproteome.scirep.2017jun8;7(1):3024)。
脑肿瘤主要分为两种:原发性脑肿瘤,如脑胶质瘤,以及从其他器官的原发肿瘤扩散到脑部的脑转移瘤。脑转移瘤(brainmetastases)作为成人中最常见的颅内肿瘤,发生率高于原发性恶性脑肿瘤10倍以上,大约20-40%的颅外恶性肿瘤会发生颅内转移,最常见的原发癌是肺癌、乳腺癌和黑色素瘤。恶性脑肿瘤的预后极差,患者的总体生存期明显缩短,严重影响了癌症患者的生活质量和生存时间(vargomm.braintumorsandmetastases.physmedrehabilclinnam,2017,28(1):115-141)。因此,亟需开发无创的生物标志物。
脑胶质瘤是中枢神经系统最常见的一种原发性肿瘤,其中,胶质母细胞瘤是神经胶质瘤中最常见且恶性程度最高的侵袭性神经胶质瘤,患者的平均存活率较低(chenl等人erastinsensitizesglioblastomacellstotemozolomidebyrestrainingxctandcystathionine-gamma-lyasefunction.oncolrep,2015,33:1465-74)。在临床上,一些原发病史不明确的单发脑转移瘤和胶质瘤具有类似的临床表现和核磁共振(mri)常规检查表现,但两者的治疗和预后方式大不相同,其鉴别诊断极其重要但缺乏确定性标准。因此,迫切需要能够鉴别检测这两种肿瘤的生物标志物,从而为患者采取合理有效的治疗措施。
先前的研究中,在脑内注射c6细胞的大鼠神经胶质瘤模型的尿液蛋白质组研究中发现,尿液蛋白的变化早于行为学和影像学的改变,鉴定到尿液差异蛋白并利用mrm靶向技术验证了39个差异蛋白(niy等人earlycandidatebiomarkersfoundfromurineofglioblastomamultiformeratbeforechangesinmri.scichinalifesci,2018)。而在本发明中,本发明人将非脑部原发性的walker-256细胞种植到大鼠脑内后,观察尿液蛋白是否会有不同的与脑转移瘤相关的变化,用以诊断脑转移瘤,以及鉴别诊断脑转移瘤和脑胶质瘤。
技术实现要素:
鉴于本领域的上述需求,根据本公开的一些实施方案,提供了蛋白的鉴定试剂在制备用于诊断脑转移瘤、鉴别诊断脑转移瘤和胶质瘤的试剂中的用途,其中所述鉴定试剂特异于选自以下任一项或其任意组合:
nkg2-dii型整合膜蛋白、半乳糖凝集素-3结合蛋白、补体c4、巨噬细胞集落刺激因子1、超氧化物歧化酶[cu-zn]、肿瘤坏死因子受体超家族成员1b、胰石蛋白、细胞间粘附分子1、血管细胞粘附蛋白1、细胞色素c,体细胞、细胞表面糖蛋白muc18、跨膜蛋白132a、芳基硫酸酯酶b、果糖二磷酸醛缩酶b、载脂蛋白e、丝氨酸蛋白酶抑制剂a3l、酒精脱氢酶[nadp(+)]、载脂蛋白a-i、rabgdp解离抑制剂β、微管蛋白α-1b链、异柠檬酸脱氢酶[nadp]细胞质、果糖-1,6-二磷酸酶1、4-三甲基氨基丁醛脱氢酶、三激酶/fmn环化酶、磺基转移酶1c2a。
在具体的实施方案中,和健康对照相比较,选自以下蛋白的表达水平提高指示所述受试者患有脑转移瘤:nkg2-dii型整合膜蛋白、半乳糖凝集素-3结合蛋白、补体c4、巨噬细胞集落刺激因子1、超氧化物歧化酶[cu-zn]、肿瘤坏死因子受体超家族成员1b、胰石蛋白、细胞间粘附分子1、血管细胞粘附蛋白1、细胞色素c,体细胞、细胞表面糖蛋白muc18、跨膜蛋白132a、及其组合。
在具体的实施方案中,和健康对照相比较,选自以下蛋白的表达水平降低指示所述受试者患有脑转移瘤:芳基硫酸酯酶b、果糖二磷酸醛缩酶b、载脂蛋白e、丝氨酸蛋白酶抑制剂a3l、酒精脱氢酶[nadp(+)]、载脂蛋白a-i、rabgdp解离抑制剂β、微管蛋白α-1b链、异柠檬酸脱氢酶[nadp]细胞质、果糖-1,6-二磷酸酶1、4-三甲基氨基丁醛脱氢酶、三激酶/fmn环化酶、磺基转移酶1c2a及其组合。
在具体的实施方案中,健康对照是指未患有脑转移瘤的个体。
在另一些实施方案中,提供了选自以下的蛋白的鉴定试剂在制备用于受试者的脑转移瘤早期诊断的试剂中的用途,其中所述鉴定试剂特异于选自以下任一项或其组合:nkg2-dii型整合膜蛋白、半乳糖凝集素-3结合蛋白、补体c4、巨噬细胞集落刺激因子1、细胞色素c,体细胞、细胞表面糖蛋白muc18、跨膜蛋白132a、及其任意组合。
在具体的实施方案中,和健康对照中的蛋白水平相比较,选自以下的蛋白的表达水平提高指示所述受试者存在脑转移瘤的早期浸润:nkg2-dii型整合膜蛋白、半乳糖凝集素-3结合蛋白、补体c4、巨噬细胞集落刺激因子1、细胞色素c,体细胞、细胞表面糖蛋白muc18、跨膜蛋白132a、及其组合。
在具体的实施方案中,健康对照是指未患有脑转移瘤的个体。
在优选的实施方案中,提供了选自以下的蛋白的鉴定试剂在制备用于受试者的脑转移瘤早期诊断的试剂中的用途,其中所述鉴定试剂特异于选自以下任一项或其组合:nkg2-dii型整合膜蛋白、半乳糖凝集素-3结合蛋白、补体c4、巨噬细胞集落刺激因子1、及其组合。
在具体的实施方案中,所述早期诊断是指可能患有脑转移瘤的受试者,在核磁共振(mri)检查或在其它临床检测脑转移瘤中,表现出异常前的早期诊断。也即,采用本发明的蛋白的鉴定试剂,可早于本领域目前对脑转移瘤的诊断的检测方法诊断出受试者患有脑转移瘤。
适用于本公开的鉴定试剂是质谱鉴定试剂、抗体或其抗原结合片段。在具体的实施方案中,抗体是单克隆抗体。本公开对单克隆抗体的物种来源没有限制,任何能够结合上述蛋白的抗体均可以使用。
在具体的实施方案中,抗原结合片段包括但不限于:fab、fab'、(fab')2、fv、scfv、双特异抗体、三特异抗体、四特异抗体、双-scfv。任何保留了抗原结合活性的抗体片段均适用于本公开。
在具体的实施方式中,根据本公开的蛋白标记物能够用于鉴别诊断脑转移瘤和胶质瘤。
在具体的实施方案中,表达水平选自核酸水平和蛋白质水平,尤其是蛋白质水平。
在具体的实施方案中,所述受试者是哺乳动物,优选是人。
在具体的实施方案中,表达水平是在尿液样本中测定的。
在具体的实施方案中,所述蛋白是尿液蛋白。
在具体的实施方案中,所述脑转移瘤是指原发肺癌、乳腺癌和黑色素瘤扩散至脑部所形成的脑肿瘤。
根据另一些实施方案,还提供了一种试剂盒或芯片,其包含鉴定试剂;所述鉴定试剂特异于选自以下任一项或其任意组合:
nkg2-dii型整合膜蛋白、半乳糖凝集素-3结合蛋白、补体c4、巨噬细胞集落刺激因子1、超氧化物歧化酶[cu-zn]、肿瘤坏死因子受体超家族成员1b、胰石蛋白、细胞间粘附分子1、血管细胞粘附蛋白1、细胞色素c,体细胞、细胞表面糖蛋白muc18、跨膜蛋白132a、芳基硫酸酯酶b、果糖二磷酸醛缩酶b、载脂蛋白e、丝氨酸蛋白酶抑制剂a3l、酒精脱氢酶[nadp(+)]、载脂蛋白a-i、rabgdp解离抑制剂β、微管蛋白α-1b链、异柠檬酸脱氢酶[nadp]细胞质、果糖-1,6-二磷酸酶1、4-三甲基氨基丁醛脱氢酶、三激酶/fmn环化酶、磺基转移酶1c2a。
在具体的实施方案中,所述鉴定试剂选自:质谱鉴定试剂、抗体或其抗原结合片段。
在优选的实施方案中,所述抗体是单克隆抗体。
在具体的实施方案中,所述的试剂盒或芯片用于实施脑转移瘤的诊断。所述诊断选自脑转移瘤的早期诊断、与脑胶质瘤的鉴别诊断或其组合。
在具体的实施方案中,当所述的试剂盒或芯片用于实施脑转移瘤的早期诊断时,所述鉴定试剂特异于选自以下的蛋白:nkg2-dii型整合膜蛋白、半乳糖凝集素-3结合蛋白、补体c4、巨噬细胞集落刺激因子1、细胞色素c,体细胞、细胞表面糖蛋白muc18、跨膜蛋白132a、及其组合。
根据一些实施方案,提供了一种用于诊断、早期诊断脑转移瘤以及鉴别诊断脑转移瘤与脑胶质瘤的方法,其包括步骤:
1)获得受试者和健康对照的尿液样本;
2)任选地,从尿液样本中分离尿蛋白;
3)确定受试者尿液样本中选自以下的蛋白的表达水平:nkg2-dii型整合膜蛋白、半乳糖凝集素-3结合蛋白、补体c4、巨噬细胞集落刺激因子1、超氧化物歧化酶[cu-zn]、肿瘤坏死因子受体超家族成员1b、胰石蛋白、细胞间粘附分子1、血管细胞粘附蛋白1、细胞色素c,体细胞、细胞表面糖蛋白muc18、跨膜蛋白132a、芳基硫酸酯酶b、果糖二磷酸醛缩酶b、载脂蛋白e、丝氨酸蛋白酶抑制剂a3l、酒精脱氢酶[nadp(+)]、载脂蛋白a-i、rabgdp解离抑制剂β、微管蛋白α-1b链、异柠檬酸脱氢酶[nadp]细胞质、果糖-1,6-二磷酸酶1、4-三甲基氨基丁醛脱氢酶、三激酶/fmn环化酶、磺基转移酶1c2a、或其组合;
4)将受试者与健康对照的尿液样本中的蛋白的表达水平相比较;
5)确定受试者是否患有脑转移瘤。
在具体的实施方案中,使用质谱方法、elisa方法、或western方法确定表达水平。
当采用质谱方法确定蛋白及其表达水平时,在获得尿液样本的步骤之后,还可以包括消化步骤。在具体的实施方式中,用蛋白酶消化尿液样本中的蛋白。
附图说明
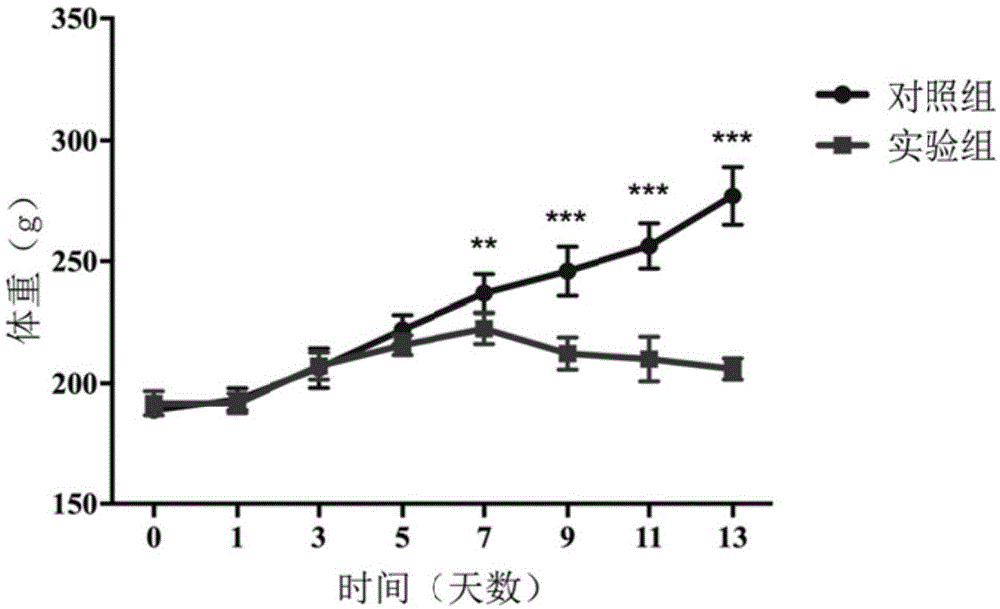
图1:walker-256脑转移瘤组大鼠和对照组大鼠体重监测结果。●代表对照组;■代表实验组。p<0.01(**),p<0.001(***)。
图2a至图2c:脑转移瘤局部生长模型第5天(图2a)、9天(图2b)和12天(图2c)的大鼠脑部14个冠状面核磁检测结果。
图3a和图3b:大鼠脑组织切片he染色结果,其中图3a放大倍数为40×;图3b为100×。
具体实施方式
下面将通过下述非限制性实施例进一步说明本发明。本领域技术人员公知,在不背离本发明精神的情况下,可以对本发明做出许多修改,这样的修改也落入本发明的范围。如无特别说明,所使用的实验材料均可从商业公司获取。
实施例
实施例1:脑转移瘤的局部生长大鼠模型的建立
walker-256大鼠乳腺癌细胞系具有良好的致瘤性而被应用于脑转移瘤的研究中(hasegawah等人changesoftheblood-brainbarrierinexperimentalmetastaticbraintumors.jneurosurg,1983,59(2):304-10)。直接脑内注射肿瘤细胞可检测大脑中肿瘤细胞的生长情况,是脑转移瘤动物模型中最易控制肿瘤生长和可重复性最高的方法(lewiskm等人characterisationofwalker256breastcarcinomacellsfromtwotumourcellbanksasassessedusingtwomodelsofsecondarybraintumours[j].cancercellint,2013,13(1):5)。通过向大鼠脑内注射walker-256细胞系模拟脑转移瘤的局部肿瘤生长过程,对临床上诊断、监测病情进展有重要的指导意义。
在本发明中,采用向大鼠脑内注射walker-256细胞系诱导大鼠脑转移瘤的局部生长模型,收集脑转移瘤大鼠在早期mri无异常阶段(第3天、5天)和mri可见肿瘤阶段(第8天)的尿液进行质谱鉴定。同时,与脑胶质瘤大鼠模型的尿液差异蛋白比较。利用该动物模型模拟脑转移瘤,对临床上脑转移瘤的早期诊断、和胶质瘤的鉴别诊断、治疗和预后有重要的指导意义。
1.材料与试剂
1)仪器:
大鼠代谢笼:购自北京佳源兴业科技有限公司;thermoorbitrapfusionlumos质谱仪:购自thermofisherscientific公司;thermoeasy-nlc1200高效液相色谱仪:购自thermofisherscientific公司;脑立体定位仪:购自wpi公司;7.0teslapharmascan70/16us小动物磁共振成像仪:购自bruker公司;millliqrg超纯水系统:购自millipore公司;c18反相分析柱(rp柱,0.1×150mm,3μm,
2)主要试剂:
walker-256细胞系从中国医学科学院医学实验动物研究所购买;4%多聚甲醛和戊巴比妥钠从国药集团化学试剂有限公司购买;去离子水来源于millliqrg超纯水系统;色谱级乙腈、甲酸和甲醇为fisher公司生产;碘乙酰铵(iaa)、碳酸氢铵、二硫苏糖醇(dtt)从merck公司购买;测序级胰酶从sigma公司购买。
3)动物:
雄性wistar大鼠(体重180至200g)购自北京维通利华实验动物技术有限公司,在标准饲养环境中饲养。
2.实验方法
1)脑转移瘤局部生长大鼠模型建立以及样品收集:
walker-256细胞培养:取出walker-256细胞冻存管,迅速置于37℃水浴锅中解冻,吸出细胞悬液移至离心管中,12000g,离心3min,弃上清。加生理盐水混匀冲洗,重复两次。再用生理盐水将细胞密度调整为1×107个/ml。取0.5ml细胞接种于幼年sd大鼠腹腔中。6-7天后抽取幼鼠腹水,将腹水瘤细胞1200g,离心8min,弃上清。生理盐水反复细胞冲洗2-3次后,调整密度为400000个/ml,作为接种使用。
脑转移瘤局部生长大鼠模型建立步骤:称量大鼠体重,以20mg/kg腹腔注射2%戊巴比妥钠试剂,大鼠麻醉后开始手术。使用脑立体定位仪固定大鼠头部,用碘酒和酒精消毒头部皮肤后,切开大鼠右侧耳后0.5cm处的皮肤。以前囟为定位点,向右移动3mm,向前移动1mm,标记位置,用钻空针钻孔,将微量进样针移至钻孔处并缓慢下降6mm,然后回抽1mm,以缓慢的速度注射5μl含有2000个肿瘤细胞的生理盐水腹水混合液,注射结束后停针3min,以防止细胞外溢。拔针后用骨蜡封闭创口并将其缝合。
对照组的大鼠模型建立步骤:用无菌5μl生理盐水替代注射。
样品收集流程:在造模过程中第3、5和8天将大鼠置于代谢笼中收集尿液样本。
2)指标检测:
体重监测:每两天测量大鼠的体重。
核磁共振检查:在注射肿瘤细胞后第5天、7天、9天和12天,对实验组的大鼠进行核磁共振检查。大鼠使用2.5%异氟烷气体麻醉,使用pharmascan70/16us小动物磁共振成像仪,扫描序列为扫描序列t2_turborare,具体扫描参数如下:tr/te=3700/33ms,slicethinkness:0.5mm,fieldofview=35×35mm,matrix:256×256,重复3次,采集时间5min,30s。
脑组织病理学:将肿瘤大鼠麻醉,用一次性输液器在左心室处开始灌注生理盐水,并夹闭腹主动脉。连续灌注4%的多聚甲醛,待大鼠出现四肢抽搐时停止灌注。迅速剥离颅骨,将脑组织取出置于10%福尔马林中充分固定。之后用石蜡包埋,切片,进行he染色,以观察注射肿瘤细胞后脑组织的病理变化。
实施例2:蛋白标志物的鉴定
1.尿蛋白提取与保存:尿液于4℃2000g离心30分钟,取上清,置于新ep管内,继续12000g4℃离心30分钟;取上清,-80℃保存。
乙醇沉淀尿液蛋白,用bradford法测蛋白浓度后进行膜上酶切,参见wisniewskijr,zougmana,nagarajn,mannm.universalsamplepreparationmethodforproteomeanalysis.naturemethods2009;6:359-62。bca法测量多肽浓度。
2.lc-ms/ms串联质谱分析:
将多肽样本用0.1%甲酸稀释成0.5μg/μl。多肽样本通过thermo液相系统easy-nlc1200上样系统分离。洗脱时间120分钟,色谱柱流速为0.3μl/min。洗脱梯度为5%至28%流动相b(流动相a为:0.1%甲酸;流动相b为:0.1%甲酸水,79.9%乙腈,20%水),洗脱时间在两次质谱鉴定中分别为1.5h和1h。洗脱下的肽段使用thermoorbitraplumos质谱仪进行分析。一级全扫描:母离子m/z扫描范围为350-1550,分辨率为120000;二级扫描为数据依赖采集模式,分辨率为30000,碎裂方式是hcd。
3.数据库检索:
所有质谱结果用mascot软件进行数据库检索。所用数据库为swiss-protratdatabase。检索条件为:胰酶酶切;允许有2个漏切的位点;固定修饰为半胱氨酸;可变修饰为蛋白质n-末端乙酰化修饰和蛋氨酸的氧化修饰;多肽母离子和子离子的质量偏差均为0.05da。
4.相对定量分析结果:
所有质谱结果通过scaffold软件进行相对定量结果分析。多肽阈值设置为大于95%,蛋白fdr设置为最大1%;每一个蛋白至少鉴定到两条不同的多肽。
5.统计分析:
将不同时间点的蛋白组数据进行统计分析,筛选出与对照组相比谱图数变化倍数≥1.5或≤0.67,p值小于0.05的蛋白作为差异蛋白,其中,上升的差异蛋白,实验组的谱图数应均高于对照组,下降的差异蛋白,实验组的谱图数应均低于对照组。
6.实验结果:
(1)体重变化
如图1所示,第7天walker-256脑转移瘤组大鼠体重与对照组相比出现显著统计学差异(p<0.01),第9天开始逐渐出现进食减少,行动迟缓等表现,体重明显降低(图1)。
(2)核磁共振检查结果
如图2a-图2c,检查结果显示,注射肿瘤细胞的右脑在第5天没有明显的肿瘤组织形成,与左脑没有差异(图2a)。在第七天开始部分大鼠mri可见疑似肿瘤,第9天均可见肿瘤,第9天,在t2加权图像上,右脑可见较小肿瘤病灶,提示有肿瘤存在(图2b)。随着肿瘤的进展,第12天,在t2加权图像上,右脑可见明显的肿瘤占位性病变,瘤周可见明显水肿,说明造模成功(图2c)。
(3)病理检测结果
如图3a和图3b,he染色结果显示:可见脑组织中存在大量肿瘤细胞,与脑实质有比较清楚的分界,不同于胶质瘤细胞极强的侵袭表现。
(4)对照组和walker-256脑转移瘤组大鼠(n=8)的第3、5和8天的尿液分两次进行质谱鉴定(每次4只),2次技术重复。与对照组蛋白定量的谱图数进行比对,筛选出实验组变化倍数在1.5倍以上及p值小于0.05的差异蛋白,同时使用uniprot数据库将大鼠蛋白转化为相应的人同源蛋白。
在建模后,walker-256脑转移瘤组大鼠体重在第7天出现统计学差异并开始下降且部分大鼠开始在mri可见疑似肿瘤,第9天均可见肿瘤;对walker-256脑转移瘤组第3、5和8天被重复鉴定到质谱差异蛋白,经过统计学分析,除去在脑胶质瘤模型中也鉴定到的三个差异蛋白(β-2微球蛋白、α-1-酸性糖蛋白和中性粒细胞明胶酶相关脂质运载蛋白),可靠的差异蛋白人同源的有25个(表1),分别为:nkg2-dii型整合膜蛋白、半乳糖凝集素-3结合蛋白、补体c4、巨噬细胞集落刺激因子1、超氧化物歧化酶[cu-zn]、肿瘤坏死因子受体超家族成员1b、胰石蛋白、细胞间粘附分子1、血管细胞粘附蛋白1、细胞色素c,体细胞、细胞表面糖蛋白muc18、跨膜蛋白132a、芳基硫酸酯酶b、果糖二磷酸醛缩酶b、载脂蛋白e、丝氨酸蛋白酶抑制剂a3l、酒精脱氢酶[nadp(+)]、载脂蛋白a-i、rabgdp解离抑制剂β、微管蛋白α-1b链、异柠檬酸脱氢酶[nadp]细胞质、果糖-1,6-二磷酸酶1、4-三甲基氨基丁醛脱氢酶、三激酶/fmn环化酶和磺基转移酶1c2a。
相较于健康对照,脑转移瘤组中表达水平提高的尿蛋白共12个,分别为nkg2-dii型整合膜蛋白、半乳糖凝集素-3结合蛋白、补体c4、巨噬细胞集落刺激因子1、超氧化物歧化酶[cu-zn]、肿瘤坏死因子受体超家族成员1b、胰石蛋白、细胞间粘附分子1、血管细胞粘附蛋白1、细胞色素c,体细胞、细胞表面糖蛋白muc18、跨膜蛋白132a。
相较于健康对照,脑转移瘤组中表达水平降低的尿蛋白的13个,分别为芳基硫酸酯酶b、果糖二磷酸醛缩酶b、载脂蛋白e、丝氨酸蛋白酶抑制剂a3l、酒精脱氢酶[nadp(+)]、载脂蛋白a-i、rabgdp解离抑制剂β、微管蛋白α-1b链、异柠檬酸脱氢酶[nadp]细胞质、果糖-1,6-二磷酸酶1、4-三甲基氨基丁醛脱氢酶、三激酶/fmn环化酶和磺基转移酶1c2a。
表1.鉴别诊断中在脑转移瘤差异变化的蛋白
由于脑内注射walk-256肿瘤细胞后第3天和第5天的临床表现和mri检查都与对照组无明显差异,因此,在脑转移瘤早期(造模第3、5天)筛选出具有人同源蛋白的差异蛋白7个(表2)。在脑转移瘤早期,nkg2-dii型整合膜蛋白、半乳糖凝集素-3结合蛋白、补体c4、巨噬细胞集落刺激因子1、细胞色素c,体细胞、细胞表面糖蛋白muc18和跨膜蛋白132a表达量提高。其中,有4个差异蛋白,分别为:nkg2-dii型整合膜蛋白、半乳糖凝集素-3结合蛋白、补体c4、巨噬细胞集落刺激因子1在第8天也有明显差异,说明了这些差异蛋白作为肿瘤早期诊断的可靠性。
表2.脑转移瘤早期诊断的尿液蛋白标志物
表中“-”表示没有达到筛选标准(谱图数变化倍数≥1.5或≤0.67,p<0.05)。
脑内注射c6细胞的大鼠神经胶质瘤模型鉴定到尿液差异蛋白并利用mrm靶向技术验证了39个差异蛋白,参见niy等人earlycandidatebiomarkersfoundfromurineofglioblastomamultiformeratbeforechangesinmri.scichinalifesci,2018。因此,在脑转移瘤组没有被鉴定到的质谱差异蛋白转化为人同源蛋白后进行汇总(表3),结合脑转移瘤组的25个差异蛋白,可以用于鉴别诊断脑转移瘤和脑胶质瘤。
和对照组中的蛋白水平相比较,nkg2-dii型整合膜蛋白、半乳糖凝集素-3结合蛋白、补体c4、巨噬细胞集落刺激因子1、超氧化物歧化酶[cu-zn]、肿瘤坏死因子受体超家族成员1b、胰石蛋白、细胞间粘附分子1、血管细胞粘附蛋白1、细胞色素c,体细胞、细胞表面糖蛋白muc18、跨膜蛋白132a在脑转移瘤组中表达水平提高。
和对照组中的蛋白水平相比较,芳基硫酸酯酶b、果糖二磷酸醛缩酶b、载脂蛋白e、丝氨酸蛋白酶抑制剂a3l、酒精脱氢酶[nadp(+)]、载脂蛋白a-i、rabgdp解离抑制剂β、微管蛋白α-1b链、异柠檬酸脱氢酶[nadp]细胞质、果糖-1,6-二磷酸酶1、4-三甲基氨基丁醛脱氢酶、三激酶/fmn环化酶和磺基转移酶1c2a在脑转移瘤组中表达水平降低。
和对照组中的蛋白水平相比较,结合珠蛋白和细胞外超氧化物歧化酶[cu-zn]在脑胶质瘤组中表达水平提高;中性和碱性氨基酸转运蛋白rbat、eh结构域蛋白1、谷氨酰氨肽酶、na(+)/h(+)交换调节辅助因子nhe-rf1、肌动蛋白,细胞质1、氨肽酶n、溶质载体家族23成员1、谷胱甘肽合成酶、钙调素、atp结合盒亚家族g成员2、β-葡萄糖醛酸、谷胱甘肽s-转移酶p、溶质载体有机阴离子转运蛋白家族成员1a1、氯化物细胞内通道蛋白1、谷氨酰胺合成酶、碱性磷酸酶,组织非特异性同工酶、脑啡肽酶、c-反应蛋白、神经元膜糖蛋白m6-a、补体c3、溶酶体酸性磷酸酶、足细胞标记蛋白、氨基酰化酶-1a和水通道蛋白1、过氧化物酶-1、黄曲霉毒素b1醛还原酶成员3、氯化物细胞内通道蛋白4、酮亚胺还原酶mu-晶体蛋白、埃兹蛋白、α-辅肌动蛋白4、肌动蛋白,α心肌1、丝切蛋白-1、组织蛋白酶d在脑胶质瘤组中表达水平降低。
表3.鉴别诊断中在脑胶质瘤差异变化的蛋白
- 还没有人留言评论。精彩留言会获得点赞!