一种利用金属有机框架材料制备酶标记抗体的方法与流程
本发明属于免疫分析技术领域,具体涉及一种酶标记抗体的制备方法。
背景技术:
发展高效检测疾病生物标记物的诊断技术已经成为生物医学研究和临床护理的重要组成部分,并对现代分析系统有着重要的意义。在过去的几十年里,研究者们已经积极探索了各种各样的基于信号传感原理的技术,比较显著的例子包含荧光、化学发光、比色、电化学、拉曼和等离子方法。而用简单和可支付得起的技术检测疾病生物标记物对提高人们的生活水平来说是必不可少的,尤其是资源短缺的地区和国家。基于酶的比色测定(酶和生物受体提前结合,对显色底物进行转移催化产生颜色信号),例如酶联免疫吸附测定、免疫组织学、免疫印迹,由于其简单性和成本效益而持续吸引了越来越多的关注,它们不仅可以经简单训练的人员用低成本的设备(分光光度计、普通光学显微镜等)进行试验操作,甚至在肉眼下可观测,这使得这项技术非常适合在资源有限的环境下进行诊断,进而使得基于酶的比色测定被人们广泛认可。
然而,在临床诊断中,传统酶免疫测定的缺点主要表现在酶标抗体的操作过程繁琐,检测的灵敏度低,从而使它们的应用大大受到限制。在传统基于酶的比色测定中,酶标记抗体是能否实现对特定抗原分析物进行定量检测的关键,检测颜色的信号由酶(一般为hrp)结合抗体并特异性地将底物转化为有色分子。常用的酶(hrp)与抗体交联方法为戊二醛法和过碘酸钠法。对于戊二醛法,其重复性好,但是酶的利用率低,一般只有2%~4%酶与蛋白质结合。而过碘酸钠法的酶利用率高,但是酶标记物时的偶联过程使酶活性和抗体活性的损失较高,且操作中对于过碘酸钠的浓度和工作ph等都需十分注意,针对不同批次的酶之间存在糖基化程度有差别的特点,使用过碘酸钠法时需对不同批次的方法有所调整。另一方面,由于重组抗体和许多单克隆抗体不含糖基,若准备用该法连接这类抗体时,需事先确定抗体上是否有合适的修饰位点。这两种方法不仅都涉及使用高浓度的酶和抗体,也需要较为繁琐的分离与纯化步骤,如凝胶过滤、长时间透析或亲和层析柱纯化等。除此之外,检测的灵敏度主要取决于酶的性质。提高灵敏度的一般策略是尽可能多的组装酶在载体(例如:亲和素、聚合物和纳米材料)上以实现颜色信号放大。例如,
金属有机框架(mofs)作为一种新型的微介孔材料,是通过无机金属离子或金属簇与有机配体桥连,自组装连接形成的周期性网络结构的晶态多孔材料。由于mofs具有多种独特的性能,比如高度有序性,超高的比表面积、孔隙度和稳定性,可调的尺寸等,因而具有大孔洞或通道的mofs可作为载体来固定许多催化剂,例如金属复合物、纳米材料和酶。游离酶的昂贵性和难以再循环利用使固定酶这一操作更具有价值。目前已通过一系列的固体支持物来研究固定酶,例如溶胶、水凝胶、有机微粒、多孔或无孔的无机支持物。然而,这些支持物都有一些缺点,譬如在无孔系统中蛋白质的运载量低;无序结构的溶胶作为载体时易被破坏,所以固定的蛋白质易变性;二氧化硅介孔材料具有孔径大,孔隙度高并且结构有序等特点,而被作为很受期待的酶支持物,但是,由于它是一维的通道结构,内通道表面和酶作用力不足,这样在循环使用时常导致酶泄露,另外在其内通道也会发生酶聚合。所以找到能高效的负载酶,同时固定化的酶能保持较好催化性质并再循环使用时尽可能少的发生酶泄露而备受关注。
技术实现要素:
本发明的目的是提供一种利用金属有机框架材料制备酶标记抗体的方法。
针对上述目的,本发明所采用的技术方案是:
1、合成pcn-333
将2,4,6-三(4-羧基苯基)-1,3,5-三嗪与六水合三氯化铝按质量比为1:2~4加入n,n-二乙基甲酰胺中或将2,4,6-三(4-羧基苯基)-1,3,5-三嗪与三氯化铁按质量比为1:0.6~1.5加入n,n-二乙基甲酰胺中,并加入聚乙烯吡咯烷酮,超声至固体完全溶解,然后加入三氟乙酸,混合均匀,所得混合液在100~130℃下加热搅拌17~24h,反应完后离心分离,固体经洗涤、干燥,得到粒径为250~300nm的pcn-333。
2、功能化pcn-333
将pcn-333、n-(3-二甲氨基丙基)-n'-乙基碳二亚胺盐酸盐、n-羟基硫代琥珀酰亚胺按质量比为1:4~22.5:8~50加入超纯水中,常温振荡反应30~40min后,用超纯水将固体离心洗涤,得到功能化pcn-333。
3、合成酶标抗体复合物
将功能化的pcn-333加入ph=7.4的磷酸盐缓冲液中,再加入抗体,常温振荡孵育30~40min后,在4℃下孵育10~15h,用pbs离心洗涤收集固体;所得固体分散于ph=7.4的磷酸盐缓冲液中,再加入酶,振荡孵育后,离心收集固体,用封闭液封闭后,分散于含牛血清白蛋白的稀释液中,得到酶标抗体复合物,于4℃下储存;其中,所述功能化的pcn-333与抗体、酶的质量比为1:0.1~0.3:0.01~0.2。
上述步骤1中,所述2,4,6-三(4-羧基苯基)-1,3,5-三嗪与n,n-二乙基甲酰胺的质量-体积比为1mg:0.4~1.4ml,2,4,6-三(4-羧基苯基)-1,3,5-三嗪与三氟乙酸的质量-体积比为1mg:0.01~0.02ml。
上述步骤1中,所得混合液中聚乙烯吡咯烷酮的浓度为0.4~0.6mmol/l,其中所述的聚乙烯吡咯烷酮的数均分子量为5000~10000;所得混合液中聚乙烯吡咯烷酮的浓度为0.02~0.03mmol/l,其中所述的聚乙烯吡咯烷酮的数均分子量为40000~50000。
上述步骤2中,所述pcn-333、n-(3-二甲氨基丙基)-n'-乙基碳二亚胺盐酸盐、n-羟基硫代琥珀酰亚胺的质量比为1:4.5~10:10~20。
上述步骤3中,所述的抗体为第一抗体或第二抗体,所述的酶为辣根过氧化物酶、微过氧化物酶、碱性磷酸酶、细胞色素c中任意一种。
本发明的有益效果如下:
1、本发明采用的pcn-333具有超大孔洞,最大的笼直径为5.5nm,对于各种各样的酶,若酶的三维空间构型上任意方向的尺寸有小于pcn-333的最大笼孔径,则可用于酶封装。hrp的空间尺寸为4.0×4.4×6.8nm,所以能加载到最大的笼中。而pcn-333的笼不仅能和封装的酶发生强烈的相互作用,有效的封装酶,保证固定化酶的稳定性,其还具有小窗口,阻止酶聚合和浸出,优化催化环境,并在水溶液中能稳定存在。本发明利用pcn-333的多孔性封装酶,提高了酶的封装量及利用率,从而极大地提高了标记酶量。
2、本发明改变了传统意义上抗体与酶的偶联过程,通过抗体与羧基功能化的pcn-333的偶联反应,避免了繁琐且低效率的酶和蛋白(抗体)的化学交联过程。
3、本发明通过简单的离心洗涤就能使制成的酶标抗体复合物与多余的抗体或者酶分离,避免了使用高浓度的酶和抗体,繁琐的分离与纯化步骤,如凝胶过滤、长时间透析或亲和层析柱纯化等,进而保证了酶和抗体的活性不受损失。
4、与市场已有的试剂盒作对照,本发明通过简单的制备过程有效地降低了制备酶标抗体的成本,并且成功的应用于人前列腺表面抗原的高灵敏度检测。
附图说明
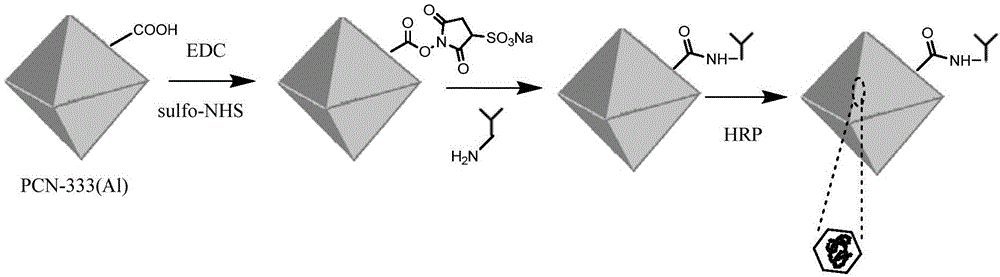
图1是利用pcn-333(al)制备酶标记抗体的方法示意图。
图2是实施例1制备的pcn-333(al)的场发射扫描电镜图。
图3是实施例1制备的pcn-333(al)和酶标抗体复合物的粉末x-射线衍射图。
图4是实施例1制备的固定抗体的pcn-333(al)的透射电镜图。
图5是hrp@pcn-333中酶活性的测量图。
图6是实施例1制备的酶标记抗体复合物以elisa法测定psa的校准曲线图。
具体实施方式
下面结合附图和实施例对本发明进一步详细说明,但本发明的保护范围不仅限于这些实施例。
实施例1
根据图1所示的合成路线制备酶标记抗体复合物,具体方法如下:
1、合成pcn-333(al)
取25mg2,4,6-三(4-羧基苯基)-1,3,5-三嗪和50mgalcl3·6h2o、20mgpvp(平均分子量40000)于50ml圆底烧瓶,加入20mln,n-二乙基甲酰胺,超声分散10min,保证所加药品完全溶解,再加入0.25ml三氟乙酸,在120℃下油浴加热搅拌20小时,离心分离,固体经n,n-二甲基甲酰胺、乙醇洗涤后,得到pcn-333(al)。由图2和图3可以看出成功合成了300nm的pcn-333(al),合成的pcn-333(al)尺寸均一,分布均匀。
2、功能化pcn-333(al)
将1mgpcn-333(al)加入到100μl超纯水中,再加入100μl25mmol/ln-(3-二甲氨基丙基)-n'-乙基碳二亚胺盐酸盐(edc)水溶液和100μl50mmol/ln-羟基硫代琥珀酰亚胺(sulfo-nhs)水溶液,常温振荡反应30min后,用超纯水将固体离心洗涤两次(15000rpm/10min),得到功能化pcn-333(al)。
3、合成酶标抗体复合物
将1mg功能化pcn-333(al)加入到900μl10mmol/lph=7.4的磷酸盐缓冲液(pbs)中,再加入100μl2mg/mlgoatanti-mouseigg溶液(用pbs稀释),常温振荡孵育30min,再将反应溶液放置到冰箱中,在4℃下12小时,离心收集固体(15000rpm/10min),用pbs洗涤两次后,得到固定抗体的pcn-333(al)。由图3和图4可见,抗体成功固定到pcn-333(al)表面,且固定抗体后的pcn-333(al)晶型保持较好。
将上述得到的修饰抗体的pcn-333(al)分散于100μlpbs中,并加入50μl1mg/mlhrp水溶液中,28℃下振荡孵育40min,离心收集固体(15000rpm/10min),加入到200μl封闭液(含5wt.%牛血清白蛋白(bsa)的pbs)中,在4℃下封闭2h后,用pbs离心洗涤收集固体(15000rpm/10min),分散到100μl含1wt.%bsa的pbs中,得到酶标抗体复合物,于4℃下储存。经测试,1mg的pcn-333(al)可封装0.25mghrp,即3.7×1015个hrp分子/1mg。
实施例2
本实施例的步骤1中,取12.5mg2,4,6-三(4-羧基苯基)-1,3,5-三嗪))和25mgalcl3·6h2o、50mgpvp(平均分子量10000)于25ml圆底烧瓶,加入10mln,n-二乙基甲酰胺,超声分散10min,保证所加药品完全溶解,再加入0.125ml三氟乙酸,在120℃下油浴加热搅拌20小时,离心分离,固体经n,n-二甲基甲酰胺、乙醇洗涤后,得到pcn-333(al)。其他步骤与实施例1相同,得到酶标抗体复合物,于4℃下储存。
实施例3
本实施例的步骤1中,取25mg2,4,6-三(4-羧基苯基)-1,3,5-三嗪))和30mgfecl3、50mgpvp(平均分子量10000)于25ml圆底烧瓶,加入10mln,n-二乙基甲酰胺,超声分散10min,保证所加药品完全溶解,再加入0.25ml三氟乙酸,在120℃下油浴加热搅拌20小时,离心分离,固体经n,n-二甲基甲酰胺、乙醇洗涤后,得到pcn-333(fe)。其他步骤与实施例1相同,得到酶标抗体复合物,于4℃下储存。
为了证明本发明的有益效果,发明人选择以h2o2氧化tmb反应,对实施例1制备的酶标抗体复合物进行了活性和动力学性能测试,并与采用实施例1制备的pcn-333(al)直接固定hrp(记为hrp@pcn-333)进行比较。由图5可见,pcn-333(al)能有效的保持酶的催化活性。动力学性能测试结果显示,hrp@pcn-333的催化常数kcat为4.82×104min-1。实施例1制备的酶标抗体复合物的催化常数kcat为2.20×104min-1,天然游离hrp的kcat为2.65×105min-1。这些数据说明酶标抗体复合物在催化产生有色产物时,与天然游离hrp同样具有高的催化活性,固定抗体后并未影响酶活性。
发明人进一步采用实施例1制备的酶标抗体复合物作为信号放大器进行酶联免疫吸附测定前列腺表面抗原(psa),psa是指示前列腺癌症治疗后复发的关键生物标记物,早期检测到微量的psa浓度对提高前列腺根治病人的生存率是至关重要的。使用酶标仪对不同浓度的psa标准浓度进行检测和量化,用硫酸终止催化反应,在450nm处读取od值,通过绘制吸光度对psa浓度图(见图6),发现在3.0~12.0ng/ml的范围内,它们呈线性关系。在整个浓度范围内,变异系数(n=3)被确定小于9.54%(范围3.25%~9.54%),说明检测的重现性较好,且最低检测限为1.6ng/ml。而在血清中前列腺特异抗原(psa)正常值一般<4ng/ml,当前列腺癌发生时psa>10ng/ml,具有辅助临床诊断的显著意义,说明本发明具有一定的可行性。
为了证明实施例1制备的酶标抗体复合物在临床中的潜在应用,发明人在0.5~50ng/ml的不同psa标准浓度的溶液中加入标准的人血浆样品,并检测psa的浓度。结果显示,加入了标准的人血浆样品的四组psa的分析物回收率在93.5%~105.8%的范围内。所有样品的变异系数(n=7)均低于8.4%。这些数据说明本发明酶标抗体复合物的elisa不受血浆中复杂组分的影响,表明该方法在临床样品检测中的可行性。
- 还没有人留言评论。精彩留言会获得点赞!