一种低成本、简单快速的糖蛋白N-糖链分析方法与流程
本发明涉及生物化学领域,尤其涉及一种糖蛋白n-糖链分析方法。
背景技术:
糖蛋白上连接的n-糖链是由葡萄糖、半乳糖、甘露糖、n-乙酰葡萄糖、n-乙酰半乳糖、唾液酸等单糖通过糖苷键连接而成的分子。n-糖链在内质网表面经糖基转移酶催化,与新生成的蛋白质上的天冬酰胺残基通过n-糖苷键连接,并进入内质网和高尔基体内发生一系列后续加工。n-糖基化通常发生在保守的氨基酸序列n-x-t/s(x≠p)中,根据五糖核心外围糖链的延长方式不同,其又可以分为高甘露糖型、杂合型以及复合型,不同的糖链结构各自发挥重要的调控功能。大量研究结果表明,细胞表面n-糖链异常变化与肿瘤细胞的侵袭和转移等有密切关系。研究n-糖链的结构变化对于阐明糖链在肿瘤和疾病发生发展中的作用,糖链标志物的发现以及早期诊断、治疗乃至药物的研发具有重要意义。
但是n-糖链分析难度较大,主要在于其含量低、种类和结构复杂、异质性等,因此n-糖链定量分析的前处理(纯化)显得尤为重要公告号为cn102788720b的专利文件(一种滤膜辅助分离生物样本中糖蛋白全n-接糖链及其鉴别方法)公开了一种n-糖链纯化及分析方法,其通过pngasef酶切割n-糖链,用10kd分子筛过滤得到n-糖链粗提液后,使用sepharose4b在离心管中纯化n-糖链;然后通过基质辅助激光解吸电离飞行时间质谱对其进行分析。但最终产生的n-糖链的质谱信号偏弱,鉴定的糖链种类偏少。
技术实现要素:
为了增强n-糖链的质谱检测信号,本发明首先提供了一种低成本、简单快速的糖蛋白n-糖链定量分析的前处理方法,它包括如下步骤:
(1)糖蛋白加热变性后进行还原烷基化处理;
(2)在超滤管中使用pngasef蛋白酶切除糖肽上的n-糖链,离心收集n-糖链;
(3)使用亲水作用色谱纯化富集n-糖链;
(4)去除唾液酸后,干燥浓缩。
前述的前处理方法,步骤(1)所述的还原烷基化处理为:分别使用二硫苏糖醇和碘乙酰胺处理。
进一步地,所述二硫苏糖醇处理为:50-60℃振荡反应30-60min。
进一步地,所述碘乙酰胺处理为:加入终浓度30-70mmol/l碘乙酰胺在室温避光反应0.5-1.5h。
前述的前处理方法,步骤(2)所述的酶切反应在条件是:酶用量:每20μg糖蛋白使用1u的酶;反应温度:37℃;反应时间:2h。
前述的前处理方法,步骤(3)使用的色谱填料是博纳爱杰尔的venusilhilic填料。
前述的前处理方法,步骤(2)结束后要对n-糖链冻干,使用平衡液复溶后进入步骤(3);所述平衡液为80%(v)乙腈和0.2%(v)三氟乙酸的混合溶液。
前述的前处理方法,其特征在于,步骤(3)为:上样后,使用平衡液洗杂质,再用0.1%(v)的三氯乙酸溶液洗脱n-糖链。
前述的前处理方法,步骤(3)在移液枪枪头中进行;所述移液枪枪头内部的前端固定有c8固相萃取盘片;所述盘片起筛板的作用。
前述的前处理方法,步骤(4)所述的去除唾液酸的方法为:在三氟乙酸环境中加热到70-100℃,维持20-40min。
进一步地,所述三氟乙酸环境中三氟乙酸的浓度为0.2%(v)。
本发明还提供了一种低成本、简单快速的糖蛋白n-糖链定量分析方法,它包括前述的前处理方法,还包括:
基质辅助激光解吸电离飞行时间质谱分析n-糖链。前述的定量分析方法,所述的质谱分析的参数为:
模式:正离子反射模式;
加速电压:20kv;
激光能量:4500。
本发明具有如下有益效果:首先,本发明在n-糖链分析前进行了去唾液酸的步骤,增强n-糖链的质谱信号,增加了糖链类型的解析丰度。进一步地,本发明使用三氟乙酸进行去唾液酸处理,相比唾液酸酶处理,节约了时间和经济成本。
其次,本发明使用亲水色谱填料对n-糖链进行纯化富集,可在移液枪枪头中进行,操作简单。
再次,本发明可广泛适用于不同来源的糖蛋白的n-糖链的分析,且分析结果稳定可靠。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过具体实施方式对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
图1是本发明的糖蛋白n-糖链分析流程图。
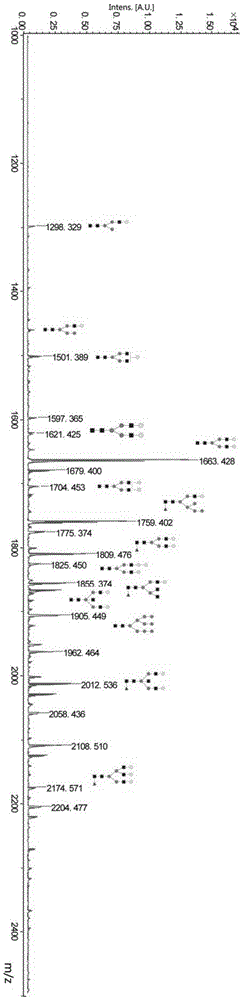
图2是iga1的经本发明分析得到的maldi谱图。
图3是umod的经本发明分析得到的maldi谱图。
图4是iga1的n-糖链不经去唾液酸处理得到的maldi谱图。
图5是iga1的n-糖链经去唾液酸酶处理后分析得到的maldi谱图。
图6是iga1的n-糖链定量重复性评估图。
具体实施方式
如图1所示为本发明的实验流程。由图可知,糖蛋白需要经过变性、还原烷基化打开二硫键,使用pngasef蛋白酶切除n-糖链,超滤管离心收集n-糖链,hilic富集得到纯化的n-糖链,酸法处理去除n-糖链的唾液酸,基质辅助激光解吸电离飞行时间质谱(maldi-tofms)对去唾液酸的n-糖链进行分析。
为使本领域技术人员更好地理解本发明的技术方案,下面结合附图对本发明做进一步详细描述。
实施例1人血液中糖蛋白免疫球蛋白a1(iga1)的n-糖链分析
1.方法
(1)从人血液中分离纯化得到的100μg的iga1溶于200μl的50mmol/l的碳酸氢铵(nh4hco3)溶液中,并在100℃加热10min进行变性。
(2)加入终浓度20mmol/l的二硫苏糖醇(dtt)在56℃振荡反应45min,加入终浓度50mmol/l碘乙酰胺(iam)在室温避光反应1h。
(3)反应液全部加入到30kd超滤管中,13000g离心15min×3次,每次用200μl的50mmol/l的nh4hco3冲洗。
(4)加入100μl的50mmol/l的nh4hco3和5u(1∶20)的pngasef蛋白酶溶液,在37℃振荡器中继续反应2h。
(5)13000g离心15min×3次,收集n-糖链,每次用200μl的超纯水冲洗。收集液冻干后备用。
(6)用ep管称取5mg的hilic填料,先用0.1%三氟乙酸(tfa)冲洗填料10min×3次,再用80%acn,0.2%tfa溶液平衡5min×3次。
(7)将步骤(5)中冻干的n-糖链使用80%acn,0.2%tfa溶液复溶,并与步骤(6)的填料混合,在室温旋转结合2h。
(8)然后转入到100微升移液枪头(c8固相萃取盘片作为筛板),3000g离心1min。
(9)用80%乙腈(acn),0.2%tfa溶液再洗一次去除非特异结合的杂质,最后用0.1%tfa洗脱3次,得到纯化的n-糖链。冻干后-20℃保存备用。
(10)将步骤(9)富集得到的纯化的n-糖链,加入200μl的0.2%的三氟乙酸溶液重新溶解,80℃振荡加热30min去除唾液酸。最后冻干得到的是去除唾液酸的n-糖链。
(11)用125μl的ta30(乙腈∶0.1%tfa=30∶70(v/v))溶解一管肽段校正标准品(peptidecalibrationstandardii)用于仪器校正。用ta30配制20mg/ml的2,5-二羟基苯甲酸(2,5-dhb)。10μl的超纯水进行溶解步骤(10)的n-糖链。
(12)取1μl样品点在anchorchip靶上,自然干燥后,取1μl基质点在样品靶上,自然干燥后,推入离子源中待测。使用peptidecalibrationstandardii对仪器进行外标校正,校准至相对误差≤10ppm。
(13)分析n糖链样品,采用maldi-tof质谱仪器(brukerdaltonics公司),正离子反射模式,加速电压20kv,激光能量4500,每个样品平行采集三张谱图。
(14)使用flexanalysis3.3版本软件分析原始数据,计算每个糖链峰强度,作为该糖型的含量依据。计算糖型比例时,先归一化之后再计算每个糖型的相对含量。
2.结果
三组人血浆iga1的n-糖链得到的maldi-tof谱图如图2所示,结果表明,本发明能实现有效地n-糖链定量分析。
实施例2人尿液中糖蛋白质尿调蛋白(umod)的n-糖链分析
1.方法
(1)将人尿液分离纯化得到的100μg的umod溶于200μl的50mmol/l的碳酸氢铵(nh4hco3)溶液中,并在100℃加热10min进行变性。
(2)加入终浓度20mmol/l的二硫苏糖醇(dtt)在56℃振荡反应45min,加入终浓度50mmol/l碘乙酰胺(iam)在室温避光反应1h。
(3)反应液全部加入到30kd超滤管中,13000g离心15min×3次,每次用200μl的50mmol/l的nh4hco3冲洗。
(4)加入100μl的50mmol/l的nh4hco3和5u(1∶20)的pngasef蛋白酶溶液,在37℃振荡器中继续反应2h。
(5)13000g离心15min×3次,收集n-糖链,每次用200μl的超纯水冲洗。收集液冻干后备用。
(6)用ep管称取~5mg的venusilhilic填料(博纳爱杰尔),先用0.1%tfa冲洗填料10min×3次,再用80%acn,0.2%tfa溶液平衡5min×3次。
(7)将步骤(5)中冻干的n-糖链使用80%acn,0.2%tfa溶液复溶,并与步骤(6)的填料混合,在室温旋转结合2h。
(8)然后转入到100微升移液枪头(c8固相萃取盘片作为筛板),3000g离心1min。
(9)用80%acn,0.2%tfa溶液再洗一次去除非特异结合的杂质,最后用0.1%tfa洗脱3次,得到纯化的n-糖链。冻干后-20℃保存备用。
(10)将步骤(9)富集得到的纯化的n-糖链,加入200μl的0.2%的三氟乙酸溶液重新溶解,80℃振荡加热30min去除唾液酸。最后冻干得到的是去除唾液酸的n-糖链。
(11)用125μl的ta30溶解一管peptidecalibrationstandardii用于仪器校正。用ta30配制20mg/ml的2,5-dhb。10μl的超纯水进行溶解步骤(10)的n-糖链。
(12)取1μl样品点在anchorchip靶上,自然干燥后,取1μl基质点在样品靶上,自然干燥后,推入离子源中待测。使用peptidecalibrationstandardii对仪器进行外标校正,校准至相对误差≤10ppm。
(13)分析n糖链样品,采用maldi-tof质谱仪器(brukerdaltonics公司),正离子反射模式,加速电压20kv,激光能量4500,每个样品平行采集三张谱图。
(14)使用flexanalysis3.3版本软件分析原始数据,计算每个糖链峰强度,作为该糖型的含量依据。计算糖型比例时,先归一化之后再计算每个糖型的相对含量。
2.结果
如图3所示,本发明从尿液umod中仍然能有效定量分析n-糖链。表明本发明的方法适应性广。
以下将以对比例的形式对本发明对唾液酸的处理方式产生的有益效果做进一步说明。
对比例1不做唾液酸去除的n-糖链定量分析
1.方法
同实施例1的方法,但要跳过步骤(10)。
2.结果
质谱图如图4所示,不去除唾液酸会使得n-糖链的质谱信号弱,鉴定的糖链种类少。
对比例2使用唾液酸酶去除唾液酸的n-糖链定量分析
1.方法
同实施例1的方法,但要将步骤(10)替换为“唾液酸酶处理”。
2.结果
如图5所示,去唾液酸酶能特异性去除唾液酸,糖链的信号会显著增加,鉴定到的糖链种类也会增加。但是去唾液酸酶成本高,保存时间短,反应时间需要过夜。
进一步地,本发明具有较好的稳定性,以下用实验例的形式对此加以说明。
实验例稳定性测试
1.方法
取3份不同人的血浆,按照实施例1的方法进行实验。
2.结果
如图6所示,三组不同人得到的iga1的n-糖链种类差异很小,表明该方法很稳定,重现性好,可靠性高。
综上,本发明的方法可以简单、快速、有效地实现糖蛋白n-糖链的定量分析,且分析成本低、适用范围较广,具有良好的产业化前景。
- 还没有人留言评论。精彩留言会获得点赞!