一种基于铜纳米簇的汞离子比色检测方法与流程
本发明涉及一种汞离子的比色检测方法,具体是一种基于铜纳米簇的汞离子比色检测方法。
背景技术:
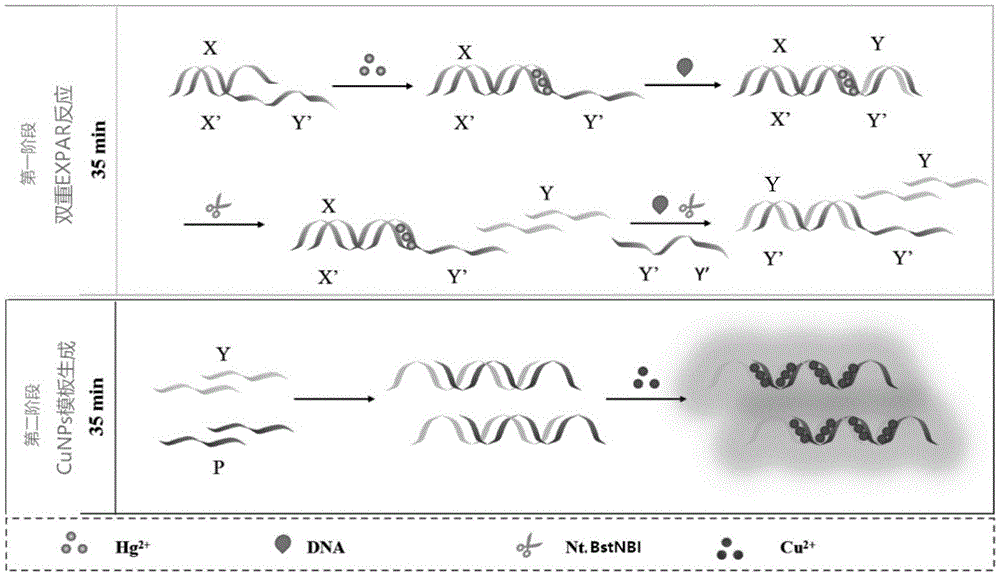
:自然界中,汞主要以无机汞和有机汞两种形式存在。无机态汞以氯化合物、氢氧化合物形式居多,此外还包括氧化态、硫化态汞等;有机态汞主要以甲基汞、乙基汞、络合汞等形式存在。因汞能长距离转移到极地、蓄积在生物体中并产生毒性危害,联合国环境规划署(unep)自2001年起将其追加为持久性有害物质(phs),我国也于2011年将汞列入《重金属污染综合防治规划(2010-2015)》。汞中毒引起的临床表现与进入体内汞的形态、进入途径、接触剂量、接触时间及人体特征密切相关。对于急性汞中毒患事件,消化道侵入的临床表现为胃肠道症状和口腔炎症,熏吸侵入的临床表现为呼吸道症状,外用侵入的临床表现为皮炎症等。此外,汞也具有慢性毒性和蓄积性毒性,其靶器官主要是神经系统。特别注意甲基汞可以通过胎盘屏障,使新生儿发生先天性疾病,如不同程度的智力低下,自闭症,瘫痪甚至死亡。为保障人类健康,美国环境保护协会(epa)规定的饮用水中的最大汞残留量为2.0ppb。2006年ono小组首次报道了hg2+能与寡核苷酸序列中的thymine-thymine碱基对特异性结合形成稳定的t-hg2+-t配合物。配合物是hg2+与t上的第三个n发生质子取代所形成的。t-hg2+-t的形成不会对dna的双螺旋结构及电子传递特性产生明显影响,因此针对hg2+的这种特性,很多生物传感器被构建并应用。恒温指数扩增技术是2003年由galas等人建立的新型核酸扩增技术,在dna聚合酶和nt.bstnbi切刻内切酶的作用下,能够在较短时间内(30min),实现目标序列106~109倍的扩增。其特点在于切刻内切酶识别特异性的双链切割位点,切割下游单链,如nt.bstnbi的识别双链识别位点是“gactc”,切割位点在下游单链的四个碱基处。然后在聚合酶的作用下,以双链dna中未被剪切的dna作为模板,在切刻酶剪切位置进行聚合延伸,链置换获得大量单链目标序列。cu2+在一定条件下可以以dna序列为模板生成荧光纳米粒子cunps,并且在紫外光照射下显示出肉眼可见的红色,因此可以将其作为传感器的输出信号。本申请主要是利用cunps和expar技术,实现hg2+的简便、可视、快速、超灵敏检测。技术实现要素:本发明的目的在于提供一种基于铜纳米簇的汞离子比色检测方法,以解决上述
背景技术:
中提出的问题。为实现上述目的,本发明提供如下技术方案:一种基于铜纳米簇的汞离子比色检测方法,其特征在于:包括以下步骤:1)mops缓冲液中加入dna模板、抗坏血酸和cu2+之后制备cunps;2)采用恒温指数扩增方法对dna引物进行扩增,生成y模板,使得x与x’模板中包含nt.bstnbi切刻内切酶的识别位点5’-gagtcnnnnn-3’;3)在体系中加入与y部分互补,并能与y结合生成dna夹心结构supersandwich的单链p,其序列为5’-gatatgatactatagtagtagtatatatgatatat-3’,以形成的dna夹心双链结构作为cunps的模板,通过模板产生的荧光信号强度判断模板浓度,通过标准曲线得出hg2+的含量。所述引物为x1,x2,x3与x’-y’,其中,x1:ctacacgcgattcatgagtctttax2:ctacacgcgattcatgagtctttx3:ctacacgcgattcatgagtctttt;x’-y’:tcgctatcagtttcttggaatttttgactcatgaatcgcgtgtag。所述标准曲线建立为:利用cu2+以随机双链为模板可以生成cunps,结合双重恒温指数扩增信号放大体系,建立一种基于cunps-biexpar的生物传感器,传感器对hg2+浓度的响应是线性的,其线性相关性可表示为y=0.222x-0.5375做为进一步优化,制备cunps包括以下步骤:将dna引物溶解在超纯水中,终浓度为10μm;配制mops缓冲液;在mops缓冲液中依次加入dna模板、100μmcuso4溶液及2mm抗坏血酸钠溶液并孵育,孵育条件和时长分别为室温、5min作为本发明进一步的方案:还包括对cunps的信号转化,其方法包括以下步骤:在上述恒温指数扩增体系中加入supersandwich的另一条模板链,37℃条件下孵育30min;随后加入cu2+、抗坏血酸钠及mops缓冲液,以生成的supersandwich为模板合成cunps,孵育条件和时长分别为室温,5min。作为本发明进一步的方案:上述cu2+、抗坏血酸钠及mops缓冲液的用量分别为:50μl浓度为1mm的cuso4溶液、100μl浓度为10mm的抗坏血酸钠溶液以及300μl的mops缓冲液。作为本发明进一步的方案:恒温指数扩增方法扩增dna引物包括以下步骤:1)将引物溶解在超纯水中,终浓度为1μm,加入10μm2.4μl的hg2+、2.5mm3μldntp以及6.8μl的超纯水,在95℃下进行变性,变性时间5min,随后在37℃下孵育30min;2)加入0.1μl、浓度为8u/μl的bstdna聚合酶、3μl的10×thermpol缓冲液,在55℃条件下孵育10min;3)加入1.2μl、浓度为10u/μl的nt.bstnbi核酸内切酶以及1.5μl的buffer3.1,在55℃下孵育20min。作为本发明进一步的方案:所述引物为x1,x2,x3与x’-y’,其中,x1:ctacacgcgattcatgagtctttax2:ctacacgcgattcatgagtctttx3:ctacacgcgattcatgagtctttt;x’-y’:tcgctatcagtttcttggaatttttgactcatgaatcgcgtgtag。作为本发明进一步的方案:建立标准曲线方法包括以下步骤:1)在expar体系中梯度加入hg2+,使hg2+的终浓度为0,0.2,0.5,1,2,5,10,20,50,100,200,500,1000,2000,5000nm;2)得到y产物后,在体系中加入20μm模板链p,37℃条件下孵育30min,使得y与p结合形成supersandwich的双链模板;3)加入100μm的cuso4及2mm抗坏血酸钠,室温孵育5min,测定荧光强度值。作为本发明进一步的方案:配制mops缓冲液方法为:将10mm3-吗啉丙磺酸、150mmnacl混合,调节ph至7.6。与现有技术相比,本发明的有益效果是:1、基于三级联放大和铜纳米粒子构建了汞离子比色、无标记的生物传感器;2、选取随机序列作为cunps的生成模板,不仅降低了背景荧光值,同时还提高了cunps的稳定性;3、expar和supersandwich结合构成三级联放大系统;4、本发明的过程是一种简便的等温操作,具有一定的通用性;5、50nm-1um范围内具有较好的的线性关系,并且最低检出限能够达到2.5um。附图说明图1为本发明中双重expar和cunps传感器检测原理图;图2为本发明中以ssdna为模板生成cunps的荧光强度结果图;图3为本发明中不同模板链的长度、聚合度下cunps荧光强度的结果图;图4为本发明中cunps随机模板优化曲线图;图5为本发明中cunps生成的动力学曲线图;图6为本发明在不同光照环境下cunps荧光强度的结果图;图7为本发明中ssdna-cunps对互补链的抗性的荧光强度结果图;图8为本发明中expar模板结构对生成产物y的影响的电泳图;line1:x1;line2:x’-y’;line3:x1+x’-y’;line4:以x1为模板的expar(+);line5:以x1为模板的expar(-);line6:x2;line7:x’-y’;line8:x2+x’-y’;line9:以x2为模板的expar(+);line10:以x2为模板的expar(-);line11:x3;line12:x’-y’;line13:x3+x’-y’;line14:以x3为模板的expar(+);line15:以x3为模板的expar(-);图9为本发明中expar与双重expar扩增效率对比的电泳图;line1:x1;line2:x’-y’;line3:y’-y’;line4:expar(+);line5:biexpar(+)图10为本发明中以supersandwich和以dsr35(80)为模板生成cunps荧光强度结果图;图11为本发明中biexpar-cunps传感器灵敏性分析结果图。具体实施方式下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。1、制备cunps以不同dna序列为模板,探究模板导致的cunps的性质差异,从而选出最适合与expar技术相结合的cunps。制备cunps的反应过程如下:1)将表1中1-26号引物溶解在超纯水中,终浓度为10μm,2)配制mops缓冲液(10mm3-吗啉丙磺酸,150mmnacl,调节ph至7.6),100μmcuso4溶液及2mm抗坏血酸钠溶液备用,抗坏血酸钠溶液需要现用现配;3)在mops缓冲液中依次加入dna模板,cuso4及抗坏血酸钠并孵育,孵育条件和时长分别为室温,5min。表1cunps模板序列及expar引物序列表2以ssdna为模板生成cunps及其抗性实验首先探究以ssdna为模板生成的cunps的性质,并测定了cunps对时间、光照、模板链互补链和多种金属离子的抗性。所使用的ssdna模板链可分为两类:一类是规则的polyn(n=a,t,c或g)序列,包括t20,t40,t80,t20-sg-t20,t40-sg-t40,a40,c40,g40;另一类是随机单链r序列,包括r15(40-1),r15(40-2),r15(80-1),r15(80-2),r25(40-1),r25(40-2),r25(80-1),r25(80-2),r35(40-1),r35(40-2),r35(80-1),r35(80-2)。表2以ssdna为模板生成cunps制备过程试剂初浓度体积终浓度ssdna模板10μm25μl500nmmops缓冲液325μlcuso41mm50μl100μm抗坏血酸钠10mm100μl2mm总体积500μlcunps的抗性试验包括以下步骤:1)cunps对互补链抗性:在cunps形成后,加入与模板链ssdna等量的互补序列,读取cunps的荧光强度,并记录荧光淬灭率;2)cunps荧光强度与时间、光照的抗性:在cunps孵育过程中,将cunps分成两组。一组保持黑暗环境,一组自然光照射,每隔15min测定cunps的荧光强度。在所有抗性实验中,记f0为无干扰因素下cunps的荧光,f为加入干扰因素后cunps的荧光,荧光淬灭效率记为η=(f0-f)/f0。3以dsdna为模板生成cunps及抗性实验dsdna模板链包括两类,一类是polyat或polycg序列,即at22,at44,at22-sg-at22,cg22及cg44,其中polyat或polycg链可以自组装成双链结构;二是随机序列,包括dsr15(40),dsr15(80),dsr25(40),dsr25(80),dsr35(40)及dsr35(80)。表3以dsdna为模板生成cunps制备过程试剂初浓度体积终浓度dsdna10μm50μl500nmmops缓冲液300μlcuso41mm50μl100μm抗坏血酸钠10mm100μl2mm总体积500μl实施例一,基于双重expar和cunps传感器的设计利用cu2+以随机双链为模板可以生成cunps,结合双重恒温指数扩增信号放大体系,建立了一种基于cunps-biexpar的生物传感器,实现了hg2+的定量检测。图1所示为双重expar和cunps传感器检测hg2+原理图,对expar扩增的模板序列进行设计,使得x与x’模板中包含nt.bstnbi切刻内切酶的识别位点5’-gagtcnnn-3’。其中,黑色三角形表示nt.bstnbi酶的切割位点,n表示任意碱基。切割位点上游的4个n碱基中,将前3个碱基设计为t,与x’序列形成3个t-t错配,第四个碱基设计为a,与x’序列形成a-t配对,biexpar的扩增产物y为生成cunps的双链模板中的一条单链。反应完成后,在体系中加入与y部分互补,并能与y结合生成dna夹心结构supersandwich的单链p,supersandwich的产物是长双链dna复合物,可以作为cunps的生成模板。当体系中没有hg2+时,x与x’间的3个t-t错配形成翘起,dna聚合酶无法延伸生成y序列,加入序列p后,由于随机单链不能作为cunps生成的模板,因此体系的荧光本底很低;当体系中有hg2+时,t-t错配与hg2+形成t-hg2+-t结构,拉近了x序列3’端的a、t碱基的距离,形成正常的a-t配对,expar反应得以发生,生成大量y产物。此时加入p序列,形成的dna夹心双链结构可以作为cunps的模板,产生强烈的荧光信号。cunps的荧光强度与模板浓度呈正相关,从而实现hg2+的定量检测。实施例二,模板碱基种类对cunps的影响1、对单、双链的碱基构成进行优化:以ssdna作为生成cunps的模板,按照碱基构成可将单链分为两种类型:模板polyn(n=a,t,c,g)序列和随机模板r序列。以ssdna为模板生成cunps的荧光强度如图2a所示,其中polyn序列的长度均为40nt。由图可知,cunps的荧光强度与n的种类有关,除polyt外,polya,polyc,polyg均不能作为生成cunps的模板,同样,随机单链序列r也不能作为生成cunps的模板。2、对dsdna生成cunps的能力进行探究:按照碱基构成,将双链分为polyat-ta,polycg-gc以及随机模板dsr。polyat-ta,polycg-gc及随机链dsr长度均为44bp。图2b表示以不同类型的双链为模板时cunps的荧光强度,与polyt相比,以双链at44及随机序列dsr44为模板生成的cunps,其最大发射波长发生明显的蓝移,且以at44作为模板可使cunps的荧光强度显著增加,随机序列dsr44生成cunps的能力较弱,其荧光强度大约为at44的5%。3、模板序列长度及聚合度对cunps的影响在ssdna中,只有polyt可以作为生成cunps的模板,因此,对polyt中t碱基的数量、t碱基的聚合度与cunps荧光强度的关系进行了分析,其结果如图3a所示:cunps的荧光强度与polyt序列的长度有关,即t80>t40>t20。随后,在polyt中引入短的随机序列sg以改变t的聚合度,t2x与tx-sg-tx中t碱基的个数相同,但前者t的聚合度高于后者。由实验结果可知,以不同polyt为模板生成的cunps的荧光强度大小关系为,t80>t40-sg-t40;t40>t20-sg-t20。也就是说,cunps的荧光强度与t的聚合度有关——随t碱基聚合度的增加而增加。在dsdna中,分析polyat-ta序列的长度及聚合度与cunps荧光强度的关系,其结果如图3b所示:cunps的荧光强度与polyat-ta序列的长度有关,即at44>at22。与polyt类似,在polyat-ta中引入短的随机序列sg以改变at的聚合度,得到at44≈at22-sg-at22,证明随机双链序列也可以作为生成cunps的模板。根据上述结果,进一步探究随机双链的长度与碱基构成对cunps生成效率的影响。所用模板序列为r15(40),r15(80),r25(40),r25(80),r35(40),r35(40),r35(80),其中,15,25,35表示模板序列的长度分别为15bp,25bp,35bp;40,80表示模板中a碱基及t碱基的占比为40%和80%,其结果如图4所示:cunps的荧光强度与模板链的长度和(a+t)%均有关,且随模板序列长度和(a+t)%的增加而增加。实施例三,cunps抗性研究,包括以下步骤:1、以单链、双链和随机双链中最优的序列t80,at44,r35(80)为模板,对cunps的生成过程进行动力学监测,其结果如图5所示。由图可知,以三种dna序列为模板均能快速生成cunps,并在5min内达到荧光强度稳定的状态;2、测定cunps对时间及光照的抗性以t80,at44,r35(80)为模板,在自然光和避光条件下对cunps进行孵育,每隔15min测定cunps的荧光强度,其结果如图6所示,其中6(a)、(c)、(e)和6(b)、(d)、(f)图分别表示在自然光和避光条件下cunps荧光强度的变化情况,孵育时间及模板类型对cunps的稳定性具有显著影响,但cunps的荧光淬灭的现象与光照无关,以t80为模板生成的cunps稳定性最好。在自然光下孵育60min,t80的荧光强度变为原先的79%。而以at44和r35(80)为模板的生成的cunps稳定性较差,在60min后荧光淬灭率达到95%以上;3、探究cunps对互补链序列的抗性在cunps生成后,加入等量的模板链互补序列,测定cunps的荧光强度。选用的模板为t80,t40,t20及a80,a40,a20,其结果由图7可知,互补链对cunps的荧光强度有显著影响,在加入等量的互补链后,cunps的荧光强度降低为原先的50%左右。实施例四,cunps形成模板的选择基于对不同模板生成cunps性质的研究,结合expar扩增技术,本发明中最终选择dsr35(80-1)作为生成cunps的一条模板链,即将dsr35(80-1)作为expar产物y的序列,以此设计biexpar的模板,原因如下:1.以polyt为模板生成的cunps在biexpar扩增中会出现荧光淬灭的现象。若将扩增产物y序列设计为polyt,则y’-y’序列为polya,由polyt-cunps对互补链的抗性实验可知,polyt与polya结合形成双链后,cunps的荧光淬灭率达到50%,因此polyt不是搭建cunps-biexpar体系的最佳模板,另一方面,以polya作为y’-y’序列为,则产物y与y’-y’结合时的位点难以确定;2.以polyat-ta序列为模板无法实现双重expar的扩增。若将y序列设计为polyat序列,polyat同时可作为y’-y’序列自我互补形成双链,产生较强的背景信号,不利于hg2+的定量检测;3.以dsr35(80-1)作为y序列,在未加入p序列时,cunps不能生成,荧光背景值低,当加入p序列时,cunps可产生强烈的荧光信号。且hg2+浓度的增加,y序列浓度增加,dna夹心结构变长,根据cunps荧光强度与模板链长度的关系实验,cunps可产生更强的荧光信号。实施例五,expar反应引物结构的优化以x1,x2,x3分别结合x’-y’模板,促发单重expar反应,以expar(-)表示体系中不加入hg2+,expar(+)表示体系中加入hg2+,且hg2+的浓度为1μm,其反应结果如图8所示:当以x1,x’-y’为模板时,在hg2+存在情况下可以产生明显的y条带,而当体系中没有hg2+时,没有y条带生成,而以x2/x3及x’-y’为模板时,无论加不加hg2+,都不能产生明显的y条带。由此可知,切割位点末端的a-t配对有利于nt.bstnbi和bstdna聚合酶的切割或延伸,而t-hg2+-t错配难以作为nt.bstnbi和bstdna聚合酶的作用位点,因此,在后续实验中,我们选择x1,x’-y’为expar生成y产物的模板。expar作为传感器中实现信号放大的单元,起到了增加传感器灵敏度的作用。biexpar在expar体系中增加了y’-y’序列,实现了信号的双重放大。图9为expar与biexpar生成y产物后经聚丙烯酰胺凝胶电泳(page)得到的结果,由图可知,biexpar扩增后产生的y条带,其浓度要高于普通expar。实施例六,cunps模板序列间互补方式的优化对biexpar反应完成后,新加入的引物与y(序列为r35(80-1))的不同结合方式进行比较:当新加入的模板与y序列的互补方式为完全互补时,生成的产物为dsr35(80);当新加入模板与y序列的互补方式为交错互补形成dna夹心结构时,生成的产物为spersandwich。两种双链在加入cu2+后的荧光强度如图10所示,分析可知cunps的荧光强度与模板链的长度存在正相关关系。实施例七,建立标准曲线在优化后的实验条件下测定含有不同浓度的hg2+(范围从0至5000nm)的溶液。biexpar-cunps传感器的检测范围及线性区间如图11所示。图11(a)显示,在0~2000nm范围内,随着hg2+浓度的增加,biexpar-cunps传感器的荧光强度显著增加,并在2000nm后达到稳定。当hg2+浓度为0~1000nm时,传感器对hg2+浓度的响应是线性的,其线性相关性可表示为y=0.222x-0.5375,相关系数r2=0.9997。图11(b)中的内嵌图像是线性区间范围内,紫外灯下肉眼观察到的荧光变化,也就是说,hg2+的浓度可通过肉眼进行定性分析。对于目视检测,可在50~1000nm的浓度范围内观察到明显的荧光变化,如果利用荧光分光光度计进行定量检测,检测的最低限可达到2.5nm。对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。序列表<110>中国农业大学<120>一种基于铜纳米簇的汞离子比色检测方法<130>mp1900903z<160>5<170>siposequencelisting1.0<210>1<211>35<212>dna<213>artificialsequence<400>1gatatgatactatagtagtagtatatatgatatat35<210>2<211>24<212>dna<213>artificialsequence<400>2ctacacgcgattcatgagtcttta24<210>3<211>23<212>dna<213>artificialsequence<400>3ctacacgcgattcatgagtcttt23<210>4<211>24<212>dna<213>artificialsequence<400>4ctacacgcgattcatgagtctttt24<210>5<211>45<212>dna<213>artificialsequence<400>5tcgctatcagtttcttggaatttttgactcatgaatcgcgtgtag45当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1