一种美澳型核果褐腐病菌的活性检测方法与流程
本申请涉及美澳型核果褐腐病菌活性检测领域,特别是涉及一种美澳型核果褐腐病菌的活性检测方法。
背景技术:
美澳型核果褐腐病菌(moniliniafructicola(winter)honey)为子囊菌核盘菌科链核盘菌属,是一种危害多种水果的恶性真菌,其主要寄主为蔷薇科果树,其中对苹果、梨、油桃、李等危害最为严重。在田间,该病原菌主要的越冬方式是靠被侵染之后的果实和枝条,春季温暖而潮湿的天气适合分生孢子大量产生及分生孢子的萌发,病菌将进行侵染,一般从伤口入侵,也可以在果皮上直接侵染,初期发病症状轻微。在果实上刚发病时只出现褐色的小病斑,但适宜条件下几天之内就能使整个果实腐烂,果实表面产生大量的灰褐色粉状分生孢子,并且容易抖落,极易在运输途中传播。美澳型核果褐腐病对中国的水果生产具有很大的威胁,中国具有大量的野生感病寄主,且分布广泛,病菌的入侵严重危害中国的李子、桃、杏、苹果、梨、葡萄等大面积主要水果的生产,经济影响大。同时,在我国各个口岸也多次截获美澳型核果褐腐病菌,例如,在2012年美国进境樱桃中截获到该病菌、2014年在南京国际机场进境旅客截获该菌。美澳型核果褐腐病菌疫情也被视为中美植物检疫双边会谈的重要议题。
目前,美澳型核果褐腐病菌的活性检测主要依赖于传统的形态学鉴定方法,该方法需要对待测样品进行培养,不仅耗时长,而且对操作人员的主观依耐性较强,不能很好的满足实际检验检疫工作的需要。因此,为了更好的保护我国生态安全,建立美澳型核果褐腐病菌病原物孢子的活性检测方法成为当务之急。
技术实现要素:
本申请的目的是提供一种新的美澳型核果褐腐病菌活性检测方法。
本申请采用了以下技术方案:
本申请公开了一种美澳型核果褐腐病菌的活性检测方法,包括采用荧光染料对美澳型核果褐腐病菌孢子进行染色,然后观察染色结果,根据染色情况判断美澳型核果褐腐病菌的活性;其中,荧光染料为碘化丙啶和/或荧光素双醋酸酯;碘化丙啶(以下缩写pi)的染色条件为,在避光条件下,采用终浓度为0.00025mg/ml的pi对孢子进行4min染色;光素双醋酸酯(以下缩写fda)的染色条件为,在避光条件下,采用终浓度为0.0025mg/ml的荧光素双醋酸酯对孢子进行16min染色。其中,pi染色后,死孢子发出红色荧光,活孢子无荧光;fda染色后,活孢子发出绿色荧光,死孢子无荧光;根据死孢子和活孢子的数量判断美澳型核果褐腐病菌的活性。
需要说明的是,本申请的活性检测方法,其关键在于创造性的从现有的若干种荧光染料中研究出能够用于美澳型核果褐腐病菌活性检测的两种荧光染料,即pi和fda;并且,创造性的研究并提出了基于这两种荧光染料的特别是针对美澳型核果褐腐病菌活性检测的具体染色条件。按照本申请的活性检测方法,能够有效的区分检测美澳型核果褐腐病菌的死活,并且,本申请的活性检测方法,从制样、染色到获得活性检测结果,整个检测过程不足30min,大大缩减了美澳型核果褐腐病菌活性检测的时间,提高了检测效率。
还需要说明的是,本申请的美澳型核果褐腐病菌活性检测方法中,pi和fda,两种荧光染料可以单独使用进行活性检测,也可以组合使用,通过复染的方式使死孢子和活孢子更有效的区分,复染的具体方法详见后续方案。
还需要说明的是,本申请的染色条件,例如pi染色条件是反应体系中采用终浓度0.00025mg/ml的pi染色4min,其中pi的终浓度和染色时间直接影响染色效果和死孢子和活孢子的区分质量。可以理解,在本申请的浓度和染色时间基础上,可以进行化学范围内可接受的调整,例如上下调整10%-20%的终浓度或时间,原则上,浓度越高染色的时间越短,反之则反;但是,需要注意的是,染色浓度太高,一方面会影响孢子的活性,另一方面,会使得染色后孢子发出的荧光过饱和,不利于活性判断;同样的染色时间越长,也会出现类似的,影响活性或荧光过饱和的情况;因此本申请优选限定采用终浓度0.00025mg/ml的pi染色4min,或采用终浓度0.0025mg/ml的fda染色16min。
优选的,本申请的活性检测方法中,观察染色结果具体采用激光扫描共聚焦显微镜。
可以理解,本申请的关键在于创造性的研究并提出可以采用两种荧光染料对美澳型核果褐腐病菌进行活性检测,至于如何观察荧光染色信号,可以参考现有技术手段和设备,例如比较常规使用的就是激光扫描共聚焦显微镜。
优选的,本申请的一种实现方式中,美澳型核果褐腐病菌活性检测方法具体包括以下步骤:
采用终浓度为0.00025mg/ml的pi对孢子进行4min避光染色,染色完成后,离心去上清液,加无菌去离子水重悬;
采用终浓度为0.0025mg/ml的fda对重悬的孢子进行16min避光染色,染色完成后,离心去上清液,加无菌去离子水重悬洗涤至少一次,然后再加无菌去离子水重悬;
采用激光扫描共聚焦显微镜对染色后的孢子进行观察;其中,碘化丙啶能够使死孢子发出红色荧光,活孢子无荧光;荧光素双醋酸酯能够使活孢子发出绿色荧光,死孢子无荧光。
优选的,本申请的一种实现方式中,美澳型核果褐腐病菌活性检测方法具体包括以下步骤:
采用终浓度为0.0025mg/ml的fda对孢子进行16min避光染色,染色完成后,离心去上清液,加无菌去离子水重悬;
采用终浓度为0.00025mg/ml的pi对重悬的孢子进行4min避光染色,染色完成后,离心去上清液,加无菌去离子水重悬洗涤至少一次,然后再加无菌去离子水重悬;
采用激光扫描共聚焦显微镜对染色后的孢子进行观察;其中,荧光素双醋酸酯能够使活孢子发出绿色荧光,死孢子无荧光;碘化丙啶能够使死孢子发出红色荧光,活孢子无荧光。
需要说明的是,以上是pi和fda组合使用,对美澳型核果褐腐病菌进行复染的具体方法,可以理解,在复染过程中,pi和fda的使用先后顺序可以根据具体的情况而定。
本申请的有益效果在于:
本申请的美澳型核果褐腐病菌活性检测方法,能够直接有效的观察区分美澳型核果褐腐病菌孢子的死活,并且操作简单;从制样到获得结果,整个检测过程不足30分钟,大大提高了美澳型核果褐腐病菌活性检测的效率。本申请的美澳型核果褐腐病菌活性检测方法具有快速、准确、灵敏、重复性好等优点,能够替代传统的通过形态学检测活性的方法,为口岸检验检疫、农业生产、植物保护等部门的美澳型核果褐腐病菌活性检测提供了一种新的快速、有效的检测方法和途径。本申请的活性检测方法,对美澳型核果褐腐病菌疫情的快速检测和防治、保障国内生态生产安全具有重要意义。
附图说明
图1是本申请实施例中fda对美澳型核果褐腐病菌孢子的染色结果图;
图2是本申请实施例中ao对美澳型核果褐腐病菌孢子的染色结果图;
图3是本申请实施例中pi对美澳型核果褐腐病菌孢子的染色结果图;
图4是本申请实施例中jc-1对美澳型核果褐腐病菌孢子的染色结果图;
图5是本申请实施例中fda原液的20倍稀释液染色16min的染色结果图;
图6是本申请实施例中fda原液染色16min的染色结果图;
图7是本申请实施例中fda原液的20倍稀释液和原液的50倍稀释液不同染色时间的染色结果比较图;
图8是本申请实施例中pi原液的20倍稀释液染色4min的染色结果图;
图9是本申请实施例中pi原液的5倍浓缩液染色4min的染色结果图;
图10是本申请实施例中相同温度和处理时间下孢子萌发率和fda染色率的比较结果图;
图11是本申请实施例中孢子40℃处理30min后的fda染色结果图;
图12是本申请实施例中孢子60℃处理20min后的fda染色结果图;
图13是本申请实施例中孢子60℃处理10min后的fda染色结果图;
图14是本申请实施例中孢子55℃处理20min后的fda染色结果图;
图15是本申请实施例中孢子不同条件处理后不同时间点的染色统计结果;
图16是本申请实施例中孢子60℃处理5min后放置不同时间的fda染色结果图;
图17是本申请实施例中相同温度和处理时间下孢子萌发率和pi染色率的比较结果图;
图18是本申请实施例中孢子45℃处理30min后的pi染色结果图;
图19是本申请实施例中孢子55℃处理30min后的pi染色结果图;
图20是本申请实施例中相同条件处理后fda和pi的染色结果比较图;
图21是本申请实施例中40℃处理温度下不同处理时间的两个菌株的孢子萌发率比较分析图;
图22是本申请实施例中60℃处理温度下不同处理时间两个菌株pi染色率比较分析图;
图23是本申请实施例中不同菌株60℃处理30min后的pi染色结果;
图24是本申请实施例中不同菌株45℃处理30min后的pi染色结果;
图25是本申请实施例中不同菌株55℃处理30min后的fda染色结果;
图26是本申请实施例中不同菌株55℃处理10min后的fda染色结果;
图27是本申请实施例中不同菌株50℃处理20min后的fda染色结果。
具体实施方式
传统的美澳型核果褐腐病菌活性检测主要是通过培养后观察其孢子形态结构,看孢子是否有萌发,以此判断其活性;这种传统的培养检测方法虽然可以准确的判断活性,但是耗时长,不利于快速检测和防治。特别是美澳型核果褐腐病菌在适宜条件下几天之内就能使整个果实腐烂,这种情况下,美澳型核果褐腐病菌的快速活性检测就显得尤为重要。
采用荧光染料对植物病原菌孢子进行染色,并观察其染色结果,以此判断活性,在大豆的一些病原菌活性检测中有相关的应用和研究。但是,适用于大豆病原菌的活性检测方法,不能直接沿用于美澳型核果褐腐病菌,例如,采用按照大豆病原菌的活性检测条件直接用pi对美澳型核果褐腐病菌进行活性检测,会出现死孢子荧光过于饱和影响观察、成像结果不佳等问题,并且pi还会影响美澳型核果褐腐病菌孢子的萌发,即pi染色本身会影响检测对象的活性,使得检测结果不够准确;又例如,常规使用的钙黄绿素、alamarblue、hoechst33342、dapi、ao等都无法明显区分美澳型核果褐腐病菌孢子的死活。
为此,本申请采用多种荧光染料,特别针对美澳型核果褐腐病菌的活性检测条件进行了深入研究,最终得出适合于美澳型核果褐腐病菌活性检测的荧光染料和相应的检测条件。具体的,适用于本申请的荧光染料为pi和/或fda;pi的染色条件为,在避光条件下,采用终浓度为0.00025mg/ml的碘化丙啶对孢子进行4min染色;fda的染色条件为,在避光条件下,采用终浓度为0.0025mg/ml的荧光素双醋酸酯对孢子进行16min染色。
需要说明的是,在本申请的pi浓度和染色时间条件下对美澳型核果褐腐病菌进行活性检测,不仅能够得到较好的死孢子和活孢子区分效果,成像效果良好,而且对孢子萌发的影响较小;在本申请的一种实现方式中,采用本申请的pi浓度和染色时间条件进行染色后,美澳型核果褐腐病菌孢子的萌发率仍然大于99%。同样的,在本申请的fda浓度和染色时间条件下,同样可以实现对美澳型核果褐腐病菌死孢子和活孢子的有效区分,而且萌发率接近100%,对孢子本身的活性几乎没有影响。并且,在本申请的一种改进方案中,将pi和fda结合起来,对美澳型核果褐腐病菌孢子进行复染,pi能够将死孢子染为红色,fda能够将活孢子染为绿色,两者染色结果相互印证,可以提高活性检测的质量。
还需要说明的是,本申请研究发现,美澳型核果褐腐病菌孢子存在一种假死或者是休眠状态,此时孢子停止萌发,但是孢子内部并没有丧失活力,在这种状态下,孢子无法被fda染色,但是将孢子重新放回培养基中培养,绝大多数孢子都能够正常萌发;这导致fda染色出现假阴性结果;影响活性检测结果的准确性。因此,本申请创造性的提出采用pi和fda对美澳型核果褐腐病菌孢子进行复染,对孢子活性状态有更准确的描述,从而提高活性检测的质量和准确性。不过,美澳型核果褐腐病菌孢子的假死或者是休眠状态通常是发生在高温条件下;因此,正常情况下,仍然可以单独采用fda染色进行美澳型核果褐腐病菌活性检测;在更严谨的检测要求下,可以采用fda和pi复染。此外,在本申请的一种实现方式中,对于正常的美澳型核果褐腐病菌孢子,即没有假死或休眠状态,pi单染、fda单染、pi-fda复染、fda-pi复染,四种活性检测方法的结果都差不多。
本申请中,荧光染料的终浓度是指在染色反应体系中荧光染料的浓度;工作液浓度是指直接使用的荧光染料溶液的浓度;初始浓度或原液是指荧光染料大量储存的浓度,或者直接购买时获得的原始浓度。
下面通过具体实施例对本申请作进一步详细说明。以下实施例仅对本申请进行进一步说明,不应理解为对本申请的限制。
实施例
一、荧光染料的筛选
1.材料和设备
本例分别采用美澳型核果褐腐病菌菌株12470和菌株127255进行试验;其中,菌株12470由深圳出入境检验检疫局于2017年3月6日在澳大利亚油桃中截获;菌株127255购自cbs,菌株来源为澳大利亚。
本例总共采用10种荧光染色剂对美澳型核果褐腐病菌孢子进行活性检测实验,荧光染料的详细信息见表1。
表1供试荧光染料
本例采用的主要试剂包括:二甲基亚砜(缩写dmso)购自上海生工生物工程,甲醇(methanol)购自西陇化工股份有限公司,丙酮(acetone)购自burdick&jackson,无水乙醇(ethanolabsolute)购自天津市百世化工有限公司。
本例的主要仪器设备包括:购自zeiss的lsm5exciter激光共聚焦扫描显微镜和zeissstandard20显微镜,购自hiayama的hiclavehv-85高压灭菌锅,购自thermo的fresco21离心机,以及购自eppendorf的thermomixer恒温混匀仪。
2.方法
(1)菌株培养
挑取美澳型核果褐腐病菌菌株12470和菌株127255的培养物,分别接种于改良pda培养基平板上,用parafilm封口膜密封培养皿,于22℃条件下光暗交替培养5~7天,其中光暗交替具体为光照12h、暗培养12h,交替进行。
(2)孢子悬浮液配制
用灭菌去离子水冲洗美澳型核果褐腐病菌培养物表面孢子堆,收集于干净的10ml离心管中,充分振荡3min左右,使得绝大多数孢子从菌丝中分离出来,用无菌枪头将菌丝吸取干净,得到纯净的孢子,显微镜下计算孢子的浓度,最后加入灭菌去离子水,分别将获取自菌株12470和菌株127255的孢子配制成105~106个孢子/ml的孢子悬浮液4~5ml。
(3)荧光染料初筛
本例以美澳型核果褐腐病菌菌株12470进行荧光染料筛选试验。具体的,新鲜配置孢子悬浮液4~5ml,每个处理取200μl孢子悬浮液到1.5ml离心管中用于试验;每个荧光染料设置两个组,一组为经过金属浴100℃处理15min的死孢子,另一组为不经过处理的活孢子;对于每个荧光染料的死孢子组和活孢子组分别进行3个不同浓度和3个不同染色时间,共计9个处理的正交筛选实验。各荧光染料的工作液浓度和染色时间详见表2。
表2荧光染料染色条件
表2中,工作液浓度是指直接使用的荧光染料溶液的浓度,pi、hoechst33258、hoechst33342、dapi、ao和钙黄绿素染料的溶剂均为ddh2o,即用ddh2o将荧光染料稀释为相应浓度,fda用丙酮稀释为相应浓度,alamarblue用马铃薯葡萄糖培养基溶液(缩写pd)稀释为相应浓度,jc-1用dmso稀释为相应浓度;台盼蓝溶液直接用水将原始溶液稀释为0.4%染色液、4%染色液或20%染色液,例如取20份台盼蓝溶液加80份的水,即稀释获得20%染色液。
染色方法:取1μl的某一种荧光染料,加入199μl孢子悬浮液,振荡混匀,室温下避光染色,到时间之后,立即14000rpm离心1min,去除上清液,加入200μl无菌去离子水,振荡混匀,14000rpm离心1min,去除上清液,加入20μl灭菌去离子水,混匀,避光放置,以备后续检测使用。
(4)激光共聚焦显微镜扫描
吸取1μl活性染料处理之后的样品制备玻片,封片,倒置于激光共聚焦扫描显微镜载物台上,调到可视档(即ocμlar),在荧光显微镜下低倍镜下找到孢子,转到20倍镜下观察,调制视野清晰度,然后调到lcm档,根据所用的荧光染料选择激发合适波长的激光器,例如氩离子激光器等,设置荧光通道的激发波长,例如340nm、488nm或534nm,收集荧光信号的发射波长,例如488nm、530nm或617nm,并且设置一个明场作为对照。
首先,选择粗略扫描模式,即xy:512*512,重复扫描次数average为1次,扫描速度speed为9,根据成像效果调整探测针孔pinhole、光电倍增管增益gain和激光扫描强度scanstr等参数,将图像调整至质量较好的效果。然后根据信噪比调整扫描模式,继续用精确扫描方式,即xy:2048*2048,重复扫描次数average为2次,扫描速度speed为6,获得最终图像。本实验中,最终获得的图像要最大程度反映出孢子的染色情况,得到的明场孢子图像要最大程度的清晰。
3.荧光染料初筛结果
(1)荧光染料fda对美澳型核果褐腐病菌孢子的染色结果
在荧光染料初筛时,分别采用了10mg/ml、1mg/ml、0.2mg/ml三个工作液浓度,对美澳型核果褐腐病菌孢子进行染色,每个浓度分别设置了10min、15min、30min三个染色时间。激光共聚焦显微镜扫描结果显示,其中,0.2mg/ml染色15min时,fda能够明显区分美澳型核果褐腐病菌活孢子和死孢子,其结果如图1所示。图1中,a图和b图为活孢子的染色结果、c图和d图为死孢子的染色结果;a图显示活孢子染色后有明亮的绿色荧光,b图为a图视场相应的明场观察图;c图显示死孢子没有发出荧光,d图为c图视场相应的明场观察图。图1的结果显示,fda能够将活孢子染为绿色,而死孢子不被染色,能够明显区分美澳型核果褐腐病菌孢子的死活。
(2)ao对美澳型核果褐腐病菌孢子染色结果
在荧光染料初筛时,分别采用了2mg/ml、0.2mg/ml、10mg/ml三个工作液浓度,对美澳型核果褐腐病菌孢子进行染色,每个浓度分别设置了10min、20min、30min三个染色时间。激光共聚焦显微镜扫描结果显示,其中,10mg/ml染色20min时,ao能够染色获得明亮的绿色荧光,但是,活孢子和死孢子都能够被染色获得绿色荧光,结果如图2所示。图2中,a图和b图为活孢子的染色结果、c图和d图为死孢子的染色结果;a图显示活孢子染色后有明亮的绿色荧光,b图为a图视场相应的明场观察图;c图显示死孢子染色后有明亮的绿色荧光,d图为c图视场相应的明场观察图。图2的结果显示,ao不能区分美澳型核果褐腐病菌孢子的死活。其它浓度和染色时间同样无法区分美澳型核果褐腐病菌孢子的死活。
(3)dapi对美澳型核果褐腐病菌孢子染色结果
在荧光染料初筛时,分别采用了0.2mg/ml、1mg/ml、0.05mg/ml三个工作液浓度,对美澳型核果褐腐病菌孢子进行染色,每个浓度分别设置了5min、10min、15min三个染色时间。激光共聚焦显微镜扫描结果显示,其中,0.2mg/ml染色10min时,dapi能够染色获得明显的蓝色荧光,但是,同样的,活孢子和死孢子都能够被染色获得蓝色荧光。可见,dapi也不能区分美澳型核果褐腐病菌孢子的死活。其它浓度和染色时间同样无法区分美澳型核果褐腐病菌孢子的死活。
(4)pi对美澳型核果褐腐病菌孢子染色结果
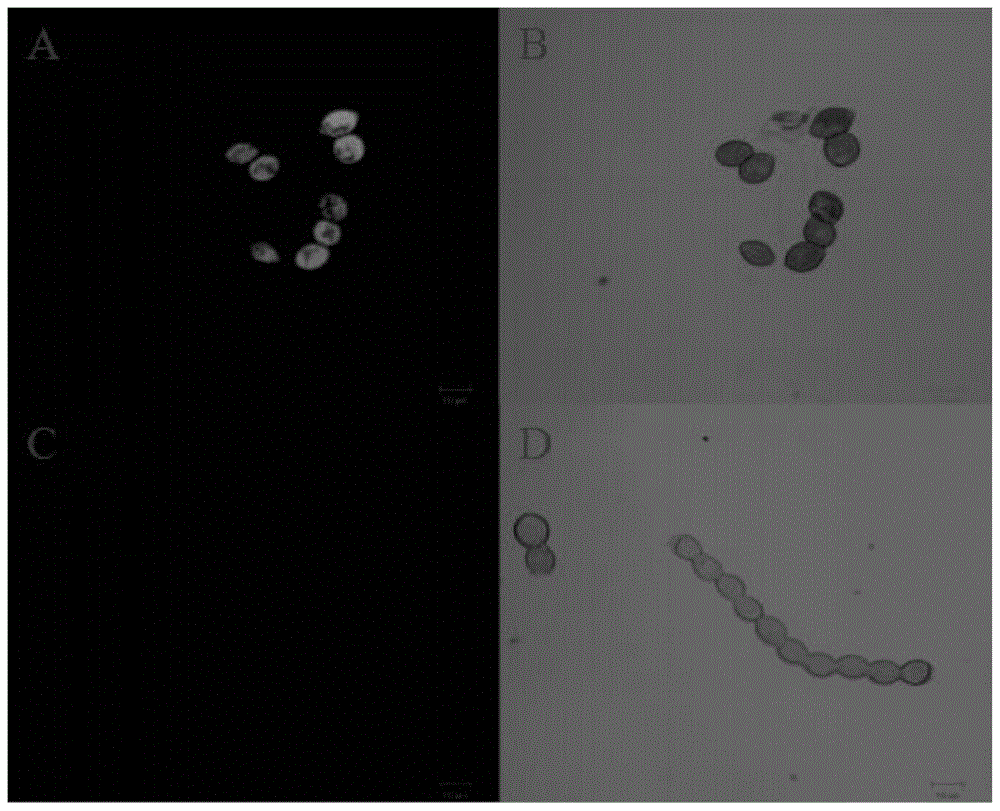
在荧光染料初筛时,分别采用了1mg/ml、10mg/ml、0.1mg/ml三个工作液浓度,对美澳型核果褐腐病菌孢子进行染色,每个浓度分别设置了10min、15min、30min三个染色时间。激光共聚焦显微镜扫描结果显示,其中,0.1mg/ml染色10min时,pi能够明显区分美澳型核果褐腐病菌活孢子和死孢子,其结果如图3所示。图3中,a图和b图为死孢子的染色结果、c图和d图为活孢子的染色结果;a图显示死孢子染色后有明显的红色荧光,b图为a图视场相应的明场观察图;c图显示活孢子没有发出荧光,d图为c图视场相应的明场观察图。图3的结果显示,fda能够将死孢子染为红色,而活孢子不被染色,能够明显区分美澳型核果褐腐病菌孢子的死活。
(5)jc-1对美澳型核果褐腐病菌孢子染色结果
在荧光染料初筛时,分别采用了1.67mg/ml、0.16mg/ml、0.5mg/ml三个工作液浓度,对美澳型核果褐腐病菌孢子进行染色,每个浓度分别设置了10min、20min、30min三个染色时间。激光共聚焦显微镜扫描结果显示,其中,0.5mg/ml染色30min时,jc-1能够将死孢子染色为明亮的绿色荧光,而活孢子仅有微弱的绿色荧光,其结果如图4所示。图4中,a图和b图为活孢子的染色结果、c图和d图为死孢子的染色结果;a图显示活孢子染色后仅有微弱的绿色荧光,b图为a图视场相应的明场观察图;c图显示死孢子染色后有明亮的绿色荧光,d图为c图视场相应的明场观察图。图4的结果显示,jc-1在0.5mg/ml染色30min时能够区分美澳型核果褐腐病菌孢子的死活,但是这种区分需要通过荧光强弱来判断,区分效果较差;并且,其它浓度和染色时间的处理都不能很清晰区分死活孢子。
(6)台盼蓝对美澳型核果褐腐病菌孢子染色结果
在荧光染料初筛时,分别采用了0.4%染色液、4%染色液、20%染色液三个工作液浓度,对美澳型核果褐腐病菌孢子进行染色,每个浓度分别设置了5min、15min、25min三个染色时间。激光共聚焦显微镜扫描结果显示,其中,0.4%染色液染色15min时,台盼蓝能够将死孢子染色为微弱的红色荧光,而活孢子没有荧光。可见,台盼蓝在0.4%染色液染色15min时,虽然能够区分美澳型核果褐腐病菌孢子的死活,但是区分效果不明显,特别是死孢子的红色荧光太微弱,容易误判。其它浓度和染色时间的处理效果更差,难以清晰区分死活孢子。
(7)hoechst33258对美澳型核果褐腐病菌孢子染色结果
在荧光染料初筛时,分别采用了10μg/ml、100μg/ml、500μg/ml三个工作液浓度,对美澳型核果褐腐病菌孢子进行染色,每个浓度分别设置了10min、30min、45min三个染色时间。激光共聚焦显微镜扫描结果显示,hoechst33258在各种浓度和染色时间条件下对美澳型核果褐腐病菌死孢子和活孢子都无法染色,染色后都没有荧光。可见,无论死孢子还是活孢子都没有荧光,hoechst33258不能区分美澳型核果褐腐病菌孢子的死活。
(8)hoechst33342对美澳型核果褐腐病菌孢子染色结果
hoechst33342同样设置了三个浓度和三个染色时间,但是,其结果与hoechst33258类似,都不能对美澳型核果褐腐病菌死孢子和活孢子进行染色,无论死孢子还是活孢子染色后都没有荧光,因此,hoechst33342也不能区分美澳型核果褐腐病菌孢子的死活。
(9)alamarblue对美澳型核果褐腐病菌孢子染色结果
alamarblue同样设置了三个浓度和三个染色时间,但是,其结果与hoechst33258类似,都不能对美澳型核果褐腐病菌死孢子和活孢子进行染色,无论死孢子还是活孢子染色后都没有荧光,因此,alamarblue也不能区分美澳型核果褐腐病菌孢子的死活。
(10)钙黄绿素对美澳型核果褐腐病菌孢子染色结果
钙黄绿素同样设置了三个浓度和三个染色时间,但是,其结果与hoechst33258类似,都不能对美澳型核果褐腐病菌死孢子和活孢子进行染色,无论死孢子还是活孢子染色后都没有荧光,因此,钙黄绿素也不能区分美澳型核果褐腐病菌孢子的死活。
综上所诉,hoechst33258、hoechst33342、alamarblue与钙黄绿素4种荧光染料均不能使美澳型核果褐腐病菌孢子染色,不能用于美澳型核果褐腐病菌孢子活性检测。fda、ao、dapi、pi、jc-1和台盼蓝6种荧光染料能够使美澳型核果褐腐病菌孢子染色;但是,ao和dapi对死孢子和活孢子都有染色,并且,死孢子和活孢子的荧光强度相当,难以区分;台盼蓝虽然仅对死孢子有染色,但是,其染色后的荧光微弱,区分效果不佳;jc-1对活孢子有微弱荧光,对死孢子有明亮的荧光,能够区分孢子死活,但是其区分有赖于荧光强弱的比较,容易误判。最终分析认为,荧光染料fda能够将活孢子染色为明亮的绿色荧光,而死孢子没有荧光;pi能够将死孢子染色为明亮的红色荧光,而活孢子没有荧光;这两者都具有很好的美澳型核果褐腐病菌孢子死活区分效果,并且,两者的染色结果可相互印证;因此,本例初筛fda和pi作为美澳型核果褐腐病菌活性检测的荧光染料。
二、染色条件优化
本例进一步的对筛选获得的fda和pi的染色条件进行深入的优化,并对不同条件处理后的孢子活性检测检测,以建立适合于美澳型核果褐腐病菌的活性检测方法。具体如下:
1.染色条件优化和活性检测
(1)染色条件优化
以美澳型核果褐腐病菌菌株12470为实验材料,每个处理取200μl孢子悬浮液到1.5ml离心管中用于试验;每个初筛获得的荧光染料设置三个组,其中两组进行染色,一组为经过金属浴100℃处理15min的死孢子,另一组为不经过处理的活孢子;再一组为不经过染色实验的孢子悬浮液,作为对照组;对于每个荧光染料的死孢子组和活孢子组分别进行五个不同浓度和五个不同染色时间,共计二十五组的正交实验。
具体的,fda的五个不同浓度分别为10mg/ml的原液、原液的5倍稀释液、原液的10倍稀释液、原液的20倍稀释液、原液的50倍稀释液,五个不同染色时间分别为4min、8min、12min、16min、20min。pi的五个不同浓度分别为原液的5倍浓缩液(即浓度为5mg/ml)、1mg/ml的原液、原液的2倍稀释液、原液的10倍稀释液、原液的20倍稀释液,五个不同染色时间分别为4min、8min、12min、16min、20min。
染色方法参照“(3)荧光染料初筛”步骤进行。染色完成后,死孢子组直接进行lscm扫描分析,获取图片;活孢子组分成两部分,一部分做扫描分析获取图片,一部分用琼脂载玻片法进行孢子萌发试验,计算萌发率。
(2)病原菌活性检测
以美澳型核果褐腐病菌菌株12470为实验材料,单染以fda染色剂为例,分别在五种温度下进行处理,每种温度分别处理五种不同时间,共计25个处理组,将所有处理组的孢子分成两组进行实验:一组进行荧光染料染色,另一组通过琼脂载玻片法测定孢子萌发率,进行统计学分析。五种温度分别为40℃、45℃、50℃、55℃和60℃,五种不同处理时间分别为1min、5min、10min、20min、30min。
其中,荧光染料染色的条件,包括染料浓度、染色时间等采用“(1)染色条件优化”步骤获得的优化条件进行,染色方法与“(1)染色条件优化”相同。
另外,本例还比较了fda和pi复染对孢子活性的影响,其中,复染的方法为,以fda-pi为例,先将在199μl的孢子悬浮液中滴加1μl的fda荧光染料进行染色,染色条件为“(1)染色条件优化”步骤的优化条件;然后,14000rpm离心1min,去上清,加入199μl无菌去离子水重悬孢子,滴加1μl的pi荧光染料进行染色,染色条件也为“(1)染色条件优化”步骤的优化条件;染色完成后,再次14000rpm离心1min,去上清,加无菌去离子水20μl重悬孢子,获得悬浮液。在改进的方案中,可以先采用无菌去离子水洗涤一次,再用20μl无菌去离子水重悬。采用20μl无菌去离子水重悬的孢子悬浮液进行制片,lscm扫描观察。
(3)孢子萌发实验
前面两个步骤中提到的萌发试验具体包括,将pda培养基放入微波炉中熔化,用移液枪吸取100μl的pda,分成三份滴加在灭菌过的载波片上,然后等其凝固,吸取1μl左右的孢子悬浮液滴加在载玻片的pda上,放置在一次性培养皿中,用parafilm封口膜封好,放置6h左右,进行观察,每份pda观察100个孢子,共计300个,重复三次。以芽管长度大于孢子本身长度为萌发标准。统计孢子萌发率,进行统计学分析。
2.染色条件优化和活性检测结果
(1)fda染色条件优化结果
本例对fda进行了10mg/ml的原液、原液的5倍稀释液、原液的10倍稀释液、原液的20倍稀释液、原液的50倍稀释液五个浓度,和4min、8min、12min、16min、20min五个染色时间的正交优化。并具体对染色时间为4min、12min、20min,fda浓度为10mg/ml的原液、原液的20倍稀释液、原液的50倍稀释液正交的9组进行了萌发试验,萌发试验结果见表3。
表3fda不同染色条件处理后的孢子萌发率(%)
表3中,对照组是“(1)染色条件优化”中设置的不经过染色实验的孢子悬浮液的萌发率统计结果。表3的结果显示,对照组的孢子萌发率为99.67%,由fda原液染色之后的孢子萌发率分别为94.67%(处理4min)、89.33%(处理12min)、84.33%(处理20min),可见原液对萌发率有影响,且染色时间越长,萌发率越低;原液的20倍稀释液和原液的50倍稀释液处理孢子的萌发几乎不受影响。可见,经fda原液染色,染色时间越长,孢子活性所受影响变大;并且,同一时间下,染色浓度增大,孢子活性受到的影响随之增大。
本例通过对fda染色浓度和染色时间的优化,结果显示,fda原液的20倍稀释液染色16min处理孢子之后,能够很明显的分辨出死活孢子,活孢子能够发出明亮的绿色荧光,而死孢子无法发出荧光,其结果如图5所示。图5中,a图和b图为活孢子的染色结果、c图和d图为死孢子的染色结果;a图显示活孢子染色后有明亮的绿色荧光,b图为a图视场相应的明场观察图;c图显示死孢子没有发出荧光,d图为c图视场相应的明场观察图。
其它试验组中,fda原液染色20min时,虽然活孢子能够发出很明显的绿色荧光,但是死孢子也能够发出微弱的绿色荧光,虽然死孢子的荧光强度明显弱于活孢子,但是也会较大影响观察,故原液染色20min不能区分孢子死活,其结果如图6所示。图6中,a图和b图为活孢子的染色结果、c图和d图为死孢子的染色结果;a图显示活孢子染色后有明亮的绿色荧光,b图为a图视场相应的明场观察图;c图显示死孢子染色后有微弱的绿色荧光,d图为c图视场相应的明场观察图。
另外,本例根据染色结果,进一步比较分析了fda原液的20倍稀释液和原液的50倍稀释液分别染色4min、8min、12min、16min、20min后的染色率,结果如图7所示。图7的结果显示,在同样的染色时间下,20倍稀释液的染色率明显高于50倍稀释液。
本例的染色率的计算方式为,在明场下统计孢子总数,在相应视图的荧光通道下统计有荧光的孢子数,荧光孢子数与孢子总数的比值即染色率。
综上,原液能够明显对孢子的活性产生影响,原液染色4min时,孢子萌发率降低为94.67%,而对应的20倍稀释液和50倍稀释液处理活孢子的孢子萌发几乎没有受到影响,接近100%,如表3所示。通过lscm所得到的图像分析,50倍稀释液在处理16min和20min时虽说染色率是100%,如图7所示,但是其荧光强度不及同等时间下其它浓度染色的荧光强度,10倍稀释液从显微镜下观察发现,背景会存在明显的泛绿,所得图片效果不佳。综合成像效果和对孢子活性的影响,通过染色浓度梯度和染色时间梯度的正交试验,本例最终确定fda最佳染色条件是20倍稀释液,即工作液浓度为0.5mg/ml,染色16min。
(2)pi染色条件优化结果
本例对pi进行了5倍浓缩液(即浓度为5mg/ml)、1mg/ml的原液、原液的2倍稀释液、原液的10倍稀释液、原液的20倍稀释液五个浓度,和4min、8min、12min、16min、20min五个染色时间的正交优化。并具体对染色时间为4min、12min、20min,pi浓度为5倍浓缩液、原液的2倍稀释液、原液的20倍稀释液正交的9组进行了萌发试验,萌发试验结果见表4。
表4pi不同染色条件处理后的孢子萌发率(%)
表4中,对照组是“(1)染色条件优化”中设置的不经过染色实验的孢子悬浮液的萌发率统计结果。表4的结果显示,对照组的孢子萌发率为99.67%,几乎为100%;由pi的5倍浓缩液染色4min、12min、20min后,孢子萌发率分别为13.33%、12.33%、4.67%;由pi的原液2倍稀释液染色后的萌发率分别为99.33%,99.33%,99.67%;可见,5倍浓缩液对孢子的活性造成很大的影响,处理20min的孢子萌发率不足5%,而2倍稀释液和更低浓度的稀释液对孢子萌发几乎没有影响。
本例通过对fda染色浓度和染色时间的优化,结果显示,pi原液的20倍稀释液对死活孢子染色4min后,能够收集到明显的红色荧光信号,而活孢子收集不到红色荧光信号,其结果如图8所示。图8中,a图和b图为死孢子的染色结果、c图和d图为活孢子的染色结果;a图显示死孢子染色后有明显的红色荧光,b图为a图视场相应的明场观察图;c图显示活孢子没有发出荧光,d图为c图视场相应的明场观察图,比较a图和c图能够很明显的看出该处理条件下能够很明显的区分死孢子和活孢子。
其它试验组中,pi的5倍浓缩液染色4min时,活孢子也可以看到明显的红色荧光,死孢子能够发出明亮的红光,其结果如图9所示。图9中,a图和b图为活孢子的染色结果、c图和d图为死孢子的染色结果;a图显示活孢子染色后也有明显的红色荧光,b图为a图视场相应的明场观察图;c图显示死孢子染色后有明亮的红色荧光,d图为c图视场相应的明场观察图。并且,图9的c图可以看出,死孢子不仅能够发出明亮的红色荧光,而且部分死孢子因为荧光强度太强导致所得到的照片过饱和,影响观察。说明该处理条件不能有效的区分孢子死活。
综上,通过对表4的孢子萌发结果分析,pi的5倍浓缩液染色活孢子之后导致孢子萌发率大幅下降,而2倍稀释液和更低浓度的对活孢子萌发没有影响,可能是因为5倍浓缩液的浓度过高影响了孢子活性。通过lscm分析,pi的5倍稀释液染色4min之后,活孢子也会被染色,并且个别死孢子荧光过于饱和影响观察,导致成像结果不佳;10倍稀释液染色结果和20倍稀释液没有太大差异,同样浓度下的不同时间处理,荧光强度没有发生明显变化;综合染色剂对孢子活性的影响和成像结果,本例最终确定pi染色剂最佳染色条件为20倍稀释液,即工作液浓度为0.05mg/ml,染色4min。
(3)病原菌活性检测结果
a)fda单染病原菌活性检测结果
本例对菌株12470进行40℃、45℃、50℃、55℃、60℃处理1min、5min、10min、20min、30min的正交试验,处理完成后,采用fda原液的20倍稀释液(即0.5mg/ml)染色16min,然后将每个处理的染色孢子分为两部分,一部分用于显微镜观察,一部分用于孢子萌发试验。分别统计各个处理后的染色率和萌发率,结果如图10和表5所示。图10中,曲线代表染色率,其中黑色线条代表40℃处理后的染色率随处理时间的变化,灰色线条代表45℃处理后的染色率随处理时间的变化;图中柱图代表萌发率,黑色柱代表40℃处理后的萌发率,灰色柱代表45℃处理后的萌发率。
表5相同处理下孢子萌发结果和fda染色结果比较
表5和图10的结果显示,孢子萌发和fda染色结果存在着一定差异,40℃处理孢子之后,处理1min、5min、10min、20min、30min的五组实验中孢子萌发率分别为99.44%、78.11%、6.89%、2.44%和0.44%,而相同的处理条件下,孢子的染色率一直稳定在99%以上;45℃处理孢子的五组实验中,从1min开始,孢子萌发率就已经开始受到影响,由接近100%的萌发率降低为97.67%,并且处理5min之后,萌发率就下降到只有6.67%,相对应的fda染色结果依旧是99.67%。直到45℃处理30min,fda染色率才明显下降,由接近100%降低为89.45%。孢子处理时间为1min不变,加大处理温度,即由40℃、45℃、50℃、55℃到60℃,萌发率依次为99.44%、97.67%、93.44%、76.78%、0.56%,相对应的fda染色结果没有变化,稳定在99%以上。从完整数据上来看,共计25组实验,只有3组实验孢子萌发率在90%以上,2组在10%到90%之间,4组在1%到10%之间,4组在10%以内,其他12组萌发率为0;反观fda染色结果,99%以上的有11组,90%到99%之间的有5组,70%到90%有6组,2组低于70%,仅仅只有60℃处理30min这一组染色率为0。从结果来看,在某些条件处理下,孢子萌发和染色实验得到的结果并不一致,染色结果显示孢子依旧还有活力,而相同条件下的孢子萌发实验却没有萌发。
部分染色结果如图11至图14所示,图11为孢子40℃处理30min后的fda染色结果图,图12为孢子60℃处理20min后的fda染色结果图,图13为孢子60℃处理10min后的fda染色结果图,图14为孢子55℃处理20min后的fda染色结果图,图11至14中,a图为荧光通道视图,b图为相应的明场视图。图11的结果显示,虽然40℃处理30min后孢子的萌发率为0.44%,但其染色率为99.78%,此图视野中共计11个孢子全部能够发出明显的绿色荧光。图12的结果显示,孢子60℃处理20min后萌发率为0,染色率为9.89%,图中可以看出视野共计7个孢子,仅1个孢子能够发出微弱的荧光。图13的结果显示,孢子60℃处理10min后萌发率为0,染色率为47.56%,图中可以看出视野共计12个孢子,有5个孢子能够发出明亮的荧光。图14的结果显示,孢子55℃处理20min后萌发率为0,染色率为77.78%,图中视野中共计4个孢子,有3个孢子能够发出微弱的荧光。
为了验证孢子在受到不同条件的处理之后是否会在几个小时之内丧失活性,故设计一组实验:将60℃的处理中,选取3个处理组,即处理5min、10min和20min这三组,将这3个处理进行4次重复,然后放置在22℃左右的室温,每隔24h进行fda染色观察,以没处理过的孢子作为对照组,对照组做染色的同时做孢子萌发实验。每个处理观察3组,每组100个,每个处理共计观察300个孢子,第一次记为0天,第二次记为1天,以此类推。连续观察测试三天,结果如图15所示。
图15中纵坐标为染色率,横坐标分别为处理5min、10min和20min的三组,每组中由左至右依序为0天、第1天、第2天和第3天的染色率统计结果。图15的结果显示,在孢子被处理之后的24h,会有一部分孢子活性受到影响,60℃处理5min的实验组,孢子染色率由86%下降到58.67%,10min处理组由46%下降到9.33%,20min处理组由7.33%下降为3.33%。之后的24h孢子染色率下降速度变缓,到第3d,孢子染色率下降速度加快。
孢子60℃处理5min后放置不同时间的fda染色结果如图16所示。图16中,a为处理24h之后染色结果、b为处理48h之后染色结果、c为处理72h之后染色结果。图16的结果显示,经过72h之后,孢子依旧能够发出明显荧光,即c图,而a图中有17个孢子,其中7个孢子能够发出明亮的荧光,2个孢子发出非常微弱的荧光,此条件下,孢子染色率为58.67%;b图有3个孢子,一个能够发出明亮荧光,一个发出微弱的荧光,此时染色率为59.33%;c图有6个孢子,有一个孢子能够发出明亮的绿色荧光,此时染色率为14.67%。
b)pi单染病原菌活性检测结果
本例对菌株12470进行40℃、45℃、50℃、55℃、60℃处理1min、5min、10min、20min、30min的正交试验,处理完成后,采用pi原液的20倍稀释液(即0.05mg/ml)染色4min,然后将每个处理的染色孢子分为两部分,一部分用于显微镜观察,一部分用于孢子萌发试验。分别统计各个处理后的染色率和萌发率,结果如图17和表6所示。图17中,曲线代表染色率,其中黑色线条代表40℃处理后的染色率随处理时间的变化,灰色线条代表45℃处理后的染色率随处理时间的变化;图中柱图代表萌发率,黑色柱代表40℃处理后的萌发率,灰色柱代表45℃处理后的萌发率。
表6相同处理下孢子萌发结果和pi染色结果比较
表6和图17的结果显示,孢子萌发结果和pi染色结果依旧存在差异,孢子处理条件为40℃持续5min时,孢子萌发明显受到影响,萌发率降低到78.11%,此时染色率依旧不足1%,直到处理条件为45℃持续30min,pi染色率才有明显提高,达到10.11%,而此时的孢子萌发率已经为0。可见,随着处理温度和处理时间的增加,孢子的萌发和pi的染色率会受到不同程度的影响,并且两者的受影响程度差异较大,25组实验中,有12组实验孢子萌发率为0,而pi染色结果显示,只有60℃处理30min这一组实验中,染色率为100%。
部分染色结果如图18和图19所示,图18为孢子45℃处理30min后的pi染色结果图,图19为孢子55℃处理30min后的pi染色结果图,图18和图19中,a图为荧光通道视图,b图为相应的明场视图。图18的结果显示,孢子45℃处理30min后萌发率为0,但是其染色率仅为10.11%,视野中共计15个孢子,2个孢子能够发出微弱的红色荧光。图19的结果显示,孢子55℃处理30min后萌发率为0,染色率为30.89%,视野中共计18个孢子,7个孢子能够发出微弱的红色荧光。另外,孢子60℃处理10min后的结果显示,其萌发率为0,染色率为52.78%,在视野中共计6个孢子,3个孢子能够发出微弱的红色荧光。
本例进一步对比了相同条件处理后fda和pi的染色结果,对比分析结果如图20所示。图20中,纵坐标为染色率,横坐标依序为孢子40℃处理1min、45℃处理5min、50℃处理10min、55℃处理20min、60℃处理30min后分别进行fda和pi的染色的试验组,每组中黑色柱代表fda的染色率,灰色柱代表pi的染色率。从图20中可以看出,孢子在相同的处理条件下,fda和pi染色结果能够以一种互补的方式来共同判断孢子活性,fda能够作用于活孢子,使活孢子能够发出明亮的绿色荧光,而pi能够作用于死孢子,让死孢子发出明亮的红色荧光。孢子在相同处理条件下,fda和pi的染色率之和接近100%,可以说明两个染色剂对孢子活性有着相近的判断标准。例如,50℃处理10min,fda染色率为92.11%,pi染色率为7.67%;55℃处理20min,fda染色率为77.78%,pi为21.11%。从完整结果来看,比如50℃处理30min,fda染色率为79%,pi染色率为20%;45℃处理30min,fda染色率为89.45%,pi染色率为10.11%;共计25个实验组,每组的fda和pi的染色结果之和都非常接近100%。
c)fda和pi复染病原菌活性检测结果
本例以美澳型核果褐腐病菌12470为实验材料,采用新鲜的孢子悬浮液,设置5组不同的处理:40℃处理1min、45℃处理5min、50℃处理10min、55℃处理20min、60℃处理30min,重复3次,分别用fda-pi、pi-fda的顺序进行复染实验,并采用fda、pi单染作为对照,记录各个染色剂的染色率,结果如表7所示。
表7不同方式染色孢子染色率比较(%)
从表7可以看出,单从fda染色率来看,fda在40℃处理1min的处理组中,fda单染结果99.78%、fda-pi染色结果99.67%、pi-fda染色结果为99.67%;从pi染色率来看,pi单染结果0.33%、fda-pi染色结果为0%、pi-fda染色结果为0.33%。其他四组处理复染和单染结果都没有较大差异,并且两个复染实验的结果也没有较大差异,说明复染能够得到和单染一样的结果,并且能够更准确的描述孢子状态,从结果来看,两个染色剂复染顺序并不会影响最终结果。
d)不同菌株差异性比较
本例以美澳型核果褐腐病菌菌株12470和菌株127255为实验材料,分别做不同温度和不同时间处理的正交试验,本例具体做了40℃、45℃、50℃、55℃、60℃五个处理温度和1min、5min、10min、15min、20min、30min五个处理时间的正交试验,共计25组。各组分为两部分,一部分做染色实验,一部分做孢子萌发实验,不经过处理的孢子作为对照。部分统计结果如图21和22所示,图21是40℃处理温度下不同处理时间的两个菌株的孢子萌发率比较分析图,图中黑色柱代表菌株127255,灰色柱代表菌株12470;图22是60℃处理温度下不同处理时间两个菌株pi染色率比较分析图,图中黑色柱代表菌株12470,灰色柱代表菌株127255。
图21和图22的结果显示,经过不同条件处理之后,两者的孢子萌发率都明显下降,如图21所示;其中,同样温度处理下,处理时间越长,孢子萌发率越低。40℃处理10min之后的12470菌株孢子萌发率降低为6.89%,菌株127255萌发率降低为10.33%;处理20min之后,12470菌株萌发率为2.44%,127255萌发率为1.33%。从完整结果来看,25个处理组中,菌株12470有3个组孢子萌发率在90%以上,菌株127255相同;菌株12470和127255都有2个处理组孢子萌发率在70%到90%之间;两个菌株都有12处理组孢子萌发率为0。从图22可以看出,随着处理时间的增加,两个菌株的孢子的pi染色率也随之增加。60℃处理5min,12470菌株染色率是12.33%,127255菌株为16.33%;处理10min,12470菌株的染色率为52.78%,127255菌株为54%;处理20min,12470菌株染色率为89.22,127255菌株为89.67%。从完整结果来看,孢子12470菌株和127255菌株5个不同温度下,处理1min,pi染色率接近0%,直到50℃处理10min,两个菌株的孢子都开始染色率的提升,12470菌株提升到3%,127255菌株同样提升到3%。随着处理时间和处理温度的上升,两个菌株的孢子染色率也在同步上升。在处理时间为30min时,45℃处理组,12470菌株染色率为10.11%,127255为17%;50℃处理组,12470菌株染色率为20%,127255菌株为25%;55℃处理组,12470菌株染色率为30.89%,127255菌株为61%。综合染色结果和孢子萌发结果,两个菌株在相同处理条件下,两方面的结果都存在一定的差距,但是两个菌株都明显存在从孢子不能萌发,但是fda染色能够明显染上而pi染色不能染上的情况。
部分染色结果如图23至图27所示。图23是不同菌株60℃处理30min后的pi染色结果,其中,a和b图均为菌株12470染色结果,a为荧光通道,b为明场;c和d图均为菌株127255染色结果,c为荧光通道,d为明场。从图23看出,两个菌株在60℃处理30min之后的染色结果相同,都为100%,菌株12470视野中共计17个孢子,13个孢子能够发出明亮荧光,4个孢子能够发出微弱荧光,此时孢子萌发率为0;菌株127255视野中共计7个完整孢子,都能发出明亮的红色荧光,此时孢子萌发率为0。
不同菌株50℃处理30min的pi染色结果显示,两个菌株在50℃处理30min之后的染色结果略有差异,菌株12470视野中共计4个孢子,1个孢子能够发出微弱荧光,此时染色率为20%,孢子萌发率为0;菌株127255视野中共计48个完整孢子,9个能发出明显荧光,2个发出微弱的红色荧光,此时染色率为25%,孢子萌发率为0。
图24是不同菌株45℃处理30minpi染色结果,其中,a和b图均为菌株12470染色结果,a为荧光通道,b为明场;c和d图均为菌株127255染色结果,c为荧光通道,d为明场。从图24看出,两个菌株在45℃处理30min之后的染色结果略有差异,菌株12470视野中共计42个孢子,4个孢子能够发出明亮的红色荧光,2个孢子能够发出微弱的荧光,此时染色率为10.11%,孢子萌发率为0;菌株127255视野中共计6个完整孢子,1个发出微弱的红色荧光,此时染色率为17%,孢子萌发率为0。
图25是不同菌株55℃处理30minfda染色结果,其中,a和b图均为菌株12470染色结果,a为荧光通道,b为明场;c和d图均为菌株127255染色结果,c为荧光通道,d为明场。从图25看出,两个菌株在55℃处理30min之后的染色结果有较大差异,菌株12470视野中共计26个完整孢子,9个孢子能够发出明显荧光,5个孢子能够发出微弱的荧光,此时染色率为70%,孢子萌发率为0;菌株127255视野中共计9个完整孢子,3个能发出明显荧光,此时染色率为39.67%,孢子萌发率为0。
图26是不同菌株55℃处理10minfda染色结果,其中,a和b图均为菌株12470染色结果,a为荧光通道,b为明场;c和d图均为菌株127255染色结果,c为荧光通道,d为明场。两个菌株在55℃处理10min之后的染色结果相近,菌株12470染色率为92.11%,菌株127255染色率为91.33%。从图26可以看出,菌株12470视野中共计9个完整孢子,8个孢子能够发出明显荧光,孢子萌发率为0;菌株127255视野中共计14个完整孢子,13个能发出明显荧光,孢子萌发率为0。
图27是不同菌株50℃处理20minfda染色结果,其中,a和b图均为菌株12470染色结果,a为荧光通道,b为明场;c和d图均为菌株127255染色结果,c为荧光通道,d为明场。两个菌株在50℃处理20min之后的染色结果相近,菌株12470染色率为84.89%,菌株127255染色率为83.33%。从图27可以看出,菌株12470视野中共计19个完整孢子,16个孢子能够发出明显荧光,孢子萌发率为0;菌株127255视野中共计13个完整孢子,9个能发出明显荧光,1个孢子能够发出微弱的荧光,孢子萌发率为0。
三、病原菌活性检测方法的建立
根据前面的分析试验,本例最终确定美澳型核果褐腐病菌的活性检测方法中,荧光染料的染色条件如下:
pi的染色条件为,在避光条件下,采用终浓度为0.00025mg/ml的pi对孢子进行4min染色;具体的,使用pi原液的20倍稀释液(即工作液浓度为0.05mg/ml),将1μl的pi原液20倍稀释液滴加到199μl的孢子悬浮液中,混匀,室温避光染色4min,染色完成之后,立即离心,去上清,终止染色,加入200μl无菌去离子水,振荡混匀,14000rpm离心1min,去除上清液,加入20μl灭菌去离子水,混匀,避光放置,用于制片,lscm观察。
fda的染色条件为,在避光条件下,采用终浓度为0.0025mg/ml的fda对孢子进行16min染色;具体的,使用fda原液的20倍稀释液(即工作液浓度为0.5mg/ml),将1μl的fda原液20倍稀释液滴加到199μl的孢子悬浮液中,混匀,室温避光染色16min,染色完成之后,立即离心,去上清,终止染色,加入200μl无菌去离子水,振荡混匀,14000rpm离心1min,去除上清液,加入20μl灭菌去离子水,混匀,避光放置,用于制片,lscm观察。
pi-fda的复染方法为,使用pi原液的20倍稀释液(即工作液浓度为0.05mg/ml),将1μl的pi原液20倍稀释液滴加到199μl的孢子悬浮液中,混匀,室温避光染色4min,染色完成之后,立即离心,去上清;然后加入无菌去离子水199μl重悬,将1μl的fda原液20倍稀释液滴加到199μl的孢子重悬液中,混匀,室温避光染色16min,染色完成之后,立即离心,去上清,终止染色,加入200μl无菌去离子水,振荡混匀,14000rpm离心1min,去除上清液,加入20μl灭菌去离子水,混匀,避光放置,用于制片,lscm观察。
fda-pi的复染方法与pi-fda复染方法类似,只是调换了荧光染料的使用顺序。
四、讨论与结论
1.活性染色剂的筛选
本例从10种荧光染料中筛选出适合美澳型核果褐腐病菌孢子活性检测研究的染料2种,在筛选过程中fda染色剂能够对活孢子染色,让活孢子发出明显的绿色荧光,而死孢子收集不到荧光。综合分析10种染色剂,文献的研究对象更多是用在动物或者植物细胞的原生质体,而非真菌孢子,研究对象的不一样,很多时候,结果只具有参考性,并不准确,适合动植物细胞的活性检测不代表能够准确判断出真菌孢子的活性状态,最终通过筛选得到pi染色剂和fda染色剂能够准确反映出美澳型核果褐腐病菌的孢子活性状态,发现台盼蓝能够使死孢子发出红色荧光,活孢子无法发出荧光;同时也发现jc-1,ao,dapi也能够使孢子发出明亮的荧光,但不能从是否发出荧光来判断孢子活性,或许可以通过死活孢子发出不同的荧光强度来判断孢子活性,另外4种染色剂,即alamarblue、hoechst33342、hoechst33258和钙黄绿素,无法使美澳型核果褐腐病菌孢子发出荧光,无法进行判断。
2.美澳型核果褐腐病菌孢子最佳染色条件优化
对于fda,以美澳型核果褐腐病菌为材料,对fda原液、5倍稀释液、10倍稀释液、20倍稀释液、50倍稀释液五个染料浓度梯度和染色时间4min、8min、12min、16min、20min五个染色时间梯度进行筛选,同时做染色之后对孢子活性影响的孢子萌发实验。从结果看出,随着染色时间增加和染色浓度的增加,染色效果越好,但是同时,孢子萌发率也随之下降,说明过高的浓度或者过高的染色时间fda会明显影响孢子萌发。空白对照的孢子萌发率为99.67%,非常接近100%,由fda原液染色4min、12min、20min之后的孢子萌发率依序为94.67%、89.33%、84.33%。通过显微镜观察,fda原液的20倍稀释液染色16min,活孢子能够发出很明亮的绿色荧光,死孢子无法发出荧光,10倍稀释液的处理会发现显微镜背景泛绿,而50倍稀释液活孢子发出的绿色荧光不及20倍稀释液,影响结果判定。对于pi染色剂,对孢子进行5倍浓缩液、原液、2倍稀释液、10倍稀释液、20倍稀释液五个染料浓度梯度和4min、8min、12min、16min、20min五个染色时间梯度的试验筛选,同时做染色之后对孢子活性影响的孢子萌发实验。由pi原液5倍浓缩液染色4min、12min、20min后,孢子萌发率分别为13.33%、12.33%、4.67%,发现和fda染色剂类似,过高的染色剂浓度和过长的染色时间会影响孢子活性。pi原液10倍稀释液染色结果,从lscm中扫描成像所得的图片过饱和,导致图片效果不够好。最终通过筛选,染色剂对孢子活性的影响需要尽量低,即染色时间尽可能短,染色浓度尽可能低;成像结果需要保证图片不能过饱和;且死活孢子务必对比明显,即死活孢子其中一个能够发出明亮的荧光,另外一个无法发出荧光;根据以上要求,得到fda最佳染色条件为原液的20倍稀释液(即工作液浓度为0.5mg/ml)染色16min,pi最佳染色条件为原液20倍稀释液(即工作液浓度为0.05mg/ml)染色4min。
本例对比分析了现有的pi和fda的染色应用,结果显示,虽然采用同种染色剂进行实验,但是对于不同的试验对象,染色条件存在差异,说明染色剂的作用效果和试验对象本身存在较大的关系,其它实验所得到的结果不能直接沿用到本例的美澳型核果褐腐病菌活性检测。
3.美澳型核果褐腐病菌活性检测分析
通过对美澳型核果褐腐病菌孢子分别在40℃、45℃、50℃、55℃、60℃五种不同温度下进行1min、5min、10min、20min、30min五种时间处理的正交试验,分别对各组进行fda或pi最佳染色条件的单染或复染,并同时平行做孢子萌发实验,进行比较,发现fda和pi的染色结果相同,在相同的处理条件下,fda染色率和pi染色率之和非常接近100%。从活性检测实验来看,孢子萌发实验和染色实验结果并没有较大的相似性,从40℃处理5min开始,孢子萌发就明显受到影响,萌发率明显降低,而此时染色率并没有明显变化,直到45℃处理30min,染色结果才开始出现明显变化,此时孢子萌发率已经接近0%。fda染色剂的作用机理为能够穿过完整的细胞膜,和细胞质中的酯酶结合,如果是死孢子酯酶并没有活性,并且死孢子细胞膜不具备选择透过性,能够发出绿色荧光的结合物无法留在死孢子中,故fda能够让活孢子发出绿色荧光,死孢子无法发出荧光。pi染色剂的作用机理为不能穿透完整的细胞膜,死孢子细胞膜失去活性,pi进入细胞核内,和核酸进行结果,发出红色荧光,所以pi能够让死孢子发出红色荧光,活孢子无法荧光,以此来区分死活孢子。两个染色剂从作用机理可以看出属于两种完全不相似的方式,而两个染色剂所得到的染色结果是非常相近的,结合孢子萌发实验,猜测受到不同温度处理的孢子可能有一部分孢子进入假死状态或者是休眠状态,所以孢子不能够萌发,但是却能够被fda染色。
之后继续做了fda稳定性实验,发现受到温度处理之后的孢子在3天之内依旧有一定比例的孢子发出绿色荧光,可以排除孢子在受到温度处理之后在一段时间内迅速失去活性的情况。在做fda稳定性实验的同时,用没有处理过的孢子做对照实验,对照实验同时做染色和孢子萌发,发现连续3天孢子萌发只有微弱下降,到第三天依旧还有90%左右的孢子能够萌发,而第1天对照组的孢子染色实验就只有不到50%的孢子能够发出明亮的绿色荧光,一部分孢子荧光强度大大减弱。猜测孢子在无菌水中,因为无法获取到足够的营养,孢子自身会主动减缓生命活动,孢子内部大多数活性物质处在一个相对静止的状态,导致fda染色实验出现偏差。这种现象也能够解释做fda稳定性实验时,第一天孢子染色率下降速度会快于第二天的孢子染色率。综合上述实验可以看出,在高温条件下美澳型核果褐腐病菌孢子存在一种假死或休眠的状态,此时孢子停止萌发,但是孢子内部并没有丧失活力,而在外界环境营养不够的情况下,孢子主动降低自身内部的各种物质的活性,来降低自身能量损耗,导致孢子无法被fda作用,而将孢子重新放回培养基中培养,绝大多数孢子都能够正常萌发,如果只有fda染色则会出现假阴性结果,不能染色但是能够正常萌发,给实验结果带来严重干扰。因此,尝试结合fda和pi一起染色,对孢子活性状态有更准确的描述。
fda和pi复染实验,以美澳型核果褐腐病菌孢子作为实验材料,设计5组实验,即40℃处理1min、45℃处理5min、50℃处理10min、55℃处理20min、60℃处理30min,分别用fda或pi染色、fda染色之后pi染色、pi染色之后fda染色,三组实验结果进行对比。通过实验结果可以看出,40℃处理1min,pi单染染色率为0.33%,fda单染染色率为99.78%,fda-pi染色结果为99.67%-0%,pi-fda染色结果为0.33%-99.67%。从完整数据来看5组实验三个染色方式之间的结果没有显著性差异,结合之前的染色之后的孢子萌发实验,染色剂能够在一定程度上对孢子活性产生影响。
在实验过程,为了,实验菌株除了从进境水果中截获的编号为12470的菌株,还有从其他机构购买回来的菌株127255。两个菌株做了完整的对比实验,从染色实验和萌发实验结果可以看出,两个菌株虽说在相同条件下的孢子萌发率和染色率有细微差别,但是不同菌株都存在假死或者休眠状态的孢子,可以证明这种状态不是因为菌株的特殊性,而是因为美澳型核果褐腐病菌孢子可能普遍存在这种现象。
本例所建立的美澳型核果褐腐病菌活性检测方法直观、快速,相较于传统的孢子萌发实验,具有更高的可信度和准确度。本例通过观察孢子染色后所发出的荧光就可以判定孢子活性状态,检测时间不到30min,相较于传统的孢子萌发实验,检测时间大大减少,且该方法能够精确到每个孢子的状态,灵敏度高。本例的活性检测方法在实际检疫过程中具有应用价值,在实际情况下,往往只能获取到少量孢子,有可能仅仅只有几个或者一个孢子,过去对于这些孢子的检测只能通过孢子萌发实验,往往会忽略掉休眠状态的孢子,得到不准确的结果,而本例的方法可以直接应用于活性检测,不仅仅降低了检测时间,也能够更准确的对孢子活性状态进行描述,增加结果的可信度。
4.结论
本例从10种活性染料中成功筛选到2种活性染料,即fda和pi,能够用于美澳型核果褐腐病菌活性检测,并且发现美澳型核果褐腐病菌孢子在高温的逆境环境中存在假死或者是休眠的状态。
本例确定了针对美澳型核果褐腐病菌孢子的pi最佳染色条件为,200μl的染色反应体系中,添加1μl的工作液浓度为0.05mg/ml的pi荧光染料,室温避光染色4min。fda最佳染色条件为,200μl的染色反应体系中,添加1μl的工作液浓度为0.5mg/ml的fda荧光染料,室温避光染色16min。
另外,本例还将fda和pi两个染色剂结合到一起,建立了美澳型核果褐腐病菌复染法和激光共聚焦显微镜的活性检测方法。
本例建立的美澳型核果褐腐病菌活性检测新方法,能够更加准确的形容孢子状态,该方法为搭建我国高频跨境入侵有害生物检测技术新平台提供理论基础和技术支持。
以上内容是结合具体的实施方式对本申请所作的进一步详细说明,不能认定本申请的具体实施只局限于这些说明。对于本申请所属技术领域的普通技术人员来说,在不脱离本申请构思的前提下,还可以做出若干简单推演或替换。
- 还没有人留言评论。精彩留言会获得点赞!