一种测定杀菌剂对小麦条锈菌毒力的方法与流程
本发明属于植物保护领域,具体涉及一种测定杀菌剂对小麦条锈菌毒力的方法。
背景技术:
锈病作为危害小麦生产中的重要病害,其病原菌锈菌是十大热点研究真菌之一。其发生与危害具有长期性、暴发性、流行性和变异性,其有效防控成为长期的难题。目前在实际生产中通常使用农业方法、培育抗病品种、化学防治、生物防治等不同措施来控制并减轻危害。在多种防治措施中,化学防治是小麦条锈病的防治主要手段之一。
国内外许多研究单位以及企业一直在研究创新和筛选对小麦条锈病具有显著防治效果的新型杀菌剂。在投入使用前需在室内进行其敏感性测定,以及在投入使用后必须严格采取抗药性监测,以防止和避免抗药性的产生和发展,延长杀菌剂的使用寿命。而新型药剂室内测量杀菌剂对真菌的敏感性基线是指导田间用药的基础,并且可以反映杀菌剂在使用之后病菌的适应度以及发展趋势。对于小麦条锈菌这种靠气流传播的专性寄生真菌而言,研究稳定可靠,操作便捷且重复性高的毒力测定方法,是杀菌剂筛选和抗药性研究及治理的前提。
对于专性寄生菌而言,不同于非专性寄生菌,其菌丝不能脱离寄主生长,孢子萌发后菌丝主要通过在寄主植物的细胞间隙内扩展,且病原菌在离体情况下难以保存。因此,传统的菌丝生长速率法以及孢子萌发法难以有效测量药剂对病菌的实际毒力效果。目前对于小麦锈菌的敏感性基线测量的方法有药剂拌种法、药剂浸种法、活体盆栽喷雾法等,但是各种方法之间测出的病菌对杀菌剂的敏感性受其他因素影响差距较大,药剂浸种和拌种一般在麦苗完全展开第1叶时开始接种,待对照组产孢达到测量标准才开始计算药效,即药剂作用时间已经长达15d后再进行测量,这对于药剂的持效期要求较高,且药剂作用受其他因素包括土壤及水分的影响较大。同活体盆栽喷雾一样,结果的调查多采用估算病斑面积,换算成病情指数,在计算各药剂的防治效果。这些方法在试验过程中受影响的因素较多,包括药剂剂型与剂量,作物生长情况等,重复性不高,并且数据的测量方法受人为因素较大,且工作量的且植物材料需要达到一定的量以调整数据的合理性。
目前国际杀菌剂抗性行动委员会(frac)中公开了一种小麦白粉菌室内测量杀菌剂药剂的方法,先对盆栽小麦苗进行药剂喷雾处理,然后剪取含药叶段置于保鲜培养基中进行孢子沉降接种,经过培养后数孢子堆个数进行防效的计算;以及测量黄瓜霜霉病菌毒力的方法是药剂悬浮叶碟,再进行精确接种的方法。上述方法表明,对于专性寄生菌的药效毒力测量方法具有操作简便,重复性高且工作量小的特点发展。但是目前针对于小麦锈菌对杀菌剂的测量方法,frac公布的是还是活体盆栽法。
由此可知迫切需要建立一种准确且有效的监测杀菌剂活性的方法,以确定和比较不同药对小麦锈病的抑菌效果和毒力,并为新型杀菌剂的筛选和田间抗性菌株的监测提供理论方法和技术支持。
技术实现要素:
有鉴于此,本发明的目的在于提供一种测定杀菌剂对小麦条锈菌毒力的方法。
为达到上述目的,本发明提供如下技术方案:
一种测定杀菌剂对小麦条锈菌毒力的方法,所述方法包括如下步骤:
(1)接种培养:将5~10μg/ml的小麦条锈菌孢子悬液接种到小麦幼苗上,于黑暗中保湿处理后取出,在温室中培养至出现病斑后备用;
(2)制备保鲜培养基:将保鲜剂和杀菌剂加入到水琼脂中混合均匀,倒入培养皿中,再覆盖滤纸制备得到含药的保鲜培养基;
(3)离体叶段药剂处理:选取步骤(1)中出现病斑的小麦幼苗,将长势相同的不同盆中的带明显病斑的中间段作为离体叶段,置于步骤(2)中所述含药的保鲜培养基中的滤纸上,将所述离体叶段的两端固定后,再置于恒温箱中培养;
(4)检测:利用photoshop测量孢子堆占比,计算防治效果和ec50。
优选的,步骤(1)中所述小麦条锈菌孢子悬液的配制方法为:将小麦条锈菌孢子粉加入到0.1%的吐温20中,继续震荡至孢子粉充分分散,即可制备得到孢子悬液。
优选的,步骤(1)中所述幼苗为1心1叶期的小麦幼苗。
优选的,步骤(1)中所述保湿处理的时间为24h,所述温室中培养的条件为17~20℃、光照16h/d。
优选的,步骤(1)中所述接种时采用的工具为喷笔,所述喷笔在接种时的压力设置为0~0.4bar,所述接种时按照每盆小麦幼苗2ml悬液的量进行接种。
优选的,步骤(2)中所述保鲜剂包含赤霉素、6-苄氨基腺嘌呤或者苯并咪唑中的任意一种。
优选的,所述赤霉素与水琼脂的质量体积比为10~30:1,所述6-苄氨基腺嘌呤与水琼脂的质量体积比为25~100:1,所述苯并咪唑与水琼脂的质量体积比为50~100:1,所述质量体积的单位为μg/ml。
优选的,步骤(3)中所述杀菌剂为三唑酮,所述三唑酮与水琼脂之比为0.03~21.87:1,μg:ml。
优选的,所述方法包括如下步骤:
(1)接种培养:将小麦条锈菌孢子粉加入到0.1%的吐温20中,震荡后加入清水,继续震荡至孢子粉充分分散,即可制备得到孢子悬液,所述孢子悬液中所述孢子粉的质量体积浓度为5~10μg/ml;
(2)制备保鲜培养基:将6-苄氨基腺嘌呤和三唑酮加入到0.5%的水琼脂中混合均匀,倒入培养皿中,所述6-苄氨基腺嘌呤、三唑酮和水琼脂的质量体积比为75:0.03~21.87:1,μg:μg:ml;
(3)离体叶段药剂处理:首先将9cm的圆形滤纸沿直径剪成2.5cm、4.0cm、2.5cm的三段,将中间4cm的滤纸条铺加到步骤(2)中的培养皿中;其次取步骤(1)中出现病斑的小麦幼苗盆栽,选取长势相同的同一高度的不同盆的小麦,剪取中间5cm的带有明显病斑的作为离体叶段,平行铺在4cm的滤纸上,用剩下的2.5cm滤纸将叶段两端固定并使之紧贴于培养基表面,使每个培养皿中含有来自不同盆的5个叶段,再将培养皿置于12℃恒温培养箱中光照培养18h形成测试组;
(4)对照组:以不加杀菌剂、其它条件与测试组相同的培养皿作为对照组;
(5)检测:用photoshop软件进行病斑占比像素分析,先记录5个叶段的总像素,再记录50,60,70三个容差下的5个叶段上孢子堆面积的总像素;用excel计算出5个叶段上孢子堆面积的总像素的平均值以及孢子堆面积占比。
本发明的有益效果在于:
1、由于小麦条锈菌通过气流传播孢子以达到扩散的目的,所以在纯化和扩繁时需要隔离培养,防治交叉污染,以收集到纯化的菌种,作为专性寄生菌,自然界中条锈菌的夏孢子在常温下的保存时间较短,需要适当的保存方法来延长孢子的保持活性时间。杀菌剂对小麦条锈病的毒力测定多采用的是整株接种病原分离物的,而这种方式用量大,且受其他因素影响大。所以本发明采用离体叶段的方式代替整株进行试验,可以解决上述用量大以及影响因素大的问题。
2、由于小麦叶片细小,其保湿保鲜工作是生物测定首先要解决的问题。保绿培养基的成分(衬垫物和保绿剂),保绿时间和保绿剂对接种菌孢子的萌发率的影响以及离体叶片自身的叶龄,长度等因素都是研究的对象。综合上述因素,本发明研究了保鲜剂以及保鲜衬底物对孢子萌芽的影响,确定了最优选的方案,即以75μg/ml的6-ba为保绿剂,结合0.5%的水琼脂和1层滤纸的组合物为衬垫物作为小麦叶段的保鲜培养基。
3、接种时要求植物和病菌互作系统中各个方面的影响因素能达到最佳的组合状态,即使病菌发挥最大的致病力,也要利于植物活体保持最佳活力,并且具有重复性,这样才利于后续药剂试验的准确性。研究表明,锈菌常用的接种方法包括人工摩擦,刷叶法(用毛笔或棉签涂抹孢子粉或孢子悬液),喷雾法,喷粉法,以及借助机械接种筒或者沉降塔来进行定量接种。本发明从便利,高效的角度出发,确立了接种的孢悬液有效浓度在5-10μg/ml之间,且利用hd-130喷笔来进行均匀喷雾接种的方式。
4、为了使药剂可以更好的作用于条锈菌且作用结果相对稳定,可重复性操作。本发明同样研究了喷药、浸药以及含药方式进行离体叶段的杀菌剂处理后对条锈菌的抑制率,选择含药方式作为优选方式,可以使杀菌剂在小麦的离体叶段上更好的作用于条锈菌,病菌对药剂的敏感性接近于活体小麦药剂喷雾处理且结果相对稳定,同时相对于传统的活体盆栽喷雾和药剂拌种法而言,药剂作用于条锈菌的效果更精确,且植物材料用量少。
5、本发明采用photoshop对叶段的夏孢子堆面积占比进行精确测量的方式来计算杀菌剂的抑菌率,相对于目前采用的分级法来目测病害严重度的方式,受人为因素的影响较小,使其测试得到的结果更准确。
本发明的其他优点、目标和特征在某种程度上将在随后的说明书中进行阐述,并且在某种程度上,基于对下文的考察研究对本领域技术人员而言将是显而易见的,或者可以从本发明的实践中得到教导。本发明的目标和其他优点可以通过下面的说明书来实现和获得。
附图说明
为了使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作优选的详细描述,其中:
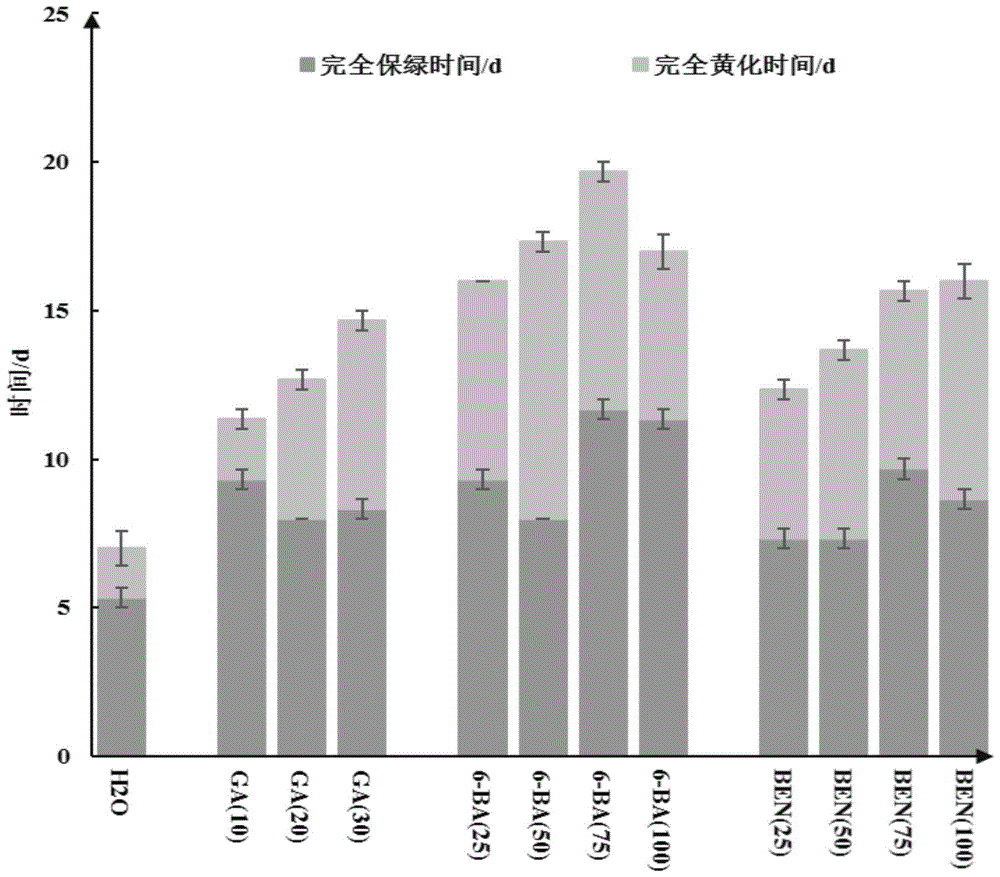
图1为小麦1cm离体叶段在不同保鲜剂在不同浓度下的保鲜时间,其中ga表示赤霉素,ben表示苯并咪唑,6-ba表示6-苯甲基腺嘌呤,横坐标括号内的数值表示各个保鲜剂的浓度(μg/ml);
图2为不同保绿衬垫物对小麦离体叶段的保绿效果,其中a、b、c、d表示的保绿衬垫物分别为0.5%的水琼脂和1层滤纸形成的组合物、0.5%的水琼脂、1%的水琼脂和1层滤纸形成的组合物、2层滤纸,而e表示盆栽小麦的叶片(对照组);
图3为喷雾接种0(ck)、0.5、1、5、10mg/ml的夏孢子悬浮液15d后小麦叶片的发病情况;
图4为1μg/ml和5μg/ml三唑酮分别通过喷药、浸药和含药三种处理方式对小麦条锈菌的防治效果,其中a为用喷壶喷雾药液在接种9d后的盆栽小麦上的药剂防治效果,b是将接种9d后的小麦叶片离体后浸泡在药液中2h后放入保绿培养基里的药剂防治效果,c是将接种9d后的小麦叶段离体后放入含药的保绿培养基里的药剂防治效果;
图5为平板含药法对离体叶段的药剂处理示意图;
图6为photoshop处理小麦离体叶段夏孢子堆占比示意图;
图7为利用平板含药法测量四个小麦条锈菌单孢子堆分离菌株(pst-20,pst-31,pst-26,pst-21)在不同浓度的三唑酮处理下的生长情况;
图8为81个小麦条锈菌单孢子堆分离菌株对三唑酮的ec50的标准q-q图;
图9为条锈菌81个单孢子堆分离菌株对三唑酮的敏感性基线;
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。需要说明的是,以下实施例中所提供的图示仅以示意方式说明本发明的基本构想,在不冲突的情况下,以下实施例及实施例中的特征可以相互组合。
本发明中采用的各种原料来源如下:
供试植物材料:小麦品种为铭贤169,是小麦条锈菌高感品种。播种待到第一叶完全展开时用于试验处理。
供试菌株:菌种为2018年重庆合川区(北纬30.10'24",东经106.25'37")田间采集的混合菌种。
供试试剂:
赤霉素(ga):称取0.1g,加入500μl酒精溶解后,再加入49.5ml蒸馏水稀释,保存在棕色瓶中,置于4℃冰箱保存;
6-苄氨基腺嘌呤(6-ba):称取1g6-ba置于小烧杯中;加入少量的0.5或1mol/l的盐酸,使之完全溶解;在用蒸馏水稀释并定容至100ml,玻璃瓶4℃保存;
苯并咪唑(ben):称取1g苯并咪唑置于小烧杯中;加入少量的0.5或1mol/l的盐酸,使之完全溶解;在用蒸馏水稀释并定容至100ml,玻璃瓶4℃保存;
95%三唑酮原药(购于湖北康宝泰公司),称取0.5g,以5ml二甲基亚砜为溶剂,配制成1×104μg/ml的母液,置于4℃的冰箱中保存备用。
供试培养基:0.5%水琼脂(wa)培养基的制备:取300ml锥形瓶,称取1g的琼脂粉,加入200ml的无菌水,封口后置于高压灭菌锅中灭菌,冷却后备用。
实施例1制备测试培养皿
1、小麦条锈菌菌株的分离与扩繁
(1)小麦种植:首先,选取饱满一致的铭贤169小麦种子,用500ml烧杯装清水浸泡1夜,种子充分吸水膨胀后,倒入直径为25cm的培养皿中,澄干表面水分,盖上湿润的纱布,装入黑色塑料袋中,置于25℃恒温箱中催芽;其次,待种子露白后,将泥炭土和蛭石混匀后加水湿润,铺在黑色7方小塑料花盆中,选取健康的露白麦种撒入中,1盆放入15~20粒种子,再覆盖上一层培养土,浇透水,放置于温室中(16h/8h光照/黑暗),待10d长到1心1叶时备用。
(2)小麦条锈菌的采集:首先采集病叶,在小麦条锈病始发期从不同小麦生态区采样,采集新鲜条锈病病叶,选择小麦叶表面孢子堆间距较大的病叶,剪取单孢子堆的叶段,用吸水纸包好,平整地夹在书中,在页脚处标记好采集信息,带回放于4℃干燥器内保存;其采集夏孢子,将单孢子堆的叶段插入干燥的玻璃试管,敲击管壁使叶片上的孢子粉抖落,用封口膜封口,贴上标签,标明采集地和时间,带回转入离心管抽真空存放在-80℃冰箱。
(3)条锈菌单孢分离(初繁):将带回的病叶进行保湿处理,选取采集的孢子堆较分散的叶段,用清水冲洗表面后铺在带有湿润滤纸的培养皿中过夜,每个培养皿中放3到5个叶片,防止交叉感染,待产出新的孢子后备用。
选取提前播种在育苗盘中10d的1穴1株的健康小麦苗。接种前先向工作台喷雾,用来沉降空气中的小麦条锈病菌孢子,再用75%的酒精对接种针和手进行消毒。选取保湿处理的病叶上的单个孢子堆,用灭菌的接种针尖端蘸取单个孢子堆上的孢子,轻轻移动针尖至待接种的小麦叶片上,尽量接种在叶片中部,接种完后喷雾少量清水,用透明的吸管套住,进行隔离。再取另1根接种针蘸取另1个孢子堆,如此重复完成单孢子堆分离接种。1个孢子堆接种1棵,1个病叶接种3株小麦。温室培养12~15d后观察发病情况。
(3)条锈菌菌株扩繁:首先,当单孢子堆分离的叶片产孢后,剪下叶片,放入接种皿中,加入少量清水搅拌,使叶片上的孢子掉落,过滤后制成孢悬液;其次,选取健康且长势一致的盆栽10d麦苗,手指蘸取清水摩擦叶片2-3次,以去掉表面蜡质层,将孢悬液加入喷笔中,喷雾接种在处理过的小麦苗上,再用喷壶喷雾少量清水湿润叶片,插上标签,然后用塑料套筒罩住隔离,在温室中黑暗处理24h后取出(处理完1个菌株后,向喷笔中加入75%酒精喷雾10s,再加入清水喷雾10s,待操作台沉降120s后,进行下1个菌株的处理);最后,每隔5d剪去心叶,浇少量清水,待产孢时用干燥的离心管收集孢子,分别编号在低温保存备用。
(5)条锈菌菌株的保存:夏孢子收集期间将盛有孢子的试管保存在4℃冰箱中的干燥器内。收集完成后将夏孢子装入离心管中抽真空保存在-80℃冰箱中。
2、保鲜剂的筛选
为了使小麦叶片在离体情况下保绿,以满足小麦条锈菌的发病条件,故采用水悬浮的方法进行小麦离体叶段保鲜单剂的筛选:用75%的酒精进行操作台消毒后,向盛有灭菌水的锥形瓶中加入不同量的保鲜单剂,再将配置好的保鲜水溶液倒入9cm的培养皿中制成水盘。选取健康长势一致的1叶1心的小麦叶段,在操作台上剪成1cm左右的叶段,每皿放置10个叶段,其中叶段均是正面朝上,密封,置于小麦温室。保鲜单剂浓度设置如下,赤霉素(ga)为10、20、30μg/ml;6-苄氨基腺嘌呤(6-ba)为25、50、75、100μg/ml;苯并咪唑(ben)为50、65、75、100μg/ml,以水为对照组,每个处理重复3次,并每天观察叶段黄化情况,记录开始黄化的时间和完全黄化的时间,结果如图1所示:通过水悬浮的方法筛选小麦离体叶段的保鲜剂,相对于水而言三种保鲜剂均有更好的离体叶段保绿效果,其中75μg/ml的6-苯甲基腺嘌呤的安全保绿时间和完全黄化所需要的时间最长,分别为12天与19.33天;苯并咪唑的保绿效果次之,100μg/ml的苯并咪唑的保绿时间均可达到16天;赤霉素的保绿效果最差,30μg/ml的赤霉素只能保绿14.67d。由于小麦叶段在完全黄化之前小麦条锈菌都可生长,并且显著性结果分析显示,75μg/ml的6-苯甲基腺嘌呤与其他浓度的保绿剂都存在显著性差异,因此将75μg/ml的6-苯甲基腺嘌呤为本发明中优选的保绿剂。
3、保鲜衬垫物的筛选
以75μg/ml的6-ba为保鲜剂,分别试验了以0.5%的水琼脂和1层滤纸形成的组合物(a)、0.5%的水琼脂(b)、1%的水琼脂和1层滤纸形成的组合物(c)和2层滤纸(d)为保鲜衬底物的保鲜情况,将盆栽小麦的叶片(e)作为对照组,试验结果如图2所示:各组分均有一定的保绿效果,以0.5%的水琼脂和1层滤纸形成的组合物为保鲜衬底物的保鲜效果最佳,叶段离体12d后才开始黄化,离体19d后完全黄化;0.5%的水琼脂为保鲜衬底物的保绿效果最差,叶段离体15d后就完全黄化。由以上结果可知0.5%的水琼脂和1层滤纸形成的组合物为保鲜衬底物时的保绿效果与其他几种保鲜衬底物的保绿效果存在显著性差异,所以可以采用0.5%的水琼脂和1层滤纸形成的组合物作为小麦离体叶段的保鲜衬底物的最优方案。
4、保绿培养基对夏孢子萌发的影响
在选取保鲜剂和保鲜衬垫物的优选组合后,再确定保绿培养基成分对小麦条锈菌夏孢子的萌发的影响:取3片干净的凹玻片,在凹槽中用移液枪分别加入250μl的保鲜衬垫物,包括无菌水,0.5%的水琼脂,以及加入75μg/ml6-ba的0.5%的水琼脂;取10ml干净的离心管,称取适量新鲜的夏孢子粉,加入3倍的滑石粉,混匀后用两层纱布封口,从上方抖落至玻片上,编号后放入瓷盘中保湿,置于12℃的培养箱中黑暗培养;再镜检培养3h和6h后的凹玻片:将玻片置于显微镜(20×10)下观察,每个凹玻片观察10个视野,记录夏孢子总数和萌发孢子数(芽管超过孢子短径1/2为萌发)并计算孢子萌发率(%),试验重复四次。
其中,孢子萌发率(%)=萌发孢子数/夏孢子总数×100%
以无菌水为对照,测量保绿培养基对夏孢子萌发的影响,结果如表1所示,表明保绿培养基中的成分0.5%水琼脂和保绿剂75μg/ml的6-ba对夏孢子萌发无影响:3种处理下孢子在6h后的萌发率都能达到80%以上,并且三组数据无显著性差异。
表1保绿剂对小麦条锈菌夏孢子萌发的影响
注:表中数据后不同字母表示采用duncan示新复极差法检验数值间差异性(p>0.05)
5、接种均匀度及接种量确定
首先,先向操作台喷雾75%的酒精,再喷雾少量清水,静置2min,以便沉降空气中的孢子;其次,称取5mg的孢子粉,加入10ml的0.02%吐温20,在涡旋振荡器上振荡5min,制成浓度为0.5mg/ml孢悬液,同样的方法与试剂配置浓度为1.0mg/ml、5mg/ml以及10mg/ml的孢悬液;然后,将制好的孢悬液加入口径为0.5mm的美术喷笔中,调节美术喷笔的压力为0~4bar后进行喷雾接种,5ml菌液接种3盆幼苗,以接种0.02%吐温20(ck)为对照组;最后黑暗保湿处理24h后置于温室培养,记录潜育期及9d、12d、15d和18d的发病情况。其中接种时将3片盖玻片放在培养皿盖中置于接种苗旁,一同喷雾。接种完成后,将盖玻片置于显微镜(10×10)下观察,每个载玻片观察5个视野。
式中:
i=f×d×100
d——病叶平均严重度;i——各严重度值;
li——各严重度值对应的病叶数,单位为片;
l——调查总叶数,单位为片;i——病情指数;
f——病叶率。
结果显示:4种浓度不同的孢子悬液在进行喷雾接种后,用光学显微镜(10×20)记录了每个玻片上5个视野的孢子数,计算平均数后用spss软件的新复极差法分析数据,各组结果如下表2所示:各组数据组内3片盖玻片之间并无显著性差异,表明喷雾接种时菌悬液分布均匀;喷雾接种0(ck)、0.5、1、5、10mg/ml的夏孢子悬浮液15d后小麦叶片的发病情况如表3以及图3所示:浓度为1~10μg/ml的孢悬液可以有效进行接种,并且孢子悬液的浓度与病害潜育期相关,即夏孢子的浓度越高,病害的潜育期越短,而以5μg/ml和10μg/ml的孢子悬液接种的小麦在15d后的病情指数无显著性差异,故可以选择5~10μg/ml作为有效接种小麦条锈菌的有效孢子悬液的浓度。
表2光学显微镜(10×20)下喷笔喷雾接种的每视野平均孢子数
注:表中数据后不同字母表示采用duncan示新复极差法检验数值间差异性(p>0.05)
表3喷雾接种不同浓度孢悬液下的病害潜育期及病情指数
注:表中数据后不同字母表示采用duncan示新复极差法检验数值间差异性(p>0.05)
6、离体叶段药剂处理
为了使杀菌剂能充分发挥作用,且可以使效果稳定且可重复,比较小麦离体叶段喷药、浸药以及平板含药3种方式对小麦条锈菌的作用效果,其中以1μg/ml和5μg/ml的三唑酮作为杀菌剂:首先,选取接种后产生病斑情况均匀的叶段,将离体叶段放入保鲜板中后用小喷壶进行喷药处理(以药滴均匀布满叶段且不凝结为水滴为止)后作为喷药组,将接种的叶段剪下浸入药液2h后用滤纸拭干表面液滴后放入保鲜板中作为浸药组,直接将药剂加入保鲜培养基中制成含药平板,将产斑的叶段放入含药平板中作为平板含药组,3种处理方式同1天进行,且选材一致;其次,将处理好的平板放入培养箱中培养,以不进行杀菌剂处理的离体叶段作为对照组(即三唑酮的浓度为0μg/ml);最后,利用phtotshop计算孢子堆面积占比。结果如图4所示:带条锈菌的小麦离体叶段经过杀菌剂的喷药、浸药以及含药3种方式处理后均能对条锈菌产生防治效果,其中无论是1μg/ml还是5μg/ml的三唑酮作为杀菌剂时,平板含药的处理方式取得的防治效果与盆栽法无显著性差异,因此在离体叶段的杀菌剂处理方式中选择平板含药可以代替盆栽法获得其对条锈菌的防治效果。
实施例2离体叶段平板含药的应用试验
结合上述实施例1的优选结果,随机选取小麦条锈菌单孢子堆分离菌株,采用平板含药法进行三唑酮对小麦条锈菌的毒力测定,具体方法如下:
(1)制备孢子悬液:将存放在-80℃的单孢子堆分离菌株取出,置于42℃水浴锅中活化5min得到孢子粉,将适量孢子粉倒入10ml离心管中,加入1ml的0.1%的吐温20,在涡旋振荡器上震荡1min后加入9ml清水,再次震荡4min左右,直至孢子粉充分分散,制成孢子悬浮液。
(2)接种:先向操作台喷雾75%的酒精,再喷雾少量清水,静置2min,以便沉降空气中的孢子;将制好的孢子悬浮液加入口径为0.3mm的美术喷笔中,在0~4bar的压力下进行小麦幼苗接种,每个菌悬液接种5盆盆栽幼苗,接种时保证叶片两面铺满雾滴且不滴落(其中每接种完1个菌株后,用清水清洗喷笔,再加入适量75%的酒精喷雾10s,最后再用清水冲洗,才可进行下1个菌株的接种);将接种好的幼苗盆栽置于温室中黑暗保湿处理24h后取出,用塑料套筒隔离开,置于温室中培养,期间除去心叶,以保证第1叶营养供应,直至第8d左右出现病斑。
(3)离体药剂处理:将出现明显病斑但未开始产孢时的小麦幼苗进行离体药剂处理,在冷却至不烫手的0.5%的水琼脂(wa)培养基中加入相应量的6-ba和三唑酮,配制成含75μg/ml6-ba及不同浓度(0.03、0.09、0.27、0.81、2.43、7.29、21.87μg/ml)的三唑酮的培养基,然后取20ml配制的培养基倒入9cm的培养皿中;将9cm的圆形滤纸沿直径剪成2.5,4.0,2.5cm的三段,将中间4cm的滤纸条铺在培养基上,选取同一高度的不同盆的小麦叶片,剪取5cm的带有明显病斑的中间叶段作为离体叶段,平行铺在4cm滤纸上,用剩下的滤纸将叶段两端固定并使之紧贴于培养基表面,要求每个培养皿中含有来自不同盆的5个叶段;处理完后,将培养皿置于12℃恒温培养箱中(光照18h)培养,以不加三唑酮的不含药培养基为对照组(如图5所示)。
(5)检测:待对照组的病斑侵染面积达到80%以上时进行数据统计,用photoshop软件进行病斑占比像素分析,先记录5个叶段的总像素,再记录50,60,70三个容差下的5个叶段上孢子堆面积的总像素;用excel计算出5个叶段上孢子堆面积的总像素的平均值以及孢子堆面积占比(如图6所示);以药剂浓度的对数为x,菌株生长的抑制率所对应的几率值为y,计算出菌株的毒力回归方程y=ax+b;当y=5时,计算出各菌株的ec50,其中,抑制率(%)=(对照组孢子堆面积占比-处理组孢子堆面积占比)/对照组孢子堆面积占比×100%;用spss软件对ec50进行描述分析和正态性检验,将菌株的ec50作为x轴,其分布频率为y值,得到一个频率直方分布图,其趋势线即为敏感性基线,将得到的敏感性基线进行正态性shapiro-wilk(w检验),并进一步生成q-q图。
用上述方法试验结果共测得81个单孢子堆分离菌株(如图7所示)对三唑酮的ec50,将得到的ec50进行正态性shapiro-wilk(w检验),其结果显示对三唑酮不同敏感性菌株的频率分布呈近似正态分布(w=0.204),并进一步生成q-q图,具体如图8所示,结果显示各ec50值围绕直线分布,呈正态分布。
综上所述,测得的81个菌株对三唑酮的ec50的变化范围为0.0015~0.3117μg/ml,平均值为0.1453±0.0081μg/ml,频率分布(组距为0.02μg/ml)(图9所示)为正态单峰曲线,所以可将所测得ec50平均值作为小麦条锈病对三唑酮的敏感性基线,从而获得测定杀菌剂对小麦条锈菌独立的方法。由于经过本发明的验证,可以在加入保鲜剂与保鲜衬底物的情况下,采用立体叶段代替小麦盆栽,故本发明的方法还可以直接用于室内测定杀菌剂对小麦条锈菌的毒力效果。
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!