一种倏逝波核酸适配体传感器及应用其进行小分子检测的方法与流程
本发明涉及一种倏逝波核酸适配体传感器及应用其进行小分子检测的方法,特别涉及一种具有靶标自富集和纯化能力的倏逝波核酸适配体传感器(sep-as/ewa),并利用该传感器实现对多种不同水溶性小分子靶标高灵敏和高特异性的检测,属于分析化学技术领域。
背景技术:
有机小分子是环境和食品污染物中的一大类,具有种类及其多样、水溶性差异大、特异性抗体少等特点,因而在分析测试中主要采用基于大型仪器的方法,比如气相色谱法、高效液相色谱法(hplc)、气相质谱联用法、液相质谱联用法等。这些方法设备昂贵,对工作环境和设备维护要求高,不适合现场检测。近些年来,为了满足现场检测的需要,各种生物传感器发展迅速。特别是基于核酸适配体的生物传感器由于其具有价格低和重现性好等优点,备受关注。
核酸适配体是通过selex技术(systematicevolutionofligandsbyexponentialenrichment,即系统指数富集的适配体系统进化技术)获得的单链或双链的dna或rna(nature,1990,346,818-822;nature,1992,355,564-566)。核酸适配体能够特异性识别包括蛋白质、小分子、细胞和组织在内的多种多样的靶分子,其化学稳定性高,易于合成和修饰,成本低,在生物传感领域具有广泛的应用前景。由于小分子的高特异性抗体不易获得,用于小分子检测的核酸适配体生物传感器尤其具有吸引力。但是小分子的核酸适配体的亲和力普遍比抗体的低很多,通常需要进行基于酶或者纳米材料的信号放大来提高检测的灵敏度,但检测的灵敏度常常还是不能达到实际需要的水平。
萃取技术是基于仪器的分析方法中常用的样品制备方法,用来去除基质和富集靶标,从而实现对靶标的定量或者定性检测。固相微萃取技术(spme)是近些年来快速发展的一类新型的萃取技术。其利用固定在固相上的各种富集材料来富集和纯化各种类型的靶标(trac-trendsinanalyticalchemistry2018,108,154-166.trac-trendsinanalyticalchemistry2019.110,66-80.)。
以三种代表性环境小分子污染物为例来展示,分别是属于高憎水性小分子邻苯二甲酸酯类物质(phthalateesters或phthalicacidesters,paes)中最常见的邻苯二甲酸二(2-乙基)己酯(dehp)、憎水性小分子抗生素磺胺地索辛(sdm)、亲水性抗生素卡那霉素(kana)。近些年来针对上述三种靶标报道了不少核酸适配体传感器,包括电化学和光学传感器,但是均存在灵敏度不高或者特异性有限的问题,尚未能用于实际应用。
技术实现要素:
在本发明中,我们首次将spme与核酸适配体传感器相结合,以倏逝波传感器为例,实现对小分子靶标的超灵敏和高特异性检测。
本发明中以三种代表性环境小分子污染物为例来展示本发明方法的普适性,分别是属于高憎水性小分子邻苯二甲酸酯类物质(phthalateesters或phthalicacidesters,paes)中最常见的邻苯二甲酸二(2-乙基)己酯(dehp)、憎水性小分子抗生素磺胺地索辛(sdm)、亲水性抗生素卡那霉素(kana)。
本发明目的是提供一种具有靶标自富集和纯化能力的核酸适配体倏逝波光纤生物传感器(sep-as/ewa)及应用其对小分子靶标实现高灵敏和高特异性检测的方法。本发明方法将具有高效靶标萃取能力的萃取剂(比如吐温80)和靶标特异的核酸适配体共同组装在光纤传感界面上,实现靶标富集、纯化和特异性检测的同步进行,检测的灵敏度和特异性都极高。本发明方法基于小分子靶标和与核酸适配体互补短链dna(cdna)与偶联在光纤表面的核酸适配体竞争性结合,实现对小分子靶标的定量检测。光纤表面的吐温80(tween80)把溶液中的小分子高效富集到光纤表面附近,大幅促进了偶联在光纤表面的核酸适配体和小分子之间的结合,使得荧光标记的与核酸适配体互补的cdna与核酸适配体的杂交大幅减弱。本发明方法以邻苯二甲酸二(2-乙基)己酯(dehp)/磺胺地索辛(sdm)/卡那霉素(kana)三种代表性强憎水性/憎水性/亲水性小分子靶标的检测为例,分别构建了三个sep-as/ewa,实现了对dehp/sdm/kana的高灵敏和高特异性的检测,检出限分别为237fm、4.84pm和5pm,无需任何信号放大。其检出限比传统ewa检测方法低1000-100,000倍,甚至比最灵敏的电化学检测方法的检出限还要低50-200倍。sep-as/ewa具有优越的特异性,对常见干扰物的选择性大于1000倍。sep-as/ewa检测非常迅速(6min),而且可以快速实现传感器的再生,再生次数100次以内时荧光信号波动仅为±6%。本发明的传感器和检测方法具有实际应用价值和普适性,利用其它萃取试剂,可以推广应用于金属离子、蛋白质等其它类型靶标的检测。
本发明的具体实验步骤:
1)光纤表面的羟基化:首先将表面处理干净的光纤浸泡在体积比为3:1的浓硫酸:30%过氧化氢混合溶液中,100-120℃下1h,然后将光纤从混合溶液中取出,用超纯水洗到中性,n2吹干,70-90℃下处理4-6h,取出后干燥器中冷却;
2)光纤表面的硅烷化:将上述光纤放入有一定浓度的3-氨丙基三乙氧基硅烷(aptes)的无水甲苯溶液,室温反应1-2h,取出后分别用无水甲苯,甲苯-乙醇(v/v=1:1),乙醇冲洗三遍,n2吹干,在180℃下处理1h,取出后于干燥器中冷却;
3)光纤表面的偶联及固定dna:将硅烷化后的光纤放入一定浓度的戊二醛(ga)一倍磷酸盐缓冲溶液中(10mm,1xpb),37℃反应60min,反应结束后用1xpb溶液清洗三次,n2吹干,将ga偶联后的光纤放入一定浓度氨基修饰的靶标的核酸适配体,室温反应6-8h,随后用1xpb溶液清洗三次,n2吹干,放入干燥器中保存;
4)还原及封闭:将光纤放入一定浓度的nabh4溶液还原30min,并用一定浓度的吐温80溶液封闭光纤界面,随后用1xpb溶液清洗三次,n2吹干,放入干燥器中保存;
5)将光纤放入倏逝波传感器的检测器中,向检测器中泵入一定浓度的小分子靶标及相应的荧光修饰核酸适配体的互补链的混合溶液,实时测试荧光信号的变化;
6)用一定浓度的sds冲洗光纤进行传感界面的再生;重复5);
7)绘制倏逝波光纤传感器检测不同靶标的工作曲线;
8)选择性实验:将5)中的靶标换成选择性测试的物质即可。
该方法具有如下优势:1)本发明方法实现靶标富集、纯化和特异性检测的同步进行,这在现有技术中是首次实现,使得操作极为便捷和快速;2)本发明方法的检测高灵敏和特异性都极高,比传统的倏逝波传感器检出限低1000-100,000倍,甚至比最灵敏的电化学检测方法的检出限还要低50-200倍;3)本发明方法的传感器具有优越的靶标普适性,高度憎水性、憎水性和亲水性小分子靶标都适用;4)利用核酸适配体实现对靶标的特异性识别,比基于抗体的传感器测试成本低、批次与批次间稳定性好;5)本发明方法的传感器可以多次循环再生(>100次)和稳定性(荧光信号变化在±6%);6)该方法的传感器检测快速,可以在几分钟内完成;7)本发明方法的传感器不局限于小分子靶标,通过更换萃取剂,可以推广到其它类型的靶标,比如重金属离子等。
附图说明
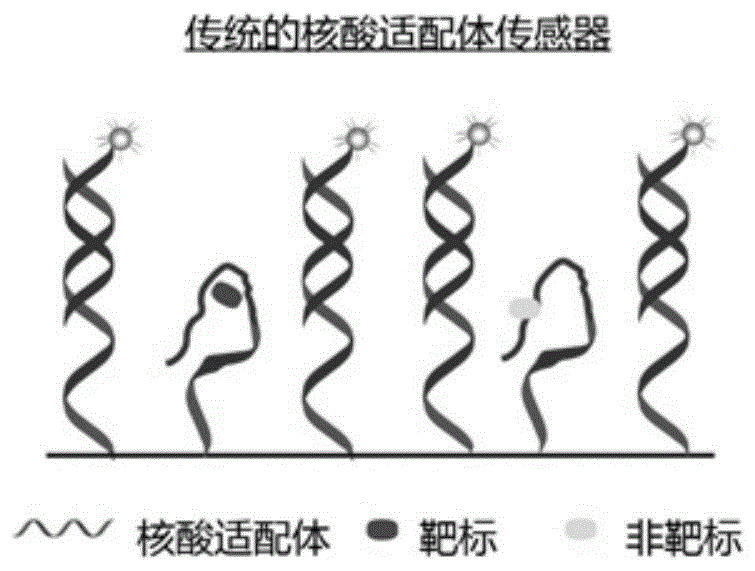
图1a和图1b是不具有萃取层(图1a)和具有萃取层(图1b)的核酸适配体传感器的示意图。
图2是本发明方法中具有靶标自富集和纯化能力的核酸适配体倏逝波光纤传感器(sep-as/ewa)的制备、检测和界面再生过程的示意图。
图3a-3c是界面化学对ewa进行dehp检测的影响的荧光信号动力学谱图:nabh4还原(图3a)、bsa(图3b)或tween80(图3c)封闭的传感界面。
图4a和4b是按照本发明方法构建的dehpsep-as/ewa(吐温80封闭)对不同浓度dehp(0,1pm,10pm,100pm,1nm,10nm,100nm)进行检测的荧光-时间检测曲线(图4a)和工作曲线(图4b)。
图5a和图5b是按照本发明方法构建的dehpsep-as/ewa对典型亲水性靶标(kana)和憎水性靶标(sdm)在不同浓度(a)下以及对其他结构类似物和重金属离子(b)的选择性测试结果图。
图6a-6d是按照本发明方法构建的sdmsep-as/ewa(吐温80封闭)对不同浓度sdm(0,1pm,10pm,100pm,1nm,10nm,100nm)进行检测的荧光-时间检测曲线(图6a)、工作曲线(图6b)和选择性测试柱状图(图6d);传感器泵入不同浓度dehp(0,1pm,10pm,100pm,1nm,10nm,100nm)样品后的荧光信号曲线(图6c)。
图7a-7c是按照本发明方法构建的kanasep-as/ewa(吐温80封闭)对不同浓度kana(0,1pm,10pm,100pm,1nm,10nm,100nm)进行检测的荧光-时间检测曲线(图7a)、工作曲线(图7b)和选择性测试柱状图(图7c)。
图8是本发明光纤表面的循环再生次数的荧光信号变化图。
具体实施方式
图1a和图1b是不具有萃取层(图1a)和具有萃取层(图1b)的核酸适配体传感器的示意图。由于萃取层对靶标的富集和纯化作用,本发明具有萃取层的核酸适配体传感器比传统的不具有萃取层的传感器灵敏度和特异性均大幅提高。图2是本发明方法中具有靶标自富集和纯化能力的核酸适配体倏逝波光纤传感器(sep-as/ewa)的制备、检测和界面再生过程的示意图。图3a-3c是界面化学对ewa进行dehp检测的影响的荧光信号动力学谱图:nabh4还原(图3a)、bsa(图3b)或tween80(图3c)封闭的传感界面。空白黑线是100nmcdna(c-pae-cy5.5)流入ewa时的荧光信号动力学谱图;红线(含有dehp所指示的线)是在100nmdehp和100nmcdna(c-pae-cy5.5)混合物流入ewa时荧光信号动力学谱图。为便于比较将各组测试中空白样品泵入0.5%sds进行界面再生前(第240s)的荧光强度设为100%。图4a和4b是按照本发明方法构建的dehpsep-as/ewa(吐温80封闭)对不同浓度dehp(0,1pm,10pm,100pm,1nm,10nm,100nm)进行检测的荧光-时间检测曲线(图4a)和工作曲线(图4b)。图5a和图5b是按照本发明方法构建的dehpsep-as/ewa对典型亲水性靶标(kana)和憎水性靶标(sdm)在不同浓度(a)下以及对其他结构类似物和重金属离子(b)的选择性测试结果图。dbp:邻苯二甲酸二丁基酯;ba:邻苯二甲酸pa:苯甲酸。图6a-6d是按照本发明方法构建的sdmsep-as/ewa(吐温80封闭)对不同浓度sdm(0,1pm,10pm,100pm,1nm,10nm,100nm)进行检测的荧光-时间检测曲线(图6a)、工作曲线(图6b)和选择性测试柱状图(图6d);传感器泵入不同浓度dehp(0,1pm,10pm,100pm,1nm,10nm,100nm)样品后的荧光信号曲线(图6c)。图7a-7c是按照本发明方法构建的kanasep-as/ewa(吐温80封闭)对不同浓度kana(0,1pm,10pm,100pm,1nm,10nm,100nm)进行检测的荧光-时间检测曲线(图7a)、工作曲线(图7b)和选择性测试柱状图(图7c)。图8是本发明光纤表面的循环再生次数的荧光信号变化图。本发明方法的传感器可以多次循环再生(>100次)和稳定性(荧光信号变化在±6%)
表1.本发明所使用的dna探针
(eg):ch2ch2o
表2.利用本发明方法检测饮用水样品中添加的dehp
实施例1.具有靶标自富集和纯化能力的核酸适配体倏逝波光纤传感器(sep-as/ewa)的原理、光纤制备、靶标测试及其传感界面再生过程。
本发明提供一种具有靶标自富集和纯化能力的核酸适配体倏逝波光纤生物传感器(sep-as/ewa)及应用其对小分子靶标实现高灵敏和高特异性检测的方法。本发明方法的原理如图1a和1b所示,将具有高效靶标萃取能力的萃取剂(比如吐温80)和靶标特异的核酸适配体共同组装在光纤传感界面上,实现靶标富集、纯化和特异性检测的同步进行,检测的灵敏度和特异性都极高。本发明方法基于小分子靶标和与核酸适配体互补短链dna(cdna)与偶联在光纤表面的核酸适配体竞争性结合,实现对小分子靶标的定量检测。光纤表面的吐温80把溶液中的小分子高效富集到光纤表面附近,大幅促进了偶联在光纤表面的核酸适配体和小分子之间的结合,使得荧光标记的与核酸适配体互补的cdna与核酸适配体的杂交大幅减弱。
按照本发明方法的原理,如图2所示构建具有靶标自富集和纯化能力的核酸适配体倏逝波光纤传感器(sep-as/ewa)。首先将光纤放入30%的hf,光纤的放入深度为3.5厘米(cm),在hf中刻蚀2-3小时(h)直到光纤直径约为220微米(μm),然后用超纯水清洗至中性。然后光纤依次经过1)表面羟基化、2)光纤表面硅烷化、3)光纤表面的偶联化、4)dna固定于光纤表面和光纤表面的还原与封闭四步完成光纤的制备过程。具体操作条件如下。
1)光纤表面的羟基化:首先将表面处理干净的光纤浸泡在体积比为3:1的浓硫酸:30%过氧化氢混合溶液中,100-120℃下1h,然后将光纤从混合溶液中取出,用超纯水洗到中性,n2吹干,70-90℃下处理4-6h,取出后干燥器中冷却;
2)光纤表面的硅烷化:将上述光纤放入有一定浓度的3-氨丙基三乙氧基硅烷(aptes)的无水甲苯溶液,室温反应1-2h,取出后分别用无水甲苯,甲苯-乙醇(v/v=1:1),乙醇冲洗三遍,n2吹干,在180℃下处理1h,取出后于干燥器中冷却;
3)光纤表面的偶联及固定dna:将硅烷化后的光纤放入一定浓度的戊二醛(ga)一倍磷酸盐缓冲溶液中(10mm,1xpb),37℃反应60分钟(min),反应结束后用1xpb溶液清洗三次,n2吹干,将ga偶联后的光纤放入一定浓度氨基修饰的靶标的核酸适配体,室温反应6-8h,随后用1xpb溶液清洗三次,n2吹干,放入干燥器中保存;
4)还原及封闭:将光纤放入一定浓度的nabh4溶液还原30min,并用一定浓度的吐温80溶液封闭光纤界面,随后用1xpb溶液清洗三次,n2吹干,放入干燥器中保存。
按照上述方法制备好的光纤装入倏逝波传感器的检测器中即可开始靶标的测试。倏逝波联机安装的荧光检测器将实时记录荧光信号的变化,用于靶标浓度的定量分析。每次测试完毕后,用0.5%的sds(ph=1.9)冲洗光纤30秒进行传感界面的再生,再次用对应的检测缓冲溶液重洗光纤后进行下一个测试。
实施例2.界面化学对ewa进行dehp检测的影响。
以下所有实施例中所使用的dna探针的序列信息见表1。dehp标准溶液配置及其检测均使用缓冲溶液1(100mm氯化钠,20mm三羟甲基氨基甲烷,2mm氯化镁,5mm氯化钾,1mm氯化钙,1%吐温20,0.03%曲拉通x-100,2%二甲基亚砜,ph7.9);sdm标准溶液配置及其检测均使用缓冲溶液2(25mm4-羟乙基哌嗪乙磺酸,20mm氯化钾,200mm硝酸钠,150mm氯化铵,0.025%曲拉通x-100,1%二甲基亚砜,ph5.3);kana标准溶液配置及其检测均使用缓冲溶液3(10mm磷酸盐缓冲溶液,1m氯化钠,5mm氯化镁2,ph7.0)。
按照实施例1所述的方法,分别构建了三个具有不同界面化学的倏逝波传感器,用于dehp的检测。界面化学分别是仅使用0.3%nabh4进行还原、nabh4还原后再用2mg/ml的牛血清白蛋白(bsa)或者和0.1%吐温(tween80)进行界面封闭一小时。将封闭好的光纤放入反应室中,清洗管道后向其中先后分别通入100nmcdna(c-pae-cy5.5)和100nmdehp与100nmcdna(c-pae-cy5.5)的混合溶液。记录两次信号随时间变化关系。
结果如图3a-3c所示,具有nabh4还原界面化学的光纤在100nm的dehp存在时,相比没有dehp的空白样品荧光信号出现小幅下降;具有bsa封闭的光纤在100nm的dehp存在时,相比没有dehp的空白样品荧光信号几乎不变;具有吐温80封闭的光纤在100nm的dehp存在时,相比没有dehp的空白样品荧光信号大幅下降。实验结果表明,界面化学强烈影响传感器的性能,吐温80封闭的倏逝波传感器最灵敏。
实施例3.利用sep-as/ewa进行dehp的高灵敏和高特异性检测。
光纤表面的羟基化、硅烷化、偶联、封闭和还原等步骤同实施例1,其中偶联上的核酸适配体为nh2-pae。配置不同终浓度的dehp标准溶液(0pm,1pm,10pm,100pm,1nm,10nm,100nm)。分别与100nm荧光修饰的互补链(c-pae-cy5.5)混合,依次由低浓度到高浓度通入倏逝波光纤传感器中,每次测试完成后进行界面再生,清洗干净管道,使其荧光信号降到基线。记录不同浓度下荧光随时间的变化,以不同靶标浓度下相对荧光信号减小百分比值为纵坐标绘制工作曲线。
分别在缓冲溶液1中配置不同终浓度的sdm和kana标准溶液(0pm,1pm,10pm,100pm,1nm,10nm,100nm);终浓度为100nm的dbp、sdm、kana、邻苯二甲酸(ba)、苯甲酸(pa)、hg2+、pb2+和100nm的荧光修饰核酸适配体的互补链(c-pae-cy5.5)。将七个靶标与互补链的混合溶液按照以下程序通入检测器中。第一步先向仪器中通入60s的缓冲溶液1,第二步向仪器中通入选择性靶标与互补链的混合溶液20s,然后在反应器中平衡180s。第三步向反应器中通入0.5%的sds(ph1.9)40s,最后通入50s的缓冲溶液。
结果如图4a和4b所示,相对荧光信号减小百分比值与dehp浓度的对数成正比,线性相关系数r2为0.998,按照三倍信噪比得出的检出限为237fm。该灵敏度比我们之前报道的dehp电化学传感器(anal.chem.2017,89,5270-5277)的检出限还要低50倍。该传感器具有极高的靶标选择性(图5a和5b)。比如,1pm的dehp所引起的相对荧光强度下降为19.31±0.08%,而100nm的kana所引起的相对荧光强度下降仅为15.60±6.94%,因此靶标选择性高达105。再比如,10pm的dehp所引起的相对荧光强度下降为28.72±4.23%,而1pm-100nm的sdm所引起的相对荧光强度下降仅为18.82±4.38%,因此靶标选择性高达104。该传感器对dbp也有相应,说明该传感器对pae具有种类特异性;对重金属、结构类似物和其它抗生素没有显著相应,这与我们之前的报道一致(anal.chem.2017,89,5270-5277)。
实施例4.利用sep-as/ewa进行sdm的高灵敏和高特异性检测。
光纤表面的羟基化、硅烷化、偶联、封闭和还原等步骤同实施例1,其中偶联上的核酸适配体为nh2-sdm。在缓冲溶液2中配置不同终浓度的sdm和dehp标准溶液(0pm,1pm,10pm,100pm,1nm,10nm,100nm)。分别与100nm荧光修饰的互补链(c-sdm-cy5.5)混合,依次由低浓度到高浓度通入倏逝波光纤传感器中,每次测试完成后进行界面再生,清洗干净管道,使其荧光信号降到基线。记录不同浓度下荧光随时间的变化,以不同靶标浓度下相对荧光信号减小百分比值为纵坐标绘制工作曲线。
结果如图6a-6d所示,相对荧光信号减小百分比值与sdm浓度的对数成正比,线性相关系数r2为0.9994,按照三倍信噪比得出的检出限为4.84pm。该灵敏度比我们之前报道的sdm电化学传感器(sens.actuatorsb2017,253,1129–1136)的检出限还要低200倍。该传感器具有极高的靶标选择性。比如,100pm的sdm所引起的相对荧光强度下降为32.9±2.7%,而100nm的kana所引起的相对荧光强度下降仅为27.5±0.3%,因此靶标选择性高达103。
实施例5.利用sep-as/ewa进行kana的高灵敏和高特异性检测。
光纤表面的羟基化、硅烷化、偶联、封闭和还原等步骤同实施例1,其中偶联上的核酸适配体为nh2-kana。在进行卡那霉素的工作曲线实验时,实验前应向分别通入0.1%的tween80和0.5%的sds,破坏光纤表面的卡那霉素的核酸适配体形成的g-四链体结构。
在缓冲溶液3中配置不同终浓度的kana标准溶液(0pm,1pm,10pm,100pm,1nm,10nm,100nm)。分别与100nm荧光修饰的互补链(c-kana-cy5.5)混合,依次由低浓度到高浓度通入倏逝波光纤传感器中,每次测试完成后进行界面再生,清洗干净管道,使其荧光信号降到基线。记录不同浓度下荧光随时间的变化,以不同靶标浓度下相对荧光信号减小百分比值为纵坐标绘制工作曲线。
分别配置终浓度为10nm的dbp和sdm的混合溶液、100nm的sdm进行靶标选择性测试。
结果如图7a-7c所示,相对荧光信号减小百分比值与kana浓度的对数成正比,线性相关系数r2为0.9792,按照3倍信噪比得出的检出限为5.0pm。该灵敏度比我们之前报道的kana倏逝波传感器(biosens.bioelectron.2018,102,646–651)的检出限还要低5400倍,比电化学传感器(electrochimicaacta,2015,182,516–523)的检出限还要低200倍。该传感器具有极高的靶标选择性(>103)。
实施例6.按照本发明的方法测定饮用水中添加的dehp。
光纤表面的羟基化、硅烷化、偶联、封闭和还原等步骤同实施例1,测定方法同实施例3。检测样品的荧光值,计算不同浓度样品(0.1nm,10nm,100nm)的荧光降低值与dehp工作曲线对比(图4b),确定样品中dehp的浓度,把样品的浓度与标准加入的浓度对比,计算出回收率。
结果如表2所示,按照本发明方法测定的dehp的浓度与真实值一致,回收率88.5~106%。表明该方法可以适用于较复杂环境下dehp的检测。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种特异识别链霉素的核酸适配子及其在链霉素检测中的应用
- 用于识别结缔组织生长因子的核酸适配子及其应用
- 结合丁型肝炎病毒的核酸适配子及其应用
- 可适配的pci-e控制器核及其方法
- 一种心肌肌钙蛋白i核酸适配子及其应用、试剂盒的制作方法
- 一种与人表皮生长因子受体iii型突变体特异性结合的核酸适配子及其应用的制作方法
- 用于海产品中有机砷化物检测的基于核酸适配子的分子印迹膜电极的制备方法及应用的制作方法
- 基于核酸适配子的海产品中有机砷化物分子印迹膜基片及其制备方法和应用的制作方法
- 一种基于核酸适配子的海产品中有机砷化物分子印迹柱的制备方法及应用的制作方法
- 用于海产品中有机砷化物检测的基于核酸适配子的分子印迹膜电极的制作方法