三元正极材料的残碱含量检测方法及其应用与流程
本发明涉及锂离子电池材料技术领域,具体而言,涉及三元正极材料的残碱含量检测方法及其应用。
背景技术:
ncm三元材料综合了licoo2、linio2和limno2三种材料的优点,被认为目前最有前景的新型正极材料,也是目前锂离子正极材料的主流产品之一,但在生产过程中考虑到锂的挥发,材料生产过程中往往会加入过量的碳酸锂,导致材料烧结后残留部分碳酸锂及副产物氢氧化锂,简称残碱。如果三元材料的碱性过高,加工过程中就会带来一定的难度,特别是残碱中氢氧化锂的含量过高会使浆料粘度过大,甚至结成果冻,导致加工性能变差,所以必须控制材料的氢氧化锂等残碱的含量,实际应用中一般都是采用滴定法进行检验,因为方法的局限性,检验的物质一般只能是氢氧化锂和碳酸锂。
但是,随着三元材料改性,两性金属氧化物包覆或掺杂体系越来越普遍,两性金属氧化物的残留会在电池制备过程中影响其电解液的体系,因此,如何实现从含有oh-、co32-等多种碱性物质的残碱体系中特异性地对两性金属氧化物对应的碱性离子进行检测,是本领域的难题。此外,现有残碱检测方法未涉及两性金属氧化物对残余碱结果的影响,进而也导致对oh-、co32-的检测结果不准确。
鉴于此,特提出本发明。
技术实现要素:
本发明的目的在于提供三元正极材料的残碱含量检测方法及其应用,以提高对含有两性金属氧化物的三元正极材料的残余碱检测的特异性和准确性。
本发明是这样实现的:
发明人发现通过现有的滴定法来检测残碱含量,其电位滴定的方法和计算公式均局限于仅对氢氧化锂和碳酸锂进行测定,没有考虑到包覆或掺杂有两性金属氧化物的三元正极材料的情况,而如何在含有oh-、co32-等多种碱性物质的残碱体系中特异性地对两性金属氧化物对应的碱性离子进行检测,以达到对两性金属氧化物残留量的准确控制,其对于本领域来说,是需要克服的一个难题。此外,在现有的残碱检测过程中,三元正极材料表面的两性金属氧化物也会对滴定结果中co32-、oh-检测含量的影响,进而导致对co32-、oh-的含量的测定会出现偏差。发明人基于以上问题的发现,对现有的滴定法进行研究和分析,发现造成以上问题的原因在于:现有的电位滴定法是根据co32-、oh-的反应情况和实际经验,先选定两个ph值范围,设定两个等当终点(即会对应两个突跃终点),在两个ph值范围内出现两个突跃终点来进行操作。而对于含铝(两性金属氧化物)或含其他弱碱三元材料,如果使用电位滴定仪检测残碱,得到的等当终点将不再是2个,如果还采用现有的检测手段即使用电位滴定仪先ph刷选后,其结果会严重失真,并且无法获得两性金属氧化物的含量。
因此,发明人基于含有两性金属氧化物的碱性离子、oh-、co32-等多种碱性物质的残碱体系,并结合阴离子电离常数为基础进行分析,即碳酸的二级电离:ka2=c(co32-)×c(h+)/c(hco3-)=5.6×10-11,x(oh)3的溶度积常数<碳酸的二级电离常数,x代表材料中添加的两性物质(如al(oh)3的酸式溶度积常数分别为:ksp=c(h+)×c(alo2-)=1.6×10-13);进一步分析得到,当溶液中含有碱性阴离子alo2-、co32-、oh-时,其酸碱反应过程为(两性元素以al为例):
第一个突跃终点:h++oh-=h2oalo2-+h++h2o=al(oh)3
co32-+h+=hco3-
第二个突跃终点:hco3-+h+=h2o+co2
第三个突跃终点:al(oh)3+3h+=al3++3h2o
通过对以上反应过程的分析,发明人以此为理论基础对现有的电位滴定法的操作和计算公式进行了改进,提出了以下方案:
第一方面,本发明实施例提供一种三元正极材料的残碱含量检测方法,其包括:
采用电位滴定仪的无窗口评估模式对三元正极材料的浸出液进行酸碱滴定,其中,所述三元正极材料含有两性金属氧化物;
记录所述电位滴定仪滴定至第二个突跃终点时的酸性溶液消耗体积v2和滴定至第三个突跃终点时的酸性溶液消耗体积v3;
根据以下公式计算所述两性金属氧化物对应的碱性离子的含量:
x%=(v3-v2)*c*(m+16*x)/a*100%/w(1)
其中,式(1)中的x为所述两性金属氧化物对应的碱性离子;x为所述碱性离子中的氧原子个数;a为所述两性金属氧化物的碱性离子中的金属元素的价键数;w为所述三元正极材料的浸出液对应的三元正极材料的质量;c为酸性溶液h+的摩尔浓度。
上述方案通过采用了无窗口评估模式来进行滴定,其不同于现有技术中的对ph筛选来设定选定的两个特定突跃终点,而是通过酸性溶液的不断滴定自动出现第一个突跃终点、第二个突跃终点以及第三个突跃终点,并分别对应上述三个阶段的反应过程。因此,通过记录达到第二突跃终点和第三个突跃终点的酸性溶液消耗的体积v2和v3结合对应的反应过程的反应式,可以准确地在含有oh-、co32-等多种碱性物质的残碱体系中特异性地对两性金属氧化物对应的碱性离子进行检测。该方法以阴离子电离常数或溶度积常数为理论基础,自动电位滴定仪为主要设备,采取分步滴定进行检测,不需要掩蔽两性阴离子,方法简单易行,测试结果准确性高。
需要说明的是,自动电位滴定仪的无窗口模式是指不对ph值进行筛选,而是直接让电位滴定仪进行滴定依次出现突跃终点,一些实施方式中,也可以对设置一个上限。例如,设置等当点个数<4个。
进一步地,在可选的实施方式中,还包括在酸碱滴定过程中,记录所述电位滴定仪滴定至第一个突跃终点时的酸性溶液消耗体积v1,且通过以下式(2)和式(3)计算co32-和oh-含量:
co32-=(v2-v1)*c*60*100%/w(2)
oh-=((2v1-v2)-(v3-v2)/a)*17*100%/w(3)
其中,式(2)和式(3)中的a为所述两性金属氧化物的碱性离子中的金属元素的价键数;w为所述三元正极材料的浸出液对应的三元正极材料的质量;c为酸性溶液h+的摩尔浓度。
通过上述技术公式可以充分考虑到三次出现突跃终点的反应过程中的化学反应,特别是两性金属氧化物参加的化学反应,进而在对co32-和oh-的计算过程中,数据更加准确。根据检测过程中记录的v1、v2和v3带入上述公式中可以快速算出对应的残碱含量,且结果准确可靠。
需要说明的是,在上述公式的应用过程中需要调整单位的一致性,例如,w的单位可以为g,v1、v2和v3的单位为ml,c的浓度为mol/l,c的浓度在计算时需要换算为mol/ml。
在可选的实施方式中,两性金属氧化物为三氧化二铝,式(1)、式(2)和式(3)分别为:
alo2-%=(v3-v2)*c*58.98/3*100%/w(1)
co32-=(v2-v1)*c*60*100%/w(2)
oh-=((2v1-v2)-(v3-v2)/3)*17*100%/w(3)
其中,式(1)、(2)和(3)中的w为三元正极材料的浸出液对应的三元正极材料的质量;c为酸性溶液h+的摩尔浓度。w的单位可以为g,v1、v2和v3的单位可为ml,c的浓度可为mol/l,c的浓度在计算时需要换算为mol/ml。
进一步地,发明人发现在溶液反应过程中处于敞口状态,溶液与空气接触,会导致co2会对结果造成一定程度的影响,因此,在可选的实施方式中,为了避免敞口时间对结果的影响,将其造成的偏差也计算在内,对两性金属氧化物为三氧化二铝时的计算公式进行了修正,即在进行检测操作时,还包括记录反应过程溶液敞口时间t,单位为min,两性金属氧化物为三氧化二铝时,将式(1)、(2)和(3)修正为:
alo2-%=(v3-v2)*c*58.98/3*100%/w(1)
co32-=(v2-v1)*c*60*100%/w-0.00066t(2)
oh-=((2v1-v2)-(v3-v2)/3)*17*100%/w+0.00044t(3)
其中,式(1)、(2)和(3)中的w为三元正极材料的浸出液对应的三元正极材料的质量;c为酸性溶液h+的摩尔浓度。优选地,溶液敞口时间t为2~5min。
在可选的实施方式中,滴定至第一个突跃终点时,反应溶液ph值为8~9;滴定至第二个突跃终点时,反应溶液的ph值为4~5;滴定至第三个突跃终点时,反应溶液的ph值为3~4。通过出现突跃终点时记录的ph值,并通过上述对应关系进行核对,可以充分保证出现的突跃终点是需要的三个突跃终点,进而保证计算结果的准确性。
进一步地,三元正极材料的浸出处理也会在一定程度上影响最终结果的准确性,浸出越充分,并且不带入反应离子,其结果更加准确。因此,在可选的实施方式中,三元正极材料的浸出液通过以下步骤得到:
将三元正极材料与纯水混合搅拌,优选地,搅拌温度为22~28℃,搅拌时间为20~30min,优选地,纯水为蒸馏水、ro水或up水;优选地,三元正极材料与纯水的比例为10~20g:90~100ml。通过上述温度和搅拌时间以及固液比可以使得三元正极材料能够充分浸出,同时上述温度也不会对材料本身的性能造成影响。搅拌过程中可以在混合液中加入聚四氟乙烯磁子,以使得搅拌浸出效果更好。此外,采用纯水对三元正极材料进行浸出操作,可以尽可能避免在水中含有碳酸根离子对测试的结果产生影响。ro水和up水是通过纯水机制得的纯水和超纯水。
需要说明的是,在实际应用中,如果需要缩短材料水洗时间,可适当提高纯水温度或减少称样重量,确保材料残碱能全部溶于水中。
进一步地,在使用自动电位滴定仪时,需要选择合适量的测试液体以保证测试的准确性,因此,在可选的实施方式中,进行酸碱滴定的浸出液的量取体积为10~20ml。需要说明的是,在对三元正极材料进行浸出时,得到的浸出液不一定完全用于检测,因此,需要根据量取的体积,对应算出对应的三元正极材料的质量,来代入计算公式中。
在可选的实施方式中,酸性溶液的h+的摩尔浓度为0.01~0.03mol/l,优选地,酸性溶液为盐酸。
在可选的实施方式中,采用电位滴定仪的无窗口评估模式进行酸碱滴定时,设置等当点个数小于4。通过上述设置可以使得不用对后续出现的一些特殊的突跃终点不用再进行观察,避免产生干扰。
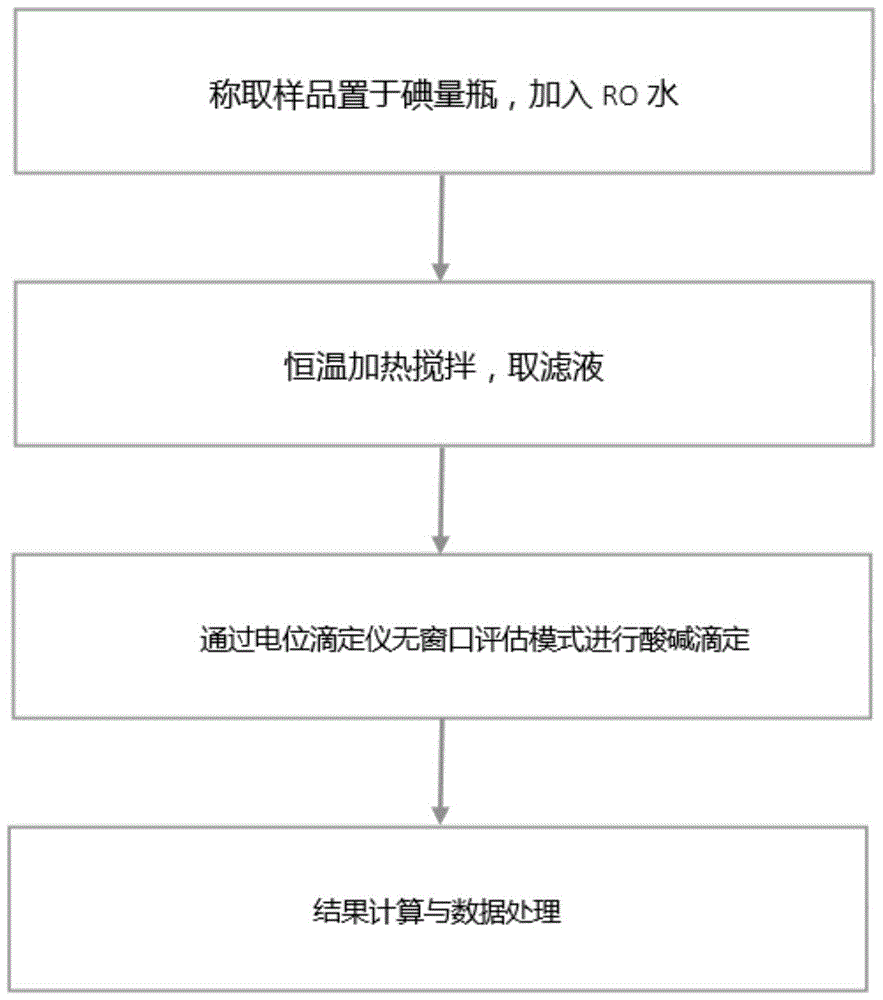
在一些实施方式中,可以采用如图1所示的检测流程图进行检测操作。
第二方面,本发明实施例提供如前述实施方式任一项的三元正极材料的残碱含量检测方法在锂离子电池制造过程中的应用。
通过对两性金属氧化物对三元正极材料残碱的影响进行考虑,重新获得上述检测方法和计算公式,进而使得对有两性金属氧化物包覆或掺杂的三元正极材料的残碱的检测更加准确客观,且操作更为简单方便。
本发明具有以下有益效果:通过电位滴定仪的无窗口评估模式对三元正极材料的浸出液进行酸碱滴定,可以依次出现三个突跃终点,通过记录达到第二突跃终点和第三个突跃终点的酸性溶液消耗的体积v2和v3,带入计算公式(1)中,实现从含有oh-、co32-等多种碱性物质的残碱体系中特异性地对两性金属氧化物对应的碱性离子进行检测,不需要掩蔽两性阴离子,方法简单易行。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明一种实施方式的三元正极材料的残碱含量检测方法的流程图;
图2为敞口时间对残碱分量的影响图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。本发明实例所用材料为含铝正极材料,但本发明所涉及的材料不只是包含铝包覆或掺杂的三元正极材料,其它碱性物质的检测只要使用本方法思路的都应纳入其保护范围。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供的一种三元正极材料的残碱含量检测方法,对一种含铝523型三元材料(其为湖南升华科技有限公司生产的三元材料n5c,添加的两性物质为al)进行检测,包括以下步骤:
s01:称取样品10.00g置于250ml碘量瓶,加入ro水100ml。
s02:加入型号为c50(长度为50mm)的聚四氟乙烯磁子,25℃恒温搅拌30min。
s03:普通中性滤纸过滤,用移液管移取溶液10ml至100ml烧杯,加入ro水40ml,得到待检测溶液。
s04:配制浓度为0.03mol/l的标准盐酸,装入玻璃瓶,放入自动电位滴定仪上,打开自动电位滴定仪,设置等当点个数<4个,采取无窗口评估,对待检测溶液进行酸碱滴定,记录滴定至第一个突跃终点时的酸性溶液消耗体积v1、滴定至第二个突跃终点时的酸性溶液消耗体积v2和滴定至第三个突跃终点时的酸性溶液消耗体积v3。
s05:计算残碱分量:
①使用公式(1)计算样品中alo2-含量:
alo2-%=(v3-v2)*c*58.98/3*100%/w,
本实施例简化后为:alo2-%=(v3-v2)*c*0.655%
②使用公式(2)计算样品中co32-含量:
co32-=(v2-v1)*c*60*100%/w
本实施例简化后为:co32-%=(v2-v1)*c*2%
③使用公式(3)计算样品中oh-含量:
oh-=((2v1-v2)-(v3-v2)/3)*17*100%/w
本实施例简化后为:oh-%=(6v1-2v2-v3)*c*0.189%。
实施例2
本实施例提供的一种三元正极材料的残碱含量检测方法,对一种含铝622型三元材料进行检测(其为湖南升华科技有限公司生产的三元材料n6d,添加的两性物质为al),包括以下步骤:
s01:称取样品10.00g置于250ml碘量瓶,加入ro水100ml。
s02:加入型号为c50(长度为50mm)的聚四氟乙烯磁子,25℃恒温搅拌30min。
s03:普通中性滤纸过滤,用移液管移取溶液10ml至100ml烧杯,加入ro水40ml。
s04:配制浓度为0.02mol/l的标准盐酸,装入玻璃瓶,放入自动电位滴定仪上,打开自动电位滴定仪,设置等当点个数<4个,采取无窗口评估,对待检测溶液进行酸碱滴定,记录滴定至第一个突跃终点时的酸性溶液消耗体积v1、滴定至第二个突跃终点时的酸性溶液消耗体积v2和滴定至第三个突跃终点时的酸性溶液消耗体积v3。
s05:计算残碱分量:
④使用公式(1)计算样品中alo2-含量:
alo2-%=(v3-v2)*c*58.98/3*100%/w,
本实施例简化后为:alo2-%=(v3-v2)*c*0.655%
⑤使用公式(2)计算样品中co32-含量:
co32-=(v2-v1)*c*60*100%/w
本实施例简化后为:co32-%=(v2-v1)*c*2%
⑥使用公式(3)计算样品中oh-含量:
oh-=((2v1-v2)-(v3-v2)/3)*17*100%/w
本实施例简化后为:oh-%=(6v1-2v2-v3)*c*0.189%。
对比例1-1:
该对比例1检测一种含铝523型三元正极材料(和实施例1中的材料相同)的残碱含量,具体操作步骤为:称取样品10g,置于250ml碘量瓶中,加入纯水100ml,加入型号为c50(长度为50mm)的聚四氟乙烯磁子,25℃恒温搅拌30min,中性滤纸过滤后取滤液10ml,使用浓度c=0.03mol/l的盐酸进行酸碱滴定,ph∈(8,9)时的最后一个电位突跃终点作为第一个突跃终点,ph∈(4,5)时的最后一个电位突跃终点作为第二个突跃终点,记录第一个突跃终点、第二个突跃终点盐酸使用体积,计算出残碱的碳酸根、氢氧根分量,计算公式为:
co32-=(v2-v1)*c*60*2%
oh-%=(2v1-v2)*c*0.189%。
对比例1-2:
该对比例1-2检测一种含铝523型三元正极材料(和实施例1中的材料相同)的残碱含量,具体操作步骤为:称取样品20g,置于250ml碘量瓶中,加入纯水100ml,加入型号为c50(长度为50mm)的聚四氟乙烯磁子,25℃恒温搅拌30min,中性滤纸过滤后取滤液10ml,使用浓度c=0.03mol/l的盐酸进行酸碱滴定,记录滴定至第一个突跃终点时的酸性溶液消耗体积v1、滴定至第二个突跃终点时的酸性溶液消耗体积v2和滴定至第三个突跃终点时的酸性溶液消耗体积v3。
alo2-%=(v3-v2)*c*58.98/3*100%/w
co32-=(v2-v1)*c*60*100%/w
oh-=((2v1-v2)-(v3-v2)/3)*17*100%/w
对比例2-1:
该对比例2-1检测一种含铝622型三元正极材料(和实施例2中的材料相同)的残碱含量,具体操作步骤为:称取样品10g,置于250ml碘量瓶中,加入纯水100ml,加入型号为c50(长度为50mm)的聚四氟乙烯磁子,25℃恒温搅拌30min,中性滤纸过滤后取滤液10ml,使用浓度c=0.02mol/l的盐酸进行酸碱滴定,ph∈(8,9)时的最后一个电位突跃终点作为第一个突跃终点,ph∈(4,5)时的最后一个电位突跃终点作为第二个突跃终点,记录第一个突跃终点、第二个突跃终点盐酸使用体积,计算出残碱的碳酸根、氢氧根分量,计算公式为:
co32-=(v2-v1)*c*60*2%
oh-%=(2v1-v2)*c*0.189%。
对比例2-2:
该对比例2-2检测一种含铝622型三元正极材料(和实施例2中的材料相同)的残碱含量,具体操作步骤为:称取样品20g,置于250ml碘量瓶中,加入纯水100ml,加入型号为c50(长度为50mm)的聚四氟乙烯磁子,25℃恒温搅拌30min,中性滤纸过滤后取滤液10ml,使用浓度c=0.03mol/l的盐酸进行酸碱滴定,记录滴定至第一个突跃终点时的酸性溶液消耗体积v1、滴定至第二个突跃终点时的酸性溶液消耗体积v2和滴定至第三个突跃终点时的酸性溶液消耗体积v3。
alo2-%=(v3-v2)*c*58.98/3*100%/w
co32-=(v2-v1)*c*60*100%/w
oh-=((2v1-v2)-(v3-v2)/3)*17*100%/w
需要说明的是,以上实施例1、2和对比例1-1、1-2、2-1、2-2进行敞口滴定的时间为5min。
实施例1、2和对比例1-1、1-2、2-1、2-2的计算结果如表1所示:
表1
通过以上数据可知,实施例1中的偏铝酸根离子的百分比含量加上氢氧根离子的百分比含量大约等于或接近对比例1中的氢氧根离子的含量,碳酸根离子的含量接近于相等;实施例2中的偏铝酸根离子的百分比含量加上氢氧根离子的百分比含量大约等于或接近对比例2中的氢氧根离子的含量,碳酸根离子的含量接近于相等。因此,可知本申请中的检测方法获得数据与对比例1和对比例2采用的检测方法具有一致性,并且对于氢氧根离子的检测更为准确,很明显的看出,对比例1和对比例2忽略了偏铝酸根离子在反应中对氢氧根离子检测造成的偏差。
对于方案中的参数设计问题,由表1可以得到,随着固液比的增高,残碱含量高的材料测试结果会偏低,残碱含量低的材料则影响不大,另一方面,如果固液比过低,会导致滴定体积小于10ml,此时滴定误差偏大,所以优选地,三元正极材料与纯水的比例为10~20g:90~100ml,盐酸量取体积不影响最终的检测结果,但为了方便起见,一般采用10/20ml的移液管量取,匹配的盐酸摩尔浓度为0.01~0.03mol/l。
此外,考虑到检测过程中二氧化碳对结果的影响,如果对检测数据要求严格的话,可将溶液反应过程的敞口时间对结果的影响偏差计算在内。图2为考察溶液敞口时间对残碱分量的影响实例,其中,图2中的c1为不同时间碳酸根的测量值,c2为不同时间氢氧根的测量值,t为敞口时间。具体是:称取样品10g,置于250ml碘量瓶中,加入纯水mml,搅拌30min,中性滤纸过滤后取滤液10ml,使用浓度c=0.02mol/l的盐酸,按照敞口时间梯度10min、20min、30min、40min、50min、60min以无窗口评估模式进行酸碱滴定,分别记录第一个突跃终点、第二个突跃终点、第三个突跃终点消耗的盐酸体积,计算出残碱分量,计算公式可修正为:
alo2-%=(v3-v2)*c*58.98/3*100%/w(1)
co32-=(v2-v1)*c*60*100%/w-0.00066t(2)
oh-=((2v1-v2)-(v3-v2)/3)*17*100%/w+0.00044t(3)
其中,v1为第一个突跃终点消耗的盐酸体积,v2为第二个突跃终点消耗的盐酸体积,v3为第二个突跃终点消耗的盐酸体积,c为标准盐酸浓度,w为三元正极材料的浸出液对应的三元正极材料的质量。
综上所述,本发明实施例的检测方法很好的从含有oh-、co32-等多种碱性物质的残碱体系中特异性地对两性金属氧化物对应的碱性离子进行检测的问题,且操作过程不需要掩蔽两性阴离子,方法简单易行。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!