一种蛋白质水解度测定方法与流程
本发明属于产品检验技术领域,涉及一种蛋白质水解度测定方法。
背景技术:
寡肽是由2-10个氨基酸构成的多肽,具有较高的营养价值和保健功能,是多肽产品中最具经济价值的成分。在酶解蛋白、制备多肽的过程中,为了提高寡肽含量,需要控制蛋白质的酶解程度,尽可能减少游离氨基酸和大分子肽的含量。因此,为了控制酶解反应过程,通常以多肽含量、游离氨基酸含量、水解度以及多肽分子量分布为指标对多肽产品进行表征。
多肽含量是指含有2-50个氨基酸的肽的含量,通常利用三氯乙酸沉淀水解液中的大分子蛋白,继而以凯氏定氮法测定氨基酸含量,减去游离氨基酸含量即为多肽含量。游离氨基酸含量测定有高效液相色谱法、离子交换色谱法、气相色谱法和毛细管电泳法,其中柱前衍生高效液相色谱法具有分析时间短、灵敏度高等优点,是目前应用最广泛的测定方法。水解度是指蛋白质分子水解断裂的肽键与总肽键的比例,常用的测定方法有茚三酮比色法、甲醛滴定法、ph-stat法等。多肽分子量分布主要采用高效凝胶过滤色谱法,它具有高效、高速、高灵敏度的特点,是一种快速、微量测定多肽分子量分布的方法,如专利cn106309372a通过高效凝胶色谱法测定牛骨多肽分子量分布。
在生产过程中,为了控制酶解程度,需要分别测定多肽产品的各项指标,这不仅增加了生产难度,而且浪费时间、不能连续测定。因此,需要开发一种可以同时检测蛋白质水解度、多肽和游离氨基酸含量的方法,以适用于工业化生产时的快速实时检测。
技术实现要素:
针对目前缺少同时检测蛋白质水解度、多肽和游离氨基酸含量的方法的问题,本发明提供一种蛋白质水解度测定方法,无需特殊设备、方法简单、可靠性高。
为实现上述目的,本发明采用如下技术方案。
一种蛋白质水解度的测定方法,包括以下步骤:
(1)将水解后的蛋白质溶液用缓冲液稀释成适当浓度的蛋白水解液;
(2)将蛋白水解液以高效凝胶过滤色谱法测定多肽分子量分布,计算不同分子量范围多肽的质量百分含量xa,其中,a为分子量;
(3)结果与计算:
(a)样品中的多肽含量,按照下式计算:
多肽含量(%)=σxa,
其中a=200da-10000da;
(b)样品中游离氨基酸的含量,按照下式计算:
游离氨基酸含量(%)=xa,
其中a<200da;
(c)蛋白水解度,按照下式计算:
蛋白水解度(%)=σ(128xa/a’),
其中128为氨基酸平均分子量,
a’为不同分子量范围多肽的平均分子量。
步骤(1)中,蛋白水解液的浓度为20-200mg蛋白/ml。
步骤(1)中,所述缓冲液的ph为6.5-8.0;所述缓冲液的浓度为20-50mmol/l(mm)。优选的,所述缓冲液选自磷酸盐缓冲溶液(pbs缓冲液),磷酸缓冲溶液(pb缓冲液),britton-robinson广泛缓冲溶液,clark-lubs缓冲溶液,tris-hcl缓冲溶液。
步骤(2)中,可以采用本领域公知的技术手段获得高效凝胶过滤色谱检测条件;优选的,所述高效凝胶过滤色谱法的色谱条件如下:
色谱柱:superdexpeptide10/300gl;
流动相:0.10-0.20mnacl、20-50mmph7.2磷酸盐缓冲液;
流速:0.2-1.0ml/min;
检测波长:214nm;
压力:不超过1.8mpa;
进样体积:20-100µl。
优选的,上述蛋白质水解度测定方法,还包括制备标准曲线并计算准确多肽含量、游离氨基酸含量和蛋白质水解度含量的步骤:
(i)将一系列不同水解程度的蛋白质标准溶液按照步骤(1)-(3)的方法分别测定游离氨基酸含量、多肽含量和蛋白质水解度;
(ii)将(i)中的一系列不同水解程度的蛋白质标准溶液测定游离氨基酸和多肽的准确含量及准确的蛋白质水解度;
(iii)以(i)中游离氨基酸含量为纵坐标,以游离氨基酸准确含量为横坐标做游离氨基酸含量标准曲线;
以(i)中多肽含量为纵坐标,以多肽准确含量为横坐标做多肽含量标准曲线;
以(i)中蛋白质水解度为纵坐标,以准确的蛋白质水解度为横坐标做蛋白质水解度标准曲线;
(iv)将测定获得的蛋白水解液的游离氨基酸含量、多肽含量和蛋白质水解度分别代入(iii)中的标准曲线,计算获得准确的游离氨基酸含量、多肽含量和蛋白质水解度。
步骤(ii)和(iii)中,所述游离氨基酸含量测定方法可以用纸层析法或柱前衍生高效液相色谱法;
所述多肽含量测定方法可以用双缩脲法、邻苯二甲醛法、紫外吸收法或三氯乙酸法;
所述蛋白质水解度可以用ph-state法,三硝基苯磺酸法、甲醛滴定法或茚三酮比色法。
本发明具有以下优点:
本发明利用高效凝胶过滤色谱法实现对样品中多肽含量、游离氨基酸含量和水解度的同时测定,与传统测定方法比较更加简单、快速。本发明的方法与传统方法的测定结果相关性高、即准确性高,为工业化生产寡肽的过程监测提供了快速、可靠的方法。
附图说明
图1是多肽的分子量标准曲线;
图2是bsa蛋白水解液游离氨基酸含量标准曲线;
图3是大米蛋白水解液游离氨基酸含量标准曲线;
图4是bsa蛋白水解液多肽含量标准曲线;
图5是大米蛋白水解液多肽含量标准曲线;
图6是-nh2基含量标准曲线;
图7是bsa蛋白水解液蛋白水解度标准曲线;
图8是大米蛋白水解液蛋白水解度标准曲线。
具体实施方式
下面结合实施例和附图对本发明做进一步说明,但本发明不受下述实施例的限制。
实施例1蛋白水解液的制备
取一定量的牛血清白蛋白(bsa)和大米蛋白于50℃20mmph8.0磷酸盐缓冲溶液中,配置成浓度为10mg/ml的蛋白溶液,加入蛋白质量1%浓度的胰蛋白酶,酶解1h,2h,3h,4h,5h,6h时分别取10ml样品,样品取出后立刻置于100℃水浴10min灭酶处理,获得不同水解度的蛋白质水解样品。
实施例2蛋白质水解度测定
将实施例1中的蛋白水解样品以高效凝胶过滤色谱法测定多肽分子量分布,并计算蛋白质水解度:
(1)多肽分子量标准曲线:将标准分子量的多肽:细胞色素c(mw12500)、抑肽酶(mw6512)、氧化型谷胱甘肽(mw615)、还原型谷胱甘肽(mw310)、甘氨酸(mw6512)、抑肽酶(mw75)分别以20mmph8.0磷酸盐缓冲溶液配制成浓度为10mg/ml的溶液;
(2)色谱条件:色谱柱:superdexpeptide10/300gl;流动相:0.15mnacl、50mmph7.2磷酸盐缓冲液;检测波长:214nm;流速:0.5ml/min;压力:不超过1.8mpa;洗脱体积:30ml(60min);进样体积:50µl;柱温:室温;
(3)检测:将实施例1中不同水解度的蛋白质水解液和标准分子量的多肽溶液按照步骤(2)中的色谱条件进行检测;
(4)样品分子量分布的计算方法:用aglientg2182aagpc数据处理软件(a.02.02),将样品的色谱数据代入多肽分子量标准曲线中进行计算,即可得到样品的分子量分布范围。用峰面积归一法按下式计算不同分子量范围肽的相对百分比:
式中:
xa—试样中某相对分子质量肽段所占肽段的质量分数%
a—某相对分子质量肽段的峰面积;
a总—各相对分子质量肽段的峰面积之和。
(5)蛋白水解液中多肽含量、游离氨基酸含量和蛋白水解度计算:
(a)样品中的多肽含量,按照下式计算:
多肽含量(%)=σxa
其中a=200da-10000da;
(b)样品中游离氨基酸的含量,按照下式计算:
游离氨基酸含量(%)=xa
其中a<200da;
(c)蛋白水解度,按照下式计算:
蛋白水解度(%)=σ(128xa/a’)
其中128为氨基酸平均分子量,
a’为不同分子量范围多肽的平均分子量。
(6)结果
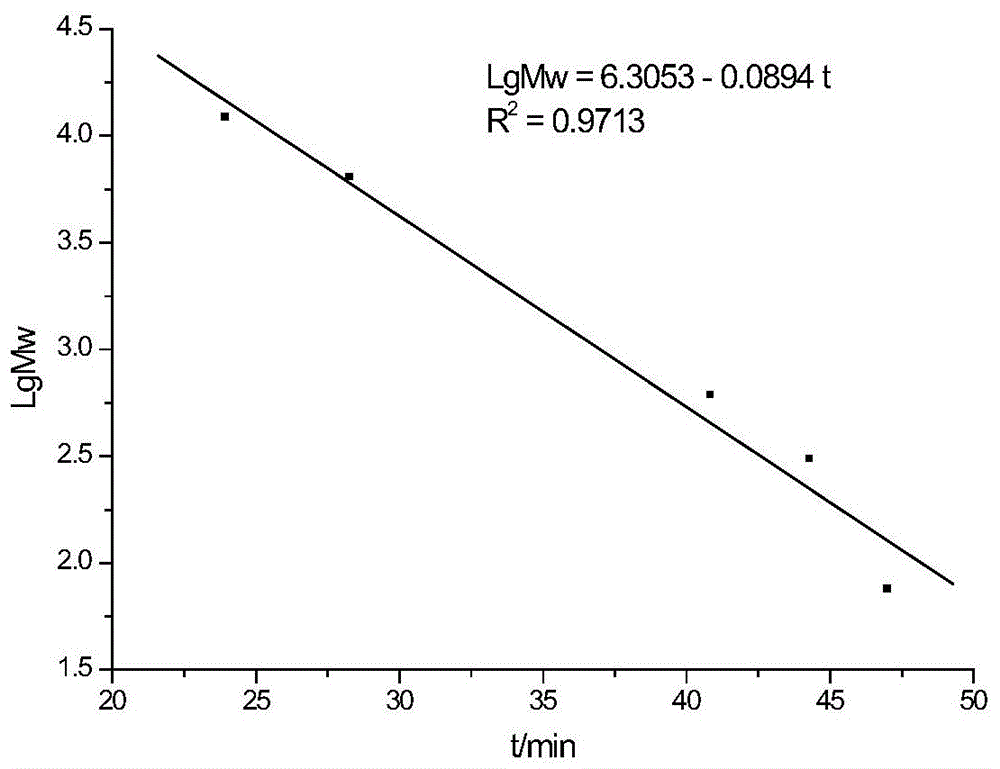
不同标准分子量多肽的保留时间和保留体积结果见表1,作多肽分子量标准曲线lgmw-t,如图1所示,拟合方程为lgmw=6.3053-0.0894t,r2=0.9713;
表1标准分子量多肽的保留时间和保留体积
根据步骤(4)中的公式将样品的色谱数据代入上述方程中进行计算,得到样品bsa和大米蛋白不同酶解时间获得的酶解液中多肽分子量分布,如表2和表3所示:
表2不同酶解时间bsa酶解液的多肽分子量分布
表3不同酶解时间大米蛋白酶解液的多肽分子量分布
根据步骤(5)-(a)的公式和表2和3的数据计算得bsa和大米蛋白不同酶解时间获得的酶解液中多肽含量(%),结果如表4所示:
表4bsa和大米蛋白酶解液的多肽含量
根据步骤(5)-(b)的公式和表2和3的数据计算得bsa和大米蛋白不同酶解时间获得的酶解液中游离氨基酸含量(%),结果如表5所示:
表5bsa和大米蛋白酶解液的游离氨基酸含量
根据步骤(5)-(c)的公式和表2和3的数据计算得bsa和大米蛋白不同酶解时间获得的酶解液中的蛋白水解度(%),其中a’的值分别取12000、8000、4500、2100、700、128,表示>10000da、10000-6000da、6000-3000da、3000-1200da、<200da多肽的平均分子量,结果如表6所示:
表6bsa和大米蛋白酶解液的蛋白水解度
(7)柱前衍生高效液相色谱法测定游离氨基酸含量
正亮氨酸内标溶液:称取正亮氨酸约10mg,加0.1mol/l盐酸溶液10ml溶解。
混合氨基酸标准溶液(表7):准确量取氨基酸标准溶液1.0ml,置于5ml容量瓶中,加0.1mol/l盐酸溶液定容至刻度,稀释5倍。
准确量取氨基酸标准溶液及实施例1中获得的水解蛋白质溶液各200μl,分别置于1.5ml离心管中;往每个离心管中准确加入正亮氨酸内标溶液20μl;分别加入三乙胺乙腈溶液100μl、异硫氰酸苯酯乙腈溶液100μl至每个离心管中,混匀,室温放置1小时;然后加入正己烷400μl至各离心管中,振摇后放置10min;取下层溶液(ptc-aa),用0.45μm针式滤器过滤;取滤液200μl,加800μl水稀释,摇匀,进样10μl。
表7氨基酸标准溶液浓度
色谱条件:venusilaa氨基酸分析柱4.6×250nm,5μm;柱温:40℃;检测波长:254nm;流动相a:称取15.2g无水乙酸钠,加水1850ml,溶解后用冰醋酸调ph至6.5,然后加乙腈140ml,混匀,用0.45μm滤膜过滤;流动相b:80%乙腈水溶液;流动相梯度如下:
按照以下公式计算样品中氨基酸浓度:
某种氨基酸浓度(μg/ml)=f1/f2×c
式中:
f1—样品溶液中某种氨基酸峰面积/内标峰面积;
f2—混合氨基酸标准溶液中各氨基酸峰面积/内标峰面积;
c—某种氨基酸对照品浓度(μg/ml)。
总氨基酸含量(%)=各种氨基酸浓度和×v×10-6×100/w
式中:
v—样品溶液的定容体积(ml);
w—样品的质量(g)。
表8柱前衍生高效液相色谱法测定游离氨基酸含量
由表8中数据结合表5数据可以看出,由于在分子量小于200da的部分存在一些小分子杂质,而凝胶过滤色谱法只能按照分子量大小区分不同物质,不能区分杂质和氨基酸,因此使凝胶过滤色谱法的测定结果略高于柱前衍生高效液相色谱法的测定结果。
分别以表5中的游离氨基酸含量为纵坐标,以表8中游离氨基酸含量为横坐标做标准曲线,bsa蛋白水解液样品如图2所示、大米蛋白水解液样品如图3所示,其拟合曲线分别为y=-0.12352+1.22402x和y=1.6029+0.93429x,其相关系数(r)分别0.9778和0.9910。可以看出,两种测量结果的相关性非常好,说明凝胶过滤色谱法能较为准确的表征氨基酸含量。
(8)三氯乙酸沉淀法测定多肽含量
取10ml样品于试管中,加入10ml10%三氯乙酸溶液,混合均匀,静置30min,于12000rpm离心5min,取上清液,用凯氏定氮法测定多肽含量。根据步骤(7)中测定获得的游离氨基酸含量和下式计算:
式中:
x—多肽的含量(%);
v—样品消耗hcl标准溶液的体积(ml);
v0—空白消耗hcl标准溶液的体积(ml);
n—hcl标准溶液的浓度(mol/l);
0.014—1mol/lhcl标准溶液1ml相当于氮的克数;
m—样品的质量(g);
f—氮的换算系数(大米蛋白为5.95,bsa为6.25)。
表9三氯乙酸沉淀法测定多肽含量
表9数据结合表4数据可知,利用两种方法测定的bsa样品和大米蛋白样品的多肽含量都随着酶解时间的增加呈递增趋势,并且两种方法测定结果相近。
分别以表4中多肽含量为纵坐标,以表9中多肽含量为横坐标做多肽含量的标准曲线,bsa蛋白水解液样品如图4所示、大米蛋白水解液样品如图5所示,其拟合曲线分别为y=-6.96975+1.14191x和y=24.92128+0.70646x,相关系数分别为0.9889和0.9813。由图可以看出,两种测定方法得到的bsa样品和大米蛋白样品多肽含量存在较好的相关性,因此可以利用凝胶过滤色谱法测定并计算出多肽含量,然后利用标准曲线对结果进行校正,得到准确的多肽含量结果。
(9)茚三酮比色法测定蛋白水解度
标准曲线的绘制:取0.1000g干燥过的甘氨酸溶解后定容至100ml,取出2.00ml定容至100ml得20μg/ml的溶液。取此液再分别稀释成含量为2-20μg/ml的溶液用于标准曲线的绘制。取2.00ml测定用稀释液于试管中加入1.00ml显色剂,混匀后沸水浴中加热15min,同时作空白试验;然后冷水冷却,加入5.00ml40%乙醇溶液混匀,放置15min后用1cm比色皿,以空白管调零与570nm处测定a值。
水解蛋白液中-nh2基的测定:取实施例1中获得的水解蛋白质溶液0.50ml定容至50ml,取0.4ml稀释液于试管中并加入1.60ml蒸馏水、1.00ml显色剂,混匀后置于沸水浴中加热15min,同时作空白试验。以后操作同标准曲线。利用标准曲线计算酶解液中-nh2基的含量(μmol/ml),按照下式计算蛋白水解度(dh):
dh(%)=
式中:
n—氮含量,mg/ml;
h—被裂解的肽键数,mmol/g。
标准曲线如图6所示,其拟合曲线为c=0.00101+0.54535a,其相关系数为0.9998,计算得蛋白水解度如表10所示:
表10茚三酮比色法测定蛋白水解度
表10数据和表6数据可知,利用凝胶过滤色谱法和茚三酮比色法测定的bsa样品和大米蛋白样品的蛋白水解度变化趋势相同、结果相近。
分别以表6中的蛋白水解度为纵坐标,以表10中的蛋白水解度为横坐标做标准曲线,bsa蛋白水解液样品如图7所示、大米蛋白水解液样品如图8所示,其拟合曲线分别为y=2.72769+1.07549x和y=-3.68374+1.04719x,其相关系数(r)分别0.97778和0.9798。可以看出,两种测定方法存在较好的相关性。因此可以利用标准曲线对凝胶过滤色谱法的测定结果进行校正,得到准确的蛋白水解度结果。
实施例3蛋白质水解度测定
取一定量的大米蛋白于50℃20mmph8.0磷酸盐缓冲溶液中,配置成浓度为10mg/ml的蛋白溶液,加入蛋白质量1%浓度的胰蛋白酶,酶解6h,取10ml样品,样品取出后立刻置于100℃水浴10min灭酶处理,获得蛋白质水解样品。
将蛋白水解样品以按实施例2所述高效凝胶过滤色谱法测定多肽分子量分布,并计算游离氨基酸含量、多肽含量和蛋白水解度,分别用实施例2中标准曲线校正,得到游离氨基酸含量为14.32%,多肽含量为77.62%,蛋白水解度为23.11%。
- 还没有人留言评论。精彩留言会获得点赞!