一种土壤中硝基多环芳烃及多环芳烃的检测方法与流程
本发明涉及土壤中污染物检测
技术领域:
,具体涉及一种土壤中硝基多环芳烃及多环芳烃的检测方法。
背景技术:
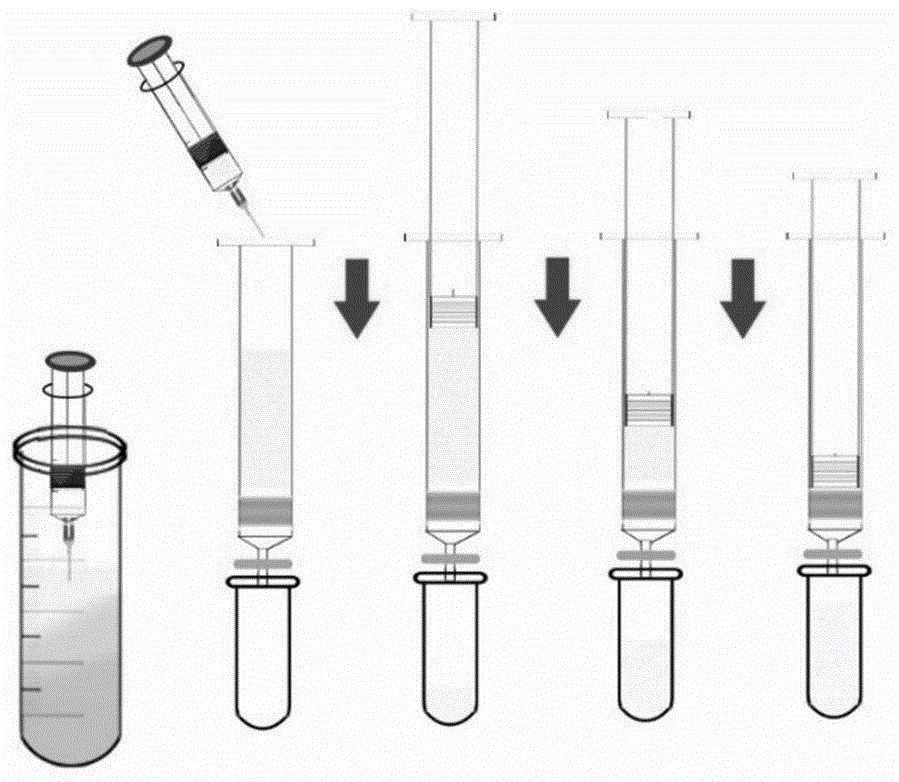
:硝基多环芳烃是多环芳烃的衍生物,通常伴随母体多环芳烃出现且其致畸致癌作用强于母体。例如典型硝基多环芳烃1-硝基芘被国际癌症研究中心(iarc)列为2a级致癌物,其毒性为母体芘的10-104倍。目前,土壤中多环芳烃的检测分析主要是应用气相色谱(gc)和高效液相色谱(hplc)及其串联质谱等仪器进行,但对硝基多环芳烃的检测方法报道很少,主要由于硝基衍生物的含量低,对检测方法灵敏度要求很高。应用色谱质谱等理化分析技术对环境样品中痕量硝基多环芳烃残留进行分析,不仅仪器化程度要求较高,通常需要用索氏提取等前处理,费时费力,同时,对操作人员专业要求较高,前处理过程需要使用大量的有机溶剂,又造成了新的环境污染。技术实现要素:针对现有技术存在的问题,本发明提供了一种土壤中硝基多环芳烃及多环芳烃的检测方法。具体来说,本发明提供了如下技术方案。一种土壤中硝基多环芳烃及多环芳烃的检测方法,其包括以下步骤:(1)提取:向土壤样品中加入正己烷涡旋,离心,取上清液;(2)净化与衍生:将步骤(1)的上清液过m-pfc净化小柱后氮气吹干,然后与荧光衍生化试剂反应生成具有荧光效应的目标物质;(3)hplc-fld测定:采用高效液相色谱-荧光检测器联用法分离检测步骤(2)所述目标物质中的硝基多环芳烃及多环芳烃。优选的,上述检测方法中,所述硝基多环芳烃及多环芳烃选自1-硝基芘、菲、芘、苯并[α]芘中的一种或几种。优选的,上述检测方法中,步骤(1)中,所述正己烷为乙腈饱和的正己烷,所述土壤样品与乙腈饱和的正己烷的质量体积比为1-10g/ml。优选的,上述检测方法中,步骤(1)中,所述涡旋后加入盐析剂,再涡旋,然后进行所述离心,优选的,所述盐析剂为氯化钠,更优选的,所述盐析剂与所述正己烷的质量体积比为0.2-0.6g/ml。优选的,上述检测方法中,步骤(1)中,将加入盐析剂再涡旋后的溶液首先经过超声,然后在进行所述离心。优选的,上述检测方法中,步骤(2)中所述净化具体为:取2ml步骤(1)的上清液从m-pfc净化小柱顶部加入,缓慢推动柱塞杆,即净化完成,更优选的,所述m-pfc净化小柱的填料包含2-3mgmwcnts和30mgc18。优选的,上述检测方法中,步骤(2)中,所述荧光衍生化试剂为含有铁粉的乙酸甲醇溶液,优选的,所述铁粉与乙酸甲醇溶液的质量体积比为10-100mg/ml。优选的,上述检测方法中,步骤(3)中,所述高效液相色谱的流动相包括流动相a和流动相b,所述流动相a为去离子水,所述流动相b为乙腈;采用梯度洗脱,以所述流动相的总体积为100%计,在第0~12min,所述流动相a的体积由70%递减为0%,所述流动相b的体积由30%递增为100%;在第12~17min,所述流动相a的体积为0%,所述流动相b的体积为100%;在第17~17.1min,所述流动相a的体积由0%递增为70%,所述流动相b的体积由100%递减为30%;在第17.1~20min,所述流动相a的体积为70%,所述流动相b的体积为30%;优选的,所述流动相的流速为0.2-1ml/min。优选的,上述检测方法中,步骤(3)中,所述高效液相色谱的色谱柱为十八烷基硅烷键合硅胶色谱柱,优选的,所述十八烷基硅烷键合硅胶色谱柱的规格为150mm×3.0mm,5μm。优选的,上述检测方法中,所述荧光检测器的条件为:0~8.43min的激发波长为240nm,发射波长为435nm;8.43~9.86min的激发波长为240nm,发射波长为370nm;9.86~10.74min的激发波长为240nm,发射波长为390nm;10.74~12.36min的激发波长为240nm,发射波长为390nm。本发明所取得的有益效果:(1)本发明的检测方法特异性强、灵敏度高,避免使用高毒重金属进行衍生,所使用的液相色谱-荧光检测器串联法可同时测定土壤中典型的硝基多环芳烃及多环芳烃;(2)本发明检测方法中样品的前处理过程简单,耗时少,能同时检测大量的样品;(3)本发明检测方法的检测成本远低于传统的仪器检测方法,不需要采用质谱联用等昂贵检测技术,对解决大批量样品的多环芳烃及其硝基衍生物技术具有重要的现实意义。附图说明图1为实施例1中m-pfc净化步骤示意图。图2为1-硝基芘衍生前后的液相色谱图。图3为1-氨基芘、菲、芘、苯并[α]芘的荧光激发光谱和荧光发射光谱。图4为1-氨基芘、菲、芘、苯并[α]芘液相色谱图。具体实施方式以下结合具体实施例对本发明作进一步详细说明,但不用来限制本发明的范围。在下面的实施例中,所用的各试剂和仪器的信息如表1所示。表1实施例中所用试剂和仪器信息表实施例1(1)土壤样品的制备:采集土壤样品1kg,自然风干后研磨,过2mm筛后混合均匀,并置于通风干燥处保存。(2)提取:称取10g步骤(1)的土壤样品,加10ml乙腈饱和的正己烷提取,涡旋1min后,加入4g氯化钠,再涡旋1min,超声15min,6000转/分的转速离心10min,取2ml上清液备用。(3)净化:如图1所示,将步骤(2)取出的2ml上清液从m-pfc净化小柱(填充物为2mg(mwcnts)+30mgpsa+30mgc18+80mgmgso4)顶部加入,缓慢推动柱塞杆,即净化完成。(4)衍生:将净化后的溶液用氮气吹干,然后加入10mg铁粉和0.2ml乙酸甲醇溶液(乙酸和甲醇的体积比为3:17),震荡20分钟后13800rpm离心10min,取上层溶液待测。衍生后1-硝基芘产物为1-氨基芘,具有强荧光性。由图2可知,通过与与1-氨基芘标准品(1-apstd)进行对比(保留时间)可知,1-硝基芘(1-np(beforereaction)衍生后全部转化为1-氨基芘(1-ap),衍生反应效率高于99%。(5)准曲线的绘制:标准贮备液:称取1-硝基芘、菲、芘、苯并[α]芘标准品各10mg,精密称定,分别置于100ml容量瓶中,加甲醇适量使溶解并定容至刻度,配制成标准储备液,-20℃保存,有效期为6个月。混合标准储备溶液:分别精密量取上述1-硝基芘和苯并[α]芘标准储备液各10ml,取菲和芘标准储备液各20ml于100ml容量瓶中,用甲醇定容至刻度,配制成混合工作液,4℃保存,有效期为1个月。基质混合标准工作溶液:基质混合标准工作溶液是将空白土壤样品经步骤(2)提取、步骤(3)净化处理后加入混合标准储备溶液后配成不同浓度梯度的基质混合标准工作溶液,用做标准工作曲线,基质混合标准工作溶液应现配现用。由高效液相色谱-荧光检测器测定步骤(4)衍生处理后的不同浓度梯度的基质混合标准工作溶液,记录峰面积,外标法绘制标准曲线,结果见表2。使用低浓度(1-硝基芘、菲和芘分别为3μg/l,苯并[α]芘为0.3μg/l)基质混合标准工作溶液进样7次后,根据3倍信噪比(s/n)得出各化合物的方法检测限。表2方法线性范围及灵敏度由表2可知,1-硝基芘在0-500μg/l范围内,线性回归方程为y=3.8x+49.9,相关系数r2为0.9954,检测限为0.53μg/l。菲在0-500μg/l范围内,线性回归方程为y=1.4x-15.8,相关系数r2为0.9995,检测限为1.53μg/l。芘在0-500μg/l范围内,线性回归方程为y=3.0x-10.9,相关系数r2为1,检测限为0.96μg/l。苯并[a]芘在0-500μg/l范围内,线性回归方程为y=6.9x-15.6,相关系数r2为0.9997,检测限为0.13μg/l。高效液相色谱测定条件如下:色谱柱:gracesmartc18色谱柱(150×3.0mm,5μm,agilent);流动相a:水;流动相b:乙腈;柱温:40℃;流速:0.4ml/min;进样量:10μl;采用梯度洗脱,以所述流动相的总体积为100%计,在第0~12min,所述流动相a的体积由70%递减为0%,所述流动相b的体积由30%递增为100%;在第12~17min,所述流动相a的体积为0%,所述流动相b的体积为100%;在第17~17.1min,所述流动相a的体积由0%递增为70%,所述流动相b的体积由100%递减为30%;在第17.1~20min,所述流动相a的体积为70%,所述流动相b的体积为30%。荧光检测器测定条件:0~8.43min的激发波长为240nm,发射波长为435nm;8.43~9.86min的激发波长为240nm,发射波长为370nm;9.86~10.74min的激发波长为240nm,发射波长为390nm;10.74~12.36min的激发波长为240nm,发射波长为390nm。(6)hplc-fld测定:取步骤(4)衍生后的上层溶液,采用高效液相色谱-荧光检测器联用法进行检测,然后通过外标法计算得到各物质的上机浓度,根据公式:式中:ρ—待测溶液中物质的浓度,μg/l;v—待测溶液的总体积,l;m—土壤样品的质量,g;f—稀释倍数;计算得土壤样品中各物质的含量。试验例1加标回收率实验取空白土壤样品,按低、中、高3种添加水平进行加标回收率实验,进行了方法回收率和精密度的测定,检测方法与实施例1相同,实验结果见表3。由表3可知,1-硝基芘、菲、芘、苯并[α]芘的回收率在85.2%~108.7%之间,精密度rsd小于11.7%,满足分析要求,具有很好的重现性。表3土壤样品中加标回收率实验结果试验例2优化荧光检测器测定条件图3为用荧光检测器分别检测1-氨基芘(衍生产物)、菲、芘、苯并[α]芘这四种物质的标准贮备溶液的荧光激发光谱和荧光发射光谱,图中峰顶位置对应波长为最优波长,在该波长下化合物的荧光信号最强,各化合物最优激发波长和发射波长见表4。图4为使用实施例1的液相色谱条件测定步骤(4)衍生处理后的基质混合标准工作溶液的色谱图。各化合物出峰时间见表4。由表4可得,所述荧光检测器的最优测定条件为:0~8.43min的激发波长为240nm,发射波长为435nm;8.43~9.86min的激发波长为240nm,发射波长为370nm;9.86~10.74min的激发波长为240nm,发射波长为390nm;10.74~12.36min的激发波长为240nm,发射波长为390nm。表4各物质的出峰时间、最优激发波长和最优发射波长rt(min)λex(nm)λem(nm)1-硝基芘8.43240435菲9.86240370芘10.74240390苯并[a]芘12.36260420实施例2实施例2与实施例1的区别仅在于步骤(3)净化所用m-pfc净化小柱的填充物不同:实施例2的填充物为3mg(mwcnts)+30mgpsa+30mgc18+80mgmgso4。对比例1对比例1与实施例1的区别仅在于步骤(3)净化所用m-pfc净化小柱的填充物不同:对比例1的填充物为5mg(mwcnts)+50mgpsa+30mgc18+80mgmgso4。按照与试验例1相同的方法对实施例2和对比例1的检测方法进行加标回收率实验(各物质添加浓度分别为50μg/kg),结果如表5所示。表5实施例2和对比例1的加标回收率实验结果由表5可知,对比例1选取5mgmwcnts和50mgc18作为填充物,所有目标物都会被吸附在净化材料中,回收率为0。而实施例1和实施例2中的填充物选择,可以保证硝基多环芳烃和多环芳烃的回收率都在理想的范围内。对比例2对比例2与实施例1的区别仅在于步骤(3)净化不同:对比例2选用的是传统硅胶固相萃取柱,取2ml正己烷提取液,经平衡:采用3ml正己烷和3ml二氯甲烷进行淋洗,活化硅胶柱;上样:将提取液加入硅胶柱中,以1ml/min的速度使其自然留下;淋洗:采用3ml二氯甲烷-正己烷混合溶液(体积比3:1)进行淋洗,去除杂质;洗脱:采用4ml正己烷进行洗脱;即完成净化。按照与试验例1相同的方法测定对比例2的回收率和精密度,结果表明,使用硅胶固相萃取柱进行净化处理,1-硝基芘、菲、芘、苯并[α]芘的回收率在78.1%-101.3%,rsd小于12.1%,而实施例1选取m-pfc小柱进行净化后,回收率为85.2%~108.7%,精密度rsd小于11.7%,说明m-pfc净化小柱可降低化合物在净化过程中的损失。此外,使用硅胶固相萃取柱的操作繁琐,耗时长,并且受限于抽真空设备,人均每次只能完成10个左右样品,一旦小柱堵塞,可能影响结果的平行性。而采用m-pfc小柱仅需要1~2分钟即可完成一个样品的净化,易于操作,无需其他配套装置,对实现大批量样品分析具有重要意义。虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对其作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1