一种抗体药物偶联物平均偶联率及药物分布情况的检测方法与流程
]本发明涉及抗体药物偶联物检测领域,具体涉及一种新的检测抗体药物偶联物的平均偶联率的方法,本发明还涉及该方法在测定抗体药物偶联物药物分布情况中的应用。
背景技术:
抗体药物偶联物(又称antibodydrugconjugates,adcs),是由抗体(antibody)、药物(drug)以及连接子(linker)三部分组成,它将抗体的靶向性与药物的抗肿瘤作用完美的结合在一起。抗体药物偶联物因其良好的靶向性及抗肿瘤活性,可实现“精准治疗”,已成为抗肿瘤抗体药物研发的新热点和重要趋势,受到越来越多的关注。
平均偶联率和药物分布情况是描述抗体药物偶联物药物特征的重要理化参数,它决定了药物“弹头”的“载弹量”,同时影响着药物的安全性和有效性。平均偶联率(即dar值)是指测量体系中总的药物分子和抗体分子的摩尔浓度之比。药物分布情况是指具有不同dar值的抗体药物偶联物分子分别占总的抗体药物偶联物分子的比例,或者抗体轻链或重链上偶联不同数量药物的分子占总轻链或总重链的比例。
目前,常见的平均偶联率和药物分布情况的分析方法包括:紫外分光光度法(uv法)、疏水作用色谱法(hic-hplc法)、反相高效液相色谱法(rp-hplc法)及质谱法(lc-ms法),其中:
(1)uv法是基于朗伯比尔定律对dar值进行测定,是最为简单的方法,采用该方法必须具备三个条件:①药物具有足够的吸光度;②药物和抗体有明显不同的最大吸收波长;③药物与抗体结合不会影响到这两个组分各自的光吸收特性,这样就可以将不同组分的吸光值简单相加。该方法简单且不需要进行分离;但缺点在于不够精确,且仅能得到体系的平均偶联率,而无法得到药物分布情况信息。
(2)疏水作用色谱法(hic-hplc)根据抗体偶联上药物后疏水性的不同而进行分离,通过色谱峰面积百分比和对应的载药数计算平均偶联率,同时可对药物的分布情况进行分析,得出偶联不同数量药物抗体药物偶联物组分的比例,但对于小分子药物和抗体的疏水性没有差别的抗体药物偶联物无能为力。
(3)反相高效液相色谱法一般需要通过还原反应解离抗体的轻链和重链,根据极性的大小分离含不同数量药物分子的轻链和重链,利用各色谱峰的峰面积和对应的载药数进行计算,可以得到抗体药物偶联物的平均偶联率,以及轻链和重链上药物的分布情况进行分析,但对于不同组分极性差别较小的抗体药物偶联物无法进行分析。
(4)质谱法通过质荷比可以辨认出质谱图上偶联不同数量药物的抗体药物偶联物的峰,然后根据各峰的峰面积可以得出各自的相对含量,并计算平均偶联率值。但质谱法分析的前提是无论药物载量的高低,都假定所有物质同未偶联抗体具有相同的离子化效率。因此,应用质谱技术分析dar值的前提是假定所有物质具有相同的回收率和电离情况,而实际情况并非总是如此,因为药物与带正电的胺的偶联将导致所带电荷和疏水程度的改变。
技术实现要素:
针对上述问题,本发明提供一种新的检测抗体药物偶联物平均偶联率的方法:rce-sds法,本发明还提供了上述检测方法在检测抗体药物偶联物药物分布情况中的应用。
具体的,本发明提供了一种抗体药物偶联物平均偶联率检测方法,其特征在于,所述的方法包括如下步骤:
a.试剂的准备:
(1)sds样品缓冲液:含1%sds的0.1mol/ltris-hcl溶液,ph9.0;
(2)sds凝胶分离缓冲液:含0.2%sds缓冲液,ph8.0;
(3)0.1mol/l盐酸溶液;
(4)0.1mol/l氢氧化钠溶液;
b.供试品制备:将供试品稀释至4mg/ml,取25μl,加入sds样品缓冲液70μl,加入适量硫醇类还原剂,使供试品的终浓度为1-2mg/ml。68-72℃孵育10min,冷却离心取上清液用于分析;
c.检测准备:
(1)检测波长:280nm;
(2)毛细管:非涂层-熔融石英毛细管,内径50μm,有效长度为20.0-24.5cm;
(3)检测窗:100×800μm;
(4)样品室温度:18-22℃;
(5)毛细管温度:18-22℃;
所述的毛细管通过以下步骤进行预处理:0.1mol/l氢氧化钠溶液在20psi压力下冲洗10min;0.1mol/l盐酸溶液在20psi压力下冲洗5min;超纯水在20psi压力下冲洗2min;用sds凝胶分离缓冲液在70psi的压力下冲洗10分钟;
d.供试品分析:
(1)0.1mol/l氢氧化钠溶液在70psi压力下冲洗3min;
(2)0.1mol/l盐酸溶液在70psi压力下冲洗1min;
(3)超纯水在70psi压力下冲洗1min;
(4)用sds凝胶分离缓冲液在70psi的压力下冲洗10分钟;
(5)用超纯水蘸洗毛细管后,-5kv电压下进样20s;
(6)-15kv电压分离30min,毛细管两端保持20psi的压力;
e.抗体药物偶联物平均偶联率的确定:
根据公式:dar=darlc+darhc,得到抗体药物偶联物平均欧联率dar值;
其中:
darlc=2×lc1%/(lc%+lc1%);
darhc=2×(hc1%+2×hc2%+3×hc3%)/(hc%+hc1%+hc2%+hc3%);
darlc代表抗体药物偶联物轻链的平均偶联率;
darhc代表抗体药物偶联物重链的平均偶联率;
lc1%代表抗体药物偶联物偶联一个linker-drug的轻链的rce-sds色谱峰校正峰面积百分比;
lc%代表抗体药物偶联物轻链的rce-sds色谱峰校正峰面积百分比;
hc1%代表抗体药物偶联物偶联一个linker-drug的重链的rce-sds色谱峰校正峰面积百分比;
hc2%代表抗体药物偶联物偶联两个linker-drug的重链的rce-sds色谱峰校正峰面积百分比;
hc3%代表抗体药物偶联物偶联三个linker-drug的重链的rce-sds色谱峰校正峰面积百分比;
hc%代表抗体药物偶联物重链的rce-sds色谱峰校正峰面积百分比。
进一步的,所述的硫醇类还原剂选自β-巯基乙醇、三(2-羧乙基)磷(tcep)、二硫苏糖醇(dtt)。
优选的,所述的硫醇类还原剂为β-巯基乙醇。
优选的,所述的硫醇类还原剂为三(2-羧乙基)磷;进一步的,所述的三(2-羧乙基)磷的浓度为0.1mol/l。
优选的,所述的硫醇类还原剂为二硫苏糖醇;进一步的,所述的二硫苏糖醇的浓度为1mol/l。
进一步的,所述硫醇类还原剂的使用量为4-6μl;优选的,所述硫醇类还原剂的使用量为5μl。
进一步的,步骤b中加入sds样品缓冲液和硫醇类还原剂后供试品的终浓度为1mg/ml。
进一步的,所用的毛细管电泳仪配备的检测器为紫外检测器(vwd)或二级管阵列检测器(pda/dad)。
进一步的,所用的毛细管有效长度为20.0cm。
进一步的,所述的抗体药物偶联物中抗体与连接子的连接方式为氨基偶联、巯基偶联和定点偶联。
进一步的,所述的抗体药物偶联物中连接子与药物偶联物的分子量不小于4000da。
本发明还涉及上述任一项所述的检测方法在检测抗体药物偶联物药物分布情况中的应用。具体的,我们可以根据抗体药物偶联物rce-sds色谱图中每个峰的校正峰面积百分比,分析偶联不同数量linker-drug的各轻链和重链的比例,得到轻链lc、连接一个linker-drug的轻链lc1、重链hc、连接一个linker-drug的重链hc1、连接两个linker-drug的重链hc2及连接三个linker-drug的重链hc3的比例,可提供更丰富的结构信息。
本发明提供的rce-sds检测方法与其他几种分析方法的分离原理不同,它的原理是:蛋白质样品在含sds的溶液中与sds结合,加热变性,结合sds后形成了蛋白质-sds胶束,其长短轴的长度都一样,且所带电荷远远超过蛋白质自身的电荷量,因而消除了不同分子间的电荷差异,使得蛋白质混合物在电场的作用下仅根据分子大小的差异而分离。rce-sds法根据抗体药物偶联物还原后分子的大小进行分离,可分析抗体药物偶联物的平均偶联率,并可对小分子药物linker-drug在抗体上的分布情况进行分析,得到轻链lc、连接一个linker-drug的轻链lc1、重链hc、连接一个linker-drug的重链hc1、连接两个linker-drug的重链hc2及连接三个linker-drug的重链hc3的比例,可以分析抗体的轻重链水平上药物的分布情况,得到的抗体药物偶联物的结构信息更丰富。该方法检测结果准确可靠,适用范围广泛,适用于大部分赖氨酸偶联、半胱氨酸偶联和定点偶联等方式得到的抗体药物偶联物,尤其适用于linker-drug分子量大于4000da的抗体药物偶联物。
附图说明
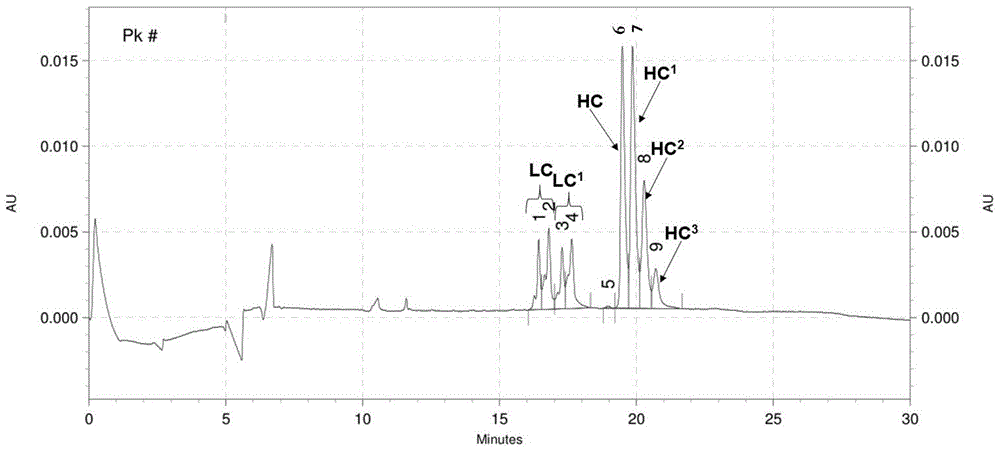
图1为通过本发明提供的检测方法得到的抗体药物偶联物供试品的rce-sds色谱图;
图2为通过本发明提供的检测方法得到与抗体药物偶联物供试品对应的单抗的rce-sds色谱图。
图3为抗体药物偶联物的药物在轻重链上的分布情况示意图。
图4为实施例涉及抗体药物偶联物供试品中linker-drug的分子量质谱图。
具体实施方式
定义
除非另有定义,在此所使用的所有技术和科学术语具有与本发明涉及领域的普通技术人员通常所理解的相同的意义。
本发明所涉及的“抗体药物偶联物”如通常定义的那样,是采用特定的连接子将抗体和药物连接起来化合物,其主要组成成分包括抗体(antibody)、连接子(linker)和药物(drug)三个部分;本发明所涉及的“连接子-药物偶联物”(即linker-drug)为连接子(linker)和药物(drug)的共价连接物。抗体药物偶联物中的连接子(或连接子-药物)与抗体有多种偶联形式,其可偶联在抗体的赖氨酸(lys)残基(即本发明所述的“氨基偶联”)或者偶联在抗体链间二硫键还原而产生的半胱氨酸(cys)残基上(即本发明所涉及的“巯基偶联”),还可通过引用反应性cys或非天然氨基酸、酶法及对二硫键进行改造进行偶联(即本发明所涉及的“定点偶联”)(李晨晨,王旻,张娟.抗体与小分子药物一体化的完美“联姻”—解析抗体-药物偶联物之定点偶联[j].药学进展,2015,39(4):283-292.)。
实施例
下面将通过实施例对本发明进行进一步的阐述,需要说明的是,以下实施例是对本发明进行进一步的阐述和解释,而不应被看作是对本发明的限制。
实施例1
我们采用本发明提供的检测方法检测某一抗体药物偶联物供试品的平均偶联了和药物分布情况,本实施例用的抗体药物偶联物供试品的分子量为148570da,linker-drug的分子量为4666da(质谱图见图4),抗体药物偶联物供试品的偶联方式为巯基偶联。具体包括如下步骤:
a.试剂的准备:
(1)sds样品缓冲液:含1%sds的0.1mol/ltris-hcl溶液,ph9.0;
(2)sds凝胶分离缓冲液:含0.2%sds缓冲液,ph8.0;
(3)0.1mol/l盐酸溶液;
(4)0.1mol/l氢氧化钠溶液;
b.供试品制备:将抗体药物偶联物供试品稀释至4mg/ml,取稀释后的供试品溶液25μl,加入sds样品缓冲液70μl,加入β-巯基乙醇5μl,涡旋混匀,使供试品的终浓度为1mg/ml。将供试品溶液在70℃孵育10min,冷却至室温后以每分钟6000转离心1min,从样品管中取出90μl至样品瓶中,用于分析。为了便于比较,按与抗体药物偶联物供试品相同的方法同时处理一份该抗体药物偶联物供试品对应的单抗。
c.检测准备:
(1)检测波长:280nm;
(2)毛细管:非涂层-熔融石英毛细管,内径50μm,有效长度为20.0cm;
(3)检测窗:100×800μm;
(4)样品室温度:20℃;
(5)毛细管温度:20℃;
所述的毛细管通过以下步骤进行预处理:0.1mol/l氢氧化钠溶液在20psi压力下冲洗10min;0.1mol/l盐酸溶液在20psi压力下冲洗5min;超纯水在20psi压力下冲洗2min;用sds凝胶分离缓冲液在70psi的压力下冲洗10分钟;
d.供试品分析:
(1)0.1mol/l氢氧化钠溶液在70psi压力下冲洗3min;
(2)0.1mol/l盐酸溶液在70psi压力下冲洗1min;
(3)超纯水在70psi压力下冲洗1min;
(4)用sds凝胶分离缓冲液在70psi的压力下冲洗10分钟;
(5)用超纯水蘸洗毛细管后,-5kv电压下进样20s;
(6)-15kv电压分离30min,毛细管两端保持20psi的压力;
图1为通过上述步骤得到的抗体药物偶联物供试品的rce-sds色谱图,图2作为对照的单抗的rce-sds色谱图。图1中,lc代表抗体药物偶联物供试品轻链的rce-sds色谱峰,lc1代表抗体药物偶联物供试品中偶联一个linker-drug的轻链的rce-sds色谱峰,hc代表抗体药物偶联物供试品重链的rce-sds色谱峰,hc1代表抗体药物偶联物供试品中偶联一个linker-drug的重链的rce-sds色谱峰,hc2代表抗体药物偶联物供试品中偶联两个linker-drug的重链的rce-sds色谱峰,hc3代表抗体药物偶联物供试品中偶联三个linker-drug的重链的rce-sds色谱峰。图2中,lc’代表对照单抗轻链的rce-sds色谱峰,hc’代表对照单抗重链的rce-sds色谱峰。
从图中我们能够看出,图1中抗体药物偶联物供试品的lc、hc和图2中单抗的lc’、hc’的保留时间一致,可对图1抗体药物偶联物供试品的rce-sds色谱图中未偶联linker-drug的轻链和重链的对应峰进行归属,读取各rce-sds色谱峰校正峰面积百分比,具体参见表1。
表1各rce-sds色谱峰校正峰面积百分比(四舍五入)
采用抗体药物偶联物供试品平均偶联率的计算公式dar=darlc+darhc,得到抗体药物偶联物供试品平均偶联率dar值为3,其中:
darlc=2×lc1%/(lc%+lc1%);
darhc=2×(hc1%+2×hc2%+3×hc3%)/(hc%+hc1%+hc2%+hc3%)。
由于rce-sds法是根据分子大小进行分离,因此我们也可确定rce-sds色谱图中linker-drug在抗体药物偶联物的轻链和重链上的可能的分布情况。图3给出了linker-drug在抗体上几种可能的偶联情况(偶联方式为巯基偶联连接方式),由于抗体上仅有4对链间二硫键(重链和重链间存在2对链间二硫键,重链和轻链间各存在一对链间二硫键),因此一条轻链单链上仅有一个偶联位点,即一条轻链单链上只可能连接一个药物,连接有linker-drug的轻链也只有一种形式(见图3中②所示);一条重链单链上有3个偶联位点,一条重链单链上最多可连接三个linker-drug,连接有linker-drug的重链可能存在7种连接形式(见图3中④、⑤、⑥所示),其中④给出了一条重链单链偶联有一个linker-drug可能的连接形式,⑤给出了一条重链单链偶联有2个linker-drug可能的连接形式,⑥给出了一条重链单链偶联有3个linker-drug可能的连接形式;图3中的①和③分别代表未偶联有连接子药物偶联物的轻链和重链。结合表1中各rce-sds色谱峰校正峰的比例和图3,我们可大致推测出此抗体药物偶联物供试品的药物分布情况(即linker-drug在轻链和重链上可能的分布形式,如偶联不同linker-drug轻链和重链的比例、偶联不同linker-drug重链的比例等),得到更丰富的的抗体药物偶联物供试品结构信息,便于我们更详细的分析偶联情况,对优化偶联方式和评价偶联效果有一定的指导意义。
本发明已通过各具体实施例作了举例说明。但是,本领域普通技术人员能够理解,本发明并不限于各具体实施方式,普通技术人员在本发明的范文内可以作出各种改动或变型,并且在本说明书中各处提及的各个技术特征可以相互组合,而仍不背离本发明的精神和范围。这样的改动和变型均在本发明的范围之内。
- 还没有人留言评论。精彩留言会获得点赞!