一种基于竞争性单克隆抗体的旋毛虫病抗体检测试剂盒及其制备方法与流程
本发明属于荧光免疫检测技术领域,具体涉及一种基于竞争性单克隆抗体的旋毛虫病抗体检测试剂盒及其制备方法。
背景技术:
旋毛虫病是一种危害非常严重的人兽共患病,其不但可给畜牧业生产造成巨大的经济损失,而且对人类身体健康也构成巨大威胁,人或动物主要通过生食或半生食含有旋毛虫的肉类(主要为猪肉)而发病。
对于屠宰动物旋毛虫病的检验,国际动物卫生组织(oie)的法规检验方法为镜检法及集样消化法,目前我国也在延用这两种方法。然而以上两方法均存在一定的弊端,镜检法费时费力而且敏感性差,其敏感性为肉中虫体密度达到每克3条虫体时方可检出。集样消化法虽可大大提高检出率,将虫体检出率提高至每克肉1条虫体,但该方法仍十分繁琐,在发现阳性样品时仍需对阳性组采用消化法进行逐头检测。从敏感性的角度来看,由镜检法和集样消化法所造成漏检的肉类均存在安全隐患并可引起人类的感染(摄入75条虫体即可引起人的感染)。国内外学者对旋毛虫检测的方法进行了大量的研究,如应用间接荧光免疫试验,免疫酶染色试验,免疫印迹试验,免疫吸附试验(elisa)等技术来检测旋毛虫抗体,但这些方法操作较复杂,常需要2-3个小时检测出结果,而且需要昂贵的仪器和专业技能人员在实验室完成,不能应用于现场和基层单位进行猪旋毛虫病的检测。目前,旋毛虫肌幼虫排泄分泌物es抗原是oie及国际旋毛虫委员会推荐的用于血清学抗体检测的标准抗原。然而es抗原成分复杂,制备繁琐、生产周期长、批次质量不均,而且存在严重的诊断盲区(感染后19d前无法检出)和交叉反应等问题,因而阻碍了其实际应用。
本实验室对感染后6h的旋毛虫cdna表达文库中进行了免疫学筛选,成功获得了一个高丰度强反应原性的抗原蛋白,命名为wn10,编码半胱氨酸蛋白酶抑制剂。wn10基因注册号:eu263325,蛋白注册号:aby60755。
免疫层析试纸快速检测技术(ilfst)是在单克隆抗体技术、免疫层析技术、新材料及标记技术基础上发展起来的一种新型免疫学快速检测技术。免疫层析试纸条不需要专业技能和昂贵复杂的仪器设备,快速性、易用性、低成本和无需设备性等优点,是理想的免疫学快速检测技术之一。常规的免疫标记是用胶体金对抗体或抗原进行标记,但由于胶体金检测在灵敏度和准确度上的限制,只能用于一些要求低的检测项目中。近年来,荧光免疫标记试纸条取得了较大发展。目前已报道的旋毛虫病抗体检测试纸条方法中,包括有胶体金试纸条和时间分辨荧光微球试纸条,且均采用肌幼虫排泄分泌物es抗原。竞争性单克隆抗体具有与抗原结合的特异性强、纯度好、重复性强、便于质量控制、亲和力好且可大量的生产优势,因而建立一种基于竞争性单克隆抗体的旋毛虫病抗体诊断荧光试纸条,对旋毛虫病的诊断方法的改进具有重要的意义。
技术实现要素:
为了更快速、稳定、准确检测猪旋毛虫感染情况,本发明提供了一种基于竞争性单克隆抗体的旋毛虫病抗体检测试剂盒及其制备方法,具体技术方案如下:
一种基于竞争性单克隆抗体的旋毛虫病抗体检测试剂盒,所述旋毛虫病抗体检测试剂盒含有试纸条和竞争性检测试剂;所述试纸条包括样品垫、层析膜、吸水垫和底板,所述层析膜上设有检测线与质控线,其中检测线上喷涂有兔抗ts-wn10多克隆抗体,质控线上喷涂有兔抗鼠igg;所述竞争性试剂含有杂交瘤细胞株wn10-1h9所分泌的单克隆抗体ts-wn10-1h9和重组抗原ts-wn10;所述杂交瘤细胞株wn10-1h9的微生物保藏号是:cgmccno.18316。
进一步地限定,所述单克隆抗体标记有cdse/zns量子点荧光微球。
进一步地限定,所述样品垫材质为玻璃纤维素膜ahistrom8964;所述层析膜材质为硝酸纤维素膜whatmanae99。
本发明还提供了上述旋毛虫病抗体检测试剂盒的制备方法,包括如下步骤:
1)旋毛虫ts-wn10重组抗原制备:将重组大肠杆菌bl21(de3)-pet28a-ts-wn10诱导表达后经ni柱一步柱上复性纯化,获得旋毛虫ts-wn10重组抗原;
2)竞争性单克隆抗体ts-wn10-1h9的制备:用微生物保藏号为cgmccno.18316的杂交瘤细胞株wn10-1h9制备小鼠腹水,收获腹水经proteing纯化,获得竞争性单克隆抗体ts-wn10-1h9,然后进行量子点荧光微球偶联标记;
3)cdse/zns量子点荧光微球偶联竞争性单克隆抗体ts-wn10-1h9标记物的制备:利用edc活化微球上的羧基,活化后的羧基与步骤2)制备的单克隆抗体蛋白上的氨基结合,促使其偶联上蛋白;
4)兔抗ts-wn10多克隆抗体的制备:用步骤1)制备得到的ts-wn10重组抗原免疫新西兰兔,收获血清经proteing纯化,获得兔抗ts-wn10多克隆抗体;
5)样品的制备:将样品垫浸泡入含0.05%(体积)tween20和0.2%(质量)bsa的0.01mph7.4的pb缓冲液中,取出后于37℃烘干;
6)检测线和质控线的制备:将步骤4)制备的兔抗ts-wn10多克隆抗体与兔抗鼠igg按照10:1的质量比,分别喷涂在层析膜上,形成检测线与质控线,37℃干燥2-3h,密封保存备用;
7)试纸条的组装:在底板上沿样品检测时的层析方向依次将样品垫、层析垫、吸水垫粘贴在底板上,制成试纸条。
进一步地限定,步骤1)中所述旋毛虫ts-wn10重组抗原的制备方法如下:将ts-wn10基因经ecori和xhoi双酶切后连接到经同样双酶切后的表达载体pet28a中,所述ts-wn10基因登录号为eu263325,得到的连接产物转化大肠杆菌bl21(de3),获得重组菌bl21(de3)-pet28a-ts-wn10,重组菌经iptg诱导表达后,经ni柱纯化得到可溶性蛋白,即为旋毛虫ts-wn10重组抗原。
进一步地限定,所述旋毛虫ts-wn10重组抗原的制备方法为,将重组菌bl21(de3)-pet28a-ts-wn10加入到lb培养基中37℃震荡培养至od600nm为0.5-1时,加iptg至终浓度为1mmol/l,37℃诱导6-8h,诱导后菌液离心后用20mmtris-hcl重悬缓冲液重悬,离心后取沉淀,用预冷的包涵体洗涤液重悬,离心收获沉淀,此步骤重复3次;离心收获的沉淀用预冷的含尿素的pbs洗涤液重悬,离心收获沉淀,此步骤重复2次;离心收获沉淀用bindingbuffer重悬,4℃溶解过夜,离心收上清,上清过滤后纯化得到旋毛虫ts-wn10重组抗原。
进一步地限定,步骤2)所述竞争性单克隆抗体ts-wn10-1h9的制备具体方法如下:取健康的balb/c小鼠腹腔向其注射石蜡油,0.5ml/只,1周后腹腔注射1×106个杂交瘤细胞wn10-1h9,7~10天后抽取腹水,隔2天抽取一次,将抽取的腹水10000rpm离心10min去除上层油脂和沉淀,上清液经纯化后得到竞争性单克隆抗体ts-wn10-1h9。
进一步地限定,步骤3)所述cdse/zns量子点荧光微球偶联竞争性单克隆抗体ts-wn10-1h9标记物的制备具体方法为:每100μl的cdse/zns量子点荧光微球中加入8mg/ml1-(3-二甲氨基丙基)-3-乙基碳二亚胺edc400μl混匀,室温孵育1h;反应结束离心后弃上清;加入150μg竞争性单克隆抗体ts-wn10-1h9混匀,室温孵育1h;反应结束离心后弃上清;加入1.5%bsa400μl混匀,室温孵育1h;反应结束离心后弃上清;加入1mlph8.0tris-hcl缓冲液重悬得到cdse/zns量子点荧光微球偶联的竞争性单克隆抗体ts-wn10-1h9。
进一步地限定,步骤4)所述兔抗ts-wn10多克隆抗体的制备具体方法如下:健康的新西兰兔背部皮下多点免疫ts-wn10重组抗原,1mg/只,初次免疫采用弗氏完全佐剂,自第2次免疫后采用弗氏不完全佐剂,每2周免疫一次,共免疫6次,每次1mg/只;6次免疫后心脏采血,离心分离后得到的血清经纯化得到兔抗ts-wn10多克隆抗体。
进一步地限定,步骤6)所述喷涂,点样速度为1μl/cm。
有益效果
本发明制备的试剂盒中,旋毛虫病荧光免疫层析检测试纸条主要由样品垫、层析摸、吸水垫和底板四个基本结构单元组成,从检测时的测试端至手柄端依次叠加于支撑底板上。样品垫为经过处理的玻璃纤维素膜ahistrom8964,用于快速吸收待检样品溶液,使其通过虹吸作用向硝酸纤维素膜侧向流动;层析膜为硝酸纤维素膜whatmanae99,其上固定有抗体,形成“检测线”(t线)和“质控线”(c线)印迹,用于拦截带标记的免疫复合物;cdse/zns量子点荧光微球偶联竞争性单克隆抗体ts-wn10-1h9,它可与待检血清中的靶标抗体竞争结合ts-wn10重组抗原,在检测线处被兔抗ts-wn10多克隆抗体截留,而剩余未反应的cdse/zns量子点荧光微球偶联竞争性单克隆抗体ts-wn10-1h9继续流向质控线,在质控线处被兔抗鼠igg截留;吸水垫为吸水纸板,用于吸收流过层析膜的待检样品溶液,以维持层析膜两端的压差,促使更多的待检样品溶液在毛细作用下向一定的方向流动,加快整个免疫层析系统的流动速度,也可防止样品的随意流动。除了样品垫、层析膜、吸水垫和底板外,本发明的试纸条还可添加一些辅助结构,如外层塑胶膜或塑料外壳等,组装成不同类型的免疫层析试纸产品。
本发明制备的试纸条具有操作简单、快速和结果易判读等elisa不具备的优点,同时在检测时不与其他寄生虫阳性血清发生交叉反应,特异性及灵敏度高;且具有长期稳定的特点,实用性较强、容易保存、具有市场开发价值。具有广泛推广空间,极具市场前景。
附图说明
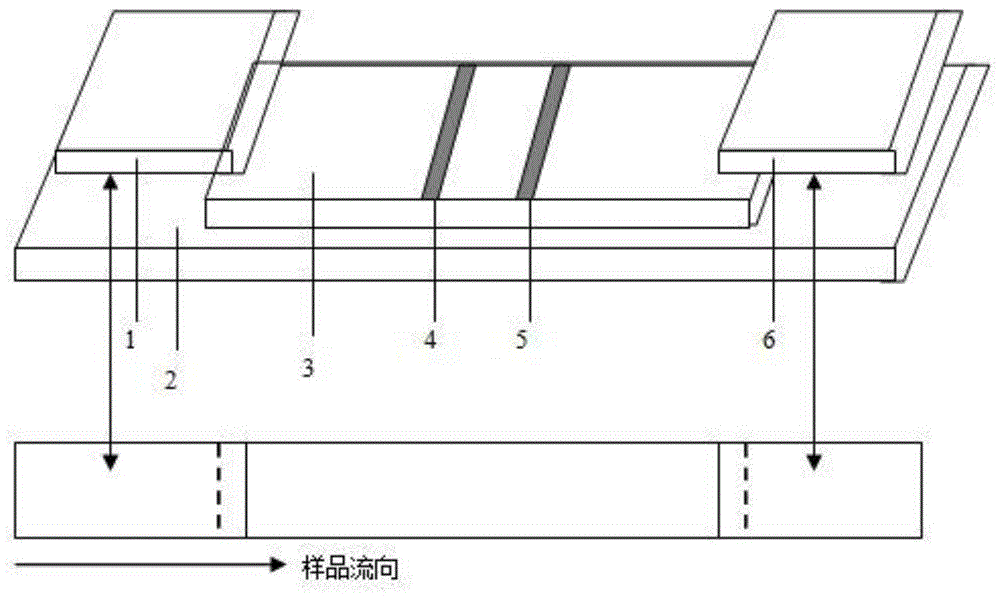
图1荧光免疫层析检测试纸条结构示意图;其中1为样品垫;2为底板;3为硝酸纤维素膜;4为检测线;5为质控线;6为吸水垫;
图2已上市的荧光免疫检测仪;其中1为台式;2为手持式;
图3荧光免疫层析检测试纸条检测结果判定示意图;其中1为检测线;2为质控线;a)为阴性结果示意图;b)为阳性结果示意图;c)为无效示意图。
具体实施方式
在旋毛虫检测方面还没有利用竞争性单克隆抗体和单一重组抗原作为诊断抗原检测抗旋毛虫抗体的荧光免疫层析试纸条,本发明对此进行了探究。本发明采用cdse/zns量子点荧光微球作为标记物,通过对各种固相材料的选择和反应体系及反应条件的优化,建立了一种基于单克隆抗体ts-wn10-1h9作为竞争单抗的旋毛虫病荧光免疫层析检测试纸条。在制作试纸条时,将兔抗ts-wn10多克隆抗体喷涂在nc膜检测线上,兔抗鼠igg喷涂在其质控线上,连同处理过的样品垫、吸水纸和底板进行旋毛虫病荧光免疫层析检测试纸条的组装。待检样品利用nc膜的毛细作用会向试纸条的上方移动,cdse/zns量子点荧光微球偶联竞争性单克隆抗体ts-wn10-1h9,它可与待检血清中的靶标抗体竞争结合ts-wn10重组抗原,在检测线处被兔抗ts-wn10多克隆抗体截留,而剩余未反应的cdse/zns量子点荧光微球偶联竞争性单克隆抗体ts-wn10-1h9继续流向质控线,在质控线处被兔抗鼠igg截留。若待检样品呈阴性,试纸条的检测线和质控线均显色;随待检样品中靶标抗体含量增多,试纸条检测线逐渐变浅。读取阴性质控血清检测线荧光值a.u.nc,待检血清检测线荧光值a.u.sample,计算抑制率pi%=(1-a.u.sample/a.u.nc)%。当待测样品pi%≥50%时,且质控线显色,则判定为阳性;当待测样品pi%<50%时,且质控线显色,则判定为阴性;如果质控线不显色,则判定为实验不成立,测试结果无效。
该试纸条具有特异、敏感、快速、简单等特点,不需要任何专业技能和其他试剂,为旋毛虫抗体检测提供了新的技术平台,可广泛应用于猪旋毛虫病的基层现场快速准确初筛。下面具体描述本发明所述的旋毛虫病荧光免疫层析检测试纸条及其制备方法与应用。
主要实验材料及来源:
ni纯化柱histraphp购自美国ge公司;胎牛血清、1640培养基购自biologicalindustries公司;hat培养基(50×)、ht培养基(50×)和抗体亚类鉴定试剂盒购自sigma公司;solubletmbsubstratesolution购自tiangen公司;辣根过氧化物酶(hrp)标记山羊抗鼠igg抗体购自北京博奥森公司;预染蛋白marker购自fermentas公司;限制性内切酶ecori和xhoi、反转录酶、extaqdna聚合酶、t4dna连接酶购自宝生物(大连)有限公司。ecl发光底物购自北京索莱宝公司。
实验动物:
6周龄balb/c小鼠由长春亿斯实验动物技术有限公司提供。
新西兰兔由长春亿斯实验动物技术有限公司提供。
其他试剂或仪器设备如无特殊说明均可通过商业化途径购买获得。
实施例1.基于竞争性单克隆抗体的旋毛虫病抗体检测试剂盒。
本实施例所述旋毛虫病抗体检测试剂盒含有试纸条和竞争性检测试剂;所述试纸条包括样品垫、层析膜、吸水垫和底板,所述层析膜上设有检测线与质控线,其中检测线上喷涂有兔抗ts-wn10多克隆抗体,质控线上喷涂有兔抗鼠igg;所述竞争性试剂含有杂交瘤细胞株wn10-1h9所分泌的单克隆抗体ts-wn10-1h9和重组抗原ts-wn10;所述杂交瘤细胞株wn10-1h9的微生物保藏号是:cgmccno.18316,该细胞株于2019年8月15日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所。
所述单克隆抗体标记有cdse/zns量子点荧光微球。
在本发明的一个实施例中,所述样品垫材质为玻璃纤维素膜ahistrom8964;所述层析膜材质为硝酸纤维素膜whatmanae99。
实施例2.基于竞争性单克隆抗体的旋毛虫病抗体检测试剂盒的制备方法。
1)旋毛虫ts-wn10重组抗原制备:将重组大肠杆菌bl21(de3)-pet28a-ts-wn10诱导表达后经ni柱一步柱上复性纯化,获得旋毛虫ts-wn10重组抗原。具体方法如下:
①.引物设计
根据genbank中已登录的ts-wn10基因序列(登录号:eu263325),设计pcr扩增引物,序列如下:
ts-wn10-ecori-atg:5’-taacgaattcatgcagatacttggtga-3’(如seqidno.1所示)
ts-wn10-xhoi-tta:5’-gacgctcgagttaacattcaaca-3’(如seqidno.2所示)
下划线部分为引入的ecori、xhoi酶切位点,预计扩增产物长度为1187bp。
②旋毛虫t1(t.spiralis)rna的提取及反转录
取本实验旋毛虫t1(t.spiralis)保种小鼠1只,断颈处死后去皮、尾、内脏及爪,将胴体洗净后绞碎,置于300ml含有1%hcl和1%胃蛋白酶的消化液中于37℃温箱内搅拌消化2h。用80目滤网过滤消化液及残渣,滤液于分液漏斗中沉淀2h后收集约500ml。沉淀30min后用20ml注射器轻轻吸去上层液体,加入生理盐水再次沉淀,弃上清,反复洗涤至无杂质。将虫体移至ep管中,1000rpm离心3min吸去多余液体。收获的虫体加入1mltrizol混匀,室温静置5min,加入0.2ml氯仿,用力振摇15s,室温孵育2-3min,12000g4℃离心15min,小心取上层液体,加入等体积预冷的异丙醇,混匀后室温孵育10min,12000g4℃离心10min,弃上清,沉淀加入1ml75%乙醇(depc水配制)轻振15s,7500g4℃离心5min,小心弃上清,沉淀室温风干3-5min,加入20-30uldepc水溶解,-20℃保存。
用提取的总rna进行反转录合成cdna,体系如下:
③pet28a-ts-wn10表达载体的构建
以反转录获得的cdna为模板扩增ts-wn10基因。pcr反应体系(50ul)如下:
反应条件为95℃预变性5min,95℃45s,53℃45s,72℃45s,循环30个,72℃终延伸10min。扩增产物经过1%琼脂糖凝胶电泳检测显示,在1161bp左右出现一条亮带,与理论上目的条带的大小一致。测序结果显示成功得到了ts-wn10蛋白的基因编码片段。对pcr产物胶回收。
ts-wn10基因的克隆的结果表明,克隆得到ts-wn10基因特异性引物扩增片段,去掉信号肽获得基因序列1161bp。
将胶回收得到的ts-wn10基因以及原核表达载体pet28a分别进行双酶切,酶切体系如下:
同时,对原核表达载体pet28a进行双酶切,酶切体系如下:
将酶切反应体系置37℃水浴静置2h,之后进行胶回收。将双酶切后的wn10基因和pet28a载体进行连接,体系为:10×t4dnaligasebuffer1ul,酶切后wn10基因4ul,酶切后pet28a1.5ul,t4dna连接酶1ul,ddh2o2.5ul。16℃连接过夜。将连接产物全部转化ecolidh5a感受态细胞,挑取单菌落进行双酶切鉴定。阳性重组质粒转化bl21(de3)感受态细胞。
④取1ml重组菌bl21(de3)-pet28a-ts-wn10加入到100ml的lb培养基中37℃震荡培养至od600nm约为0.5-1时,加iptg至终浓度为1mmol/l,37℃诱导6-8h。诱导后菌液离心后用30ml重悬缓冲液(20mmtris-hclph8.0)重悬。冰上超声破碎,离心收获沉淀用30ml预冷的包涵体洗涤液(2m尿素、20mmtris-hcl、0.3mnaclph8.0)重悬,冰上超声破碎,离心收获沉淀。此步骤重复3次。离心收获沉淀用30ml预冷的pbs洗涤液(含4m尿素的0.01mpbs)重悬,冰上超声破碎,离心收获沉淀。此步骤重复2次。离心收获沉淀用5mlbindingbuffer(8m尿素、20mmtris-hcl、0.3mnacl、5mm咪唑ph8.0)重悬,4℃溶解过夜。离心收上清,上清过滤后准备上样。akta蛋白纯化仪柱上复性流程参考gehealthcaare手册purifyingchallengingproteins77-79内容。纯化柱采用histraphp1ml。注射上样后柱上复性时间为2h。100%置换至refoldingbuffer(20mmtris-hcl、0.3mnacl、5mm咪唑、1mm2-巯基乙醇ph8.0)溶液后,更换至elutionbuffer(20mmtris-hcl、0.3mnacl、500mm咪唑、ph8.0)洗脱目的蛋白。
2)竞争性单克隆抗体ts-wn10-1h9的制备:用微生物保藏号为cgmccno.18316的杂交瘤细胞株wn10-1h9制备小鼠腹水,收获腹水经proteing纯化,获得竞争性单克隆抗体ts-wn10-1h9,然后进行量子点荧光微球偶联标记。具体方法如下:
给12周龄左右健康的balb/c小鼠腹腔注射石蜡油,0.5ml/只,1周后腹腔注射1×106个杂交瘤细胞wn10-1h9(微生物保藏号是:cgmccno.18316),7~10天后当小鼠腹腔极度膨胀时抽取腹水,隔2天抽取一次,将抽取的腹水10000rpm离心10min去除上层油脂和沉淀,上清分装保存于-20℃。akta蛋白纯化仪抗体纯化流程参考gehealthcaare手册antibodypurification125内容。纯化柱采用hitrapproteinghp1ml。
3)cdse/zns量子点荧光微球偶联竞争性单克隆抗体ts-wn10-1h9标记物的制备:
利用edc活化微球上的羧基,活化后的羧基与抗体蛋白上的氨基结合,促使其偶联上蛋白。
a)向100μlcdse/zns量子点荧光微球中,加入400μl0.05mol/l2-吗啉乙磺酸mes溶液混匀,离心后弃上清,然后加入400μl1-(3-二甲氨基丙基)-3-乙基碳二亚胺edc(8mg/ml)混匀,室温孵育1h;反应结束后,离心后弃上清,400μlmes溶液重悬。
b)加入150μg的竞争性单克隆抗体ts-wn10-1h9(0.01mol/lpb缓冲液稀释),室温孵育1h,反应结束后,离心后弃上清。
c)加入400μl的1.5%bsa溶液(0.01mol/lpb缓冲液配制),室温孵育1h。
d)4℃,8000×g离心30min,弃上清。
e)加入1000μltris-hcl缓冲液(ph8.0)重悬。于4℃保存备用。
4)兔抗ts-wn10多克隆抗体的制备:用步骤1)制备得到的ts-wn10重组抗原免疫新西兰兔,收获血清经proteing纯化,获得兔抗ts-wn10多克隆抗体;
5)样品垫的处理:将样品垫浸泡入含0.05%(体积)tween20和0.2%(质量)bsa的0.01mph7.4的pb缓冲液中,于37℃烘箱过夜干燥后保存备用。
6)检测线和质控线的制备:将步骤4)制备的兔抗ts-wn10多克隆抗体与兔抗鼠igg按照10:1的质量比,分别喷涂在层析膜上,形成检测线与质控线,37℃干燥2h,密封保存备用;
7)试纸条的组装:在底板上沿检测时的层析方向依次将样品垫、层析垫、吸水垫粘贴在底板上,制成纸纸卡,具体方法为:按图1示意图所示,将荧光专用黑色底板、样品垫ahistrom8964、吸水垫h5072、硝酸纤维素膜whatmanae99粘在一起,并用试纸条切割机将其切成3.8mm宽的试纸条,将试纸条放入含有干燥剂的密封袋内,密封后于4℃保存备用。
试纸条cut-off值的测定:用本发明试纸条分别测定猪阴性质控血清和270头份正常猪血清,读取阴性质控血清检测线荧光值a.u.nc,正常猪血清检测线荧光值a.u.sample,计算抑制率pi%=(1-a.u.sample/a.u.nc)%。将270份正常猪血清的pi%进行统计学分析,计算平均值和标准差,以平均值加2倍标准差为试纸条的cut-off值,经计算得到该试纸条的cut-off值为50%。即当待测样品pi%≥50%时,且质控线显色,则判定为阳性;当待测样品pi%<50%时,且质控线显色,则判定为阴性;如果质控线不显色,则判定为实验不成立,测试结果无效。
上述制备制备后的试纸条及竞争性检测试剂检测旋毛虫病抗体方法如下:
样品稀释:分别用生理盐水将旋毛虫抗体阴性质控血清(如正常猪血清)和待检血清(如猪血清)样品稀释1倍,即向50μl生理盐水中加入50μl猪血清,用移液器混匀。向微孔板孔中加入100μl稀释后的血清样品,再加入1μl量子点荧光微球偶联竞争性单克隆抗体ts-wn10-1h9的标记物(浓度为0.1mg/ml)和0.1μgts-wn10重组抗原,混匀,室温反应5min。将试纸条垂直插入于微孔板孔中,虹吸5min后取出,将试纸条平放至桌面室温静置10min后用荧光试纸条测试仪读取荧光值见图2。
结果判定应在10min内进行。如果阴性质控血清样品质控线和检测线均显色;待测样品质控线显色,则试验成立,结果有效。
读取阴性质控血清检测线荧光值a.u.nc,待检血清检测线荧光值a.u.sample,计算抑制率pi%=(1-a.u.sample/a.u.nc)%。当待测样品pi%≥50%时,且质控线显色,则判定为阳性;当待测样品pi%<50%时,且质控线显色,则判定为阴性;如果质控线不显色,则判定为实验不成立,测试结果无效。荧光免疫层析试纸条检测结果判定示意图见图3所示。
实施例3.本发明制备的旋毛虫病抗体检测荧光试纸条灵敏性、特异性以及稳定性检测。
采用实施例2所述的检测方法,考察本发明制备的试剂盒的灵敏性、特异性以及稳定性检测。
1.灵敏性试验:
用旋毛虫荧光免疫层析检测试纸条检测不同感染条件下的猪血清中抗旋毛虫抗体,将检测结果和商品化的酶联免疫吸附抗体检测方法eselisa(qiagen)进行对比。确保检测中应用的试纸条来自同一批次。商品化的eselisa试剂盒为同一批次产品,检测步骤和结果判定标准按照试剂盒说明书进行。
结果显示eselisa检测30份血清为阳性,试纸条检测26份血清为阳性。30份阴性血清,elisa和试纸条全为阴性。本发明的敏感性和特异性与oie推荐的猪旋毛虫病抗体检测方法(eselisa)吻合度较强,但与elisa相比,其具备操作简单、快速和结果易判读等elisa不具备的优点,具有广泛推广空间,极具市场前景。
2.旋毛虫病抗体检测荧光试纸条的特异性检测:
检测其他寄生虫感染的猪阳性血清和常规疫苗免疫的猪血清,感染有猪亚洲带绦虫、弓形虫、猪带绦虫和华支睾吸虫的阳性猪血清,以及6头份规模化养殖场内经过常规疫苗免疫(包括伪狂犬疫苗、兰耳疫苗、圆环病毒疫苗、猪瘟疫苗和口蹄疫疫苗)的猪血清(6头猪的旋毛虫集样消化法检测结果为阴性),并进行特异性分析。本发明中旋毛虫病抗体检测荧光试纸条检测以上猪血清均为阴性,但商品化的eselisa试剂盒检测结果显示与华支睾吸虫猪阳性血清有交叉反应,即本发明中旋毛虫病抗体检测荧光试纸条不与其他寄生虫发生交叉反应,且比oie推荐的eselisa具有更高的特异性。
3.猪感染不同剂量及时间点旋毛虫抗体水平的检测:
对感染旋毛虫后不同时间点猪血清的抗旋毛虫抗体检测。在感染10000条/只时,消化法检测为每克肌肉幼虫数636.7-1257.6lpg,商品化的eselisa试剂盒21天可以检测到旋毛虫感染,而试纸条同样可以在21天检测到旋毛虫感染。在感染1000条/只时,消化法检测为每克肌肉幼虫数30.7-98.5lpg,商品化的eselisa试剂盒25天可以检测到旋毛虫感染,而试纸条可以在25-35天检测到旋毛虫感染,比eselisa相比试剂盒的灵敏性略低。
4旋毛虫病抗体检测荧光试纸条的重复性:
选择不同批次的试纸条进行重复性分析。分别用3个不同批次的试纸条检测,经elisa检测后的20份猪旋毛虫感染阳性血清及20份正常猪阴性血清;3个不同批次的试纸条对20份阳性血清检测结果16份为阳性,4份为阴性,对20份阴性血清检测结果均为阴性,显示出本发明较好的灵敏性和特异性,且稳定性和重复性良好。
5.旋毛虫病抗体检测荧光试纸条的稳定性检测:
将试纸条置于4℃保存,每隔30天分别检测猪阳性和阴性血清各10份,共检测4次,试纸条结果敏感性和特异性均为100%,且检测线和控制线的颜色均不存在明显的差异。表明4℃环境下可保存至少4个月。证明本发明具有长期稳定的特点,实用性较强、容易保存、具有市场开发价值。
sequencelisting
<110>吉林大学
<120>一种基于竞争性单克隆抗体的旋毛虫病抗体检测试剂盒及其制备方法
<130>
<160>2
<170>patentinversion3.5
<210>1
<211>27
<212>dna
<213>ts-wn10-ecori-atg
<400>1
taacgaattcatgcagatacttggtga27
<210>2
<211>23
<212>dna
<213>ts-wn10-xhoi-tta
<400>2
gacgctcgagttaacattcaaca23
- 还没有人留言评论。精彩留言会获得点赞!